2. 中国水产科学研究院淡水渔业研究中心 农业部鱼类免疫药理学国际联合实验室 无锡 214081;
3. 南京农业大学 无锡渔业学院 无锡 214081
2. International Joint Research Laboratory for Fish Immunopharmacology, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081;
3. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081
近年来,鱼类脂肪肝的发病率呈不断扩大趋势。鱼类脂肪肝是养殖过程中的一种常见病,已知容易发生此病的鱼类有鲤鱼 (Cyprinus carpio)、鲫鱼 (Carassius auratus)、罗非鱼 (Oreochromis sp.) 等 (赵蕾等, 2011)1),本病发病初期鱼类体型体色无明显变化,仅表现出食欲不振、生长速度缓慢等症状;一旦病情严重,鱼体色发黑、反应呆滞、昏迷翻转 (彭勇鳌等, 2007),如果得不到及时治疗,病鱼往往不久便会死亡,对养殖户造成很大的损失。肝脏是鱼体内重要的代谢器官,肝脏如果发生病变或者损伤,常常导致机体抵抗力下降而易受传染病影响。关于鱼类脂肪肝的发病原因,有报道称其发病原因是由于营养不均衡造成肝脏脂类代谢发生障碍,导致甘油三酯在肝细胞内异常堆积 (王菊花等, 2008; 李秀梅, 2001);也有报道称是由于滥用抗生素或化学药物所致 (向朝林, 2011)1)。关于此病的防治,在实践中虽然已经摸索出某些中药或者西药有一定效果 (胡金城, 2004; 张盈娇等, 2009; 陈兴发; 20082); 李国春, 2015),但还没有获得理想的保肝药物。
1) Zhao L, Hou SL, Yang XL, et al. The research on fish hepatobiliary damage. Proceedings of the 2011 Annual Meeting of the Chinese Academy of Fisheries, 2011, 240–240 [赵蕾, 侯三玲, 杨先乐, 等.鱼类肝胆损伤研究进展. 2011年中国水产学会学术年会论文集, 2011, 240–240]
1) Xiang CL. A grass carp thioacetamide liver injury model establishment and its application research. Master's Thesis of Soochow University, 2011, 4–27 [向朝林.草鱼 (Ctenopharyngodon idellus) 硫代乙酰胺肝损伤实验模型建立及其应用研究.苏州大学硕士研究生学位论文, 2011, 4–27]
2) Chen XF. Study on the effect of curcumin on growth, antioxidation and lipid metabolism of Tilapia. Master's Thesis of South China Agricultural University, 2008, 7–30 [陈兴发.姜黄素对罗非鱼生长、抗氧化及脂类代谢的影响.华南农业大学硕士研究生学位论文, 2008, 7–30]
当前,国内外关于脂肪肝疾病的研究涉及对象主要是人和哺乳动物 (Xu et al, 2006),而关于水产动物方面的报道还相对较少且主要为体内研究,利用体外培养的鱼肝细胞进行研究则更少。虽然已有报道用氧化油脂成功制备草鱼脂肪肝细胞 (肝细胞系L8824) 模型 (秦洁, 2012)3),化学药物诱导青鳉鱼 (Oryzias latipes) 脂肪肝变性模型 (Kuwashiro et al, 2011),但未见用鲤鱼原代肝细胞来构建脂肪肝细胞变性模型的相关报道。
3) Qin J. The effect of oxidized oil on primary culture of hepatocytes from Ctenopharyngodon idellu. Master's Thesis of Shanghai Ocean University, 2012, 27–32 [秦洁.氧化油脂对草鱼肝细胞损伤机制的研究.上海海洋大学硕士研究生学位论文, 2012, 27–32]
本研究主要采用建鲤 (Cyprinus carpio var. Jian) 原代肝细胞作为实验材料,用油酸来构建肝细胞脂肪变性模型。肝细胞脂肪变性模型的成功构建,可以大大缩短研发药物周期,提高筛选药物效率,为筛选治疗鱼类脂肪肝类药物奠定良好基础。
1 材料与方法 1.1 实验材料 1.1.1 实验鱼实验用建鲤取自中国水产科学研究院淡水渔业研究中心渔场,健康,无伤,体重为30 g左右。取回后将建鲤饲养于循环水系统中,暂养7 d。
1.1.2 试剂和仪器L15培养基、油酸 (二甲基亚砜为助溶剂,终浓度不超过0.1%)、PBS溶液、链霉素/青霉素购自美国Sigma公司;新生小牛血清 (FCS) 购自杭州四季青生物工程材料有限公司;细胞培养板购自美国康宁公司;谷丙转氨酶 (GPT)、谷草转氨酶 (GOT)、甘油三酯 (TG)、总胆固醇 (TC)、γ-谷氨酰转肽酶 (γ-GT)、乳酸脱氢酶 (LDH) 和超氧化物歧化酶 (SOD) 测定试剂盒购自南京建成科技有限公司。
1.2 实验方法 1.2.1 建鲤原代肝细胞的分离和培养无菌条件下于超净台内取建鲤肝脏,用含双抗的PBS缓冲液进行漂洗,修剪,加入浓度为0.125%的胰蛋白酶消化液,27℃水浴条件下消化10–15 min。过滤,滤液用PBS缓冲液洗3次,采用梯度离心法 (离心转数分别为1100、900和800 r/min) 分别离心5 min。离心结束后弃上清液,用含有10%新生小牛血清 (FCS) 的L-15培养基制成细胞悬液,台盼蓝染色法进行细胞存活率检测,计数结束后将细胞接种于24孔培养板中,27℃条件下培养。
1.2.2 MTT法确定油酸浓度将肝细胞接种于96孔细胞培养板中,随机将其分为6个处理组,每组设定3个重复,将不同浓度油酸 (0、0.05、0.1、0.2、0.4、0.8 mmol/L) 与肝细胞进行共培养24 h、48 h。培养结束后,每孔加50 μl 1×MTT溶液,孵育4 h后,吸出上清液,每孔加150 μl DMSO,放在平板摇床上摇匀,使甲臜颗粒充分溶解,形成均匀的蓝紫色溶液。使用酶标仪在570 nm波长处测定各孔吸光度值。
| $ 细胞存活率\left( \% \right) = ({\rm{O}}{{\rm{D}}_{加药细胞}}/{\rm{O}}{{\rm{D}}_{对照细胞}}) \times 100 $ |
将肝细胞接种于24孔培养板中培养24 h后进行后续实验操作,设空白对照组和模型组,每组设定4个重复,接种密度为1×106/ml。空白对照组仅加入含有10%新生小牛血清 (FCS) 的L-15培养基,模型组中分别用含0.05、0.1、0.2、0.4、0.8 mmol/L的油酸与肝细胞共培养24 h、48 h。培养结束后,收集上层培养液及肝细胞,于–20℃保存待用。
1.2.4 油红O染色法观察肝细胞内脂肪滴的沉积情况将培养24 h和48 h的肝细胞爬片取出,用PBS进行清洗,然后采用4%的多聚甲醛固定30 min。肝细胞染色操作参照南京建成科技有限公司油红O染液说明书。脂肪变性细胞结果判定以细胞质内出现脂肪滴为准。
1.2.5 肝细胞及培养液中生化指标的测定GOT、GPT、TG、TC、γ-GT等的测定参照试剂盒说明书。
1.2.6 统计学处理实验数据采用SPSS 16.0软件进行分析处理,各药物处理组与空白对照组之间采用单因素方差分析法 (One-way ANOVA) 进行显著性分析,结果以平均值±标准误 (Mean±SE) 表示。
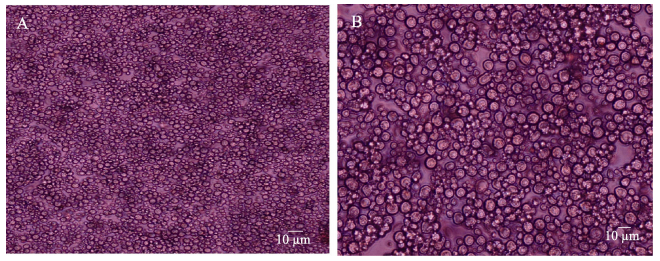
2 结果 2.1 建鲤原代肝细胞的形态学观察采用胰蛋白酶消化液分离培养的肝细胞生长状态良好,细胞存活率在90%以上,可用于后续实验。通过显微镜观察发现,刚分离的原代肝细胞呈透明圆球状 (图 1-A),接种4 h后开始贴壁,培养24 h后,多数细胞已经贴壁,肝细胞相互粘连,呈岛屿状连接 (图 1-B),有个别细胞出现了伸展变形,活力较差的肝细胞由于没有贴壁而呈悬浮状态。
|
图 1 建鲤肝细胞形态 Figure 1 Morphology of hepatocytes of C. carpio var. Jian A: 4 h, ×100; B: 24 h, ×200 |
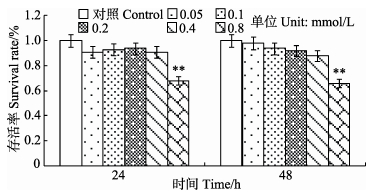
由图 2可以看出,油酸与肝细胞共培养24 h和48 h后,各浓度处理组的肝细胞存活率呈一定下降趋势,2个时间段0.8 mmol/L油酸均显著降低了肝细胞的存活率 (P<0.01),对肝细胞造成较严重损伤,0.4 mmol/L及以下浓度油酸培养肝细胞24–48 h对细胞的活性无显著影响。
|
图 2 油酸对建鲤肝细胞存活率的影响 Figure 2 Changes in the survival rate of the hepatocytes of C. carpio var. Jian induced by oleic acid 与空白对照组相比较,*为P < 0.05; **为P < 0.01,下同 *: P < 0.05; **: P < 0.01, compared to the control group, the same as below |
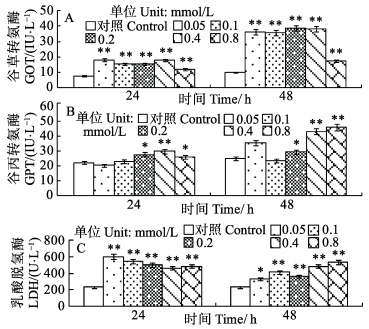
由图 3可知,加入不同浓度的油酸与肝细胞共培养24 h和48 h后发现,0.2、0.4、0.8 mmol/L的油酸可以不同程度升高肝细胞中GOT、GPT、LDH的活性,与空白对照组相比,差异显著或极显著 (P<0.05或P<0.01)。其中,随着培养时间的延长,肝细胞内GOT、GPT两种酶的释放量增加比较明显。
|
图 3 油酸对建鲤肝细胞上清液中GOT (A)、GPT (B) 和LDH (C) 活性的影响 Figure 3 The changes in activities of GOT (A), GPT (B), and LDH (C) in the supernatant of the hepatocytes of C. carpio var. Jian induced by oleic acid |
由图 4可以看出,与空白对照组相比,0.4、0.8 mmol/L油酸可以诱导肝细胞内TG、TC含量显著升高 (P<0.05或P<0.01),且随着时间延长,其含量水平增加越明显。

|
图 4 油酸对建鲤肝细胞中TG (A)、TC (B) 含量的影响 Figure 4 The changes in contents of TG (A), and TC (B) in the hepatocytes of C. carpio var. Jian induced by oleic acid |
由图 5可以看出,油酸与肝细胞共培养24 h后,肝细胞中γ-GT活力无显著变化,共培养48 h后,0.4、0.8 mmol/L油酸诱导肝细胞内γ-GT活力显著升高 (P<0.05或P<0.01)。

|
图 5 油酸对建鲤肝细胞上清液中γ-GT活性的影响 Figure 5 The changes in activity of γ-GT in the supernatant of C. carpio var. Jian hepatocytes induced by oleic acid |
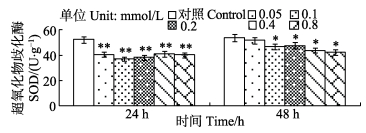
由图 6可以看出,油酸与肝细胞共培养24 h后,各药物处理浓度肝细胞内SOD活力明显下降,与空白对照组相比,差异极显著 (P<0.01)。共培养48 h后发现,0.1、0.2、0.4、0.8 mmol/L油酸可以显著降低肝细胞的抗氧化能力 (P<0.05)。
|
图 6 油酸对建鲤肝细胞上清液中SOD活性的影响 Figure 6 The changes in SOD activity in the supernatant of Jian Carp hepatocytes induced by oleic acid |
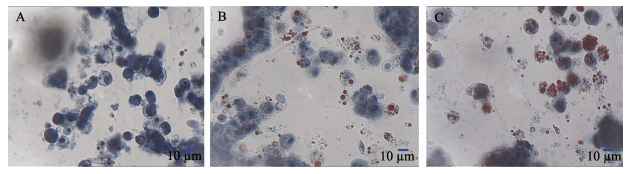
油红O染色后显微镜下观察肝细胞内脂肪的蓄积情况发现,空白对照组的细胞边缘整齐,细胞核清晰可见,细胞核大且呈蓝色,细胞内可见少量脂肪滴 (图 7-A)。0.4 mmol/L油酸处理肝细胞24 h后,与空白对照组相比,细胞边缘以及细胞核稍显不清晰,细胞内出现较大红色脂肪滴,脂肪变性细胞明显比空白对照组多 (图 7-B);0.4 mmol/L油酸处理肝细胞48 h后,细胞内堆积了大量脂肪滴,部分脂肪滴出现融合现象,此时间段脂肪变性细胞最多 (图 7-C)。
|
图 7 油红O染色后建鲤的肝细胞形态 (×400) Figure 7 Morphological changes and lipid accumulation in C. carpio var. Jian hepatocytes after Oil Red O staining (×400) A:空白对照组; B: 0.4 mmol/L油酸诱导24 h; C: 0.4 mmol/L油酸诱导48 h A: Negative control; B: Treated with 0.4 mmol/L oleic acid for 24 h; C: Treated with 0.4 mmol/L oleic acid for 48 h |
鱼类脂肪肝是一种养殖过程常见的营养性疾病 (张水波, 2011)。鱼类所摄取的脂肪主要存储于肝脏内,容易造成脂肪在鱼体内聚集,形成脂肪肝疾病。为了缓解脂肪肝疾病给水产养殖业造成的影响,急需研发能够预防和治疗脂肪肝疾病的药物。研究人员对脂肪肝类疾病进行了大量研究,但关于脂肪肝类疾病的具体发病机制还未探明 (邱德凯, 2001)。目前,在学术界普遍认可的理论是“二次打击学说”,该学说认为氧化应激反应在对肝脏损伤的过程中起到了关键作用,加剧了脂肪肝类疾病的发生 (董姝等, 2012; 刘树军等, 2007)。本研究利用分离的原代肝细胞作为实验材料来构建脂肪肝细胞损伤模型,可以更好地模拟在体鱼类肝组织损伤,同时也可以在很大程度上缩短筛选保肝药物的研发周期。已有研究报道称,酒精、化学药物、脂肪乳等成功构建了脂肪肝细胞变性模型 (杨林辉等, 2007; 张红锋等, 2002; 廖于等, 2010)。
本研究设置不同浓度油酸与建鲤肝细胞共培养24–48 h,诱导建鲤肝细胞发生变性。利用油酸来构建脂肪肝细胞变性模型,符合非酒精性脂肪肝的病理过程,为深入研究非酒精性脂肪肝的发病机制研究提供了良好的技术手段 (刘江等, 2009)。GOT、GPT是临床上常被用来判定肝脏是否正常的经典指标,在肝炎、脂肪肝等疾病测定时常常会发现,这2种转氨酶的活性升高,并以此作为肝脏功能异常的依据 (李彦娜, 2015; 颜宏华, 2015)。在本研究中,随着油酸浓度的不断提高以及作用时间的延长,与空白对照相比,GOT、GPT两种酶的活性显著升高 (P<0.01),这说明在一定程度上油酸对肝细胞造成了损伤,致使细胞膜通透性增加,使得肝细胞内的酶类物质从细胞内释放出来,从而使这2种酶的活性增加。
γ-谷氨酰转移酶 (γ-GT) 是一种主要分布于肾、肝、胰等脏器的肽转移酶,临床上常被用作肝脏疾病检测辅助指标。孙琳等 (2014)认为,γ-GT与肝脏疾病存在一定关联,能够反映肝脏炎症及纤维化情况,当肝脏出现异常时,γ-GT活力值会升高。本研究中,0.4、0.8 mmol/L油酸与肝细胞共培养48 h后,γ-GT活力明显升高,这是由于油酸破坏了肝细胞内的酶系统,引发了代谢障碍,导致了肝细胞变性,致使其活性升高,本结果与李瑞芳 (2015)的实验结果类似。
乳酸脱氢酶 (LDH) 是一种广泛存在于肝、肾等组织中的糖酵解酶,是肝功能检查中的一项重要指标,肝脏等组织受到损伤可引起其活性升高 (Jia et al, 2014; Gupta et al, 2015)。LDH共有5种同工酶,而与肝功能有关联的同工酶主要是LDH4和LDH5,当肝细胞受损伤时,肝细胞就会释放大量的LDH4和LDH5,使得LDH5与LDH4比值变大,临床上常常把二者比值大于1作为肝损伤的信号指标。本研究中,各浓度LDH活性在24 h和48 h两个时间段,均表现出活性显著升高,表明油酸对肝细胞造成了较明显损伤,使得LDH催化丙酮酸与L-乳酸之间的还原与氧化反应出现了紊乱。
肝脏是动物体内重要的代谢器官,机体发生脂肪肝疾病主要是肝脏的脂肪代谢能力出现异常,造成肝脏内甘油三酯 (TG) 在肝细胞内过多蓄积 (张海苗等, 2015)。总胆固醇 (TC) 包括游离胆固醇和胆固醇酯,是构成细胞膜的主要成分,可用作脂代谢指标,当胆固醇的酯化发生障碍时,就会造成肝脏合成胆固醇的能力增强,发生肝损伤后,主要是造成游离胆固醇含量升高 (Dixon et al, 2004; Tainaka et al, 2011)。本研究中,0.4、0.8 mmol/L油酸可以显著增加肝细胞中TG、TC含量 (P<0.05或P<0.01),说明油酸对肝细胞造成了较为严重的损伤。卢荣华等 (2015)利用脂肪乳构建草鱼肝细胞脂肪变性研究也发现,脂肪乳明显造成肝细胞内甘油三酯的升高。
当机体发生脂肪肝疾病时,机体抗氧化系统就会出现失衡状态,导致大量氧自由基的产生。超氧化物歧化酶 (SOD) 是生物体内重要的抗氧化酶,SOD可以清除体内过多的氧自由基,保护组织免受氧自由基的侵害 (Hammes et al, 2012; Du et al, 2008)。本研究中,油酸各浓度处理组与肝细胞共培养24 h后,SOD活性显著降低 (P<0.01),这说明一定浓度油酸诱导肝细胞损伤,而在油酸作用48 h后,SOD活性有所恢复,说明机体自身也在不断抵抗氧自由基给肝细胞带来的损害,努力使抗氧化系统恢复正常。
4 结论本研究利用油酸成功建立了建鲤肝细胞脂肪变性模型,且油酸浓度在0.4 mmol/L、作用时间为48 h构建效果最好。本实验模型的成功建立,可以较好模拟鱼类脂肪肝的特征,为后期筛选保肝类药物提供了很好的技术手段,对于深入研究鱼类脂肪肝的发病机制也具有重要意义。
| Dixon JB, Bhathal PS, Hughes NR, et al. Nonalcoholic fatty liver disease: Improvement in liver histological analysis with weight loss. Hepatology, 2004, 39(6): 1647-1654 DOI:10.1002/(ISSN)1527-3350 | |
| Dong S, Liu P, Sun MY, et al. Role of "two-hit" in non-alcoholic fatty liver disease. Journal of Clinical Hepatology, 2012, 28(7): 551-555 [董姝, 刘平, 孙明瑜, 等. 非酒精性脂肪肝发病机制-"二次打击"学说研究进展. 临床肝胆病杂志, 2012, 28(7): 551-555] | |
| Du ZY, Clouet P, Degrace P, et al. Hypolipidaemic effects of fenofibrate and fasting in the herbivorous grass carp (Ctenopharyngodon idella) fed a high-fat diet. British Journal of Nutrition, 2008, 100(6): 1200-1212 DOI:10.1017/S0007114508986840 | |
| Gupta V, Mah XJ, Garcia MC, et al. Oily fish, coffee and walnuts: Dietary treatment for nonalcoholic fatty liver disease. World Journal of Gastroenterology, 2015, 21(37): 10621-10635 DOI:10.3748/wjg.v21.i37.10621 | |
| Hammes TO, Pedroso GL, Hartmann CR, et al. The effect of taurine on hepatic steatosis induced by thioacetamide in zebrafish (Danio rerio). Digestive Diseases and Sciences, 2012, 57(3): 675-682 DOI:10.1007/s10620-011-1931-4 | |
| Hu JC. The prevention and control of factory farming Trachinotus ovatus of fatty liver disease. Scientific Fish Farming, 2004(1): 42 [胡金城. 工厂化养殖卵形鲳鲹脂肪肝病的防治. 科学养鱼, 2004(1): 42] | |
| Jia R, Cao LP, Du JL, et al. Effects of carbon tetrachloride on oxidative stress, inflammatory response and hepatocyte apoptosis in common carp (Cyprinus carpio). Aquatic Toxicology, 2014, 152: 11-19 DOI:10.1016/j.aquatox.2014.02.014 | |
| Kuwashiro S, Terai S, Toshiyuki O, et al. Telmisartan improves nonalcoholic steatohepatitis in medaka (Oryzias latipes) by reducing macrophage infiltration and fat accumulation. Cell and Tissue Research, 2011, 344: 125-134 DOI:10.1007/s00441-011-1132-7 | |
| Li GC. Protective effects of Penthorum chinense extract in the treatment of alcoholic fatty liver in Rats. Chinese Journal of Gerontology, 2015(14): 3845-3846, 3847 DOI:10.3969/j.issn.1005-9202.2015.14.022 [李国春. 赶黄草对大鼠酒精性脂肪肝的保护作用及机制. 中国老年学杂志, 2015(14): 3845-3846, 3847] | |
| Li RF. The serum AST/ALT ratio, gamma GT, ALP and AFP combined detection for the diagnosis value of primary hepatic carcinoma. Proceeding of Clinical Medicine, 2015(10): 757-758, 792 [李瑞芳. 血清AST/ALT比值、γ-GT、ALP及AFP联合检测对原发性肝癌的诊断价值. 临床医药实践, 2015(10): 757-758, 792] | |
| Li XM. Causes of fatty liver in fish and its control measure. Animal Science & Veterinary Medicine, 2001, 18(6): 57 [李秀梅. 鱼类脂肪肝病因及防治. 动物科学与动物医学, 2001, 18(6): 57] | |
| Li YN. Liver function and serum indexes inspection in the diagnosis of fatty liver. China Rural Health, 2015(20): 48 [李彦娜. 肝功与血清学指标水平检验在脂肪肝诊断中的应用探讨. 中国农村卫生, 2015(20): 48] | |
| Liao Y, Li LH, Zuo GQ, et al. Establishment and identification of alcohol induced steatotic hepatocytes model. Chongqing Medicine, 2010, 39(8): 902-904 [廖于, 李龙辉, 左国庆, 等. 体外诱导的酒精性脂肪肝细胞模型的建立、鉴定及机制探讨. 重庆医学, 2010, 39(8): 902-904] | |
| Liu J, Li YM, Chen SH, et al. An in vitro hepatic steatosis cell model for study of non-alcoholic fatty liver disease. Journal of Zhejiang University (Medical Sciences), 2009, 38(6): 626-629 [刘江, 厉有名, 陈韶华, 等. 一种实用的体外非酒精性脂肪肝细胞模型. 浙江大学学报 (医学版), 2009, 38(6): 626-629] | |
| Liu SJ, Huang JJ, Che NC, et al. Research advances on mechanism of nonalcohol fatty liver. Journal of Capital Medical University, 2007, 28(2): 216-219 [刘树军, 黄静娟, 车念聪, 等. 非乙醇性脂肪肝发病机制研究进展. 首都医科大学学报, 2007, 28(2): 216-219] | |
| Lu RH, Liang XF, Sun JJ, et al. Establishment of a model of grass carp hepatocyte steatosis and analysis of lipid metabolism gene expression. Journal of Fishery Sciences of China, 2015(1): 24-32 [卢荣华, 梁旭方, 孙君君, 等. 草鱼肝细胞脂变模型的建立及脂代谢基因表达分析. 中国水产科学, 2015(1): 24-32] | |
| Peng YA, He YG. Liver disease symptoms and prevention of fish diseases. Ocean and Fishery, 2007(2): 36 [彭勇鳌, 何有根. 鱼类疾病中肝脏病变症状与防治. 海洋与渔业, 2007(2): 36] | |
| Qiu DK. Research progress of fatty liver. Contemporary Medicine, 2001, 7(5): 23-26 [邱德凯. 脂肪肝研究进展. 当代医学, 2001, 7(5): 23-26] | |
| Sun L, Liu QY, Pei B, et al. The preliminary discussion of changes of serum γ-GT level in patients with chronic hepatitis B and early liver cirrhosis. Chinese Hepatology, 2014(7): 511-512, 524 [孙琳, 刘沁毅, 裴彬, 等. 慢性乙型肝炎及早期肝硬化患者血清谷氨酰转肽酶活性变化的初步探讨. 肝脏, 2014(7): 511-512, 524] | |
| Tainaka T, Shimada Y, Kuroyanagi J, et al. Transcriptome analysis of anti-fatty liver action by Campari tomato using a zebrafish diet-induced obesity model. Nutrition & Metabolism, 2011, 8(1): 1926-1932 | |
| Wang JH, Xue M, Ding JZ, et al. Research progress of fish nutritional fatty liver. Feed Industry, 2008, 29(4): 34-37 [王菊花, 薛敏, 丁建中, 等. 鱼类营养性脂肪肝的研究进展. 饲料工业, 2008, 29(4): 34-37] | |
| Xu P, Zhang XG, Li YM, et al. Research on the protection effect of pioglitazone for non-alcoholic fatty liver disease (NAFLD) in rats. Journal of Zhejiang University Science B, 2006, 7(8): 627-633 DOI:10.1631/jzus.2006.B0627 | |
| Yan HH. Application of liver function and serum index level test in the diagnosis of fatty liver. Medical Information, 2015(31): 213 DOI:10.3969/j.issn.1006-1959.2015.31.305 [颜宏华. 肝功与血清学指标水平检验在脂肪肝诊断中的应用. 医学信息, 2015(31): 213] | |
| Yang LH, Chen DF. Establishment of hepatocyte steatosis models induced by oleic acid. Chongqing Medicine, 2007, 36(8): 698-700 [杨林辉, 陈东风. 油酸诱导培养肝细胞脂肪变性模型的建立. 重庆医学, 2007, 36(8): 698-700] | |
| Zhang HF, Yang HP, Wang YF, et al. Fatty liver models on cellular level in vitro induced by ethanol and palmitic acid. Journal of East China Normal University (Natural Science), 2002(4): 88-95 [张红锋, 杨慧萍, 王耀发, 等. 乙醇和软脂酸诱导的脂肪肝离体细胞模型. 华东师范大学学报 (自然科学版), 2002(4): 88-95] | |
| Zhang HM, Gao YM. Clinical study on the relationship between fatty liver and blood lipid. For All Health, 2015(2): 343 [张海苗, 高玉梅. 脂肪肝与血糖血脂的相关性临床研究. 大家健康, 2015(2): 343] | |
| Zhang SB. Causes of fatty liver in fish and its control measure. China Fisheries, 2011(2): 55 [张水波. 鱼类脂肪肝的成因及防治对策. 中国水产, 2011(2): 55] | |
| Zhang YJ, Zhu Y, Wang J, et al. The combination of Chinese and Western medicine prevention and treatment of fish liver and gallbladder disease in summer. Modern Agricultural Science and Technology, 2009(20): 336, 339 [张盈娇, 朱宇, 王娟, 等. 中西药结合防治养殖鱼类夏季肝胆疾病. 现代农业科技, 2009(20): 336, 339] |



