2. 上海海洋大学 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Shanghai Ocean University, Shanghai 2013061;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
1981年,在美国夏威夷地区细角滨对虾 (Litopenaeus stylirostris) 中发现的传染性皮下及造血组织坏死病毒 (Infectious hypodermal and hematopoietic necrosis virus,IHHNV) 是引起全球养殖对虾疾病的主要病原之一,IHHNV感染的野生和养殖对虾遍布世界各地,世界动物卫生组织 (World Organization for Animal Health,OIE) 将其收录为甲壳类重要疫病之一 (OIE, 2015)。IHHNV能够感染多种对虾,对幼虾危害尤为明显 (Kalagayan et al, 1991),至今尚无有效防治方法。该病毒可使凡纳滨对虾 (Litopenaeus vannamei) 患上慢性矮小残缺综合征 (Runt deformity syndrome,RDS),导致养殖规格参差不齐,产量下降,损失严重 (Bell et al, 1984; Kalagayan et al, 1991; Primavera et al, 2000; Chayaburakul et al, 2004)。Yang等 (2007)首次检测并报道自2001年中国养殖凡纳滨对虾中就发现IHHNV的感染和流行。虾肝肠胞虫 (Enterocytozoon hepatopenaei, EHP) 是专性细胞内寄生的原生生物,2009年于泰国养殖池塘生长迟缓的斑节对虾 (Penaeus monodon) 中发现 (Chayaburakul et al, 2004; Tourtip et al, 2009)。Flegel (2012)报道,EHP在泰国和越南出现白便综合征 (White feces syndrome, WFS) 的斑节对虾和凡纳滨对虾中有较高的检出率,且严重感染虾肝肠胞虫。后虽证明,该微孢子虫并不是引起对虾白便的病原微生物,但无疑对凡纳滨对虾的生长和繁殖有负面影响,且会加重其水平传播的可能性 (Tangprasittipap et al, 2013)。2013年以来,本实验室自国内采集的养殖对虾样品中检测到EHP,表明EHP已在我国存在。该病原在泰国的对虾养殖中已经造成了一定的影响,我国尚未有相关统计和报道。
实时荧光定量PCR用于检测对虾病毒是近期迅速发展起来的新技术,其定量检测灵敏度高、特异性好,已被广泛应用。现已有许多建立完善的实时荧光定量PCR体系用于对虾病毒的检测 (韦信贤等, 2011)。Tang等 (2000)应用实时荧光定量PCR技术,从感染IHHNV后31 d的红额角对虾 (Penaeus stylirostris) 中检测出108的病毒拷贝;王忠发等 (2007)应用实时荧光定量PCR技术检测IHHNV,灵敏度达到50个病毒拷贝。泰国学者报道了PCR法、地高辛标记核酸探针原位杂交法以及LAMP检测方法检测寄生于斑节对虾和凡纳滨对虾肝胰腺中的EHP (Tangprasittipap et al, 2013; Suebsing et al, 2013; Tourtip et al, 2009),本实验室根据GenBank中公布的EHP-SU rDNA序列设计1对特异性引物,建立并优化了EHP实时荧光定量PCR检测方法,检测灵敏度为80个拷贝。
2013年,河北、天津等地区养殖凡纳滨对虾出现育苗期死苗、出苗率低的情况,损失严重。同时,生产上还存在虾苗个体差异较大的现象。经病原检测发现,IHHNV和EHP的感染率较高。为此,本研究随机采集该发病群体仔虾样品,并针对IHHNV和EHP单尾进行实时荧光定量PCR检测,分析IHHNV和EHP在此地区的感染水平,为IHHNV和EHP的混合感染及流行情况提供科学依据。
1 材料与方法 1.1 对虾及病毒样品待检样品为2013年5月14日采自天津大港某育苗场的凡纳滨对虾仔虾活体样品108尾,个体大小差异较大,单尾对虾生物学体长的范围为0.7–2.0 cm,单尾样品重量8–50 mg,编号为20130521001–20130521108。取单尾对虾个体样品提取组织DNA。IHHNV阳性、EHP阳性、肝胰腺细小病毒 (HPV) 阳性、白斑综合征病毒 (WSSV) 阳性、副溶血弧菌 (Vibrio parahaemoly-ticus) 阳性及无特定病原 (Special pathogen free, SPF) 的凡纳滨对虾组织DNA,均由本实验室保存并提供。
1.2 引物和探针IHHNV荧光定量PCR引物及探针参考OIE《水生动物疾病诊断手册》(2015版) 第2.2.2章的荧光定量PCR探针法中推荐的引物和探针:上游引物 (1608F):5'-TACTCC-GGA-CAC-CCA-ACC-A-3';下游引物 (1688R):5'-GGC-TCT-GGC-AGC-AAA-GGT-AA-3';探针 (TaqMan probe):5'-FAM-ACC-AGA-CAT-AGA-CT-ACA-ATC-CTC-GCC-TAT-TTG-TAMRA-3'。EHP的荧光定量PCR荧光染料法检测引物由本实验室设计 (刘珍等, 2016),上游引物EnF:5'-GTA-GCG-GAA-CGG-ATA-GGG-3';下游引物EnR:5'-CCA-GCA-TTG-TCG-GCA-TAG-3';扩增片段为185 bp。以上引物、探针均由生工生物工程 (上海) 股份有限公司合成。
1.3 试剂材料DNA提取试剂盒购自TianGen公司。pMD™ 18-T Vector Cloning Kit,Ex Taq聚合酶 (含10 mmol/L MgCl2、10×PCR Buffer、2.5 mmol/L dNTP each),2×Premix Ex Taq(probe qPCR) 聚合酶及2×SYBR Green Premix Ex Taq聚合酶均购自TaKaRa (大连宝生物) 公司。
1.4 实时荧光定量PCR检测IHHNV 1.4.1 标准品模板的制备以IHHNV阳性样品的DNA为模板,采用引物1608F/1688R进行常规PCR扩增获取目的产物,用pMD18-T载体在E. coli DH5α中克隆,克隆片段送生工生物工程 (上海) 股份有限公司测序验证 (目的片段为81bp)。目的产物的克隆经扩大培养后,用质粒提取试剂盒[生工生物工程 (上海) 股份有限公司]提取质粒DNA。用核酸分析仪 (Nanodrop 2000c, Thermo) 测定重组质粒DNA浓度为157.9 ng/μl,拷贝数为5.20×1010copies/μl DNA,将该重组质粒作为本实验标准品原液,–80℃保存。
1.4.2 反应体系的优化荧光定量PCR-IHHNV反应体系参照Premix Ex TaqTM (Probe qPCR) 试剂盒说明书 (TaKaRa, 大连),冰上配制,设计5×5矩阵法对引物及探针浓度进行优化,引物终浓度梯度分别为0.1、0.2、0.3、0.4、0.5 μmol/L,探针终浓度梯度分别为0.1、0.2、0.3、0.4、0.5 μmol/L。2×Premix Ex Taq (probe荧光定量PCR) 12.5 µl,5.20×103copies/μl的标准品模板1 µl。荧光定量PCR反应程序:95℃ 10 min预变性;95℃ 15 s和60℃ 1 min,40个循环。
1.4.3 特异性实验以WSSV、HPV的阳性样品DNA及SPF凡纳滨对虾组织DNA作为模板,以超纯水为模板做空白对照 (NTC)。使用优化后的体系进行荧光定量PCR,验证引物及探针特异性。
1.4.4 构建标准曲线将构建好的质粒标准品进行10倍梯度稀释,得到5.20×109–5.2×100copies/μl共10个梯度,每组3个平行,使用优化后的体系进行荧光定量PCR,建立质粒标准品拷贝数与Ct值对应的标准曲线。通过分析标准曲线相关系数以及扩增效率来判断标准曲线的质量。使用前述已建立的荧光定量PCR方法对天津大港108份单尾采集的样品分别进行IHHNV的检测。
对已检测的天津大港地区108份凡纳滨对虾样品,进行IHHNV载量指数与对虾生长速率分析。以每微克DNA中IHHNV的相对拷贝数的对数为IHHNV载量指数 (Exponential relative copies, ERC),结合样品采集时测量的对虾单尾生物学体长,分析IHHNV感染对对虾生长的影响,利用Excel绘制对虾生物学体长与IHHNV载量指数的散点图,分析样品体长与IHHNV载量指数二者之间的相关性。
1.5 荧光定量PCR检测EHP 1.5.1 质粒标准品的制备以EHP阳性样品DNA为模板,用引物ENF185/ENR185进行常规PCR扩增获取目的产物,用pMD18-T载体在E. coli DH5α中克隆,克隆的片段送上海生工测序验证 (目的片段185 bp)。目的产物的克隆经扩大培养后,用质粒提取试剂盒 (上海生工) 提取质粒DNA。用核酸分析仪 (Nanodrop 2000c, Thermo) 测定重组质粒DNA浓度为26.3 ng/µl,换算成拷贝数为8.3×109copies/µl,将该重组质粒作为本实验标准品原液,–80℃保存。
1.5.2 反应体系和条件优化荧光定量PCR-EHP反应体系参照SYBR® Premix Ex TaqTM Ⅱ (TliRNaseH Plus) 试剂盒 (TaKaRa,大连) 说明在冰上配制,25 μl的反应体系含SYBR® Premix Ex TaqTM Ⅱ,不同终浓度 (0.1–1.0 μmol/L) 的引物ENF185/ENR185和标准品 (8.3×103 copies) 为模板。95℃预变性30 s后,进行95℃10 s和X℃ 45 s (X为退火温度梯度,设定范围50–65℃) 的40个循环扩增,选择最佳退火温度。扩增完成后测定产物的熔解曲线。
1.5.3 特异性实验使用EHP阳性样品DNA、IHHNV、WSSV、HPV的阳性样品DNA及SPF凡纳滨对虾组织DNA作为模板,以超纯水为模板做空白对照 (NTC)。使用优化后的体系进行荧光定量PCR,验证其特异性。
1.5.4 构建标准曲线已明确标准质粒单位体积拷贝数约为8.3×109copies/μl DNA,经梯度稀释后,分别以8.3×108–8.3×101copies/μl DNA共8个梯度作为模板,实验设置NTC,每组3个平行,使用优化后的体系进行荧光定量PCR,生成标准曲线。使用前述已建立的荧光定量PCR方法对天津大港108份单尾采集的样品分别进行EHP的检测。
对已检测的天津大港地区108份凡纳滨对虾样品,进行EHP载量指数与对虾生长速率分析。以每微克DNA中EHP的相对拷贝数的对数为EHP载量指数,结合样品采集时测量的对虾单尾生物学体长分析EHP感染对对虾生长的影响,利用Excel绘制对虾生物学体长与EHP载量指数的散点图,分析样品体长与EHP载量指数二者之间的相关性。
2 结果与分析 2.1 IHHNV的荧光定量PCR技术的建立 2.1.1 荧光定量PCR-IHHNV扩增条件的建立采用5.2×103copies/μl含有IHHNV目的基因的质粒标准品为模板,确定了荧光定量PCR-IHHNV扩增体系,其中,引物1608F和1688R的最佳浓度为0.5 μmol/L,探针的最佳浓度为0.4 μmol/L,即25 µl荧光定量PCR-IHHNV体系中,含2×Premix Ex Taq (probe荧光定量PCR) 12.5 µl、10 μmol/L引物1608F和1688R各1.25 µl、5 μmol/L探针2 µl、5–50 ng/µl DNA模板1 µl。
2.1.2 特异性实验荧光定量PCR引物及探针特异性实验结果显示 (图 1-a),IHHNV阳性样品DNA的Ct值为28,WSSV阳性、HPV阳性凡纳滨对虾组织DNA和SPF凡纳滨对虾组织DNA与NTC均未检测到荧光信号。产物琼脂糖凝胶电泳结果 (图 1-b) 进一步证实了特异性实验结果,说明此方法引物及探针对IHHNV的检测方法特异性强,无非特异性扩增。
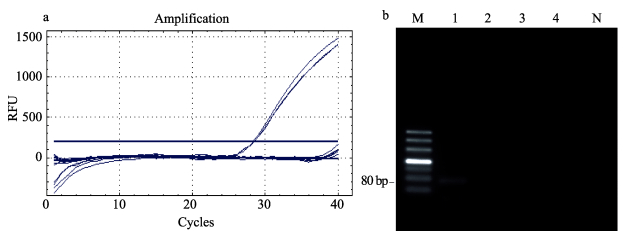
|
图 1 IHHNV荧光定量PCR特异性
Figure 1 Specificity of IHHNV real-time PCR
a.扩增曲线;b.扩增产物电泳结果 M: DL500 DNA Marker (TaKaRa); 泳道1–4分别为IHHNV DNA、HPV DNA、WSSV DNA和SPF对虾组织DNA; N:对照 a. Amplification plots; b. Gel electrophoresis of real-time PCR products M: DL500 DNA Marker (TaKaRa); Lane 1–4: IHHNV DNA, HPV DNA, WSSV DNA, and SPF shrimp DNA respectively; N: NTC (No template control, distilled water) |
将构建好的质粒DNA (浓度为5.2×1010copies/μl) 进行10倍梯度稀释作为模板,分别为109–100copies/μl DNA,共10个梯度。在已优化的体系条件下进行扩增。标准曲线显示,质粒浓度为100时仍可以检测到荧光信号,达到阈值线 (图 2),由此本实验优化的方法检测下限可低至5 copies/μl DNA。
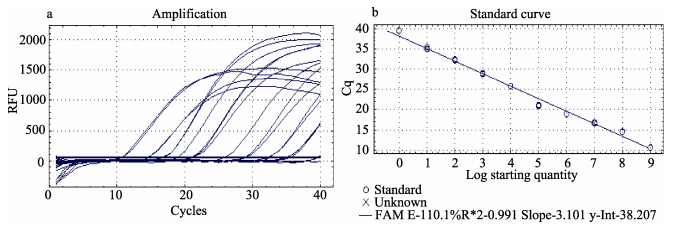
|
图 2 IHHNV荧光定量PCR标准曲线构建 Figure 2 Generation of IHHNV real-time PCR standard curve a. 10×梯度质粒扩增曲线;b.标准曲线 a. 10×gradient of plasmid amplification plots; b. Standard curve |
采用8.3×103copies/µl的含有EHP目的基因的DNA标准品为模板,确定了荧光定量PCR-EHP扩增体系,其中,引物ENF185和ENR185的最佳浓度为0.2 μmol/L。即25 µl qPCR-EHP体系中,含2×SYBR®Premix Ex TaqTM Ⅱ 12.5 µl、10 μmol/L引物ENF185和ENR185各0.5 µl,5–50 ng/µl DNA模板1 µl。退火温度为60℃时,扩增效率和引物特异性最佳,确定荧光定量PCR-EHP反应条件:95℃ 30 s预变性,95℃ 10 s和60℃ 45 s,40个循环。
2.2.2 特异性实验荧光定量PCR引物及探针特异性的实验结果显示 (图 3),除EHP阳性样品DNA在21循环处起峰外,WSSV阳性、IHHNV阳性、HPV阳性、副溶血弧菌阳性和SPF凡纳滨对虾组织DNA与NTC均未检测到荧光信号,说明引物及探针针对EHP的特异性强。

|
图 3 EHP荧光定量PCR特异性
Figure 3 Specificity of EHP real-time PCR
a.扩增曲线;b.扩增产物电泳结果 M: DL500 DNA Marker (TaKaRa);泳道1–6分别为EHP DNA、WSSV DNA、IHHNV DNA、HPV DNA、副溶血弧菌DNA和SPF对虾组织DNA;N:空白对照 a. Amplification plots; b. Gel electrophoresis of real-time PCR products M: DL2000 DNA Marker (TaKaRa); Lane 1–6: EHP DNA, WSSV DNA, IHHNV DNA, HPV DNA, Vibrio Parahaemolyticus DNA, and SPF shrimp DNA respectively; N: NTC (No template control, distilled water) |
将构建好的质粒DNA (浓度为8.3×109copies/μl)10倍梯度稀释作为模板,分别为108–101 copies/μl DNA共8个梯度,在已优化的体系条件下进行扩增。标准曲线显示,质粒浓度在101处可检测到荧光信号 (图 4),由此本实验优化的方法检测下限为80 copies/μl DNA。
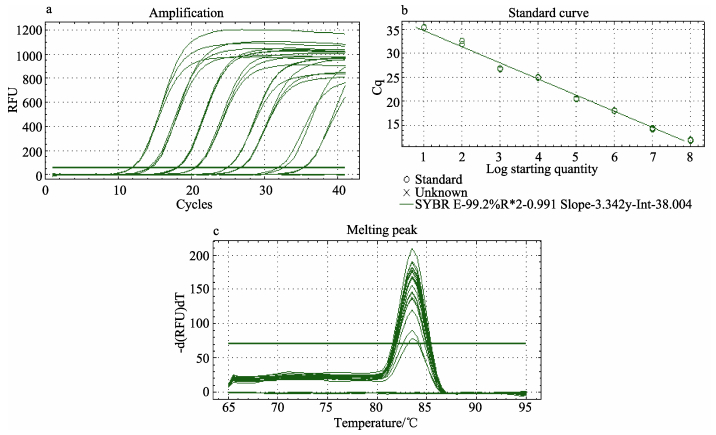
|
图 4 EHP荧光定量PCR标准曲线构建 Figure 4 Generation of EHP real-time PCR standard curve a. 10×梯度质粒扩增曲线; b.标准曲线; c.熔解曲线 a. 10×gradient of plasmid amplification plots; b. Standard curve; c. Melting curve |
IHHNV荧光定量PCR检测结果以每微克对虾组织DNA所含病毒拷贝数 (copies/μg DNA) 表示。结果显示,IHHNV的阳性率为100%,病毒拷贝数最低为1.01×103copies/μg DNA (体长0.9 cm对虾),最高为3.07×107copies/μg DNA (体长2.0 cm对虾),个体较小的样品 (54尾,体长0.7–1.1 cm对虾) 每微克对虾组织DNA中病毒拷贝数在103–105copies/μg DNA之间;个体较大的样品 (54尾,体长1.2–2.0 cm对虾) 拷贝数则在104–107copies/μg DNA之间。EHP的阳性率为49.1%,EHP拷贝数最低为3.26×102copies/μg DNA (体长1.4 cm对虾),最高为1.25×106copies/μg DNA (体长0.8 cm对虾)。EHP阳性的样品每微克DNA的拷贝数在103–105copies/μg DNA之间,且阳性主要集中在个体较小 (体长0.7–1.1 cm) 的对虾样品中 (表 1)。
|
|
表 1 荧光定量PCR检测天津大港凡纳滨仔虾IHHNV和EHP Table 1 Real-time PCR result of IHHNV and EHP detection for L. vannamei from Tianjin Dagang |
对采集自天津大港108份凡纳滨对虾样品进行逐尾体长测定和对虾组织中IHHNV、EHP的qPCR检测,该批凡纳滨仔虾样品来源于同时放苗的样品,但批内体长大小不均匀、生长缓慢。108份样品中,荧光定量PCR-IHHNV阳性检出率为100%,平均体长 (1.19±0.32) cm,分布在0.7–1.8 cm范围。荧光定量PCR检测结果见表 1,平均IHHNV载量指数 (Exponential relative copies of IHHNV, ERCIHHNV) 为4.93±0.90,平均拷贝数为8.51×104copies/μg DNA,与对虾体长呈正相关性 (R=1.1419)(图 5)。
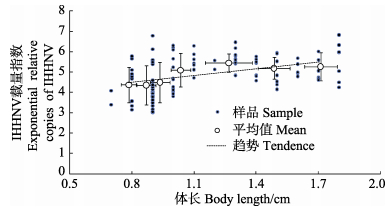
|
图 5 凡纳滨对虾中IHHNV载量指数与对虾体长的相关性 Figure 5 Correlation of body length and exponential relative copies of IHHNV (ERCIHHNV) in L. vannamei |
从表 1可知,108份凡纳滨样品中,有55尾对虾在40个循环的荧光定量PCR-EHP检测中未出现扩增信号,检出率为49.1%,对53份阳性凡纳滨对虾样品进行EHP载量指数 (ERCEHP) 与对虾体长的相关性分析,其中,平均体长为 (1.00±0.24) cm对虾的平均EHP载量指数 (ERCEHP) 为4.34±0.81,拷贝数为2.19×104copies/μg DNA,两者呈轻微的负相关性 (R=–0.4791)。体长分布在0.7–1.1 cm对虾的EHP阳性率最高,且平均EHP载量指数达到 (4.42±0.0.78),平均拷贝数为2.63×104copies/μg DNA (图 6)。
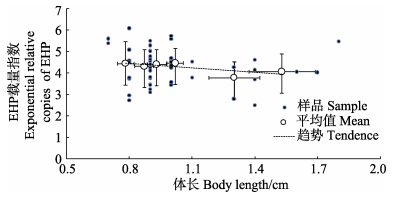
|
图 6 凡纳滨对虾中EHP载量指数与对虾体长的相关性 Figure 6 Correlation of body length and exponential relative copies of EHP (ERCIHHNV) in L. vannamei |
凡纳滨对虾以其盐度适应范围广、生长速度快、抗病力强等优点已成为国内主要对虾养殖品种。然而,种苗及亲虾的大量引进增加了疾病传入我国的机率,且造成了一定经济损失。Yang等 (2007)针对2001–2004年国内299份养殖对虾IHHNV流行情况进行分析,该病毒阳性检出率为51.4%,在国内一直呈流行趋势。童桂香等 (2013)根据广西凡纳滨对虾养殖情况,分别在北海市、钦州市、防城港市设立监测区,应用PCR对采集样品进行IHHNV检测,2010–2012年IHHNV阳性率分别为62.1%、44.3%和32.1%。通过严格控制亲虾品质及引进无病毒感染种苗,凡纳滨对虾品质已得到提升,IHHNV感染呈逐年下降的趋势。EHP近年来已成为导致对虾生长缓慢的主要病原性因素之一,且在亚洲多个国家检出。我国针对2013–2015年的养殖对虾EHP携带情况进行调查,显示其具有较高的风险水平。
PCR技术在水产养殖病原检测中的应用已非常广泛,相对于传统的组织学方法省时省力。现已建立和报道了多种检测IHHNV的PCR方法,并且被OIE收录和推荐使用 (Shike et al, 2000; Tang et al, 2000、2001、2007; Nunan et al, 2000; Krabsetsve et al, 2004)。荧光定量PCR技术以其特异性和准确性高等特点逐渐被广泛应用于水产动物病原的检测,其灵敏度高于普通PCR,解决了常规PCR无法对扩增反应进行实时监测和对起始模板准确定量的问题 (钟江华等, 2011),作为一种新的成熟核酸检测方法广泛用于基因检测、传染病诊断等诸多领域。任聪等 (2009)建立了IHHNV实时荧光定量PCR检测方法,并优化了体系和退火温度,检测灵敏度能达到10个病毒拷贝。徐丽美等 (2013)建立的实时荧光定量PCR方法检测灵敏度能达到10个病毒拷贝。本研究中,采用OIE推荐的Real-time PCR检测IHHNV,在进行体系优化后,其检测灵敏度可低至5个病毒拷贝。本研究建立的荧光定量PCR检测EHP的灵敏度为80个拷贝。
荧光定量PCR检测IHHNV,阳性检出率为100%,个体较小的样品病毒拷贝数 (103–105 copies/μg DNA) 低于个体较大的样品病毒拷贝数 (104–107 copies/μg DNA)。IHHNV会造成养殖凡纳滨对虾患矮小残缺综合征,导致个体大小参差不齐,检测结果表明自然状态下感染IHHNV的同一批凡纳滨对虾仔虾中,个体较大的IHHNV的带毒量比个体较小的高1个数量级,研究认为IHHNV在宿主体内的复制取决于宿主生长的年龄阶段,IHHNV的病毒粒子极小,其携带基因量很有限,所以病毒主要依靠其宿主细胞来进行复制增殖 (Tang et al, 2001),结果使得个体生长较大的仔虾带毒量会高,这与本实验的检测结果相符合;EHP阳性检出率为49.1%,每微克DNA的拷贝数在103–105之间,阳性主要集中在个体较小的样品中。而通过对对虾体长与IHHNV载量指数分析显示IHHNV载量指数与对虾体长呈正相关性,平均IHHNV载量指数为4.93±0.90,拷贝数达到8.51×104copies/μg DNA左右时,对天津大港地区凡纳滨对虾养殖造成严重经济损失,达到较高的风险水平;而对虾体长与EHP载量指数成轻微的负相关性,平均EHP载量指数为4.34±0.81,拷贝数达到2.19×104copies/μg DNA,达到较高的风险水平。这与对虾生长速率与EHP载量关系的荧光定量PCR-EHP验证结果相一致 (刘珍等, 2016)。通过本实验数据,造成天津大港地区凡纳滨对虾生长缓慢参差不齐的原因,为IHHNV和EHP协同感染凡纳滨对虾仔虾造成,而两种病原相关性差异的原因可能与病原感染时间早晚、虾体对不同病原抵抗力的差异,虾苗健康状况等综合因素有关。
本实验随机采集天津大港某养殖场108份凡纳滨仔虾样品,IHNNV阳性率为100%,表明IHHNV在该批次养殖对虾中流行非常严重,因此,对IHHNV的防控应引起更多的重视。EHP对对虾生长和繁殖的危害尚无确切的研究结果,但其感染导致对虾生长缓慢的问题应给予更多关注。近年来,EHP在我国对虾养殖中已存在并流行,本研究通过定量的方法对对虾体长与EHP载量关系的荧光定量PCR-EHP进行了验证,对其更多的检测和研究十分必要。本研究首次提供IHHNV和EHP同时进行定量检测的数据,河北、天津地区的育苗期死苗及出苗率低的情况与两种病原的混合感染有极大相关性。研究显示,两种病原同时感染,其载量存在一定的相关性,即体长相对较小的个体EHP载量较IHHNV偏高,而体长较大则反之。导致同一批的养殖对虾个体偏小、生长缓慢的现象是由于单一病原作用还是两种病原共同导致,以及对于两种病原感染的相互作用机制和混合感染的危害评估等还需要更深入的研究。
| Bell TA, Lightner DV. IHHN virus infectivity and pathogenicity studies in Penaeus stylirostris and Penaeus vannamei. Aquaculture, 1984, 38(3): 185-194 DOI:10.1016/0044-8486(84)90142-X | |
| Chayaburakul K, Nash G, Pratanpipat P, et al. Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand. Diseases of Aquatic Organisms, 2004, 60(2): 89-96 | |
| Flegel TW. Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 2012, 110(2): 166-173 DOI:10.1016/j.jip.2012.03.004 | |
| Kalagayan H, Godin D, Kanna R, et al. IHHN virus as an etiological factor in runt-deformity syndrome (RDS) of juvenile Penaeus vannamei cultured in Hawaii. Journal of the World Aquaculture Society, 1991, 22(4): 235-243 DOI:10.1111/jwas.1991.22.issue-4 | |
| Krabsetsve K, Cullen BR, Owens L. Rediscovery of the Australian strain of infectious hypodermal and haematopoietic necrosis virus. Diseases of Aquatic Organisms, 2004, 61(1-2): 153-158 | |
| Liu Z, Zhang QL, Wan XY, et al. Development of real-time PCR assay for detecting microsporridian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates. Progress in Fishery Science, 2016, 37(2): 119-126 DOI:10.11758/yykxjz.20150512003 [刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫 (Enterocytozoon hepatopenaei) 实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119-126] | |
| Nunan LM, Poulos BT, Lightner DV. Use of polymerase chain reactionfor detection of infectious hypodermal and hematopoieticnecrosis virus in penaeid shrimp. Marine Biotechnology, 2000(4): 319-328 | |
| OIE, World Organisation For Animal Health. Diagnostic manual for aquatic animal diseases, Paris, France, 2014, 119-137 | |
| Primavera JH, Quinitio ET. Runt-deformity syndrome in cultured giant tiger prawn Penaeus monodon. Journal of Crustacean Biology, 2000, 20(4): 796-802 DOI:10.1163/20021975-99990101 | |
| Ren C, Chen XZ, Gong YQ, et al. Real-time fluorescence quantitative PCR for the detection of infectious hypodermal and haematopoietic nerosis viurs in penaeid shrimp. Chinese Journal of Animal Quarantine, 2009, 26(2): 38-41 [任聪, 陈信忠, 龚艳清, 等. 实时荧光定量PCR法检测对虾皮下和造血器官坏死病毒. 中国动物检疫, 2009, 26(2): 38-41] | |
| Shike H, Dhar AK, Burns JC, et al. Infectious hypodermal and hematopoietic necrosis virus of shrimp is related to mosquito brevidenso viruses. Virology, 2000, 277(1): 167-177 DOI:10.1006/viro.2000.0589 | |
| Suebsing R, Prombun P, Srisala J, et al. Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei in penaeid shrimp. Journal of Applied Microbiology, 2013, 114(5): 1254-1263 DOI:10.1111/jam.2013.114.issue-5 | |
| Tang KFJ, Durand SV, White BL, et al. Postlarvae and juveniles of a selected line of Penaeus stylirostris are resistant to infectious hypodermal and hematopoietic necrosis virus infection. Aquaculture, 2000, 190(3-4): 203-210 DOI:10.1016/S0044-8486(00)00407-5 | |
| Tang KFJ, Navarro SA, Lightner DV. PCR assay for discriminating between infectious hypodermal and hematopoietic necrosis virus (IHHNV) and virus-related sequences in the genome of Penaeus monodon. Diseases of Aquatic Organisms, 2007, 74(2): 165-170 DOI:10.3354/dao074165 | |
| Tang KFJ, Lightner DV. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus in penaeid shrimp by real-time PCR. Diseases of Aquatic Organisms, 2001, 44(2): 79-85 | |
| Tangprasittipap A, Srisala J, Chouwdee S, et al. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei. BMC Veterinay Research, 2013(1): 1-10 | |
| Tong GX, Wei XX, Wu WJ, et al. Investigation and analysis of infectious hypodermal and hematopoietic necrosis virus infection in Penaeus vannamei in Guangxi. Journal of Southern Agriculture, 2013, 44(12): 2089-2093 DOI:10.3969/j:issn.2095-1191.2013.12.2089 [童桂香, 韦信贤, 吴伟军, 等. 广西凡纳滨对虾IHHNV感染情况的调查与分析. 南方农业学报, 2013, 44(12): 2089-2093] | |
| Tourtip SS, Wongtripop GD, Stentiford KS, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21-29 DOI:10.1016/j.jip.2009.06.004 | |
| Wang ZF, Wang JY, Lu YY, et al. Development and application of a Real-time PCR-based diagnostic for IHHNV. Chinese Journal of Health Laboratory Technology, 2007, 17(9): 1591-1593 [王忠发, 王建跃, 卢亦愚, 等. 实时荧光定量PCR快速检测对虾IHHNV载量方法的建立和应用. 中国卫生检验杂志, 2007, 17(9): 1591-1593] | |
| Wei XX, Li XZ, Tong GX. Technique and application of real-time fluorescent quantitative PCR in diagnosis of aquatic animal virosis: A review. Fisheries Science, 2011, 29(11): 681-687 DOI:10.3969/j.issn.1003-1111.2011.11.006 [韦信贤, 黎小正, 童桂香, 等. 实时荧光定量PCR技术及其在水生动物病毒病定量检测中的应用. 水产科学, 2011, 29(11): 681-687] | |
| Yang B, Song XL, Huang J, et al. Evidence of existence of infectious hypodermal and hematopoietic necrosis virus in penaeid shrimp cultured in China. Veterinary Microbiology, 2007, 120(1-2): 63-70 DOI:10.1016/j.vetmic.2006.10.011 | |
| Zhong JH, Zhang GZ, Liu XY. Development of real-time fluorescent quantitative PCR and its application. Amino Acids and Biotic Resources, 2011, 33(2): 68-72 [钟江华, 张光萍, 柳小英. 实时荧光定量PCR技术的研究进展与应用. 氨基酸和生物资源, 2011, 33(2): 68-72] |



