2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛大学生命科学学院 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. College of Life Science, Qingdao University, Qingdao 266071
原癌基因c-Jun是促分裂原活化蛋白激酶AP-1 (Activator protein 1) 复合物家族的一个重要转录因子。AP-1复合物包括Jun(Jun proto-oncogene)(c-jun、jun-B和jun-D)、Fos(c-Fos、Fos-B、Fra-1和Fra-2) 及Atf (Activating transcription factor) 因子 (Eferl et al, 2003)。在细胞的催化区域,c-Jun和c-Fos通过亮氨酸拉链结构 (BRLZ, Leucine zipper structure domain) 相互结合,再通过Atf蛋白嵌合,形成异质二聚体,并绑定AP-1启动子结合位点,调节神经元中下游基因的转录 (Angel et al, 1988; Bohmann et al, 1987)。JUN蛋白以及FOS蛋白组成DNA结合蛋白,根据不同的生物体信号指挥转录调节基因的表达,它主要参与体内免疫应答,调节细胞增殖分化、肿瘤生长、细胞死亡 (Blau et al, 2012; Karin et al, 2001; Shaulian, 2010; Vesely et al, 2009)。c-Jun基因以及其家族转录因子广泛参与到B细胞受体信号通路、T细胞受体信号通路、MASP信号通路以及JNK信号通路等诸多的信号通路中,并在各个通路中发挥着重要的信号传导作用,因此,对c-Jun以及相关转录因子的研究必将对信号通路的探索提供重要线索 (Novoszel, 2013)。
c-Jun的研究始于20世纪80年代中后期,研究表明其在哺乳动物、鸟类的生长发育、免疫应答中起着重要作用 (Alladi et al, 2005; Santos et al, 2012)。目前,c-Jun家族基因的克隆以及功能已在一些鱼类中进行了研究,包括鲫鱼 (Carassius auratus) (Fujikawa et al, 2006)、鲢鱼 (Hypophthalmichthys molitrix) (李园园等, 2013)、点带石斑鱼 (Epinephelus coioiaes) (Wei et al, 2015)、虹鳟 (Oncorhynchus mykiss) (Matsuoka et al, 1998) 等,但在半滑舌鳎 (Cynoglossus semilaevis) 中却未有相关报道。半滑舌鳎是我国重要的海水养殖鱼类,养殖规模日益扩大,而养殖病害问题一直是影响产业可持续发展的瓶颈。因此,探讨半滑舌鳎抗病分子机制将会对半滑舌鳎的病害防治提供重要理论基础,本研究将重点解析c-Jun基因鉴定、表达模式及免疫应答表达分析,以期探明半滑舌鳎免疫机制的理论基础。
1 材料与方法 1.1 实验鱼以及病原实验用半滑舌鳎购于日照东鑫现代渔业技术研究所,为1.5龄鱼,平均体长为30 cm。鳗弧菌 (Vibrio anguillarum) 由本实验室自行保存。
1.2 主要试剂TRIzol试剂 (Invitrogen, 美国);总RNA提取试剂盒 (天跟);Trans-T1(全式金);PrimeScriptTM RT reagent试剂盒 (Perfect Real-time) (TaKaRa);5'-Full RACE试剂盒 (TaKaRa);3'-Full RACE试剂盒 (TaKaRa, 大连) 等。
1.3 实验方法 1.3.1 鳗弧菌感染实验实验鱼暂养于60 cm× 30 cm×40 cm塑料箱中,20-22℃水温条件下暂养7 d以消除环境胁迫。鳗弧菌感染实验参照Sha等 (2012)略作修改,实验组按照3.18×105CFU/g (半数致死量, LD50) 的剂量进行腹腔注射,对照组注射等体积1×PBS溶液。分别在注射后0、6、12、24、48、72 h共6个时间点取样,每个时间点3个样本,分别取肝、小肠、脾、头肾、鳃、血液6种组织;另外,随机选3条健康鱼,分别收集肝、脾、头肾、后肾、小肠、胃、血液、鳃、皮肤、肌肉、心脏、脑、卵巢13个组织,所有组织迅速投入液氮中,随后将其转移至–80℃冰箱中保存,用于总RNA提取。
1.3.2 细胞感染实验脂多糖Lipopolysaccharide (LPS, 革兰氏阴性菌模拟物)、肽聚糖Peptidoglycan (PGN, 革兰氏阳性菌模拟物)、聚肌胞Poly muscle cell (PolyI:C, 病毒模拟物) 和葡聚糖Dextran (WGP, 真菌模拟物) 分别稀释到50 ng/ml、100 μg/ml、50 μg/ml、50 μg/ml,感染6孔板中接种的半滑舌鳎外周血淋巴细胞,PBS组为对照组,每组3个平行。感染后0.5 h收集细胞悬液,1000 r/min、5 min离心去培养基,使用PBS洗涤半滑舌鳎外周血淋巴细胞数次,加入新培养基进行培养。分别在0、2、6、12、24 h共5个时间点取样。低温离心去上清,各加1 ml TRIzol试剂收集细胞,–80℃冰箱超低温保存,待提取RNA。
1.3.3 总RNA提取与cDNA第一链合成液氮条件下研磨收集的组织,先加入500 μl的裂解液RZ裂解并研磨充分,最后再加入500 μl裂解液充分裂解,具体步骤参照总RNA提取试剂盒 (天根) 提取操作说明,得到的RNA在1%琼脂糖上进行电泳检测,并用紫外分光光度计检测所提取的RNA浓度及质量。取1 μl的RNA,按照TaKaRa反转录试剂盒 (TaKaRa) 说明书,首先去除基因组DNA,再进行反转,反转产物稀释到相应倍数作为qRT-PCR模板。
1.3.4 c-Jun基因的克隆根据本实验室转录组测序获得的c-Jun基因cDNA序列 (Zhang et al, 2015),运用Primer 5.0软件设计CDS扩增引物c-Jun-F、c-Jun-R (表 1),以半滑舌鳎混合组织cDNA为模板,扩增目的基因;设计5'-RACE扩增引物RACE-F1、RACE-R1和3'-RACE扩增引物RACE-F2、RACE-R2 (表 1),按照TaKaRa RACE扩增试剂盒说明书对5'-UTR和3'-UTR进行扩增。PCR产物用1%琼脂糖检测,进行切胶回收,连接T载体,转化到感受态细胞中,并孵育、涂板,培养过夜后挑取单克隆,菌液PCR检测选取阳性单克隆后送苏州金唯智生物有限公司测序。
|
|
表 1 实验所用引物 Table 1 Primers and their sequences used in this study |
运用NCBI的Protein Blast (http://blast.ncbi.nlm.nih.gov/) 分析半滑舌鳎C-JUN和其他同源蛋白的相似性,SMART (http://smart.embl-heidelberg.de/) 预测蛋白质结构域ClustalW (http:www.genome.jp/tools/clustalw/) 以及MEGA 5.0 (http://megasoftware.net) 进行序列比对,采用Neighbour-Joining方法构建系统进化树。
1.3.6 c-Jun基因组织表达分析运用实时荧光定量PCR技术检测c-Jun基因在各个组织中的表达情况。以半滑舌鳎18S rRNA作为内参,采取三步法进行PCR扩增:95℃预变性15 min;95℃变性10 s,60℃退火20 s,最后72℃延伸30 s,同时采集荧光信号,共40个循环,程序自动加入熔解曲线分析,分析结束后采用ABI-7500Fast自有软件SDS v2.0.6对扩增曲线、熔解曲线分析,相对定量分析采用2–DDCt法计算,7500 software v2.0.6处理结果后导出相对定量数据,用SPSS 19.0对数据进行单因素分析,利用Origin 9.0制作相对定量表达柱状图。18S rRNA扩增引物和组织特异性检测引物序列见表 1。
2 结果 2.1 c-Jun基因cDNA序列扩增以半滑舌鳎混合组织为模板,扩增得到c-Jun基因cDNA全长为2093 bp,CDS区域共含有981个碱基,编码326个氨基酸,其5' UTR为377 bp,3' UTR为735 bp。预测编码蛋白质的分子量约为35.9 kDa,等电点为8.24。通过在线蛋白质结构与预测软件Smart分析得c-Jun编码的蛋白质含有JUN结构域和1个高度保守的亮氨酸拉链 (BRLZ) 结构域 (图 1)。

|
图 1 半滑舌鳎c-Jun基因cDNA序列以及推导的氨基酸序列 Figure 1 The cDNA and deduced amino acid sequences of C. semilaevis c-Jun 图中下划线所标出的5–236号氨基酸为JUN结构域,用方框圈出的245–309号氨基酸为亮氨酸拉链结构域 (BRLZ) The JUN domain from No.5 to No.236 amino acid residues is marked by an underline, the leucine zipper structure domain (BRLZ) from No.245 to No.309 amino acid residues is marked by a box |
利用Protein blast对在NCBI数据库中下载的其他物种:斑马鱼 (Danio rerio, NP_956281.1)、大黄鱼 (Larimichthys crocea, XP_010738075.1)、非洲爪蟾 (Xenopus laevis, NP_001084266.1)、红鳍东方鲀 (Takifugu rubripes, XP_003974079.1)、虹鳟 (Oncorhynchus mykiss, NP_001117883.1)、孔雀鱼 (Poecilia reticulata, XP_008405560.1)、罗非鱼 (Oreochromis niloticus, XP_005478994.1)、青鳉 (Oryzias latipes, XP_ 004068223.1)、原鸡 (Gallus gallus, NP_001026460.1)、人 (Homo sapiens, NP_002219.1)、小鼠 (Mus musculus, NP_034721.1) 的C-JUN蛋白同源序列进行氨基酸序列比对 (图 2)。结果显示,半滑舌鳎C-JUN蛋白序列与其他物种相似度很高,与大黄鱼C-JUN序列相似高达94%,与其他几种常见硬骨鱼类相似度在90%左右,亮氨酸拉链结构域氨基酸序列在不同的物种之间均呈现出高度的相似性。系统进化树分析显示 (图 3),鱼类的c-Jun聚为一支,其中,半滑舌鳎首先与虹鳟聚为一支;红鳍东方鲀首先与青鳉聚为一支,然后又与大黄鱼、罗非鱼聚为一支。鱼类与两栖类、鸟类和哺乳类的c-Jun分别聚类在两大不同的分支上,显示鱼类的亲缘关系更为接近。

|
图 2 半滑舌鳎C-JUN蛋白质多重序列比对结果 Figure 2 The multiple sequence alignment of the C-JUN protein 用黑色线框标注的是亮氨酸拉链结构域 (BRLZ) Leucine zipper structure domain (BRLZ) is marked by a black box |

|
图 3 半滑舌鳎c-Jun与其他物种c-Jun系统进化分析 Figure 3 Phylogenetic analysis of C. semilaevis c-Jun sequence with other c-Jun sequences in fish, amphibians, birds and mammals |
c-Jun基因在健康半滑舌鳎13种组织:肝脏、小肠、脾脏、头肾、后肾、鳃、血液、脑、皮肤、肌肉、胃、心脏、卵巢中均有不同程度的表达 (图 4)。其中,卵巢中的表达量最高,后肾中的表达最低,卵巢中的表达量是后肾中的14.43倍;其次在皮肤中的表达较高,另外在脑、鳃、肝、脾、小肠组织中也都有较高的表达。
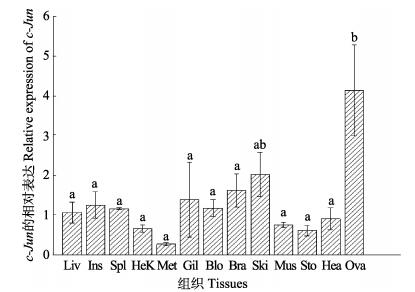
|
图 4 半滑舌鳎c-Jun基因在不同组织中的表达分布 Figure 4 c-Jun gene of C. semilaevis expression profile in different tissues Liv:肝脏; Ins:小肠; Spl:脾脏; HeK:头肾; Met:后肾; Gil:鳃; Blo:血液; Bra:脑; Ski:皮肤; Mus:肌肉; Sto:胃; Hea:心脏; Ova:卵巢。图中“a, b”为SPSS软件中Duncan算法计算出的子集分组,有相同字母表示差异不显著 (P > 0.05),无相同字母表示差异显著 (P < 0.05) Liv: Liver; Ins: Intestine; Spl: Spleen; HeK: Head-kidney; Met: Metanephros; Gil: Gill; Blo: Blood; Bra: Brain; Ski: Skin; Mus: Muscle; Sto: Stomach; Hea: Heart; Ova: Ovary. The letters "a, b" were subsets by Duncan algorithm. The same letters indicated no significant difference (P > 0.05), the different letters indicated significant difference (P < 0.05) |
鳗弧菌感染半滑舌鳎后,c-Jun基因在主要免疫组织的表达如图 5所示。c-Jun的表达量在6种组织 (肝脏、脾脏、鳃、血液、头肾、小肠) 均呈现上升趋势,达到峰值后开始降低到正常量。鳃和血液中变化趋势最为明显,设定0 h表达量为标准,表达量为1,在鳃中12 h的表达量达到0 h的13.20倍 (P < 0.01),之后在24 h迅速下降到0 h的2.10倍 (P < 0.05),开始回归正常水平;血液中的表达变化趋势与鳃中相似,也在12 h达到最高峰,是0 h表达水平的5.79倍 (P < 0.01),之后也开始下降;其他免疫相关的组织中也呈现不同程度的上升趋势,其中,肝脏中表达峰值为0 h的4.32倍 (P < 0.01),小肠组织中的变化是在6 h时上升到最高,为0 h的4.75倍 (P < 0.01);c-Jun基因在脾和头肾表达峰值均出现在24 h,头肾中24 h表达量是0 h的4.62倍 (P < 0.01);脾脏中24 h时的表达量为0 h的3.41倍 (P < 0.01)。
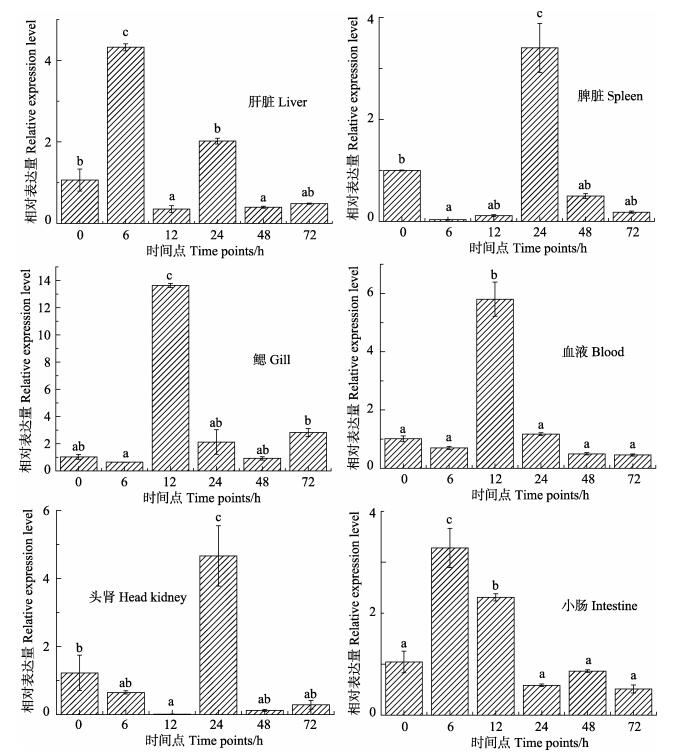
|
图 5 鳗弧菌感染后半滑舌鳎c-Jun在免疫组织中表达变化 Figure 5 The expression of C. semilaevis c-Jun gene in immunologic tissues after V. anguillarum infection 图中“a, b, c”为SPSS软件中Duncan算法计算出的子集分组,下同 The letters "a, b, c" were subsets by Duncan algorithm, the same as below |
c-Jun基因在不同病原模拟物处理后的外周血淋巴细胞中表现出不同的表达趋势 (图 6)。其中,LPS处理后的细胞中c-Jun表达量呈现下降趋势,2 h后表达量即下降到了0 h时的33.26%,并一直保持在低的表达状态;PGN处理组没有明显的变化;PolyI:C处理后表达量也下降;WGP组处理之后,c-Jun基因表达量有所升高,在6 h相对表达量达到峰值,为0 h时的2.49倍,之后在12 h、24 h时呈现下降趋势。
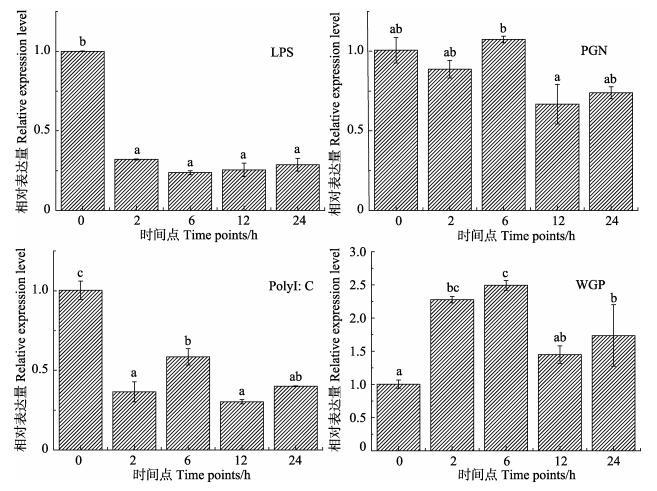
|
图 6 病原模拟物处理后半滑舌鳎c-Jun基因在外周血淋巴细胞中的表达分布 Figure 6 The expression of C. semilaevis c-Jun gene in lymphocyte after stimulation with LPS, PGN, Poly I: C and WGP respectively |
本研究结果显示,半滑舌鳎C-JUN蛋白中具有典型的亮氨酸拉链结构域,而且通过蛋白质多重序列比对得知,不同物种之间C-JUN的亮氨酸拉链结构域具有高度的保守性,由此可以推测,半滑舌鳎的C-JUN可能通过亮氨酸拉链结构域结合特异目标蛋白,从而在不同的信号通路中发挥信号传递、调控的功能 (Angel et al, 1988)。
c-Jun基因在健康半滑舌鳎不同的组织中呈现组成型表达,谭俊等 (2012)1)在文昌鱼 (Branchiostoma japonicum) 的研究已经证明了AP-1家族基因与卵巢发育、机体免疫密切相关;本研究中,半滑舌鳎c-Jun基因在卵巢中表达量最高,由此可以推测,半滑舌鳎c-Jun基因在卵巢发育或母源免疫中或许发挥重要的作用。
1) Tan J. Molecular cloning and expression of transcription factor AP-1 in amphioxus Branchiostoma japonicum. Masterxs Thesis of Shanghai Ocean University, 2012 [谭俊.日本文昌鱼转录因子AP-1基因的克隆和表达.上海海洋大学硕士研究生学位论文, 2012]
经鳗弧菌感染后c-Jun基因在半滑舌鳎各免疫组织都呈现出不同程度的上调趋势,推测c-Jun转录因子参与了革兰氏阴性菌引起的机体免疫信号传导。结合之前学者对AP-1家族基因参与免疫反应机制的研究 (Ameyar et al, 2003; 吴冰等, 2014),推测在半滑舌鳎B细胞受体激活的通路中,机体经过外源细菌刺激后,会迅速发生信号传递作用于通路下游因子,而受通路信号刺激之后,c-Jun基因与c-Fos基因会迅速而短暂地被诱导表达 (Tischmeyer et al, 1999),由于二者都具有亮氨酸拉链结构,因此可以在Atf基因的嵌合作用下形成二聚体,然后再与DNA序列特异性的结合 (Uimari et al, 1997) 作用在B细胞膜受体上激活B细胞通路,从而使B细胞尽快参与到体液免疫,发挥免疫应答作用。
LPS、PolyI:C、WGP分别是革兰氏阴性菌、病毒、真菌真菌模拟物,经不同病原模拟物处理后,在淋巴细胞的表达只有WGP组出现明显上调趋势,LPS、PolyI:C组经处理后呈现不同程度的下调趋势,而PGN组没有明显的变化。由此可以推测,c-Jun在介导信号通路的过程中,对病原的识别具有广谱性,但由于体外单独的培养环境很难达到体内的状态,使其缺乏了一些激活该通路的介导因子,因此,不会产生像体内一样在短的时间内出现显著变化,但该实验同时也可以从细胞层面上确定c-Jun基因在免疫过程中发挥着积极作用。
综上,本研究报告了半滑舌鳎c-Jun基因的克隆和鉴定,分别从个体及细胞两个水平对半滑舌鳎的c-Jun基因的表达分析进行了研究,研究结果显示,该基因参加了半滑舌鳎的免疫应答,为今后更深入研究半滑舌鳎的免疫应答机理提供了详实的数据,奠定了理论基础。
| Alladi PA, Roy T, Singh N, et al. Developmentally regulated expression of c-Fos and c-Jun in the brainstem auditory nuclei of Gallus domesticus is modified by prenatal auditory enrichment. Journal of Neurobiology, 2005, 62(1): 92-105 DOI:10.1002/(ISSN)1097-4695 | |
| Ameyar M, Wisniewska M, Weitzman J. A role for AP-1 in apoptosis: The case for and against. Biochimie, 2003, 85(8): 747-752 DOI:10.1016/j.biochi.2003.09.006 | |
| Angel P, Allegretto EA, Okino ST, et al. Oncogene jun encodes a sequence-specific trans-activator similar to AP-1. Nature, 1988, 332(6160): 166-171 DOI:10.1038/332166a0 | |
| Blau L, Knirsh R, Bendror I, et al. Aberrant expression of c-Jun in glioblastoma by internal ribosome entry site (IRES)-mediated translational activation. Proceedings of the National Academy of Sciences, 2012, 109(42): 2875-2884 DOI:10.1073/pnas.1203659109 | |
| Bohmann D, Bos TJ, Admon A, et al. Human proto-oncogene c-jun encodes a DNA binding protein with structural and functional properties of transcription factor AP-1. Science, 1987, 238(4832): 1386-1392 DOI:10.1126/science.2825349 | |
| Eferl R, Wagner EF. AP-1: A double-edged sword in tumorigenesis. Nature Reviews Cancer, 2003, 3(11): 859-868 DOI:10.1038/nrc1209 | |
| Fujikawa Y, Kozono K, Esaka M, et al. Molecular cloning and effect of c-fos mRNA on pharmacological stimuli in the goldfish brain. Comparative Biochemistry and Physiology, Part D: Genomics and Proteomics, 2006, 1(2): 253-259 DOI:10.1016/j.cbd.2005.12.005 | |
| Karin M, Shaulian E. AP-1: Linking hydrogen peroxide and oxidative stress to the control of cell proliferation and death. IUBMB Life, 2001, 52(1-2): 17-24 | |
| Li YY, Ma JG, Li XY. Cloning and sequence analysis of immediately early genes (c-fos & c-jun) in Hypophthal-michthys molitrix. Journal of Hydroecology, 2013, 34(6): 63-69 [李园园, 马军国, 李效宇. 鲢即刻早期基因c-fos和c-jun的克隆及其序列分析. 水生态学杂志, 2013, 34(6): 63-69] | |
| Matsuoka I, Fuyuki K, Shoji T, et al. Identification of c-fos related genes and their induction by neural activation in rainbow trout brain. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1998, 1395(2): 220-227 DOI:10.1016/S0167-4781(97)00164-4 | |
| Novoszel P. The role of the AP-1 proteins c-Jun and JunB in the development and function of plasmacytoid dendritic cells. Uniwien, 2013 | |
| Santos FR, Diamond-Stanic MK, Prasannarong M, et al. Contribution of the serine kinase c-Jun N-terminal kinase (JNK) to oxidant-induced insulin resistance in isolated rat skeletal muscle. Archives of Physiology and Biochemistry, 2012, 118(5): 231-236 DOI:10.3109/13813455.2012.713366 | |
| Sha ZX, Wang QL, Liu Y, et al. Identification and expression analysis of goose-type lysozyme in half-smooth tongue sole (Cynoglossus semilaevis). Fish & Shellfish Immunology, 2012, 32(5): 914-921 | |
| Shaulian E. AP-1—the Jun proteins: Oncogenes or tumor suppressors in disguise. Cellular Signalling, 2010, 22(6): 894-899 DOI:10.1016/j.cellsig.2009.12.008 | |
| Tischmeyer W, Grimm R. Activation of immediate early genes and memory formation. Cellular and Molecular Life Sciences CMLS, 1999, 55(4): 564-574 DOI:10.1007/s000180050315 | |
| Uimari A, Strommer J. Myb26: A MYB-like protein of pea flowers with affinity for promoters of phenylpropanoid genes. Plant Journal, 1997, 12(6): 1273-1284 DOI:10.1046/j.1365-313x.1997.12061273.x | |
| Vesely PW, Staber PB, Hoefler G, et al. Translational regulation mechanisms of AP-1 proteins. Mutation Research/Reviews in Mutation Research, 2009, 682(1): 7-12 DOI:10.1016/j.mrrev.2009.01.001 | |
| Wei S, Huang Y, Huang X, et al. Characterization of c-Jun from orange-spotted grouper Epinephelus coioides involved in SGIV infection. Fish & Shellfish Immunology, 2015, 43(1): 230-240 | |
| Wu B, Liu YC, Zhang YC, et al. Cloning and expression profile analysis of AP-1 gene from Pacific white shrimp (Litopenaeus vannamei). Journal of Fisheries of China, 2014, 38(9): 9-14 [吴冰, 刘逸尘, 张亦陈, 等. 凡纳滨对虾AP-1基因的克隆和表达特征分析. 水产学报, 2014, 38(9): 9-14] | |
| Zhang X, Wang S, Chen S, et al. Transcriptome analysis revealed changes of multiple genes involved in immunity in Cynoglossus semilaevis during Vibrio anguillarum infection. Fish & Shellfish Immunology, 2015, 43(1): 209-218 |




