2. 上海海洋大学水产与生命学院 上海 201306;
3. 莱州明波水产有限公司 烟台 261418
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Laizhou Mingbo Aquatic Co., Ltd., Yantai 261418
上皮囊肿病是由隶属于衣原体目 (Chlamydiales) 的细菌引起的一种鱼类传染病,在世界范围内流行。最早关于该病的报道始于1920年,至今上皮囊肿病已在全世界90余种海水、淡水野生和养殖鱼类中被发现 (Stride et al, 2014)。该病的典型特征是病鱼的鳃、表皮等组织的上皮细胞因衣原体寄生而增生、肥大,最后形成囊肿,严重影响鱼体的呼吸功能和气体交换。鱼类上皮囊肿病发病速率较慢,发病初期不易被发现。后期病鱼呼吸困难,代谢机能紊乱,会陆续死亡,死亡率最高可达100% (Katharios et al, 2008)。国内尚未有关于鱼类上皮囊肿病的研究报道。
衣原体是绝大多数鱼类上皮囊肿病的病原,为严格的细胞内寄生细菌,革兰氏染色阴性 (Draghi et al, 2007),目前尚无法在体外培养 (Stride et al, 2014)。该病原主要侵染鱼体的鳃和表皮的上皮细胞,在宿主细胞质内不断分裂增殖,形成一个大包涵体。被衣原体感染的鱼体上皮组织除出现囊肿外,还表现为发炎、细胞坏死、分泌黏液增多等病理现象。近年来,通过16S rDNA序列比对分析,确定这些衣原体均隶属于衣原体目,但分属于不同的科和属 (Stride et al, 2014)。
斑石鲷 (Oplegnathus puncatus) 在分类上属于鲈形目 (Perciformes)、石鲷科 (Oplegnathidae)、石鲷属,为温热带近海鱼类,主要分布于我国黄海、东海、南海和日本、韩国等海域。斑石鲷生长速度快,饵料转化率高,肉质鲜美,是优质的可食用海水鱼类。2014年,斑石鲷在我国规模化人工繁育成功,成为有发展潜力的海水养殖鱼类新品种。国内外已报道的斑石鲷病害不多,主要有虹彩病毒感染、病毒性神经坏死病、黏孢子虫病等 (Skliris et al, 2001; Yanagida et al, 2008; Dong et al, 2010)。此外,日本学者曾在25日龄的斑石鲷仔鱼 (全长为9–12 mm) 中发现过疑似上皮囊肿病的病例,但未进行更深入的研究 (Egusa et al, 1987)。2015年,某养殖场的斑石鲷幼鱼陆续发病死亡,15 d内累积死亡率达40%以上,造成了较大的经济损失。本研究通过对疾病的现场调查、病鱼的临床检查、病理组织的光学显微镜和扫描电子显微镜观察,将该病初步确定为斑石鲷上皮囊肿病。这是上皮囊肿病在中国养殖斑石鲷中首次被发现和记载。
1 材料与方法 1.1 疾病的现场调查与临床检查在养殖场调查并记录疾病发生时养殖池海水的温度、盐度,病鱼大小、养殖密度、死亡特征等信息。观察病鱼的游泳、呼吸、摄食等状态。取濒死的病鱼,进行外观检查和剖检,观察、记录各器官病变情况。剪取病鱼鳃丝制成水浸片,置于光学显微镜下观察。
1.2 病理组织的显微观察剪取濒死的斑石鲷幼鱼鳃丝,迅速放入Davidson’s AFA固定液中。固定后进行常规石蜡切片和苏木精–伊红染色,用光学显微镜观察鳃组织的病变情况。同时,取病鱼的鳃丝,用解剖刀切成1–2 mm3的小块,置于多聚甲醛–戊二醛固定液中固定,然后经脱水、临界点干燥、真空镀膜等处理,制成扫描电子显微镜样品,使用日本电子公司JSM-840型扫描电子显微镜观察、拍照。
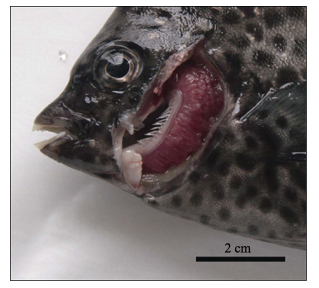
2 结果2015年初,某养殖场40个斑石鲷幼鱼养殖池中,有9个养殖池发病。此时养殖池的水温为21℃,盐度为30。病鱼全长约为15 cm,养殖密度为70–80尾/m3水体。起初各发病池每天只有数尾鱼死亡,但随着病程的延长,每天的死鱼数量逐渐增加,15 d内累积死亡率达40%以上。患病幼鱼鱼群散开、不聚集。病鱼在水池中活力差,身体侧偏,常静止于水底或侧壁,严重者随着水流漂流。但病鱼反应灵敏,难以捕捉。病鱼的典型症状是呼吸困难,口部持续张开,鳃盖开合频繁,对投喂的食物无反应。外观检查可见病鱼体表无明显损伤或溃疡,但鳃部覆盖有大量黏液,鳃丝残缺,颜色鲜红 (图 1)。剖检发现,病鱼肝、脾、肾等内脏表观正常,无明显病变。肠道无肿胀积水现象,但其中无食物。
|
图 1 患上皮囊肿病斑石鲷幼鱼的鳃 Figure 1 Epitheliocystis-infected gills of juvenile O. puncatus |
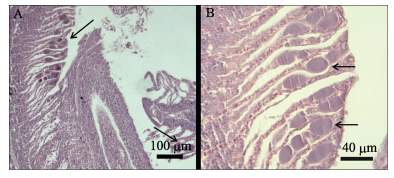
取病鱼鳃丝制成水浸片,置于相差显微镜下观察,可见鳃丝末端有许多大小不一的包囊,直径约为30–70 μm,平均直径约为50 μm (图 2-A)。在普通光学显微镜下,这些包囊大量附着在鳃丝上,外观圆形或卵圆形,呈浅黄棕色,少数包囊已从鳃丝上脱落 (图 2-B)。在苏木精–伊红染色的石蜡切片中,患病斑石鲷的鳃丝病变严重,鳃丝末端的许多上皮细胞膨大呈囊肿状,部分上皮细胞坏死、脱落 (图 3-A)。次级鳃丝粘连,呈棍棒化。囊肿嗜碱性,内部均质化 (图 3-B)。通过扫描电子显微镜观察患病斑石鲷的鳃丝,可发现鳃丝棍棒化,鳃小片被大量黏液覆盖,有许多大小不一的囊肿细胞镶嵌于鳃小片之间 (图 4-A),只露出光滑的上表面 (图 4-B)。

|
图 2 患上皮囊肿病的斑石鲷鳃丝上附着的包囊 Figure 2 Cysts attached to the epitheliocystis-infected gill of O. puncatus A:鳃丝末端大小不一的包囊;B:圆形或卵圆形的呈浅黄棕色的包囊 A: Cysts of different sizes at the end of gill filaments; B: Round or ovoid cysts with light yellow-brown color |
|
图 3 病鱼鳃丝末端呈囊肿状的上皮细胞 Figure 3 Enlarged epithelial cells (cysts) in the end of secondary lamellae A:次级鳃丝末端粘连;B:囊肿嗜碱性且内部均质化 A: The ends of secondary lamellae adhered each other; B: The cysts were basophilia and homogeneous |

|
图 4 扫描电子显微镜下患病斑石鲷幼鱼的鳃丝及包囊 Figure 4 Scanning electron micrographs of gill filament and cyst in epitheliocystis-infected O. puncatus A:棍棒化的鳃丝及镶嵌着上皮囊肿细胞的鳃小片;B:表面光滑的上皮囊肿细胞 A: Clavate gill filament and cysts embedding secondary lamellae; B: A cyst with smooth surface |
文献报道,鱼类上皮囊肿病的主要症状包括病鱼游泳无力、在水中停滞,呼吸困难、常在水面处呼吸,食欲下降,鳃丝分泌出大量黏液,鳃丝和体表有大量的白色或淡黄色的包囊 (Nylund et al, 1998; Draghi et al, 2007; Mitchell et al, 2011)。上皮囊肿病病原体在在大西洋鲑 (Salmo salar) 鳃上皮细胞内增殖,形成包囊并不断变大,最后导致鳃小片相互粘连,鳃上皮细胞坏死、脱落,严重影响了病鱼的呼吸功能 (Nylund et al, 1998; Draghi et al, 2004)。与上述报道相类似,本研究的调查和观察结果也表明,斑石鲷上皮囊肿病的病灶主要是鳃。囊肿的不断增大,引起鳃丝上皮细胞坏死,也刺激鱼体产生应激反应,导致鳃丝分泌大量黏液。鳃丝的病变严重影响了鱼体气体交换,因此病鱼表现出严重的缺氧症状。此外,感染上皮囊肿病的斑石鲷幼鱼,15 d内的累积死亡率超过40%,该数值与北极红点鲑 (Salvelinus alpinus) 最高44%的累积死亡率相当,但低于尖吻重牙鲷 (Diplodus puntazzo) 仔鱼100%的死亡率 (Draghi et al, 2007; Katharios et al, 2008)。这说明与仔鱼相比,幼鱼对该病具有更强的抵抗力,因此发病初期症状不明显,发病后仍然能够存活较长时间,其特征表现为慢性死亡。因此,通过疾病的现场调查、病鱼的临床检查、病理组织的光学显微镜和扫描电子显微镜观察,可以初步确定此次斑石鲷幼鱼罹患了上皮囊肿病。
感染不同鱼类的上皮囊肿病,其病原菌株差异较大。但通过16S rDNA序列分析发现,绝大部分菌株隶属于衣原体目,分属于不同的科、属 (Stride et al, 2014)。在今后的研究中,可以通过测定斑石鲷上皮囊肿病病原的16S rDNA序列,最终确定该病原的分类地位,并研发病原特异性的分子生物学检测技术,对该病进行早期诊断。
作为新兴的海水鱼类养殖品种,斑石鲷的病害少有报道。感染上皮囊肿病的斑石鲷幼鱼虽然表现为慢性死亡,但如果不及时采取治疗措施,累积死亡率仍然很高,导致较大的经济损失。养殖场曾尝试使用甲醛和硫酸铜对病鱼进行药浴,但没有治疗效果。曾有文献报道,土霉素对大口黑鲈 (Micropterus salmoides) 上皮囊肿病有较好的治疗效果 (Goodwin et al, 2005),但其是否适合治疗斑石鲷上皮囊肿病,仍需进一步研究。
| Dong C, Weng S, Luo Y, et al. A new marine megalocytivirus from spotted knifejaw, Oplegnathus punctatus, and its pathogenicity to freshwater mandarinfish, Siniperca chuatsi. Virus Research, 2010, 147(1): 98-106 DOI:10.1016/j.virusres.2009.10.016 | |
| Draghi A Ⅱ, Bebak J, Popov VL, et al. Characterization of a Neochlamydia-like bacterium associated with epitheliocystis in cultured Arcticcharr Salvelinus alpinus. Diseases of Aquatic Organisms, 2007, 76(1): 27-38 | |
| Draghi A Ⅱ, Popov VL, Kahl MM, et al. Characterization of "Candidatus Piscichlamydia salmonis" (Order Chlamydiales), a Chlamydia-like bacterium associated with epitheliocystis in farmed Atlantic salmon (Salmo salar). Journal of Clinical Microbiology, 2004, 42(11): 5286-5297 DOI:10.1128/JCM.42.11.5286-5297.2004 | |
| Egusa S, Miyazaki T, Shiomitsu T, et al. Epitheliocystis-like disease occurred among hatchery-reared fly of Oplegnathus punctatus. Fish Pathology, 1987, 22(1): 33-34 DOI:10.3147/jsfp.22.33 | |
| Goodwin AE, Park E, Nowak, B F. Successful treatment of largemouth bass, Micropterus salmoides (L.) with epitheliocystis hyperinfection. Journal of Fish Disease, 2005, 28(10): 623-625 DOI:10.1111/jfd.2005.28.issue-10 | |
| Katharios P, Papadaki M, Papandroulakis N, et al. Severe mortality in mesocosm-reared sharpsnout sea bream Diplodus puntazzo larvae due to epitheliocystis infection. Diseases of Aquatic Organisms, 2008, 82(1): 55-60 | |
| Mitchell SO, Rodger H. A review of infectious gill disease in marine salmonid fish. Journal of Fish Diseases, 2011, 34(6): 411-432 DOI:10.1111/jfd.2011.34.issue-6 | |
| Nylund A, Kvensenth AM, Isdal E. A morphological study of the epitheliocystis agent in farmed Atlantic salmon. Journal of Aquatic Animal Health, 1998, 10(1): 43-55 DOI:10.1577/1548-8667(1998)010<0043:AMSOTE>2.0.CO;2 | |
| Skliris GP, Krondiris JV, Sideris DC, et al. Phylogenetic and antigenic characterization of new fish nodavirus isolates from Europe and Asia. Virus Research, 2001, 75(1): 59-67 DOI:10.1016/S0168-1702(01)00225-8 | |
| Stride MC, Polkinghorne A, Nowak BF. Chlamydial infections of fish: Diverse pathogens and emerging causes of disease in aquaculture species. Veterinary Microbiology, 2014, 170(1-2): 258-266 | |
| Yanagida T, Palenzuela O, Hirae T, et al. Myxosporean emaciation disease of cultured red sea bream Pagrus major and spotted knifejaw Oplegnathus punctatus. Fish Pathology, 2008, 43(1): 45-48 DOI:10.3147/jsfp.43.45 |



