2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
配合饲料是对虾养殖中的主要食物来源,价格随着捕鱼量的减少和鱼粉价格上升而大幅增长。近年来,不断从植物中开发能够替代鱼粉的原料(Hardy, et al 1995; Cheng et al, 2013),在众多被考察的植物性饲料原料中,豆粕凭借其稳定的供给、合理的价格和丰富的营养成分,成为了最具潜力的鱼粉替代物(Lemos et al, 2000),在多种水产动物中已有豆粕替代鱼粉的研究,如大西洋鲑(Salmo salar)(Refstie et al, 1998)、凡纳滨对虾(Litopenaeus vannamei)(Lim et al, 1990)、美洲龙虾(Homarus americanus)(Floreto et al, 2000)等。
豆粕含有多种抗营养因子(Rumsey et al, 1994; Anderson et al, 1995),氨基酸组成不平衡(Floreto et al, 2000),限制了豆粉替代鱼粉的量。豆粕经过微生物发酵后,具有较高的养分消化率和营养价值,如维生素A和B (Kim et al, 1999)以及必需氨基酸(Weng et al, 2010);能够有效去除抗营养因子,提高小肽含量(吴胜华等, 2009)。柴鹏程等(2013)研究表明,在饲料中添加坚强芽孢杆菌(Bacillus firmus)可显著提高凡纳滨对虾的免疫力。本研究采用的坚强芽孢杆菌PC024,是经抗病功能筛选得到的抗病微生物,添加到对虾饲料能有效提高对虾抗白斑综合征病毒(WSSV)感染的能力,对注射WSSV的凡纳滨对虾的相对保护率可达33.7% (孙艳等, 2013)。采用该菌种对豆粕进行发酵,有望获得具有提高对虾抗病力的发酵豆粕,同时改善豆粕的营养特征。
1 材料与方法 1.1 菌种坚强芽孢杆菌PC024为中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室于2010年3月28日从健康中国明对虾(Fennero-penaeus chinensis)养殖环境中分离(孙艳等, 2013)。菌种经平板划线活化,挑取单菌落接入100 ml 2216E海水液体培养基,28℃、150 r/min过夜培养至菌浓度为108 CFU/ml。
1.2 豆粕的平板浅层发酵市售豆粕的蛋白含量为45%。在高速万能粉碎机中经25000 r/min粉碎1 min,过80目筛,于121℃高压灭菌20 min,50℃、12 h烘干。取5.00 g烘干的豆粕置于平皿中,加入适量无菌水,接种适量菌液,摊开成1.5 cm的薄层,于28℃恒温培养一定时间,取发酵产物测定其菌浓度。
1.3 菌浓度的测定将发酵产物充分搅拌混匀,称取2.00 g于50 ml无菌离心管中,加磷酸盐缓冲液(PBS)至20 ml,超声波振荡25 min后取出,用装有PBS的1.5 ml无菌离心管中进行10倍梯度稀释,稀释到10-4、10-5和10-6共3个梯度,取100 μl涂布于2216E固体海水培养基,每个梯度涂3个平板,置于28℃恒温培养箱中过夜培养,24 h后进行平板菌落计数。
1.4 单因素实验 1.4.1 接种量单因素实验采用平板浅层发酵,每个平皿装料量(灭菌烘干后豆粕粉)为5.00 g,料水比[豆粕质量(g)/无菌水体积(ml)]为1:0.6,加水4 ml,发酵温度为28℃,接种量设置1×106、2×106、3×106和4×106 CFU/g共4个梯度,每个梯度设置3个平行,平板浅层发酵64 h后,取样稀释涂平板测定菌浓度。
1.4.2 料水比单因素实验采用平板浅层发酵,每个平皿装料量(灭菌烘干后豆粕粉)为5.00 g,接种量为2×106 CFU/g,发酵温度为28℃,料水比(1:n),n分别为0.4、0.5、0.6、0.7、0.8,每个梯度设置3个平行,平板浅层发酵64 h后,取样稀释涂平板测定菌浓度。
1.4.3 发酵时间单因素实验采用平板浅层发酵,每个平皿装料量(灭菌烘干后豆粕粉)为5.00 g,接种量为2×106 CFU/g,发酵温度为28℃,料水比为1:0.8,发酵时间分别设为24 h、42 h、48 h、66 h、72 h和90 h,每个梯度设置3个平行,取样稀释涂平板测定菌浓度。
1.4.4 发酵温度单因素实验采用平板浅层发酵,每个平皿装料量(灭菌烘干后豆粕粉)为5.00 g,接种量为2×106 CFU/g,料水比为1:0.8,设置4个实验组,每组3个平行,分别在28℃、32℃、37℃和42℃4个温度下发酵96 h后取样稀释涂布测定菌浓度。
1.5 响应面实验根据Box-Behnken中心组合设计的原理(Saha et al, 2011),对接种量、料水比、发酵时间、发酵温度4个影响因素进行四因素三水平响应面分析实验(Response surface methodology,RSM),以菌浓度为响应值,各因素及水平见表 1。
|
|
表 1 响应面优化的因素及水平设计 Table 1 Factors and levels for response surface methodology |
称取100.00 g的豆粕6份,3份在105℃烘箱内经5-6 h烘干后取出,放入干燥器中冷却30 min,再重复烘干1 h,待2次称重差小于0.002 g,即为恒重状态,记录烘干后质量(n1)。其余3份用于发酵,发酵条件采用最终优化的接种量、料水比、发酵时间和发酵温度,发酵产物采用相同烘干操作后称重(n2)。
| $豆粕发酵得率\left( \% \right) = \frac{{{n_2}}}{{{n_1}}} \times 100\% $ |
采用水溶法测定可溶性固形物含量:将粉碎过80目筛的豆粕粉末采用如上相同烘干操作。称取等量干燥至恒重的2种豆粕粉末于烧杯中,加入100 ml水不断搅拌至均匀,采用布氏漏斗进行抽滤。将滤纸片和滤纸片上的不溶物放进烘箱烘干至恒重,冷却称量为m1,滤纸片称量为m。
| $\begin{array}{l} 豆粕中可溶性固形物含量\left( \% \right) = \\ \frac{{2.000 - \left( {{m_1} - m} \right)}}{{2.000}} \times 100\% \end{array}$ |
豆粕和发酵豆粕中粗蛋白以及15种氨基酸经国家水产品质量检测中心测定,分别按照标准方法GB/T 6432-1994和GB/T 18246-2000进行测定。
1.8 豆粕和发酵豆粕的可溶性蛋白组成称取粉碎烘干后的样品0.20 g,充分溶解于5 ml PBS中,4℃条件下4000 r/min离心10 min,采用Pierce BCA蛋白定量分析试剂盒测定上清液的蛋白浓度,加PBS稀释到同一浓度,用于SDS-PAGE分析。可溶性蛋白的分析采用欧阳亮等(2008)的方法:取上清液40 μl,加入10 μl 5×上样缓冲液,沸水浴3 min后取出冷却即为液体样品。采用15%的下胶和5%的上胶,70 V电泳30 min,待样品进入分离胶后,将电压调至110 V。采用考马斯亮蓝R250染色液染色1 h,脱色过夜至蛋白质区带清晰。
1.9 统计分析响应面实验设计及结果分析采用Design-Expert 8.0.5b软件,采用SPSS 16.0软件进行数据分析和统计,单因素方差分析(One-way ANOVA),P < 0.05作为差异显著水平。
2 结果与分析 2.1 豆粕发酵前后的状态和感官变化豆粕发酵前呈浅黄色,松散状粉末,有淡淡的豆腥味;经平板浅层发酵后,随着发酵时间的延长,豆粉黏着性增加,颜色变得更深,逐渐呈现为褐色,散发出浓烈的豆豉香味,略带酸味。
2.2 单因素实验结果分析 2.2.1 接种量对菌浓度的影响不同接种量组豆粕中,坚强芽孢杆菌数在3.15×109-5.33×109 CFU/g之间,从平均值来看,最佳接种量为2×106 CFU/g,且各组间差异不显著(P > 0.05)(图 1-A)。
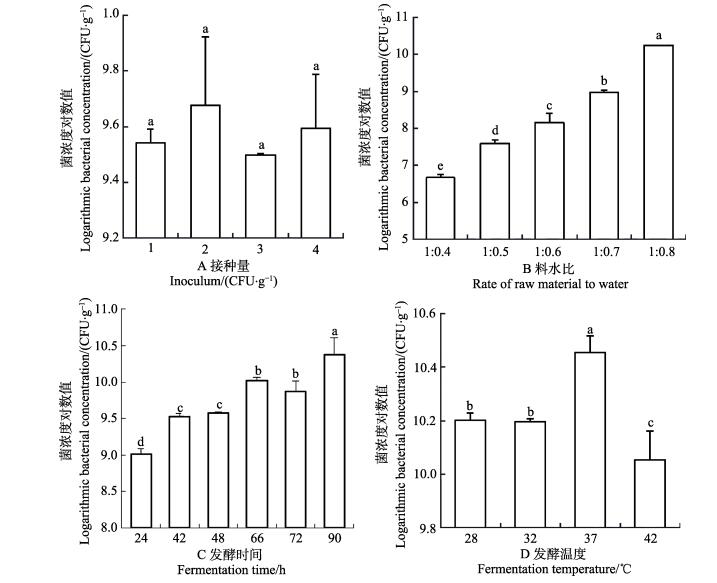
|
图 1 不同因素对发酵后豆粕中菌浓度的影响 Figure 1 Effects of four factors on bacterial concentration in fermented soybean meal 相同字母代表差异不显著(P > 0.05),不同字母代表差异显著(P < 0.05) Same letter indicated no significant difference (P > 0.05), different letters indicated significant differences (P < 0.05) |
不同料水比组豆粕中坚强芽孢杆菌数在4.76×106-1.76×1010 CFU/g之间,最佳料水比为1:0.8,且各组间差异显著(P < 0.05) (图 1-B)。
2.2.3 发酵时间对菌浓度的影响不同发酵时间组豆粕中,坚强芽孢杆菌数在1.05×109-2.36×1010CFU/g之间,从平均值来看,最佳发酵时间为90 h,并且90 h和24 h发酵豆粕中菌浓度与其他发酵时间组具有显著性差异(P < 0.05),42 h与48 h之间无显著性差异(P > 0.05),但二者与其他发酵时间组均具有显著性差异(P < 0.05),66 h与72 h组之间也无显著性差异(P > 0.05),但与其他组均具有显著性差异(P < 0.05) (图 1-C)。
2.2.4 发酵温度对菌浓度的影响不同发酵温度组豆粕中,坚强芽孢杆菌数在1.12×1010-2.82×1010 CFU/g之间,从平均值来看,最佳发酵温度为37℃,并且37℃发酵温度下菌浓度与其他各发酵温度组具有显著性差异(P < 0.05),28℃与32℃之间无显著性差异(P > 0.05),但二者与其他发酵时间组均具有显著性差异(P < 0.05),42℃发酵温度与其他组均具有显著性差异(P < 0.05)(图 1-D)。
2.3 响应面实验 2.3.1 响应面实验设计组及结果选取发酵温度(X1)、发酵时间(X2)、料水比(X3)和接种量(X4)为自变量,发酵产物的菌浓度(Y)为响应值,响应面法实验设计方案及结果见表 2。
|
|
表 2 响应面设计及实验结果 Table 2 Experimental design and results of RSM |
使用Design-Expert 8.0.5b软件对实验结果进行多元回归拟合,从而得到总芽孢杆菌浓度(Y)与发酵温度(X1)、发酵时间(X2)、料水比(X3)、接种量(X4)之间的二次多元回归模型:
| $\begin{array}{l} Y = -178.80227 + 5.45219{X_1} + 0.31789{X_2} + \\ \quad \;113.15821{X_3} + 7.26961{X_4} + 0.00692857{X_1}{X_2} + \\ \quad \;0.68214{X_1}{X_3}-0.033929{X_1}{X_4}-0.085417{X_2}{X_3}-\\ \quad \;0.00520833{X_2}{X_4}-1.45000{X_3}{X_4}-0.085643X_1^2-\\ \quad \;0.00242111X_2^2-65.31875X_3^2-0.52444X_4^2 \end{array}$ |
回归方程方差分析见表 3,由表 3可知,该模型的P < 0.0001,表明模型极显著,且失拟项为0.1407,不显著,从而说明方程对实验的拟合较好。模型中一次项X3和二次项X12、X32差异极显著,一次项X1和二次项X22、X42差异高度显著。在所选取的因素水平范围内,各因素对结果的影响排序为X3 > X1 > X2 > X4。
|
|
表 3 方差分析 Table 3 Analysis of variance (ANOVA) |
通过Design-Expert 8.0.5b软件对实验结果进行处理,得到响应曲面图(图 2)。三维曲面图直接反映了各因素对芽孢杆菌发酵浓度的影响,位点越凸表示响应值越大。
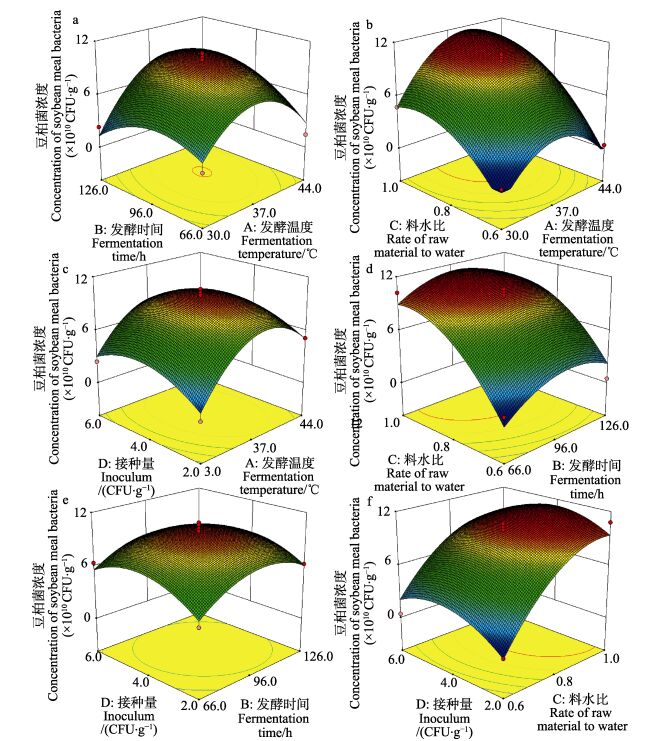
|
图 2 不同因素对豆粕菌浓度响应值的影响 Figure 2 The influence of four factors on the response value of soybean meal bacteria concentration |
发酵温度、发酵时间、料水比和接种量四因素两两之间均与豆粕发酵后产物中芽孢杆菌浓度呈抛物线型关系(图 2),并且存在极大值点,回归方程中的所有二次项P > 0.05,两两因素之间的交互作用不显著;当发酵温度为39.0℃、发酵时间为100 h 18 min、料水比为1:0.96、接种量为3.84×106CFU/g时得到极大值点。
2.3.4 验证实验采用上述结果所得的坚强芽孢杆菌PC024发酵豆粕的最佳条件(发酵温度为39.0℃、发酵时间为100 h 18 min、料水比为1︰0.96、接种量为3.84×106CFU/g)进行发酵,设置3个平行,发酵后,菌浓度分别为1.22×1010 CFU/g、1.38×1010 CFU/g、1.10×1010 CFU/g,均值为1.23×1010 CFU/g,与预测值1.17×1010 CFU/g十分接近,误差仅为5.13%,说明响应面法分析所得的优化模型是可靠的。
2.4 豆粕发酵得率及可溶性固形物含量测定豆粕为细菌的生长繁殖提供多种有机物、蛋白质和糖类等,微生物在繁殖过程即发酵豆粕的过程中产生蛋白酶等降解大分子蛋白,去除抗营养因子,但同时也将一部分营养物质转化成了CO2和水分释放到外界。等质量的豆粕发酵前烘干至恒重n1为(91.60±1.43) g,采用上述条件发酵100 h 18 min后,产物烘干至恒重n2为(86.00±0.57) g,豆粕发酵的得率为(93.89±0.01)%。
可溶性固形物含量的变化能够反映微生物发酵豆粕的能力,发酵后可溶性固形物含量越高,越利于养殖动物的消化吸收。豆粕经芽孢杆菌PC024发酵后,可溶性固形物含量有了明显提高,由发酵前的(39.16±0.01)%增加到(58.80±4.54)%。芽孢杆菌在发酵过程中分泌一些酶类作用于豆粕,蛋白质和碳水化合物等大分子物质得到不同程度的降解,可望提高豆粕的消化和吸收利用率。
测定豆粕发酵前后的粗蛋白含量,结果显示,豆粕经过发酵,粗蛋白增加到原有的108.50%,结合发酵得率可知,100.00 g豆粕经发酵得到93.89 g发酵产物,其中,蛋白质由发酵前的50.71 g增加到51.67 g。
测定豆粕发酵前后的15种氨基酸含量,结果显示(表 4),发酵后各种氨基酸比例均有所增加,15种氨基酸的总含量增加到原来的132.30%,与原来氨基酸含量相比,增加比例最大的5种氨基酸为精氨酸(168.60%)、赖氨酸(157.20%)、丝氨酸(152.50%)、苏氨酸(139.04%)和甘氨酸(138.40%)。其中,6种必需氨基酸(赖氨酸、苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸和缬氨酸)的含量平均增加到原来的133.20%。
|
|
表 4 豆粕和发酵豆粕中15种氨基酸的组成 Table 4 Amino acid composition of soybean meal and fermented soybean meal (%) |
比较发酵前后豆粕的SDS-PAGE (图 3),结果显示,发酵前豆粕可溶性蛋白带较多,而且多数集中在35 kDa以上,发酵之后,豆粕中分子量在35 kDa以上的大分子蛋白大部分被降解,蛋白带出现在20-30 kDa之间,表明坚强芽孢杆菌PC024的发酵豆粕,能够使其中的蛋白质发生降解。

|
图 3 豆粕发酵前后的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of soybean meal and fermented soybean meal M:蛋白分子量标准;1:豆粕;2:发酵豆粕 M: Protein marker; 1: Soybean meal; 2: Fermented soybean meal |
近年来,益生菌在水产养殖中的应用越来越广泛,取得了很好的养殖防病效果,大大降低了抗生素的使用。芽孢杆菌属具有对热、pH和盐等耐受性高的生理特性,在豆粕发酵的应用中倍受青睐。马文强等(2008)利用枯草芽孢杆菌(Bacillus subtilsi)、乳酸菌(Lactic acid bacteria)、酿酒酵母菌(Brewing yeast)发酵豆粕,豆粕中的胰蛋白酶抑制因子和其他抗营养因子得到了有效消除。吴胜华等(2008)利用枯草芽孢杆菌、蜡样芽孢杆菌(Bacillus cereus. Frankland)、植物乳酸菌和酵母菌两两结合固态发酵豆粕,发现用枯草芽孢杆菌和植物乳酸菌混菌发酵时,产物中小肽含量达到12.01%。戚薇等(2008)采用纳豆芽孢杆菌(Bacillus natto)、凝结芽孢杆菌(Bacillus coagulans) TQ33固态发酵豆粕,胰蛋白酶抑制剂因子TI降解率高达95%。除此之外,芽孢杆菌是一类能够提高对虾的抗病力的益生菌,Rengpipat等(2003)将芽孢杆菌S11作为饲料补充剂投喂斑节对虾(Penaeus monodon),不仅提高了对虾的生长率,而且对虾抵抗发光细菌鳗弧菌(Vibrio anguillarum)的能力也得以增强。Li等(2009)将芽孢杆菌OJ添加到饲料中也能够提高凡纳滨对虾抵抗WSSV的能力。本研究采用经过安全性实验和免疫实验验证的坚强芽孢杆菌PC024(孙艳等, 2013)对豆粕进行发酵,将坚强芽孢杆菌PC024在发酵产物中的浓度作为评价发酵工艺的优化指标。
人们关注并研究发酵豆粕,目的是通过发酵这种温和的生物技术解决豆粕抗营养因子含量高的问题,减轻和消除对动物消化和吸收的不利影响,降低胰蛋白酶抑制因子含量(吴胜华等, 2009),减轻对蛋白质消化和利用的阻碍;提高肽含量(吴胜华等, 2008; 何勇锦等, 2011)、肽转化率(吴宝昌等, 2010)和水解度(姚小飞等, 2010)等,使豆粕具有更好的溶解性,在动物体内小肽更容易被吸收,转化利用率高;提高蛋白质含量(何勇锦等, 2011; 胡瑞等, 2013),使氨基酸组成更加平衡合理。本研究旨在建立一种高效可行又经济实用的抗病微生物在饲料中的添加技术,首先对坚强芽孢杆菌PC024发酵豆粕的发酵因素进行优化,该菌株首次作为发酵菌种应用到发酵豆粕中,各发酵参数不明,故参考其他菌种发酵因素进行发酵温度、时间、接种量和料水比的优化。结果显示,该菌能够充分利用豆粕中的营养成分,并在发酵过程中迅速繁殖,发酵约100 h的菌浓度可达到1010 CFU/g,不仅能够起到降解豆粕大分子蛋白的作用,而且能提高豆粕可溶性成分及粗蛋白的含量,这与Teng等(2012)用枯草芽孢杆菌BS102和米曲霉(Aspergillus oryzae) AO3042发酵豆粕后粗蛋白和可溶性蛋白含量提高的结果相符。Weng等(2010)研究发现:豆粕经发酵36 h后的半胱氨酸含量减少22%,所有的氨基酸含量减少46%以上,其中,谷氨酸和丝氨酸下降71%;当豆粕发酵48 h时,大多数必需氨基酸除组氨酸外含量均显著增加,其中,缬氨酸增加93.60%,甘氨酸增加50%。这与本研究结果不同,本研究豆粕发酵前测定的6种必需氨基酸中含量最高的是缬氨酸,其次是亮氨酸、苯丙氨酸、赖氨酸、异亮氨酸和苏氨酸;非必需氨基酸含量最高的是天门冬氨酸,其次是谷氨酸、丙氨酸、精氨酸、丝氨酸、甘氨酸、组氨酸、络氨酸和脯氨酸,经过约100 h的发酵后,15种氨基酸比例均有所增加。推断发酵约100 h增加了豆粕的营养价值和功能。
本研究采用的芽孢杆菌PC024在豆粕发酵过程中生长快速,提高豆粕可溶性成分及粗蛋白含量,降解豆粕大分子蛋白,提高必需氨基酸含量,这些指标均对发酵豆粕作为水生动物饲料原料提高豆粕营养利用率十分有利,为获得具有提高对虾抗病力的发酵豆粕,同时改善豆粕的营养特征提供了可能。
| Anderson RL, Wolf WJ. Compositional changes in trypsin inhibitors, phytic acid, saponins and isoflavones related to soybean processing. Journal of Nutrition, 1995, 125(3 Supplement): 581S-588S | |
| Chai PC, Song XL. Effects of Bacillus PC465 added in feed on the grow rate and expression of STAT gene of Litopenaeus vannamei. Progress in Fishery Sciences, 2013, 34(3): 97-103[柴鹏程, 宋晓玲. 饲料中添加芽孢杆菌PC465对凡纳滨对虾生长和STAT基因表达的影响. 渔业科学进展, 2013, 34(3): 97-103] | |
| Cheng W, Chiu CS, Guu YK, et al. Expression of recombinant phytase of Bacillus subtilis E20 in Escherichia coli HMS 174 and improving the growth performance of white shrimp, Litopenaeus vannamei, juveniles by using phytase-pretreated soybean meal-containing diet. Aquaculture Nutrition, 2013, 19(2): 117-127 DOI:10.1111/anu.2013.19.issue-2 | |
| Floreto EA, Bayer RC, Brown PB. The effects of soybean-based diets, with and without amino acid supplementation, on growth and biochemical composition of juvenile American lobster, Homarus americanus. Aquaculture, 2000, 189(3-4): 211-235 DOI:10.1016/S0044-8486(00)00363-X | |
| Hardy RW, Lim C, Sessa DJ. Current issues in salmonid nutrition. Nutrition and Utilization Technology in Aquaculture, 1995: 26-35 | |
| He YJ, Wu MQ, Cai CY, et al. Study on the production of new protein feeds by fermentation of soybean meal power of Bacillus subtilis KJ. Journal of Yunnan University of Nationalities (Natural Sciences Edition), 2011, 20(6): 462-465, 475[何勇锦, 吴美琼, 蔡聪育, 等. 枯草芽孢杆菌KJ发酵豆粕制备新型蛋白肽饲料的研究. 云南民族大学学报(自然科学版), 2011, 20(6): 462-465, 475] | |
| Hu R, Chen Y, Wang ZS, et al. Optimization of process parameters of probiotics-fermented soybean meal and effects of coordination action between compound probiotics and enzyme on fermentation quality. Chinese Journal of Animal Nutrition,, 2013, 25(8): 1896-1903[胡瑞, 陈艳, 王之盛, 等. 复合益生菌发酵豆粕生产工艺参数的优化及酶菌联合发酵对豆粕品质的影响. 动物营养学报, 2013, 25(8): 1896-1903] | |
| Kim BN, Yang JL, Song YS. Physiological functions of chungkukjang. Food Industry and Nutrition, 1999, 4: 40-46 | |
| Lemos D, Ezquerra JM, Garcia-Carre o FI. Protein digestion in penaeid shrimp: Digestive proteinases, proteinase inhibitors and feed digestibility. Aquaculture, 2000, 186(1-2): 89-105 DOI:10.1016/S0044-8486(99)00371-3 | |
| Li J, Tan B, Mai K. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture, 2009, 291(1-2): 35-40 DOI:10.1016/j.aquaculture.2009.03.005 | |
| Lim C, Dominy W. Evaluation of soybean meal as a replacement for marine animal protein in diets for shrimp (Penaeus vannamei). Aquaculture, 1990, 87(1): 53-63 DOI:10.1016/0044-8486(90)90210-E | |
| Ma WQ, Feng J, Liu X. Nutritional characteristics of microbe fermented soybean meal. Journal of the Chinese Cereals and Oils Association, 2008, 23(1): 121-124[马文强, 冯杰, 刘欣. 微生物发酵豆粕营养特性研究. 中国粮油学报, 2008, 23(1): 121-124] | |
| Ouyang L, Li L, Cai YF. Study on the anti-nutritional factors in soybean meal using vertical SDS-PAGE analysis. Feed Industry, 2008, 29(21): 43-45 DOI:10.3969/j.issn.1001-991X.2008.21.014[欧阳亮, 李亮, 蔡源锋. 垂直型SDS-PAGE分析发酵豆粕中蛋白类抗营养因子的研究. 饲料工业, 2008, 29(21): 43-45] | |
| Qi W, Tang XY, Wang JL. Study on preparation of bioactive feed by probiotics-fermented soybean meal. Feed Industry, 2008, 29(5): 15-19[戚薇, 唐翔宇, 王建玲, 等. 益生菌发酵豆粕制备生物活性饲料的研究. 饲料工业, 2008, 29(5): 15-19] | |
| Refstie S, Storebakken T, Roem AJ. Feed consumption and conversion in Atlantic salmon (Salmo salar) fed diets with fish meal, extracted soybean meal or soybean meal with reduced content of oligosaccharides, trypsin inhibitors, lectins and soya antigens. Aquaculture, 1998, 162(3-4): 301-312 DOI:10.1016/S0044-8486(98)00222-1 | |
| Rengpipat S, Tunyanun A, Fast AW, et al. Enhanced growth and resistance to Vibrio challenge in pond-reared black tiger shrimp Penaeus monodon fed a Bacillus probiotic. Diseases of Aquatic Organisms, 2003, 55(2): 169-173 | |
| Rumsey GL, Siwicki AK, Anderson DP, et al. Effects of soybean protein on serological response, non-specific defense mechanism, growth and protein utilization in rainbow trout. Veterinary Immunology and Immunopathology, 1994, 41(3-4): 323-339 DOI:10.1016/0165-2427(94)90105-8 | |
| Saha J, Biswas A, Chhetri A, et al. Response surface optimisation of antioxidant extraction from kinema, a Bacillus-fermented soybean food. Food Chemistry, 2011, 129(2): 507-513 DOI:10.1016/j.foodchem.2011.04.108 | |
| Sun Y, Song XL, Liu F, et al. Isolation and identification of Bacillus sp. and evaluation of its effect on WSSV disease resistance in Litopenaeus vannamei. Journal of Fisheries of China, 2013, 37(4): 574-583[孙艳, 宋晓玲, 刘飞, 等. 一株芽孢杆菌PC024的鉴定及其抗WSSV感染效果的研究. 水产学报, 2013, 37(4): 574-583] | |
| Teng D, Gao M, Yang Y, et al. Bio-modification of soybean meal with Bacillus subtilis or Aspergillus oryzae. Biocatalysis and Agricultural Biotechnology, 2012, 1(1): 32-38 DOI:10.1016/j.bcab.2011.08.005 | |
| Weng TM, Chen MT. Changes of protein in natto (a fermented soybean food) affected by fermenting time. Food Science and Technology Research, 2010, 16(6): 537-542 DOI:10.3136/fstr.16.537 | |
| Wu BC, Song JM. Bacillus Subtilis and Aspergillus niger mixing fermentation to make bean pulp feedstuffs. Journal of Shandong Institute of Light Industry, 2010, 24(1): 54-57[吴宝昌, 宋俊梅. 枯草芽孢杆菌与黑曲霉混合发酵制备豆粕饲料. 齐鲁工业大学学报, 2010, 24(1): 54-57] | |
| Wu SH, Li LM, Zhang BH, et al. Single strain yeast solid-state fermentation of soybean meal. Journal of the Chinese Cereals and Oils Association, 2009, 24(7): 41-44[吴胜华, 李吕木, 张邦辉, 等. 酵母菌单菌固态发酵豆粕研究. 中国粮油学报, 2009, 24(7): 41-44] | |
| Wu SH, Li LM, Zhang BH, et al. Studies on oligopetides feedstuff by solid-stated fermented with manifold strains. Food and Fermentation Industries, 2008, 34(10): 113-115[吴胜华, 李吕木, 张邦辉, 等. 多菌种固态发酵豆粕生产小肽饲料. 食品与发酵工业, 2008, 34(10): 113-115] | |
| Yao XF, Ye L, Zhao SM. Study on breeding of Bacillus subtilis and its fermentation process on soybean meal. Journal of Anhui Agriculture Science, 2010, 38(16): 8476-8478, 8490 DOI:10.3969/j.issn.0517-6611.2010.16.074[姚小飞, 叶璐, 赵世敏. 枯草芽孢杆菌的选育及其发酵豆粕的工艺条件研究. 安徽农业科学, 2010, 38(16): 8476-8478, 8490] |



