2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 大连海洋大学水产与生命学院 大连 116023
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023
中国明对虾(Fenneropenaeus chinensis)属无脊椎动物,主要依赖非特异性免疫进行防御保护(段亚飞等, 2014)。体液免疫在甲壳动物非特异性免疫系统中占有最为重要的地位,酶原免疫是体液免疫的重要途径,能够协助机体识别外源异物、催化吞噬和包被反应,控制机体的氧化代谢状态,实现对机体的免疫调节。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)属于抗氧化酶系,通过维持机体的氧化自由基产生和清理的动态平衡,调节甲壳动物的免疫保护和抵抗外界应激的能力(Holmblad et al, 1999)。酸性磷酸酶(ACP)是动物体内重要的水解酶(Wu et al, 2014),主要用于降解血细胞吞噬和包囊反应时表面带有磷酸酯的异物(王玥等, 2005)。丙二醛(MDA)是脂质过氧化的产物(梁忠秀等, 2013)。总抗氧化能力(T-AOC)是评价机体抗氧化能力的综合性指标,用于衡量机体对外来刺激的代偿能力和氧化代谢状态(崔惟东等, 2009)。
聚β-羟基丁酸酯(Poly-β-hydroxybutyrate,PHB)是短链脂肪酸β-羟基丁酸的聚合体(薛林贵等, 2010),在动物肠道内可通过酶解和化学水解的方式,降解为β-羟基丁酸单体(Yu et al, 2005),对肠道上皮细胞具有直接的营养作用(刘松珍等, 2013);还可以通过调节肠道环境的pH值,增加有益菌的丰度,以维持电解质的平衡(陈燕等, 2006),实现肠道的免疫调节。目前,有学者针对卤虫(Artemia franciscana) (孙慧贤等, 2011)、欧洲鲈鱼(Dicentrarchus labrax)(De Schryver et al, 2010)、中华绒螯蟹(Eriocheir sinensis) (刘玉等, 2013)和凡纳滨对虾(Litopenaeus vannamei) (邓康裕等, 2015)等物种进行了PHB对其生长和免疫性能影响的研究,证实其可以作为一种免疫增强剂和饲料添加剂。但是,PHB作为一种新型的免疫增强剂,对中国明对虾免疫因子的影响尚未有细致的研究。本研究以中国明对虾“黄海2号”为实验材料,探究PHB作为饲料添加剂对机体提供的免疫保护以及引起机体免疫酶在时间和空间分布上的变化,为PHB在水产养殖行业中的应用提供理论基础。
1 材料与方法 1.1 实验材料中国明对虾取自中国水产科学研究院黄海水产研究所遗传育种中心,共540尾,初始平均体重为(9.99±2.06) g,于60 L整理箱暂养7 d,暂养期间,投喂不含PHB的基础饲料。海水经砂滤井过滤,盐度为29±1,自然水温为(23.0±1.2)℃。
1.2 实验饲料基础饲料配方由中国水产科学研究院黄海水产研究所食品工程与营养研究室提供。PHB纯品干粉由宁波天安生物材料有限公司提供。实验饲料是在基础饲料配方上添加不同质量百分比的PHB制成。基础饲料采用鱼粉(38%)、谷朊粉(2%)、酵母粉(5%)、豆饼(25%)、高筋粉(12.5%)、磷脂(1.5%)、胆碱(1%)、鱼油(2%)、磷虾粉(10%)、Ca(H2PO4)2(1.5%)、维生素(多维)(0.5%)、矿物质(多矿)(0.5%)、黏合剂(0.5%)等原料预混。饲料原料经60目粉碎,搅拌混匀,制粒、切割、烘干,制成直径为2 mm、长度为3 mm的颗粒。制成品密封袋储存,干燥通风环境条件下保存。
1.3 实验分组与管理实验在中国水产科学院黄海水产研究所进行,共6周,将540尾暂养7 d的中国明对虾平均分为6组,每组3个平行,每个平行组30尾。实验设置1个对照组C,对应PHB浓度为0;5个实验组(E0.5、E1.0、E2.5、E5.0和E10.0),分别对应PHB浓度为0.5%、1.0%、2.5%、5.0%、10.0%,每天投喂4次(06:00、12:00、18:00、24:00),饲料日投喂量占体重的5%,随实验进行适度调整。
1.4 实验方法 1.4.1 相对免疫保护率以1 d为时间单位,观察和记录个体生存状态,获得各组死亡率和相对免疫保护率(Relative percent survival,RPS):
死亡率(Death rate,%)=死亡对虾数/(初始对虾数–取样对虾数)×100%
RPS=(对照组死亡率–实验组死亡率)/对照组死亡率
1.4.2 实验取样以开始饲喂不同浓度PHB饲料为时间起点,每周从各组随机取3尾对虾解剖,获得肝胰腺、肌肉和血液样品,迅速放入液氮,随后–80℃保存。
1.4.3 血清和匀浆液获取血液在4℃、3500 r/min离心30 min,吸取上清液,获得血清。肌肉和肝胰腺按重量(g)︰体积(ml)为1︰9的比例加入匀浆介质1×PBS,使用全自动组织破碎仪(Precellys 24-Dual)在5500 r/min、组织破碎20 s条件下进行组织破碎,4℃、2500 r/min离心10 min,获得10%组织匀浆液。
1.4.4 免疫酶活检测使用南京建成生物工程研究所提供的试剂盒,对获得的血清和匀浆液进行免疫酶活力检测。使用IMARK酶标仪(伯乐,日本)检测总抗氧化能力(T-AOC)、酸性磷酸酶(ACP)、过氧化物酶(POD)和过氧化氢酶(CAT)。
1.5 数据处理与统计分析数据用SPSS 19.0、Origin 8.0处理,以平均值±标准差(Mean±SD)表示。采用单因素方差分析方法(One-way ANOVA)分析数据,显著水平设为0.05,P < 0.05为差异显著。
2 结果 2.1 PHB对中国明对虾的相对免疫保护率实验组死亡率随PHB浓度的增加呈现先下降后上升的趋势。E1.0组死亡率最低,并且与其他各组相比差异显著(P < 0.05)。RPS随PHB浓度的增加基本呈现先上升后下降的趋势。E10.0时RPS为负值,表明该浓度PHB促进个体死亡;E1.0组RPS最高;E1.0、E2.5较其他组差异显著(P < 0.05)(表 1)。
|
|
表 1 PHB对中国明对虾的相对免疫保护率的影响 Table 1 The effect of PHB additives on relative percent survival of F. chinensis |
T-AOC随着时间的变化整体呈现先上升后下降的趋势(图 1)。血清和肝胰腺T-AOC在饲喂第2–4周,水平较高。E1.0组血清T-AOC在第2、4周最高,较其他组具有显著差异(P < 0.05),E2.5组血清T-AOC在第3周水平最高,与C、E5.0、E10.0组差异显著(P < 0.05)(图 1-A)。E1.0组肝胰腺T-AOC在第4周较其他组差异显著(P < 0.05),在第2、3周各组均具有较高T-AOC水平,组间无差异(图 1-B)。

|
图 1 PHB对中国明对虾总抗氧化能力(T-AOC)的影响 Figure 1 The effects of PHB on total antioxidant capacity of F. chinensis |
ACP酶活力随着时间的变化整体呈现先上升后下降的趋势(图 2)。血清ACP在第3周、肝胰腺ACP在第2–5周具有较高酶活力。E1.0、E2.5组的血清ACP酶活力在第3周与其他组差异显著(P < 0.05)(图 2-A)。E1.0组肝胰腺ACP在第3周与其他组差异显著(P < 0.05)(图 2-B)。

|
图 2 PHB对中国明对虾ACP酶活力的影响 Figure 2 The effects of PHB on acid phosphatase activity of F. chinensis |
CAT酶活力随着时间的变化整体呈现先上升后下降的趋势(图 3)。血清CAT酶活力在第3–4周、肝胰腺CAT酶活力在第1–2周,具有较高值。E1.0、E2.5组的血清CAT酶活力在第3周与其他组差异显著(P < 0.05);E0.5、E1.0、E2.5组在第4周与其他组差异显著(P < 0.05)(图 3-A)。E10.0组肝胰腺CAT酶活力第1周与其他组差异显著(P < 0.05),E0.5、E1.0组在第2周与其他组相比差异显著(P < 0.05)(图 3-B)。
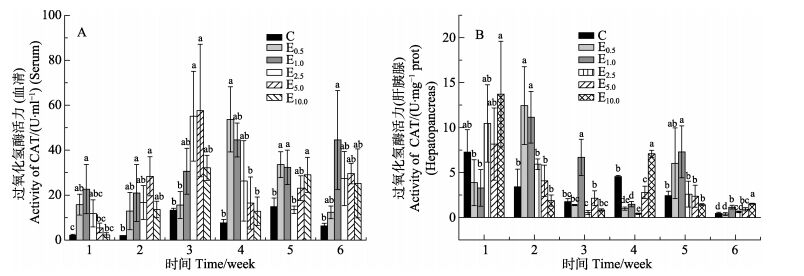
|
图 3 PHB对中国明对虾CAT酶活力的影响 Figure 3 The effects of PHB on catalase activity of F. chinensis |
POD酶活力随着时间的变化整体呈现先上升后下降的趋势(图 4)。血清POD酶活力在第1–3周,肝胰腺POD酶活力在第2–5周,具有较高值。E0.5、E1.0、E10.0组血清POD酶活力在第1周,E0.5、E2.5组在第2周,E1.0组在第3周与同时间段其他组差异显著(P < 0.05)(图 4-A)。E1.0组肝胰腺POD酶活力在第2周、E2.5组在第3周、E10.0组在第4周与同时间段其他组差异显著(P < 0.05);E0.5组胰腺POD酶活力在第5周与其他组差异显著(P < 0.05),C、E1.0、E2.5、E5.0与E10.0组相比差异显著(P < 0.05),且E1.0组的均值大于C、E2.5、E5.0组(图 4-B)。
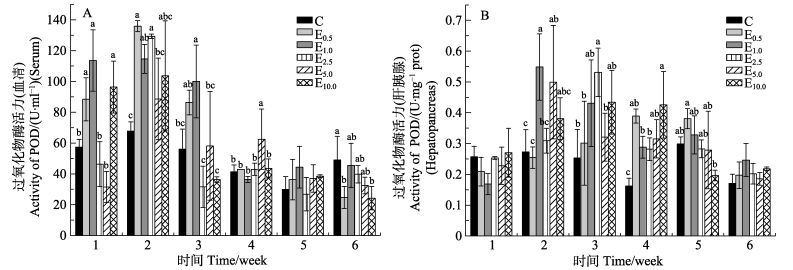
|
图 4 PHB对POD酶活力的影响 Figure 4 The effects of PHB on peroxidase activity of F. chinensis |
SOD酶活力随着时间的变化整体呈现先上升后下降的趋势(图 5)。血清SOD酶活力在第2–3周、肝胰腺SOD酶活力在第1–5周,具有较高值。E0.5、E1.0组血清SOD酶活力在第2周,E1.0组在第3周与同时间段其他组差异显著(P < 0.05)(图 5-A)。E0.5组肝胰腺SOD酶活力在第1周,E1.0组在第2周,E0.5、E1.0、E2.5、E5.0组在第4周,E1.0组在第5周与同时间段其他组差异显著(P < 0.05)(图 5-B)。

|
图 5 PHB对中国明对虾SOD酶活力的影响 Figure 5 The effects of PHB on superoxide dismutase activities of F. chinensis |
MDA含量随着时间的变化整体呈现先下降后上升的趋势(图 6)。E0.5、E1.0组血清中的MDA含量在第3–6周处于最低水平,并且二者与同时间段其他组相比差异显著(P < 0.05)(图 6-A)。肝胰腺中的MDA含量在第2–5周水平较低,E0.5组在第2周,E1.0组在第3周,E0.5、E1.0、E2.5组在第4周,E0.5、E1.0、E2.5组在第5周,与同时间段其他组相比差异显著(P < 0.05) (图 6-B)。
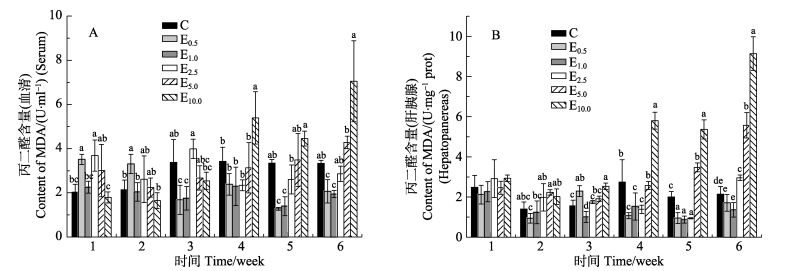
|
图 6 PHB对中国明对虾丙二醛含量的影响 Figure 6 The effects of PHB on malonaldehyde content of F. chinensis |
研究PHB对中国明对虾的相对免疫保护率发现,E1.0、E2.5相对于其他浓度组,能显著提高中国明对虾的相对免疫保护率(P < 0.05)。这与PHB在凡纳滨对虾、卤虫、中华绒螯蟹幼蟹免疫促进方面的研究结果一致(孙慧贤等, 2011; 刘玉等, 2013; 邓康裕等, 2015),再次说明了PHB具有免疫保护的效果。PHB实现免疫保护的作用,可能是因为单体β-羟基丁酸(Defoirdt et al, 2006)穿越肠道或G–细菌的细胞膜的同时释放质子,降低细菌肠道环境或者细胞本身的pH,迫使细菌消耗较大的能量来维持微环境pH的稳定,从而使其生长受到抑制(邓康裕等, 2014)。此外,丁酸类短链脂肪酸可被动物肠道上皮细胞直接吸收,实现营养供应;还可以抑制肠炎发生(邓名荣等, 2009);激活黏膜修复相关的酶(孙浪等, 2013),保持肠道的完整性;参与调节血液渗透压(石桂城等, 2014),实现对机体的综合免疫保护。
本研究还发现,高浓度组(E10.0)相对免疫保护率为负值,即PHB促使中国明对虾死亡的现象。可能是由于过多摄入单一短链脂肪酸,易导致过氧化反应的发生,超氧阴离子会攻击免疫细胞膜,从而大大降低其免疫性能(左然涛等, 2015);进而使代谢系统紊乱,导致机体组织器官受损,影响生长和存活(石桂城等, 2014)。邓元告等(2016)研究发现,E10.0高浓度PHB饲喂中华绒螯蟹幼蟹时,肝胰腺脂肪含量显著高于其他组,肝胰腺可溶性蛋白的比例减少,导致生物的自我保护、调控和抗胁迫能力下降,产生免疫副作用(孔祥会等, 2008)。
3.2 PHB添加剂对免疫相关酶的影响抗氧化酶活力是反映机体健康与否的重要指标。抗氧化酶在机体的生长发育、生化代谢和抵抗外界应激等方面具有重要作用(孟晓林等, 2015)。SOD、CAT、POD属于抗氧化酶系。研究PHB作为短链丁酸类高聚体对免疫酶活性的作用发现,E1.0组血清SOD酶活力在第2–3周、肝胰腺在2、4、5周,较对照组均差异显著(P < 0.05)。这与PHB能提高中华绒螯蟹肝胰腺SOD活力和凡纳滨对虾血液SOD活力的研究结果相同(邓康裕等, 2015; 邓元告等, 2016)。但与邓康裕等(2015)研究的PHB对凡纳滨对虾肝胰腺SOD无显著影响的结果不一致,结合其实验中氨氮应激时的SOD基因表达量存在显著变化,说明PHB能够影响SOD活力。SOD酶活力无显著差异可能是因为取样时间(21 d)处于肝胰腺SOD的高表达阶段,PHB浓度可以影响高表达的时间点和高活性的时间长度,但是不能改变SOD表达的阈值,这与本研究中21 d取样时,SOD在各个浓度组无显著性差异的结果保持一致。本研究中,在适宜PHB浓度时,CAT和POD酶活力均与对照组差异显著,与PHB能显著提高氨氮胁迫条件下凡纳滨对虾CAT基因的表达量(邓康裕等, 2015),进而调节酶的活性的研究一致。在不饱和脂肪酸方面,n-3 PUFA能够提高大鼠(Rattus norvegicus)红细胞CAT活性,降低氧化状态(Iraz et al, 2005)。赵磊等(2016)研究发现,鱼油等不饱和脂肪酸能提高中华绒螯蟹POD酶活力。由此说明PHB作为一种不饱和脂肪酸对免疫和抗氧化的作用。MDA是油脂在体内发生过氧化的指标(姚仕彬等, 2015)。而T-AOC是衡量机体氧化程度的综合性指标(谭树华等, 2005)。研究中,适宜浓度的PHB具有减少MDA积累,提高T-AOC水平的效果。但是,PHB作为短链脂肪酸,长时间高浓度的使用会产生较大的氧化压力,影响机体正常的代谢反应。本研究中,E10.0组在饲喂的第4–6周,血液和肝胰腺MDA含量显著高于同时间段其他组(P < 0.05)。同时,E5.0、E10.0组T-AOC活性水平也整体较低。Park等(2009)在大鼠中进行DHA饲料添加的研究发现,低剂量短链脂肪酸的添加不会影响体内脂质的过氧化反应,但是高浓度剂量添加会使机体产生极其敏感的反应的结论,为本研究结果提供了证据。结合SOD、CAT、POD、MDA和T-AOC的变化状态,说明PHB可以调节抗氧化酶系的活性,提高机体的抗氧化和抗应激能力。
ACP是一种重要的水解酶,在对甲壳动物的研究中,ACP作为免疫功能性酶用作检测甲壳动物机体代谢状态的指标(何南海等, 2004)。本研究中,ACP酶活力在第3周有最高均值,并且E1.0组与其他组差异显著(P < 0.05)。关于脂肪酸对ACP酶活力的影响,孙静秋等(2007)研究脂肪酸对凡纳滨对虾生理代谢影响时发现,ACP阳性颗粒受到脂类水解代谢的影响,且ACP颗粒数量与对虾的肝胰腺健康状况密切相关,为PHB对ACP的调控提供了依据。
3.3 PHB添加剂影响下酶的“免疫疲劳”现象水产免疫增强剂,具有增强个体非特异性免疫的能力,在水产动物的疾病防治方面具有良好的效果。Chang等(2000)在研究β-1, 3-葡聚糖对斑节对虾(Penaeus monodon)亲虾的影响时发现,血液呼吸暴发随着时间变化出现高峰期,随后降到与对照组相似水平,将这种持续饲喂单一免疫增强剂产生的免疫指标由上升至高峰再下降的现象,称为“免疫疲劳”。本研究中,血清T-AOC在第4–6周、ACP在第4–6周、CAT在第5–6周及POD在第4–6周均产生活力值降低或接近初始水平的“免疫疲劳”现象。Zuo等(2012)发现,当饲料中添加适量多不饱和脂肪酸,尤其是n-3 PUFA时,长时间饲喂并不能进一步提高鱼类的免疫力,反而会出现免疫抑制现象。这可能是由于过量的n-3 PUFA降低了鱼类免疫器官表面病原识别受体(TLR22) 及其接头蛋白(MyD88) 的表达所致。“免疫抑制”现象还有可能是机体中存在应对免疫刺激的负反馈调节系统,最终使免疫水平回复到初始状态(Yoshida et al, 1995)。
缓解“免疫疲劳”现象,可以通过调节免疫增强剂给予途径和剂量,达到有效地调节。Cuesta等(2002)研究发现,注射和口服醋酸维生素A会对金鲷(Sparus aurata)免疫体系产生不同的影响。刘群芳等(2013)将单一的免疫增强剂βG、Se联合添加,能一定程度地提高凡纳滨对虾的免疫防御功能。复合免疫增强剂的使用,可对疲劳现象的缓解产生积极的影响。免疫增强剂合理使用方式的研究对于其推广应用具有重要作用。
综上所述,PHB添加剂可以提升中国明对虾的非特异性免疫力,E1.0组具有最佳的免疫效果,投喂第2–3周具有高水平的免疫酶活力,为PHB做为添加剂使用提供了基础数据。
| Chang CF, Chen HY, Su MS, et al. Immunomodulation by dietary β-1, 3-glucan in the brooders of the black tiger shrimp Penaues monodon. Fish and Shellfish Immunology, 2000, 10(6): 505-514 DOI:10.1006/fsim.2000.0266 | |
| Chen Y, Cao YS, Liu XH. Short chain fatty acids and intestinal microflora. Jiangxi Science, 2006, 24(1): 38-40,69[陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群. 江西科学, 2006, 24(1): 38-40,69] | |
| Cuesta A, Ortu o J, Rodriguez A, et al. Changes in some innate defence parameters of seabream (Sparus aurata L.) induced by retinol acetate. Fish and Shellfish Immunology, 2002, 13(4): 279-291 DOI:10.1006/fsim.2001.0403 | |
| Cui WD, Leng XJ, Li XQ, et al. Effects of astaxanthin and canthaxanthin on pigmentation of muscle and total antioxidant capacity of liver in rainbow trout (Oncorhynchus mykiss). Journal of Fisheries of China, 2009, 33(6): 987-995[崔惟东, 冷向军, 李小勤, 等. 虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响. 水产学报, 2009, 33(6): 987-995] | |
| De Schryver P, Sinha AK, Kunwar PS, et al. Poly-β-hydroxybutyrate (PHB) increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax. Applied Microbiology and Biotechnology, 2010, 86(5): 1535-1541 DOI:10.1007/s00253-009-2414-9 | |
| Defoirdt T, Halet D, Sorgeloos P, et al. Short-chain fatty acids protect gnotobiotic Artemia franciscana from pathogenic Vibrio campbellii. Aquaculture, 2006, 261(2): 804-808 DOI:10.1016/j.aquaculture.2006.06.038 | |
| Deng KY, Kong J, Meng XH, et al. Effects of poly-β-hydroxybutyrate on WSSV resistance in Fenneropenaeus chinensis. Journal of Fisheries of China, 2014, 38(8): 1167-1174[邓康裕, 孔杰, 孟宪红, 等. 聚β-羟基丁酸酯对中国明对虾抗WSSV能力的影响. 水产学报, 2014, 38(8): 1167-1174] | |
| Deng KY, Meng XH, Kong J, et al. Effects of poly-β-hydroxybutyrate on non-special immunity and expression of immune gene under the ammonia stress of Litopenaeus vannamei. Progress in Fishery Sciences, 2015, 36(6): 71-78 DOI:10.11758/yykxjz.20150611[邓康裕, 孟宪红, 孔杰, 等. 聚β-羟基丁酸酯对凡纳滨对虾(Litopenaeus vannamei)非特异性免疫力及氨氮胁迫后免疫基因表达量的影响. 渔业科学进展, 2015, 36(6): 71-78] | |
| Deng MR, Guo J, Zhu HH. Progress on biotechnological production of butyric acid. China Biotechnology, 2009, 29(3): 117-122[邓名荣, 郭俊, 朱红惠. 微生物催化生产丁酸研究进展. 中国生物工程杂志, 2009, 29(3): 117-122] | |
| Deng YG, Huang QY, Ma GN, et al. Effect of dietary PHB dose and feeding duration on enzyme activities and gut microbial diversity in juvenile Chinese mitten crab (Eriocheir sinensis). Journal of Fishery Sciences of China, 2016, 23(1): 138-145[邓元告, 黄琼叶, 马灌楠, 等. PHB剂量和饲喂时间对中华绒螯蟹肝胰腺酶活力和肠道菌群多样性的影响. 中国水产科学, 2016, 23(1): 138-145] | |
| Duan YF, Zhang JS, Dong HB, et al. The non-specific immune response of Penaeus monodon to Vibrio parahaemolyticus challenge. Journal of Fisheries of China, 2014, 38(9): 1557-1564[段亚飞, 张家松, 董宏标, 等. 副溶血弧菌对斑节对虾非特异性免疫酶活性的影响. 水产学报, 2014, 38(9): 1557-1564] | |
| He NH. The establishment and application of immune indexes of penaeid shrimp. Journal of Xiamen University (Natural Science), 2004, 43(3): 385-388[何南海. 对虾免疫功能指标的建立及其应用. 厦门大学学报(自然科学版), 2004, 43(3): 385-388] | |
| Holmblad T, S derh ll K. Cell adhesion molecules and antioxidative enzymes in a crustacean, possible role in immunity. Aquaculture, 1999, 172(1-2): 111-123 DOI:10.1016/S0044-8486(98)00446-3 | |
| Iraz M, Erdogan H, Ozyurt B, et al. Brief communication: Omega-3 essential fatty acid supplementation and erythrocyte oxidant/antioxidant status in rats. Annals of Clinical and Laboratory Science, 2005, 35(2): 169-173 | |
| Kong XH, Zhang HX, Wang GZ, et al. Seasonal changes of soluble proteins and soluble saccharide in mud crab (Scylla Serrata). Journal of Henan Normal University (Natural Science), 2008, 36(1): 99-102[孔祥会, 张红绪, 王桂忠, 等. 锯缘青蟹可溶性蛋白与可溶性糖的季节变化. 河南师范大学学报(自然科学版), 2008, 36(1): 99-102] | |
| Liang ZX, Li J, Tan ZJ, et al. Effects of the toxic dinoflagellate Alexandrium tamarense on MDA, SOD and GST in hepatopancreas and gill of Fenneropenaeus chinensis. Journal of Fisheries of China, 2013, 37(8): 1192-1197[梁忠秀, 李健, 谭志军, 等. 塔玛亚历山大藻对中国明对虾肝胰腺及鳃SOD、GST和MDA的影响. 水产学报, 2013, 37(8): 1192-1197] | |
| Liu QF, Cao JM, Huang YH, et al. Effects of β-glucan and selenium, vitamin E combined supplementation on tissue biochemical indexes and immune, antioxidant related enzyme mRNA expression of Litopenaeus vannamei. Chinese Journal of Animal Nutrition, 2013, 25(5): 1045-1053[刘群芳, 曹俊明, 黄燕华, 等. β-葡聚糖与硒、维生素E联合添加对凡纳滨对虾组织生化指标及免疫、抗氧化相关酶、mRNA表达的影响. 动物营养学报, 2013, 25(5): 1045-1053] | |
| Liu SZ, Zhang Y, Zhang MW, et al. Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids. Guangdong Agricultural Sciences, 2013(11): 99-103 DOI:10.3969/j.issn.1004-874X.2013.11.029[刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展. 广东农业科学, 2013(11): 99-103] | |
| Liu Y, Sui LY, Deng YG, et al. Effect of poly-β-hydroxybutyrate on growth and hepatopancreatic enzyme activities of Eriocheir sinensis juveniles. Oceanologia et Limnologia Sinica, 2013, 44(5): 1333-1338[刘玉, 隋丽英, 邓元告, 等. 聚β-羟基丁酸酯(PHB)对中华绒螯蟹(Eriocheir sinensis)幼蟹生长和肝胰腺酶活力的影响. 海洋与湖沼, 2013, 44(5): 1333-1338] | |
| Meng XL, Tian X, Guo QQ, et al. Copper specific accumulation and its effect on the activity of antioxidant enzyems and metabolism of lipid in gill or hepatopancreas of Patinopecten yessoensis. Journal of Fisheries of China, 2015, 39(6): 908-915[孟晓林, 田雪, 郭倩倩, 等. 铜在虾夷扇贝鳃和肝胰腺中的累积及对抗氧化酶脂代谢的影响. 水产学报, 2015, 39(6): 908-915] | |
| Park Y, Nam S, Yi HJ, et al. Dietary n-3 polyunsaturated fatty acids increase oxidative stress in rats with intracerebral hemorrhagic stroke. Nutrition Research, 2009, 29(11): 812-818 DOI:10.1016/j.nutres.2009.10.019 | |
| Shi GC, Dong XH, Chen G, et al. Effects of dietary lipid level on growth performance of genetic improvement of farmed tilapia (GIFT, Oreochromis niloticus) and its serum biochemical indices and fatty acid composition under cold stress. Chinese Journal of Animal Nutrition, 2012, 24(11): 2154-2164 DOI:10.3969/j.issn.1006-267x.2012.11.013[石桂城, 董晓慧, 陈刚, 等. 饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响. 动物营养学报, 2012, 24(11): 2154-2164] | |
| Sun HX, Sui LY. Artemia nauplii enrichment with poly-β-hydroxybutyrate. Journal of Shanghai Ocean University, 2011, 20(3): 392-398[孙慧贤, 隋丽英. 聚β-羟基丁酸酯对卤虫幼体的强化作用. 上海海洋大学学报, 2011, 20(3): 392-398] | |
| Sun JQ, Xu Y, Zhang HQ, et al. Study on cytochemical location of acid phosphatase and alkaline phosphatase of Litopenaeus vannamei. Journal of Fudan University (Natural Science), 2007, 46(6): 947-951[孙静秋, 许燕, 张慧绮, 等. 凡纳对虾体内ACP、AKP酶的细胞化学定位. 复旦学报(自然科学版), 2007, 46(6): 947-951] | |
| Sun L, Liu Z, Hao G, et al. Effects of sodium butyrate on growth and intestinal cell proliferation of Carassius auratus. Journal of Fishery Sciences of China, 2013, 20(4): 893-901[孙浪, 刘臻, 郝光, 等. 丁酸钠对鲫鱼生长和肠细胞增殖的影响. 中国水产科学, 2013, 20(4): 893-901] | |
| Tan SH, He DY, Yan F, et al. Effects of NaNO2 on malondialdehyde content and total antioxidative capacity in the liver of Carassius auratus. Joumal of Agro-Environment Science, 2005, 24(增刊): 21-24[谭树华, 何典翼, 严芳, 等. 亚硝酸钠对鲫鱼肝脏丙二醛含量和总抗氧化能力的影响. 农业环境科学学报, 2005, 24(增刊): 21-24] | |
| Wang Y, Hu YB, Jiang NC. Effects of ammonia-N and nitrite-N on immune enzymes of Macrobrachium rosenbergii. Journal of Zhejiang University (Science Edition), 2005, 32(6): 698-705[王玥, 胡义波, 姜乃澄. 氨态氮亚硝态氮对罗氏沼虾免疫相关酶类的影响. 浙江大学学报(理学版), 2005, 32(6): 698-705] | |
| Wu FJ, Xue Y, Liu XF, et al. The protective effect of eicosapentaenoic acid-enriched phospholipids from sea cucumber Cucumaria frondosa on oxidative stress in PC12 cells and SAMP8 mice. Neurochemistry International, 2014, 64(1): 9-17 | |
| Xue LG, Zhao X, Chang SJ, et al. A strain of high PHB output by mutagenesis of 80 Me V/u C-12 ions. Nuclear Techniques, 2010, 33(4): 284-288[薛林贵, 赵旭, 常思静, 等. 80MeV/u C-12离子诱变选育PHB高产菌株. 核技术, 2010, 33(4): 284-288] | |
| Yao SB, Ye YT, Cai CF, et al. Damage of MDA on intestinal epithelial cells in vitro of grass carp (Ctenopharyngodon idella). Acta Hydrobiologica Sinica, 2015, 39(1): 133-141 DOI:10.7541/2015.17[姚仕彬, 叶元土, 蔡春芳, 等. 丙二醛对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报, 2015, 39(1): 133-141] | |
| Yoshida T, Kruger R, Inglis V. Augmentation of non-specific protection in African catfish, Clarias gariepinus (Burchell), by the long-term oral administration of immunostimulants. Journal of Fish Diseases, 1995, 18(2): 195-198 DOI:10.1111/jfd.1995.18.issue-2 | |
| Yu J, Plackett D, Chen LXL. Kinetics and mechanism of the monomeric products from abiotic hydrolysis of poly (R)-3-hydroxybutyrate under acidic and alkaline conditions. Polymer Degradation and Stability, 2005, 89(2): 289-2999 DOI:10.1016/j.polymdegradstab.2004.12.026 | |
| Zhao L, Long XW, Wu XG, et al. Effects of fish oil replacement by blending vegetable oils in fattening diets on gonadal development, lipid metabolism, antioxidant and immune capacities of adult male Chinese mitten crab (Eriocheir sinensis). Chinese Journal of Animal Nutrition, 2016, 28(2): 455-467[赵磊, 龙晓文, 吴旭干, 等. 育肥饲料中混合植物油替代鱼油对中华绒螯蟹成体雄蟹性腺发育、脂质代谢、抗氧化及免疫性能的影响. 动物营养学报, 2016, 28(2): 455-467] | |
| Zuo RT, Ai QH, Mai KS, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans). Fish and Shellfish Immunology, 2012, 32(2): 249-258 DOI:10.1016/j.fsi.2011.11.005 | |
| Zuo RT, Mai KS, Xu W, et al. Advance of studies on the effects of fatty acids on immune responses and nutritional regulation mechanism in fish species. Journal of Fisheries of China, 2015, 39(7): 1079-1088[左然涛, 麦康森, 徐玮, 等. 脂肪酸对鱼类免疫系统的影响及调控机制研究进展. 水产学报, 2015, 39(7): 1079-1088] |



