2. 山东省海洋生物研究院 青岛 266014
2. Marine Biology Institute of Shandong Province, Qingdao 266014
刺参(Apostichopus japonicus),又称仿刺参,极具营养保健作用,有较高的经济价值。在我国,刺参养殖主要分布在山东、辽宁等地的沿海地区(李成林等, 2010)。近年来,随着刺参养殖规模的迅猛发展,其养殖环境尤其是池塘养殖环境不断恶化,刺参的池塘养殖遭遇了瓶颈(常亚青等, 2006; 赵艳芳等, 2010; 刘锡胤等, 2012)。
氨氮是养殖水体中重要的环境指标之一。池塘高密度养殖模式下,水中残饵、排泄物的氨化作用提高了水体中的氨氮浓度,导致水产养殖动物长期处于氨氮胁迫的生长环境中(罗鸷等, 2013)。秦传新(2009)1)发现,氨氮胁迫对水产养殖动物的生长产生不利影响。氨氮浓度过高会导致水产动物的摄食率降低、死亡率升高(Rodríguez-Ramos et al, 2008; 胡毅等, 2012)、非特异性免疫酶活性降低(刘洪展等, 2012)。臧元奇等(2012)、刘洪展等(2012)研究了氨氮胁迫对同等规格刺参生理生态学的影响。本实验通过为期13 d的氨氮胁迫,研究了氨氮胁迫对不同规格刺参非特异性免疫酶活性的影响,以期为刺参养殖水体环境的有效调控和刺参健康养殖的免疫机制提供基础数据和理论支持。
1) Qin CX. Research on structure of culturing sea cucumber Apostichopus japonicus Selenka and its optimization in pond. Doctoral Dissertation of Ocean University of China, 2009, 15-23 [秦传新.刺参(Apostichopus japonicus Selenka)的池塘养殖结构及其优化研究.中国海洋大学博士研究生学位论文, 2009, 15-23]
1 材料与方法 1.1 实验刺参实验刺参采自山东省莱阳市养殖池塘,选用体表正常、活力旺盛、肉刺坚挺、摄食正常的个体。按体重分为小(S)、中(M)、大(B) 3个规格,分别为(6.05±0.44) g、(14.68±1.76) g、(25.64±3.27) g。实验于2014年4月在山东省海洋生物研究院种质资源研究中心鳌山卫实验室进行。
1.2 刺参暂养实验刺参在容积为0.5 m3的圆形玻璃钢水槽中暂养,小规格刺参200-300头/槽,中规格刺参120-160头/槽,大规格刺参60-100头/槽。养殖用水为经沉淀砂滤的自然海水,盐度为31.0±0.2,水温为(15.0±1.5)℃,pH为8.1±0.2,氨氮<0.05 mg/L。实验期间,日换水1次,连续充气,每天投喂配合饲料1次,暂养适应7 d后进行实验。
1.3 实验设计根据实验暂养的不同规格刺参急性氨氮毒性预实验结果,以96 h LC50平均值的10%为基础,设置2、4、6、8、10 mg/L共5个氨氮浓度梯度,通过计算得出非离子氨浓度分别为0.066、0.131、0.197、0.263、0.328 mg/L。各组氨氮浓度用1000 mg/L的NH4Cl母液进行调节。同时,以氨氮浓度低于0.05 mg/L自然海水为对照组。各实验组与对照组实验刺参为30头,放养在整理箱(80 cm× 60 cm×48 cm)中,每实验组设3组平行。养殖条件与日常管理同暂养期,每天换水后用纳氏试剂法测定并及时校正水中氨氮浓度,氨氮波动范围 < 0.1 mg/L,实验共进行13 d。
1.4 样品采集、处理在第4、7、10、13天时分别对实验刺参进行取样,每次取样时每个整理箱随机各取3头,将刺参擦干并排净体内海水后放入玻璃培养皿中,用解剖刀在刺参腹部切开1 cm,立即用无菌注射器从切口处收集体腔液于细胞培养皿中,每个整理箱3头刺参体腔液混匀,用灭菌枪头取混合体腔液1.0 ml于1.5 ml离心管中,10000 r/min离心10 min,取上清液分装于0.5 ml Eppendorf管中,-80℃超低温冰箱保存待测。
1.5 数据测定与处理刺参存活率采用以下公式计算:
| $存活率\left( \% \right) = S/{S_0} \times 100$ |
式中,S0为实验开始时刺参数量-取样刺参数量,S为实验结束取样完成后存活的刺参数量。
非离子态氨采用以下公式计算:
| ${\rm{N}}{{\rm{H}}_3} = \left[ {{\rm{N}}{{\rm{H}}_3} + {\rm{NH}}_4^ + } \right]/\left[ {1 + {{10}^{\left( {{\rm{p}}Ka - {\rm{pH}}} \right)}}} \right]$ |
式中,pKa为离解常数,pKa=0.09018+2729.92/T;T为开尔文温度,T=273+t(℃)。
溶菌酶(LSZ)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活力的测定均用南京建成生物有限公司生产的试剂盒。LSZ的活性定义:在特定的实验条件下,每分钟使底物溶液的OD值下降0.001为1个活性单位,以mg/ml表示;体腔液CAT活性单位定义:每毫升样品每秒分解1 μmol的H2O2的量为1个活性单位,以mmol/L表示;体腔液SOD活性单位定义:每毫升反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活性单位,以U/ml表示。
运用SPSS 18.0及Excel软件进行数据分析统计,以P < 0.05为显著性差异的标志。
2 结果与分析 2.1 氨氮胁迫对不同规格刺参存活率的影响实验结束时统计各组刺参的存活率,结果见表 1。在氨氮浓度为0-6 mg/L时,除小规格刺参在氨氮浓度为6 mg/L时存活率为(97.8±3.1)%外,其余所有实验组存活率均达100%,3种规格刺参均能正常活动、摄食、生长未表现出异常状况;当氨氮浓度为8 mg/L时,在第10天后,3种不同规格刺参均出现了吐肠、化皮,实验结束时的存活率分别为(91.1±3.1)%、(95.6±3.1)%、(95.6±3.1)%;氨氮浓度为10 mg/L时,实验结束时平均存活率最高的是大规格刺参,为(91.1±3.1)%,中规格刺参存活率最低,为(86.7±5.4)%,小规格刺参存活率为(88.9±6.2)%。
|
|
表 1 氨氮胁迫下不同规格刺参存活率(%) Table 1 The survival rate of different sized sea cucumber under ammonia stress(%) |
由图 1(A)可知,第4天时,3种不同规格刺参在不同氨氮浓度环境中的LSZ活性较对照组显著升高(P < 0.05),随着氨氮浓度的升高,LSZ活性呈现升高的趋势。在氨氮浓度为10 mg/L时,小、中、大规格刺参LSZ活性最高,分别为对照组的146.2%、159.8%、158.5%,与对照组差异性显著(P < 0.05)。相同氨氮浓度下,中规格刺参的LSZ活性高于小、大规格刺参。

|
图 1 不同浓度的氨氮处理对3种不同规格刺参LSZ活性影响 Figure 1 Effect of different ammonia nitrogen concentration on the activity of LSZ of three sized sea cucumber 图中标注有不同字母的表示显著性差异(P < 0.05),下图同 Different letters on the graph indicated significant difference(P < 0.05). The same as below |
由图 1(B)可知,第7天时,除对照组外,3种不同规格刺参的LSZ活性高于第4天,与对照组差异显著(P < 0.05)。与第4天相比,氨氮浓度为2、4、6、8、10 mg/L时,3种不同规格刺参的LSZ活性分别升高:小规格5.8%、5.9%、9.3%、12.3%、11.7%,中规格9.4%、10.7%、8.3%、7.8%、8.9%,大规格5.9%、5.6%、12.5%、6.3%、9.2%。相同氨氮浓度下,中规格刺参的LSZ活性高于小、大规格刺参。
由图 1(C)可知,第10天时,3种不同规格刺参的LSZ活性较第7天呈现降低的趋势,分别降低:小规格3.8%、34.5%、37.3、48.4%、61.2%,中规格3.4%、8.1%、21.5%、43.5%、56.2%,大规格0、1.8%、23.8%、46.3%、60.6%,氨氮浓度为6、8、10 mg/L时的LSZ活性降幅大于2、4 mg/L。相同氨氮浓度下,中规格刺参的LSZ活性高于小、大规格刺参。
由图 1(D)可知,第13天时,随着氨氮浓度的升高,3种不同规格刺参的LSZ活性呈现降低的趋势。在氨氮浓度为2、4 mg/L时,3种不同规格刺参的LSZ活性高于对照组(P < 0.05);氨氮浓度为6、8、10 mg/L时,LSZ活性显著低于对照组(P < 0.05),小规格刺参LSZ活性下降幅度最大,分别为对照组的51.2%、70.7%、73.2%,与对照组差异性显著(P < 0.05)。相同氨氮浓度下,中规格刺参的LSZ活性高于小、大规格刺参。
2.3 氨氮胁迫对不同规格刺参CAT活性的影响由图 2(A)可知,第4天时,3种不同规格刺参在不同浓度氨氮环境中的CAT活性较对照组显著升高(P < 0.05)。相同规格的实验组中,刺参的CAT活性随氨氮浓度增大而升高。相同氨氮浓度下,中规格刺参的CAT活性高于小、大规格刺参。

|
图 2 不同浓度的氨氮处理对3种不同规格刺参CAT活性影响 Figure 2 Effect of different ammonia nitrogen concentration on the activity of CAT of three sized sea cucumber |
由图 2(B)可知,第7天时,3种不同规格刺参的CAT活性高于第4天,小规格分别升高5.1%、12.5%、17.1%、20.9%、19.1%,中规格分别升高11.9%、13.6%、8.5%、7.8%、5.4%,大规格分别升高10.5%、12.2%、20.9%、22.2%、16.0%,与对照组差异显著(P < 0.05)。相同氨氮浓度下,中规格刺参的CAT活性高于小、大规格刺参。
由图 2(C)可知,第10天时,3种不同规格刺参的CAT活性随氨氮浓度增大呈现降低的趋势,氨氮浓度为2、4 mg/L时的CAT活性降幅比6、8、10 mg/L小,与对照组间差异显著(P < 0.05)。相同氨氮浓度下,中规格刺参的CAT活性高于小、大规格刺参。
由图 2(D)可知,第13天时,3种不同规格刺参的CAT活性大幅降低。氨氮浓度为2、4、6 mg/L时,3种不同规格刺参的CAT活性高于对照组(P < 0.05);氨氮浓度为8、10 mg/L时,CAT活性与对照组差异不显著(P > 0.05)。相同氨氮浓度下,中规格刺参的CAT活性高于小、大规格刺参。
2.4 氨氮胁迫对不同规格刺参SOD活性的影响由图 3(A)可知,第4天时,氨氮浓度为2、4 mg/L时,3种不同规格刺参在不同浓度氨氮环境中的SOD平均活性高于对照组,分别升高:小规格10.3%、11.4%,中规格3.8%、6.1%,大规格5.7%、9.7%;氨氮浓度为6、8、10 mg/L时,小、中、大规格刺参SOD活性呈现升高的趋势,分别为对照组的128%、142%、155%,125%、142%、151%,118%、140%、148%,与对照组差异显著(P < 0.05)。相同氨氮浓度下,中规格刺参的SOD活性高于小、大规格刺参。由图 3(B)可知,第7天时,3种不同规格刺参的SOD活性较对照组显著升高(P < 0.05)。氨氮浓度为10 mg/L时,3种不同规格刺参的SOD活性最高,分别为对照组的160%、161%、151%(P < 0.05)。相同氨氮浓度下,中规格刺参的SOD活性高于小、大规格刺参。
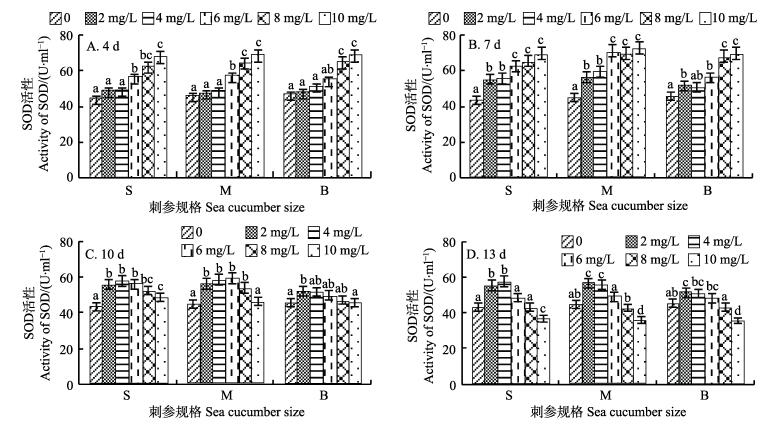
|
图 3 不同浓度的氨氮处理对3种不同规格刺参SOD活性影响 Figure 3 Effect of different ammonia nitrogen concentration on the activity of SOD of three sized sea cucumber |
由图 3(C)可知,第10天时,3种不同规格刺参的SOD活性呈现降低的趋势。与第7天相比,氨氮浓度为2、4 mg/L时的SOD活性降幅比6、8、10 mg/L小;氨氮浓度为6、8、10 mg/L时,SOD活性分别降低:小规格10.7%、19.7%、30.2%,中规格16.8%、22.7%、35.8%,大规格11.5%、30.5%、34.3%。相同氨氮浓度下,中规格刺参的SOD活性高于小、大规格刺参。
由图 3(D)可知,第13天时,3种不同规格刺参的SOD活性有所降低。氨氮浓度为2、4 mg/L时,SOD活性维持平稳水平且显著高于对照组(P < 0.05);氨氮浓度为6 mg/L时,SOD活性虽有所降低但仍高于对照组;氨氮浓度为8、10 mg/L时,小、中、大规格刺参SOD活性低于对照组,分别为对照组的99.8%、85.1%,95.1%、79.7%,95.1%、77.8%。
3 讨论 3.1 氨氮胁迫对刺参存活的影响在水产养殖中,残饵、粪便以及动植物尸体等含氮有机物的分解是水体中氨氮的主要来源,其非离子态具有较高脂溶性,容易透过细胞膜使养殖动物中毒,还会降低其能量代谢活动(任海等, 2014)。本研究中,当养殖水环境中的氨氮浓度≤6 mg/L时,实验期间,3种规格刺参均能正常活动、摄食,未表现出异常状况;但当氨氮浓度超过8 mg/L时,实验后期,3种不同规格刺参均出现了吐肠、化皮,直至死亡,8 mg/L的氨氮浓度为3种规格刺参耐受的极限值。另外,不同规格刺参对氨氮的耐受能力不同(臧元奇等, 2012),本研究中,当氨氮浓度为10 mg/L时,至实验结束,不同规格刺参的存活率存在一定差异,大规格刺参存活率最高,中规格最低,但单因素方差分析显示,其差异不显著(P > 0.05),表明当氨氮浓度超过刺参耐受极限时,对其造成的不利影响无体重规格上的差别。
3.2 氨氮胁迫对刺参3种非特异性免疫酶活性影响刺参属于无脊椎动物,不具备脊椎动物所具有的特异性免疫,在抵抗外界病原的过程中,非特异性免疫发挥了巨大作用(臧元奇, 2012)1)。体液免疫属于非特异性免疫,在无脊椎动物免疫防御过程中有着至关重要的作用,体液性免疫因子包括天然形成或诱导产生的各种生物活性分子以及各种免疫活性的酶类(刘洪展等, 2012)。
1) Zang YQ. Ecological and physiological mechanisms on typical environmental factors in sea cucumber, Apostichopus japonicus Selenka. Doctoral Dissertation of Ocean University of China, 2012, 4-6 [臧元奇.刺参(Apostichopus japonicus Selenka)对典型环境胁迫的生理生态学响应及其机制研究.中国海洋大学博士研究生学位论文, 2012, 4-6]
LSZ是一种碱性蛋白酶,存在于动物组织和体液中,其作用原理是分解微生物的细胞壁,对消除外来病原微生物起着重要作用,它的活性是反映非特异性免疫水平的指标之一(李鑫等, 2014),养殖环境中氨氮的突然升高往往也伴随着水环境恶化、致病菌丛生,因此,本研究选择LSZ作为首先测定对象。在实验中,随着氨氮胁迫时间的延长,LSZ活性呈现先升高后降低的趋势。在第7天,氨氮浓度为10 mg/L时,LSZ活性最高,但当氨氮胁迫到第10、13天时,LSZ活性显著降低。
CAT和SOD是生物体内两种相互关联的抗氧化酶,两者能够协同清除自由基(洪美玲等, 2007)。CAT能催化H2O2分解成氧和水(Bakala et al, 2012),而且存在于所有已知的动物的各组织中。SOD是能够催化超氧化物通过歧化反应转化为O2和H2O2,保护细胞免受氧化损伤(徐钢春等, 2007),基因工程改造后缺乏该酶的小鼠(Mus musculus)会患上严重的疾病(Huang et al, 2001)。刘洪展等(2012)研究表明,适宜浓度的氨氮可减轻活性氧对刺参造成的机体损伤,促进刺参的免疫水平,因此,研究氨氮胁迫中CAT和SOD的变化具有重要意义。在本研究中,氨氮胁迫对刺参CAT和SOD两种酶的影响呈现明显的相似性。氨氮胁迫到第7天,CAT和SOD的活性与氨氮浓度呈正相关性,当氨氮浓度为10 mg/L时,2种酶活性最高;到第10天时,2种酶的活性显著降低且低于对照组,芦光宇等(2014)、任海等(2014)在氨氮胁迫对甲壳动物免疫指标影响的研究中指出,长时间的氨氮胁迫会使动物机体免疫活性降低甚至低于正常水平,与本研究结果基本一致,可见刺参在维持非特异性免疫酶的持续高活性存在一个时间极限值。氨氮作为胁迫刺激,能引起甲壳动物血细胞数量变化,促使免疫力升高(Chen et al, 2012; Rodríguez-Ramos et al, 2008)。本研究中,氨氮胁迫到第4、7天,3种不同规格刺参非特异性免疫酶呈现显著升高,免疫力明显增强。但在第10、13天时,3种不同规格刺参非特异性免疫酶活性显著降低,免疫力明显减弱。其原因可能是随着氨氮胁迫时间的延长,刺参的非特异免疫调节已经达到极限,并超出了刺参非特异性免疫酶的正常调控范围,从而不能维持LSZ、CAT、SOD的高活性,进而不能维持刺参正常的生理状态,最终使刺参出现吐肠、化皮等疾病。
3.3 氨氮胁迫对不同规格刺参非特异性免疫酶活性影响的差异刺参的生长发育分为胚胎发育期、浮游幼体期和底栖生长期,底栖生长期包括稚参、幼参和成参3个阶段。本实验以3种不同规格的幼参为研究对象,结果表明,中规格刺参对氨氮胁迫较为敏感,相同氨氮浓度时,中规格刺参的LSZ、CAT和SOD活性始终高于小、大规格刺参,小、大规格刺参3种酶活性略有差异并呈现大规格活性高于小规格。朱江艳等(2013)研究表明,氨氮胁迫对不同规格刺参非特异性免疫酶活性影响存在差异,但差异不显著。同时,不同规格刺参对外界的胁迫刺激反应不同(赵斌等, 2015; 李根瑞等, 2016),最明显的是温度对不同规格刺参的影响。小规格刺参对温度的敏感性显著低于中、大规格刺参,在刺参夏眠过程中,小规格刺参夏眠阀值温度明显高于中、大规格刺参(纪婷婷, 2009)1)。本实验中,不同规格刺参在相同强度的氨氮胁迫时非特异性免疫酶活性略有差异,原因可能是:小规格刺参的非特异性免疫调节相对较弱,不能有效利用体内能量维持3种非特异性免疫酶的高活性,导致整个实验过程中非特异性免疫酶活性最低;中、大规格刺参的非特异性免疫调节能力相当,但与大规格刺参相比,中规格刺参面临更大的生存压力,并且观察到其运动、摄食行为等均高于大规格刺参,因此,中规格刺参在面对胁迫环境时更能有效地利用体内能量并提高自身免疫水平,从而在氨氮胁迫时使非特异性免疫酶长时间处于高活性。
1) Ji TT. Ecological and physiological mechanisms on temperature change in sea cucumber, Apostichopus japonicus. Doctoral Dissertation of Ocean University of China, 2009, 14-19[纪婷婷.刺参(Apostichopus japonicus)对温度变化的生态生理学响应机制.中国海洋大学博士研究生学位论文, 2009, 14-19]
目前,池塘养殖是刺参养殖的主要模式之一,随着池塘养殖规模的扩大,出现了池塘的养殖年限过长、养殖密度过大、池底清理不及时等问题,导致池塘环境污染严重,使水环境指标急剧变化,氨氮含量往往处在较高水平(迟爽等, 2013),而长时间的高氨氮含量会导致刺参免疫力降低,扰乱刺参正常生理状态,最终出现病害、死亡。本研究结果表明,在刺参养殖过程中,当氨氮浓度≤6 mg/L时,刺参能够很好地维持正常生理状态;当氨氮浓度≥8 mg/L时,短时间内(≤10 d),刺参基本处于较正常生理状态,但其运动、摄食及自然伸展状态均不同程度地受到影响,长时间(≥13 d)胁迫会导致刺参吐脏、化皮,甚至死亡。因此,在刺参养殖过程中,水环境中氨氮浓度最好控制在6 mg/L以内,以保证刺参正常生长和生存,不可长时间高于8 mg/L,尤其不能高于10 mg/L,长时间(≥13 d)高浓度氨氮会导致刺参生理状态紊乱,增加刺参患病和死亡风险。本研究结果在一定程度上可为刺参池塘水质调控与高效健康养殖提供基础数据和理论支持。
| Bakala H, Hamelin M, Mary J, et al. 2012. Catalase, a target of glycation damage in rat liver mitochondria with aging. Biochimica et Biophysica Acta, 1822(10): 1527-1534 | |
| Chang YQ, Sui XL, Li J. The current situation, problem and prospect on the Apostichopus japonicas aquaculture. Fisheries Science, 2006, 25(4): 198-201[常亚青, 隋锡林, 李俊. 刺参增养殖业现状、存在问题与展望. 水产科学, 2006, 25(4): 198-201] | |
| Chen YY, Sim SS, Chiew SL, et al. Dietary administration of a Gracilaria tenuistipitata extract produces protective immunity of white shrimp Litopenaeus vannamei in response to ammonia stress. Aquaculture, 2012, 370-371(2): 26-31 | |
| Chi S, Zeng Y, Zhao ZJ, et al. Variation of water quality in culture ponds for Apostichopus japonicas. Journal of University of Jinan (Science and Technology), 2013, 27(3): 239-244 DOI:10.7632/J.ISSN:1671-3559.2013.03.006[迟爽, 曾勇, 赵振军, 等. 刺参养殖池塘的水质变化. 济南大学学报(自然科学版), 2013, 27(3): 239-244] | |
| Hong ML, Chen LQ, Gu SZ, et al. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (Eriocheir sinensis). Journal of Fishery Sciences of China, 2007, 14(3): 412-418[洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412-418] | |
| Hu Y, Huang Y, Zhong L, et al. Effects of ammonia stress on the gill Na+/K+-ATPase, microstructure and some serum physiological-biochemical indices of juvenile black carp (Mylopharyngodon piceus). Journal of Fisheries of China, 2012, 36(4): 538-545[胡毅, 黄云, 钟蕾, 等. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响. 水产学报, 2012, 36(4): 538-545] | |
| Huang TT, Carlson EJ, Kozy HM, et al. Genetic modification of prenatal lethality and dilated cardiomyopathy in Mn superoxide dismutase mutant mice. Free Radical Biology & Medicine, 2001, 31(9): 1101-1110 | |
| Li CL, Song AH, Hu W, et al. Status analysis and sustainable development strategy of sea cucumber Apostichopus japonicus Selenka aquaculture industry in Shandong Province. Progress in Fishery Sciences, 2010, 31(4): 126-133[李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策. 渔业科学进展, 2010, 31(4): 126-133] | |
| Li GR, Ren LH, Sun GH, et al. Effects of hypoxic stress on oxidative stress indices in Apostichopus japonicas. Progress in Fishery Sciences, 2016, 37(5): 133-139[李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参(Apostichopus japonicus)氧化应激指标的影响. 渔业科学进展, 2016, 37(5): 133-139] | |
| Li X, Tan ZJ, Ling XH, et al. Application of lysozyme in aquaculture. Veterinary Orientation, 2014(4): 51-53[李鑫, 谭志坚, 凌欣华, 等. 溶菌酶在养殖中的应用. 兽医导刊, 2014(4): 51-53] | |
| Liu HZ, Zheng FR, Sun XQ, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian Apostichopus japonicas. Marine Sciences, 2012, 36(8): 47-52[刘洪展, 郑风荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响. 海洋科学, 2012, 36(8): 47-52] | |
| Liu XY, Jiang CJ, Wang GH, et al. Strategic thoughts on promoting the sustainable development of sea cucumber aquaculture. China Fisheries, 2012(2): 76-78[刘锡胤, 姜成嘉, 王国华, 等. 推进刺参养殖业可持续发展的战略思考. 中国水产, 2012(2): 76-78] | |
| Lu GY, Liu GX, Li JJ, et al. Effect of ammonia nitrogen on function of antioxidant system in Procambarus clarkia. Acta Agriculture Jiangxi, 2014, 26(2): 129-133[芦光宇, 刘国兴, 李佳佳, 等. 氨氮对克氏原螯虾抗氧化功能的影响. 江西农业学报, 2014, 26(2): 129-133] | |
| Luo Z, Zhai YY, Chen JX. High density aquaculture research technology in Penaeus vannamei pond. Modern Agricultural Science and Technology, 2013(16): 266-270 DOI:10.3969/j.issn.1007-5739.2013.16.168[罗鸷, 翟拥艳, 陈进喜. 南美白对虾池塘高密度养殖技术研究. 现代农业科技, 2013(16): 266-270] | |
| Ren H, Li J, Li JT, et al. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in Exopalaemon carinicauda. Journal of Agro-Environment Science, 2014, 34(4): 647-655 DOI:10.11654/jaes.2014.04.005[任海, 李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾(Exopalaemon carinicauda)抗氧化系统酶活力及GPx基因表达的影响. 农业环境科学学报, 2014, 34(4): 647-655] | |
| Rodríguez-Ramos T, Espinosa G, Marrero J, et al. Effects of Echerichia coli lipopolysaccharides and dissolved ammonia on immune response in southern white shrimp Litopenaeus schmitti. Aquaculture, 2008, 274(1): 118-125 DOI:10.1016/j.aquaculture.2007.10.049 | |
| Xu GC, Gu RB, Wen HB, et al. Effects of environmental stress on lysozyme and superoxide dismutase of Corbicula fluminea (Müller). Journal of Anhui Agricultural University, 2007, 34(1): 74-78[徐钢春, 顾若波, 闻海波, 等. 环境胁迫对河蚬溶菌酶和超氧化物歧化酶活性的影响. 安徽农业大学学报, 2007, 34(1): 74-78] | |
| Zang YQ, Tian XL, Dong SL, et al. The activities of immunoenzymes and heat shock protein 70 content of sea cucumber, Apostichopus japonicus (Selenka) to chronic stress of ammonia nitrogen. Periodical of Ocean University of China, 2012, 42(Z1): 60-66[臧元奇, 田相利, 董双林, 等. 氨氮慢性胁迫对刺参免疫酶活性及热休克蛋白表达的影响. 中国海洋大学学报, 2012, 42(Z1): 60-66] | |
| Zhao B, Hu W, Li CL, et al. The effects of low salinity on the growth and activities of digestive enzymes in sea cucumber Apostichopus japonicus. Progress in Fishery Sciences, 2015, 36(1): 91-96 DOI:10.11758/yykxjz.20150114[赵斌, 胡炜, 李成林, 等. 低盐环境对3种规格刺参(Apostichopus japonicus)幼参生长与消化酶活力的影响. 渔业科学进展, 2015, 36(1): 91-96] | |
| Zhao YF, Ma GW, Wang PP, et al. Investigation report on Jiaonan sea cucumber aquaculture. Shandong Fisheries, 2010, 27(4): 53-55[赵艳芳, 马广文, 王萍萍, 等. 关于胶南市刺参养殖业的调研报告. 齐鲁渔业, 2010, 27(4): 53-55] | |
| Zhu JY, Zhang HC, Chen ZQ, et al. Comparisons of innate immune activity among different-sized members of the sea cucumber species Apostichopus japonicas. Journal of Jimei University (Natural Science), 2013, 18(6): 408-412[朱江艳, 张洪彩, 陈政强, 等. 不同规格刺参的非特异性免疫活性研究. 集美大学学报(自然科学版), 2013, 18(6): 408-412] |



