2. 中国水产科学研究院黄海水产研究所 农业部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;
3. 连云港市启明水产有限公司 连云港 222100;
4. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Lianyungang Ganyu Marine Fishery Technical Guidance Station, Lianyungang 222100;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
凡纳滨对虾(Litopenaeus vannamei)养殖业在全世界水产养殖业中占有十分重要的地位,凡纳滨对虾年产量在全球养殖水产品中位居第6位,其年总产值高居养殖水产品第1位,我国的凡纳滨对虾年产量占世界总产量的40%左右(FAO, 2012)。对虾的传统养殖模式,以提高密度、加大投饵量来追求更高的产量,导致水体中的氨氮、亚硝酸氮及有机营养废物等的含量提高,养殖水体和底质富营养化,病原菌大量繁殖,造成对虾的发病和大量死亡(周鲜娇等, 2009; 葛红星等, 2014; 孙舰军等, 1999)。
以色列科学家Avnimelech(1999)分析养殖过程中无机氮的代谢通路,提出通过调节C/N来控制水体中无机氮的循环,以降低水体中无机氮的浓度,并首次将生物絮团技术应用在水产养殖中。之后,该技术被广泛应用于各类对虾养殖的各个时期(陈亮亮等, 2014),展现了巨大的推广前景。在对虾养殖中使用生物絮团,可以改善养殖水质,降低水体中的氨氮、亚硝酸盐及硝酸盐的浓度(Ray et al, 2011; Zhao et al, 2012),改善水体微生物的群落结构(杨章武等, 2015),抑制弧菌等有害病原的数量(Devaraja et al, 2002),并且可以有效提高对虾产量(张许光, 2012)1)。
1) Zhang XG. The application and research of bio-floc technology in factory farming systems of Litopenaeus vannamei. Masterxs Thesis of Ocean University of China, 2012, 34-38 [张许光.生物絮团技术在凡纳滨对虾工厂化养殖中的应用与研究.中国海洋大学硕士研究生学位论文, 2012, 34-38]
杨章武等(2015)研究表明,除简单添加有机碳源外,在絮团培养过程中添加适当的功能益生菌,可以调节水体微生物群落结构、提高水体中有益菌比例、提高对虾的免疫力,进而降低养殖过程中的发病率,使对虾的成活率明显提高。为了获得培养絮团所需的大量功能益生菌,本实验室前期研究使用秸秆、麦麸、花生粕等农业副产品进行简易发酵,得到一定数量的芽孢杆菌(Bacillus)发酵液(赵培, 2011)2),但发酵材料及发酵过程不适用于养殖现场使用。
2) Zhao P. The study and application of bio-flocs technology in seawater aquaculture. Doctoral Dissertation of Shanghai Ocean University, 2011, 32-42 [赵培.生物絮团技术在海水养殖中的研究与应用.上海海洋大学博士研究生学位论文, 2011, 32-42]
本研究旨在探索一种适用于养殖现场的功能益生菌简易发酵及使用模式,降低益生菌使用成本,为更加有效地推广生物絮团技术提供新的思路。
1 材料与方法 1.1 菌种与对虾实验用巨大芽孢杆菌(B. megaterium)由中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室分离保藏。实验用凡纳滨对虾于2015年7月9日购自江苏连云港赣榆区某育苗场,暂养15 d后进行实验,平均体重为(0.147±0.066) g。
1.2 实验场地及设施实验于2015年7月–10月在连云港启明水产有限公司实验大棚中进行。养殖实验使用15个Ø 0.8 m × 1.0 m的水泥池,每池进注0.8 m深的消毒海水,每池底部对称安装2个气石。42个气石连接一台0.3 kW电磁式空气压缩机(海利, 广东)。菌液的大量培养使用容积为30 L (Ø 0.3 m×0.45 m)的带盖塑料桶,每桶底部布置1个气石并使用气阀调节供气。
1.3 发酵材料的预处理 1.3.1 菌株种子液制备将保存于–80℃的菌种转接到新鲜的2216E平板培养基上,28℃培养24 h。挑取平板上的单菌落,接种于装有200 ml 2216E液体培养基的500 ml锥形瓶中,于28℃、180 r/min摇床中震荡培养24 h。
1.3.2 发酵用器材及海水消毒条件探索发酵使
用盐度为29±2的砂滤海水,经黑暗沉淀15 d,注入发酵塑料桶中,充气用气管、气阀及气石同时浸入水中。分别加入三氯异氰尿酸钠(中博生物, 武汉, 有效氯浓度≈50%)至终浓度为0、20、40、100、200、300 mg/L,静置处理12 h。取各浓度水样100 μl,稀释为1/101–1/103系列,取100 μl涂布于2216E及TCBS固体平板培养基,28℃培养24 h,进行平板计数。每个浓度重复3次。
1.4 发酵培养基配比及培养条件优化本实验使用对虾0#颗粒饲料(三发普林,唐山,粗蛋白≥43%、粗脂肪≥4%、灰分≤16%、水分≤12%)及赤砂糖(蔗糖含量>98%)分别作为发酵培养的氮源和碳源,对培养基比例、发酵时间、温度及装液量等发酵条件逐一优化。采样平板稀释涂布法进行发酵产物的活菌计数与纯度检测。
1.4.1 培养基优化使用L9(33)正交设计方案,进行三因素三水平实验,因素及水平设置见表 1。接种种子液浓度为2.0×109 CFU/ml,培养温度为28℃,装液量为20%,24 h后取样,每组设置3个平行。数据使用SPSS 18.0进行分析。
|
|
表 1 培养基优化正交设计 Table 1 The orthogonal experiment design of culture medium |
使用优化后条件,保持其他条件不变,温度分别设置为25℃、28℃、31℃、34℃及37℃,每个温度3个平行。于24 h进行取样计数。
1.4.3 装液量使用优化后条件,保持其他条件不变,装液量分别设定为20%、30%、40%、50%及60%,每个装液量设置3个平行。于24 h进行取样计数。
1.4.4 发酵时间使用优化后的最佳比例进行发酵,设置3个平行,从0 h起,每隔12 h进行取样计数,至72 h。绘制生长曲线。
1.5 添加益生菌发酵液的凡纳滨对虾养殖实验 1.5.1 分组及日常管理在15个Ø0.8 m×1.0 m的水泥池中,每池注0.8 m深的消毒海水,按照400尾/m3密度放苗开始养殖实验。实验设置对照组、絮团组及增强絮团组,每组分别设置3个平行,研究发酵液添加对养殖水体水质及凡纳滨对虾生长的影响。对照组为常规换水养殖,前25 d,每3 d换水30 cm;25 d后,每2 d换水30 cm。絮团组向水体中添加赤砂糖,前7 d,每天按照30 g/池进行添加;7 d后,每天赤砂糖按照前一天饲料投喂量的70%进行添加(张许光, 2012)1)。增强絮团组赤砂糖添加量同絮团组,发酵液(浓度约1×1010 CFU/ml)每5 d按照200 ml/池进行添加。根据养殖水体检测情况,絮团组及增强絮团组均于30 d及43 d换水2次,每次约40 cm水位的换水量。各组日常饲料投喂量根据预估的对虾存活情况维持在相同水平。各组每天进行吸底,定时观察对虾活动情况。
1) Zhang XG. The application and research of bio-floc technology in factory farming systems of Litopenaeus vannamei. Masterxs Thesis of Ocean University of China, 2012, 9-21 [张许光.生物絮团技术在凡纳滨对虾工厂化养殖中的应用与研究.中国海洋大学硕士研究生学位论文, 2012, 9-21]
1.5.2 指标监测养殖过程中,每7 d从各池中层取水3 L,混匀后取1 L注入沉淀漏斗(1000-0010, Nalgene)中,静置30 min,测量絮团量。每5 d从各池取中层水500 ml,经0.45 μm微孔滤膜过滤后,进行水质指标测试,分别使用次溴酸盐氧化法(国家海洋局, 2007) 及盐酸萘乙二胺分光光度法(国家海洋局, 1991) 测定养殖水体的氨氮(NH3-N)及亚硝酸氮(NO2-N)含量。每天06:00使用水质检测仪(YSI-556,维赛,美国)测定各池的温度、pH、溶解氧及盐度。养殖周期为52 d,其中,30 d及52 d测量对虾的体长及体重。
1.6 数据分析统计使用SPSS 18.0设计正交实验,对数据进行单因素方差分析(One-way ANOVA)、Turkey’s多重检验,以P<0.05作为差异显著水平判定条件。
2 结果 2.1 所需添加菌液大量培养条件的探索及优化 2.1.1 培养用海水的消毒处理设置不同终浓度对发酵用海水及器材进行同步消毒处理,结果显示,未消毒海水中活菌数量达到9×105CFU/ml,经200 mg/L及以上浓度的三氯异氰尿酸钠(有效氯约50%)处理12 h后,水体中没有监测到可培养活菌(表 2)。因此,细菌培养用海水用200 mg/L三氯异氰尿酸钠进行消毒处理。
|
|
表 2 三氯异氰尿酸钠处理12 h对海水的消毒效果 Table 2 Disinfection of seawater with sodium trichloroisocyanurate for 12 h |
通过L9(33)正交设计方案,对培养基参数中的饲料、赤砂糖添加量及菌种接种量进行优化,24 h时取样检测活菌数(表 3),经方差分析可以得出,饲料(A)、赤砂糖(B)、接种量(C)三个因素均对巨大芽孢杆菌的发酵产生显著影响(P<0.05) (表 4)。极差(R)表明三个因素对发酵后菌液浓度的影响大小依次为赤砂糖>饲料>接种量。根据各因素K值可以得到最优组合为A2B2C3,此组合在正交实验结果中也得到验证。因此,培养基最优比例为饲料3 g/L、赤砂糖6 g/L、接种剂量1×108 CFU/ml。
|
|
表 3 简易发酵培养基优化正交实验结果 Table 3 The orthogonal experiment result for the optimization of simplified fermentation medium |
|
|
表 4 正交实验方差分析 Table 4 Variance analysis of the orthogonal experiment |
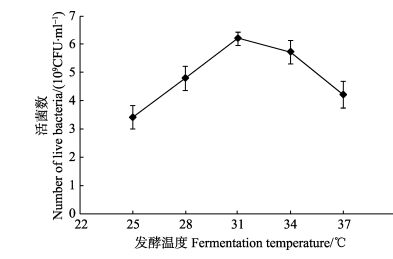
不同的发酵温度下,发酵液中菌浓度有显著差异(图 1),在31℃时,巨大芽孢杆菌生长速度最快;在34℃时,菌浓度仍为最佳温度时的90%以上。故应将温度控制在31–34℃范围内。而25℃时,发酵效果只有31℃的50%,即在此条件下,发酵时间应该延长为2倍。
|
图 1 发酵温度对巨大芽孢杆菌在简易发酵中活菌数的影响 Figure 1 Effects of temperature on the number of live B. megaterium during the simplified fermentation |
装液量影响发酵液的搅拌力度和溶解氧水平。容量为30 L(Ø 0.3 m×0.45 m)的塑料桶中,装液量为20%、30%和40%,即装液深度为9 cm、13.5 cm和18 cm时,经24 h培养后,巨大芽孢杆菌的浓度基本保持在同一水平(图 2),随着装液量继续加大,菌浓度明显下降。在装液量为60%(装液深度为27 cm)时,发酵产物的活菌数为最适条件下的57%。

|
图 2 装液量对巨大芽孢杆菌在简易发酵中的活菌数的影响 Figure 2 Effects of loading volume on the number of live B. megaterium during the simplified fermentation |
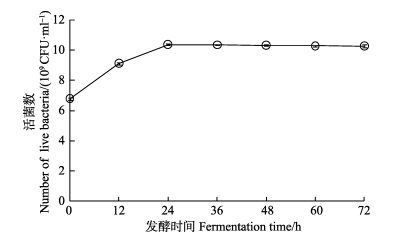
按照优化过的培养基配方:饲料3 g/L、赤砂糖6 g/L、接种量1×108 CFU/ml,在31℃下按照40%装液量进行巨大芽孢杆菌发酵,从0 h开始,每12 h取样进行平板涂布,检测发酵液活菌数。如图 3所示,菌株在前24 h内指数增速大量繁殖,在24 h时达到数量顶点,活菌数达到1.16×1010 CFU/ml,总菌数比接种量提高了100倍以上。24 h之后到达平台期,其后活菌数基本维持在同一水平至少2 d以上。在实际生产中,随着发酵时间的延长,发酵液被杂菌污染的几率会逐渐增大。因此,应在发酵液活菌数达到平台期后尽快使用。
|
图 3 发酵时间对巨大芽孢杆菌在简易发酵中的活菌数的影响 Figure 3 Effects of incubation time on the live number of B. megaterium during the simplified fermentation |
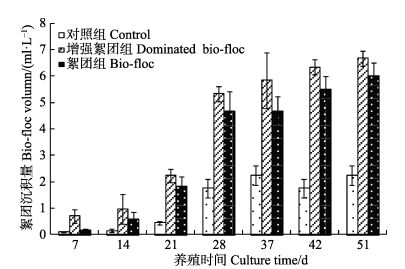
在养殖开始时,絮团组和巨大芽孢杆菌增强絮团组每天添加赤砂糖,水色逐渐变为棕褐色,并伴随有絮状物产生,透明度迅速降低。对照组水色无明显变化,透明度较高(>40 cm)。每7 d观察各池中生物絮团的沉积量,以获得整个养殖周期内絮团的变化情况(图 4)。增强絮团组的水体中,在第7天时就有明显的棕色絮状物生成且沉积量高于其他2组,并保持较快的增长速度,在整个养殖期内始终高于其他2组,在中后期一直保持在5 ml/L以上。絮团组中絮团量的增长速度显著高于对照组,但低于增强絮团组,且沉积量在后期才高于5 ml/L。对照组的絮团沉积量始终在2 ml/L左右,并且获得的沉积颜色较浅,不同于另外2组的棕褐色。
|
图 4 养殖过程水体加糖和巨大芽孢杆菌对絮团量的影响 Figure 4 Effects of sugar and B. megaterium on the bio-floc biomass in pond water of farmed shrimp |
7月25日–9月15日的养殖过程中,水温由(32.0±1.0)℃缓慢降至(25.9±0.5)℃,溶解氧保持在(6.0±1.5) mg/L,pH由最初的7.80±0.15逐步升高至8.25±0.25。因异养菌的大量繁殖需要消耗氧气并产生二氧化碳,造成2个培养絮团组的溶解氧水平较对照组低约0.5–1.5 mg/L,pH较对照组低约0.3–0.5。
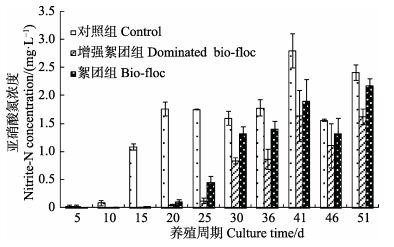
养殖期间每5 d进行氨氮及亚硝酸氮浓度的监测,以了解养殖水体水质的变化(图 5和图 6)。结果显示,对照组虽然每2 d换水30%,放苗后10 d其氨氮水平依然快速升高至1 mg/L以上,换水后,氨氮水平依然维持在0.8 mg/L左右达15 d以上;亚硝酸氮也在第15天增加到1 mg/L以上,且呈持续增长的趋势。而2个实验组在前期不换水的情况下,总氨氮浓度只是缓慢上升,亚硝酸氮浓度到第30天才达到1 mg/L左右的水平。在养殖30 d后,氨氮浓度在各组均出现明显下降,保持在0.5–0.2 mg/L的较低水平。

|
图 5 养殖过程中水体加糖和巨大芽孢杆菌对氨氮浓度变化的影响 Figure 5 Effects of sugar and B. megaterium on the ammonia-N concentration in pond water of farmed shrimp |
|
图 6 养殖过程中水体加糖和巨大芽孢杆菌对亚硝酸氮浓度变化的影响 Figure 6 Effects of sugar and B. megaterium on the nitrite-N concentration in pond water of farmed shrimp |
增强絮团组及絮团组在30 d及43 d时进行换水处理,第1次换水时,2组的氨氮浓度均有大幅下降(图 5),第2次时亚硝酸氮浓度下降明显(图 6)。增强絮团组亚硝酸氮浓度始终低于絮团组(在25 d、30 d、36 d及51 d差异显著,P<0.05)。
2.2.3 对虾生长情况本实验中,放苗时凡纳滨对虾的平均体长为(2.24±0.34) cm,平均体重为(0.15±0.07) g。经养殖51 d,对照组对虾平均体长为(5.6±0.1) cm,平均体重为(2.0±0.1) g;絮团组平均体长为(5.5±0.2) cm,平均体重为(2.0±0.2) g;增强絮团组平均体长为(5.7±0.3) cm,平均体重为(2.2±0.3) g (图 7)。而在养殖过程中,30 d时的增强絮团组对虾的体长与体重增长速度具有更大的差异,显著高于对照组与絮团组,分别较对照组高约16%和45%。统计的51 d存活率显示,增强絮团组为(56.4±3.2)%,絮团组为(47.3±2.1)%,显著高于对照组的(37.1±4.1)%。养殖过程中,由于苗种质量问题以及水体偏小,对虾整体生长速度较为缓慢,对虾在35 d时发生白斑病,对照组发病最重,日常检查时偶现对虾残体,导致最终存活率普遍偏低,同批次虾苗的常规养殖生产出现同样情况,于40 d时停止养殖。
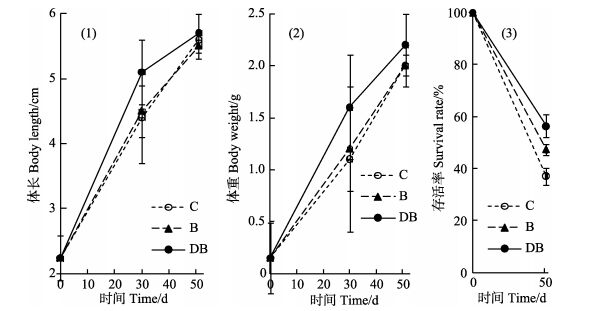
|
图 7 养殖凡纳滨对虾生长和存活情况 Figure 7 The growth and survival of the farmed L. vannamei (1) 体长变化;(2) 体重变化;(3) 存活率C:对照组; B:絮团组; DB:增强絮团组 (1) Change of body length; (2) Change of body weight; (3) Survival rate C: Control; B: Bio-floc group; DB: Dominated bio-floc group |
生物絮团技术强调对水体C/N的调节,对添加碳源的种类和数量进行了研究(邓应能等, 2012),但功能益生菌添加对生物絮团应用影响方面的研究较少。本研究探索优化了一种便捷的功能益生菌大量培养方式,将之用于凡纳滨对虾生物絮团养殖过程,并与对照组养殖效果相比较,以探究功能益生菌的添加对生物絮团养殖效果的影响。不同于实验室条件下生物絮团养殖添加的少量益生菌,工厂化生物絮团养殖过程中所需添加的菌量较大,因此,益生菌加强的生物絮团工厂化养殖技术,需要一种简易快速培养所需微生物的方法和工艺。
因养殖厂环境较为简陋,要使菌液的大量培养既简便易行又低成本进行,需要使用取材容易又方便可行的方法和工艺,其中,细菌培养使用的器具及海水的消毒灭菌,使用了养殖场用来日常消毒的三氯异氰尿酸钠,培养基营养成分则使用就地取材的对虾饲料与赤砂糖。本研究中使用的巨大芽孢杆菌为芽孢杆菌科一种好氧的革兰氏阳性菌,因其对氮磷钾等营养元素具有较好的代谢作用,被广泛应用于水体净化、微生物复合肥、畜牧养殖及原核表达系统等领域(Claudia et al, 2012; 王琳等, 2009)。在对巨大芽孢杆菌培养基的配比进行优化的基础上,对影响细菌生长的培养温度、生长时间、发酵用塑料桶的装液量及充气情况进行了优化。
温度对细菌的生长速度影响较大,每种细菌均可在一定温度范围内生长。随着温度升高,细菌因酶活力升高而加速生长,但超过最适温度,细菌就会因酶活力降低而加速衰老,使生长速度减慢。Kanjanachumpol等(2013)选择30℃为巨大芽孢杆菌的最佳发酵温度,陈凯等(2010)研究确定的最适发酵温度范围为32–34℃,这与本研究确定的最适范围为31–34℃的结果相接近。装液量影响发酵系统内的溶解氧水平及体系内搅拌强度,进而影响菌株的生长。章四平等(2010)对枯草芽孢杆菌(B.subtilis)的发酵实验显示,装液量达到50%时,发酵产物的活菌数会有显著下降。本研究中优化的最佳装液量为40%。
优化培养条件后,巨大芽孢杆菌的最终发酵产物中的活菌数可达到1.16×1010CFU/ml。相较于张媛媛等(2012)在实验室条件下使用废糖蜜、玉米粉、豆粕等材料对2株复合芽孢杆菌进行发酵获得的活菌浓度6.62×1010 CFU/ml,本实验条件优化后的发酵结果可达到相同数量级。同样在养殖现场条件下发酵,较赵培(2011)1)使用秸秆、麦麸等农业副产品发酵坚强芽孢杆菌(B.firmus)获得的活菌浓度(4×107 CFU/ml)高3个数量级。这种在养殖现场简易快速大量培养微生物的方法,可以满足微生物增强絮团养殖模式所需要的生物量与低成本的的要求,易于推广应用。
1) Zhao P. The study and application of bio-flocs technology in seawater aquaculture. Doctoral Dissertation of Shanghai Ocean University, 2011, 32-42 [赵培.生物絮团技术在海水养殖中的研究与应用.上海海洋大学博士研究生学位论文, 2011, 32-42]
生物絮团技术应用中,同时添加碳源和益生菌,能有效控制水体中氨氮及亚硝酸氮的积累(葛红星等, 2013)。相较于单纯的添加益生菌或碳源,同时添加益生菌及碳源可提高对虾的存活率、降低饵料系数(张欢欢等, 2016)。本研究中,增强絮团组同时添加益生菌和赤砂糖,其亚硝酸氮的浓度始终显著低于单纯絮团组,因亚硝酸氮有毒害作用,絮团组对虾的体长、体重及成活率均明显低于增强絮团组。本研究的结果表明,对虾生物絮团养殖技术结合功能性益生菌的适量添加,可以更大程度地提高生物絮团养殖技术的效率。本研究中的生物絮团只添加了一株益生菌,虽然增强组各指标明显优于单纯絮团组,但由于所用虾苗质量问题,养殖实验在50 d就停止,在一定程度上影响了实验结果的显著性。随着后期更多不同功能的潜在益生菌的获得和在絮团养殖中的应用探索,有望通过在絮团养殖技术中添加不同功能的微生物,建立更加高效的生物絮团养殖模式。
| Avnimelech Y. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture, 1999, 176(3-4): 227-235 DOI:10.1016/S0044-8486(99)00085-X | |
| Chen K, Li JS, Yang HT, et al. Phosphate solubilizing abilities of Bacillus megaterium strain P1 and its fermentation conditions. Soil and Fertilizer Science in China, 2010(4): 73-76[陈凯, 李纪顺, 杨合同, 等. 巨大芽孢杆菌P1的解磷效果与发酵条件研究. 中国土壤与肥料, 2010(4): 73-76] | |
| Chen LL, Dong HB, Li ZJ, et al. Review of the application and perspective of biofloc technology in shrimp culture. Marine Science, 2014, 38(8): 103-108 DOI:10.11759/hykx20130816001[陈亮亮, 董宏标, 李卓佳, 等. 生物絮团技术在对虾养殖中的应用及展望. 海洋科学, 2014, 38(8): 103-108] | |
| Claudia K, Josef BC, Thibault G. Debottlenecking recombinant protein production in Bacillus megaterium under large-scale conditions — targeted precursor feeding designed from metabolomics. Biotechnology & Bioengineering, 2012, 109(6): 1538-1550 | |
| Deng YN, Zhao P, Sun YZ, et al. Conditions for bio-floc formation and its effects in closed culture system of Litopenaeus vannamei. Progress in Fishery Sciences, 2012, 33(2): 69-75[邓应能, 赵培, 孙运忠, 等. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果. 渔业科学进展, 2012, 33(2): 69-75] | |
| Devaraja TN, Yusoff FM, Shariff M. 2002. Changes in bacterial populations and shrimp production in ponds treated with commercial microbial products. Aquaculture,, 2066(3-4): 245-256 | |
| FAO. FAO yearbook. Fishery and Aquaculture Statistics, 2012 | |
| Ge HX, Li J, Chen P, et al. The immune response of Litopenaeus vannamei and its susceptibility to Vibrio parahaemolyticus under stress caused by ammonia nitrogen at different concentrations. Progress in Fishery Sciences, 2014, 35(6): 76-82 DOI:10.11758/yykxjz.20140611[葛红星, 李健, 陈萍, 等. 氨氮胁迫下凡纳滨对虾对副溶血弧菌的易感性. 渔业科学进展, 2014, 35(6): 76-82] | |
| Ge HX, Li J, Chen P, et al. Effects of the fermentation solution of wheat bran, cane sugar and Bacillus substilis on water quality and growth performance of cultured Penaeus vannamei in indoor industrial facilities. Chinese Fishery Quality and Standards, 2013, 3(4): 55-62[葛红星, 李健, 陈萍, 等. 麦麸、蔗糖和芽孢杆菌发酵液对室内工厂化养殖凡纳滨对虾水质和生长的影响. 中国渔业质量与标准, 2013, 3(4): 55-62] | |
| Kanjanachumpol P, Kulpreecha S, Tolieng V. Enhancing polyhydroxybutyrate production from high cell density fed-batch fermentation of Bacillus megaterium BA-019. Bioprocess and Biosystems Engineering, 2013, 36(10): 1463-1474 DOI:10.1007/s00449-013-0885-7 | |
| Ray AJ, Dillon KS, Lotz JM. Water quality dynamics and shrimp (Litopenaeus vannamei) production in intensive, mesohaline culture systems with two levels of biofloc management. Aquacultural Engineering, 2011, 45(3): 127-136 DOI:10.1016/j.aquaeng.2011.09.001 | |
| Sun JJ, Ding ML. Effect of ammonia-N on anti-disease ability of Penaeus chinensis. Oceanologia et Limnologia Sinica, 1999, 30(3): 267-272[孙舰军, 丁美丽. 氨氮对中国对虾抗病力的影响. 海洋与湖沼, 1999, 30(3): 267-272] | |
| Wang L, Li J, Zhang PY. Laboratory study on treatment of eutrophicated scenery water body by Bacillus megaterium. Ecology and Environmental Sciences, 2009, 18(1): 75-78[王琳, 李季, 张鹏岩. 巨大芽孢杆菌对富营养化景观水体的净化效果. 生态环境学报, 2009, 18(1): 75-78] | |
| Yang ZW, Yang K, Zhang Z, et al. Research on the biofloc bacterial community structure during larval rearing of Litopenaeus vannamei using metagenome sequencing. Journal of Fujian Fisheries, 2015, 37(2): 91-97[杨章武, 杨铿, 张哲, 等. 基于宏基因组测序技术分析凡纳滨对虾育苗中生物絮团细菌群落结构. 福建水产, 2015, 37(2): 91-97] | |
| Zhang HH, Wang XH, Li C, et al. Isolation and identification of a Bacillus sp. and application in bioflocs technology shrimp culture system. Progress in Fishery Sciences, 2016, 37(2): 111-118 DOI:10.11758/yykxjz.20150416001[张欢欢, 王秀华, 李晨, 等. 一株芽孢杆菌的分离鉴定及在生物絮团对虾养殖中的应用. 渔业科学进展, 2016, 37(2): 111-118] | |
| Zhang SP, Liu SM, Wang JX, et al. Optimizing fermentation condition for the antagonistic Bacillus subtilis NJ-18 strain. Journal of Nanjing Agricultural University, 2010, 33(2): 58-62[章四平, 刘圣明, 王建新, 等. 枯草芽孢杆菌生防菌株NJ-18的发酵条件优化. 南京农业大学学报, 2010, 33(2): 58-62] | |
| Zhang YY, Zhao M, Zhang N. Optimization of culture medium and fermentation conditions for compound probiotics of Bacillus. Journal of Northeast Forestry University, 2012, 40(3): 93-97[张媛媛, 赵敏, 张宁. 复合益生菌芽孢杆菌发酵培养基及条件的优化. 东北林业大学学报, 2012, 40(3): 93-97] | |
| Zhao P, Huang J, Wang XH. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus. Aquaculture, 2012, s354-355(2): 97-106 | |
| Zhou XJ, Qiu DQ. Effects of nitrite nitrogen and Vibrio parahaemolyticus on some immunity indicators of Litopenaeus vannamei. Journal of Hydroecology, 2009, 2(1): 49-53[周鲜娇, 邱德全. 亚硝酸氮和副溶血弧菌对凡纳滨对虾部分免疫指标的影响. 水生态学杂志, 2009, 2(1): 49-53] |



