牙鲆(Paralichthys olivaceus)是一种重要的海水养殖鱼类,主要分布于日本,韩国和中国的沿海地区(Seikai, 2002),其肉质细嫩、营养丰富,深受广大消费者的喜爱。在我国牙鲆养殖业蓬勃发展的同时,由于牙鲆人工养殖特别是高密度集约化养殖条件与天然环境差别很大,导致各种疾病时有发生。牙鲆养殖病害日趋严重,已成为制约其养殖发展的重大障碍。
牙鲆病害主要有病毒性和细菌性疾病,在我国细菌性疾病危害最为严重。牙鲆的病原细菌有许多种,主要包括鳗弧菌(Vibrio anguillarum)、迟缓爱德华氏菌(Edwardsiella tarda)、溶藻弧菌(Vibrio alginolyticus)、链球菌(Streptococcus)等(周丽等, 1997)。其中,由鳗弧菌引起的鳗弧菌病是一种危害性较大的细菌性疾病,致死率较高,且在世界范围内流行(Egidius, 1987;杨少丽等, 2005)。
由于牙鲆细菌性病害死亡率高,对养殖业存在严重危害,研制稳定、可靠的商品疫苗预防细菌性疾病的暴发,培育具有抗细菌性疾病的优良品种是牙鲆病害防治的主要途径。无论采用哪种途径,首先必须深入了解鲆鲽类受细菌感染的影响,研究牙鲆免疫相关分子机理。在脊椎动物中,免疫系统通常被分为两个相互独立又相互关联的亚系统,即先天性免疫和获得性免疫。而在鱼类中,虽然同时存在先天性免疫和获得性免疫,但其获得性免疫较原始,与哺乳动物和鸟类相比免疫应答时间较长,且免疫记忆弱,同时会受到水温的影响,二次应答与初次应答抗体价的比率一般较低,有的鱼类几乎没有区别(Sun et al, 2014)。因此,在鱼类抵御外来病原体入侵等免疫过程中,先天性免疫的作用更为突出。补体系统是先天性免疫的重要组成部分,它能够帮助抗体和吞噬细胞清除病原微生物,是一套复杂高效而精密的防御系统,由30多种蛋白质组成。而在调节补体激活保护机体免受自身补体攻击的过程中,终末裂解途径又起到至关重要的作用。CD59蛋白,又称保护素(Protectin),是迄今为止唯一被鉴定出的研究最为透彻的可在终末裂解途径中起到调节作用的蛋白(Miwa et al, 2001)。CD59是一个分子量为18-20 kDa的球状膜糖蛋白,它通过糖基化磷脂酰基醇(GPI)锚定在细胞膜上(Davies et al, 1989)。CD59的主要功能是抑制终末裂解途径中攻膜复合体(MAC)的装配,且其抑制原理是通过阻止C9结合到C5b-8复合体上而完成的(Meri et al, 1990)。在鱼类中,CD59的分子特征及功能已有报道。Sun等(2013) 克隆了斑马鱼的CD59基因并进行了原核表达,且研究了其时空表达模式。结果发现,重组表达蛋白能够与革兰氏阴性和阳性细菌特有的细胞壁成分LPS和LTA结合,进而表现出抑菌活性;Gan等(2015) 在尼罗罗非鱼(Oreochromis niloticus)中也进行了CD59基因的克隆与表达分析,同样通过原核表达获得重组蛋白,该蛋白具有与PGN和LTA的结合能力,且对无乳链球菌(Streptococcus agalactiae)具有一定的杀菌活性。此外,CD59基因在大黄鱼(Pseudosciana crocea)、虹鳟(Oncorhynchus mykiss)和斑点叉尾鮰(Ictalurus Punetaus)等鱼类中均有研究(Liu et al, 2007; Papanastasiou et al, 2007; Yeh et al, 2007)。
本研究以牙鲆为研究对象,研究了感染鳗弧菌后牙鲆CD59基因的表达模式,并进行了CD59基因在大肠杆菌系统中的原核表达,成功得到了重组蛋白并对其进行了纯化复性。同时,还研究了该重组蛋白对各类致病菌的抑菌活性,为进一步研究牙鲆CD59基因功能提供了一定的理论基础。
1 材料与方法 1.1 实验材料 1.1.1 鳗弧菌的培养实验所用鳗弧菌菌株来自中国海洋大学海洋微生物研究中心。将该菌株划线接种于2216E固体培养基(蛋白胨5.0 g/L,酵母提取物1.0 g/L,FePO4·4H2O 0.1 g/L,琼脂20 g/L,pH 7.6) 中,28℃活化培养12 h。活化后将单克隆菌落接种于2216E液体培养基(蛋白胨5.0g/L,酵母提取物1.0 g/L,FePO4·4H2O 0.1 g/L,pH 7.6) 中,28℃扩大培养12 h。用PBS缓冲液稀释至终浓度为109 CFU/ml。
1.1.2 实验牙鲆来源本研究所用牙鲆为6月龄,平均体长为20-22 cm,来源于山东省黄海水产有限公司(山东,海阳),实验前置于充气海水中,17-20℃暂养7 d。
1.2 实验方法 1.2.1 鳗弧菌攻毒实验取12尾牙鲆,进行腹腔注射。其中,6尾作为对照组,注射生理盐水;6尾作为实验组,注射109 CFU/ml的鳗弧菌菌液。注射剂量为1 ml/尾。随后,将注射组和对照组分别暂养于17-20℃的充气海水中,48 h后取样。取牙鲆的4种免疫器官:肝脏、脾脏、肾脏和鳃,用组织剪剪碎,液氮速冻后,于-80℃保存备用。
1.2.2 RNA的提取与反转录采用TRIzol法(Invitrogen, 美国)进行牙鲆各组织RNA的提取。操作步骤严格按照厂家提供的说明书进行。采用1%琼脂糖凝胶电泳进行检测所提取的RNA质量和完整性,采用微量紫外分光光度计(NanoPhotometer Pearl,德国)测定RNA浓度。随后,用DNaseⅠ(RNase free)(TaKaRa,日本)去除可能存在的DNA残留。cDNA的合成采用M-MLV(TaKaRa,日本)方法。操作步骤严格按照产品说明书进行,cDNA合成后于-20℃保存备用。
1.2.3 半定量PCR根据实验室前期克隆得到的牙鲆CD59基因序列(GenBank登录号:EU224373) 设计特异性引物(表 1) 进行半定量PCR,检测鳗弧菌感染前后各个免疫组织的CD59表达模式。实验组和对照组各取3条牙鲆,每条牙鲆均取4种免疫组织(肝脏、脾脏、肾脏和鳃),同一种组织的cDNA混合后进行检测。反应总体系为25 μl:cDNA 2 μl,10×PCR Buffer (Mg2+) 2.5 μl,MgCl2 (25 mmol/L)1.5 μl,dNTP (2.5 mmol/L) 2 μl,引物(10 μmmol/L)各0.5 μl,Taq酶(5 U/μl) 0.25 μl,ddH2O补足至25 μl。选用牙鲆18S RNA基因作为内参基因。扩增条件为94℃ 4 min;94℃ 30 s,65℃ 30 s,72℃ 30 s;从20个循环开始,每2个循环取出1个PCR小管,直到28个循环,确定指数期在26个循环以内,由此各组织差异表达选定循环数为24个。目的基因CD59的扩增条件为94℃ 4 min;94℃ 30 s,60℃ 30 s,72℃ 30 s;从28个循环开始,每2个循环取出1个PCR小管,直到40个循环,确定指数期在40个循环之内,各组织差异表达选定循环数为36个。PCR结束后,用1.5%的琼脂糖凝胶电泳进行检测。
|
|
表 1 本研究所用引物 Table 1 Primer used in the study |
设计1对引入EcoRⅠ和XhoⅠ两个酶切位点的引物(表 1),对编码CD59成熟肽(氨基酸序列20-99) 的cDNA进行PCR扩增。扩增得到的PCR产物用EcoRⅠ和XhoⅠ(TaKaRa,日本)进行双酶切,并连接入EcoRⅠ和XhoⅠ双酶切的pET-32a(+)(Invitrogen,美国)载体中。将构建好的pET-32a-CD59载体转化入克隆菌株trans 5α (全式金,中国),通过菌落PCR挑取阳性克隆,送往生工生物工程(上海)有限公司进行测序鉴定。测序鉴定序列正确后,将pET-32a-CD59载体转化入表达菌株BL21(DE3) pLysS(全式金,中国)。绘制重组表达菌株的生长曲线:取16支试管,用含有50 μg/ml氨苄霉素和34 μg/ml氯霉素双抗的LB液体培养基(蛋白胨10 g/L, 酵母提取物5 g/L,NaCl 10 g/L,pH 7.0) 37℃培养重组表达菌。每小时取1支试管,测定OD600值,根据每小时所测得的菌液OD600值,绘制重组表达菌株的生长曲线。根据测定的重组菌株的生长曲线(见结果2.2),在培养3 h时,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为1 mmol/L。分别在37℃诱导1 h、3 h和6 h后,收集菌液,用SDS-PAGE电泳进行检测。
1.2.5 CD59重组蛋白表达形式的确定用上述条件进行重组蛋白的诱导表达,诱导3 h后,收集菌液。5000×g离心10 min,收集菌体,用预冷的裂解液(50 mmol/L Tris, 100 mmol/L NaCl, pH 8.0) 重悬菌体,冰浴进行超声破碎。12000×g离心20 min,分离上清液和沉淀,用SDS-PAGE电泳进行检测。
1.2.6 CD59重组蛋白的纯化CD59重组蛋白以包涵体形式存在于超声破碎的沉淀中(见结果2.4)。因其含有His标签,使用Ni-Agarose His标签蛋白纯化试剂盒(包涵体蛋白)(CWBIO,中国)进行纯化。用上述条件进行超声破碎后,12000×g离心20 min,收集沉淀(包涵体),充分溶解于Binding Buffer (Tris-HCl 20 mmol/L,咪唑5 mmol/L,NaCl 0.5 mmol/L,尿素8 mol/L)中,负载过Ni柱,最后用Elution Buffer (Tris-HCl 20 mmol/L,咪唑500 mmol/L,NaCl 0.5 mol/L,尿素8 mol/L)洗脱目的蛋白,得到纯化的CD59重组蛋白,用SDS-PAGE电泳进行检测。
1.2.7 Western blotting通过SDS-PAGE分离蛋白样品,湿转法将蛋白样品转移至PVDF膜上,用含有4% BSA的10 mmol/L PBS封闭,室温孵育2 h。PBS洗涤PVDF膜后,孵育一抗(Anti-His Antibody,CWBIO),抗体浓度为0.2-1.0 μg/ml,4℃孵育过夜。PBS洗涤PVDF膜后,室温孵育1︰400稀释的二抗(羊抗鼠IgG-HRP,CWBIO) 40 min。最后,用DAB加0.03%双氧水进行显色。
1.2.8 CD59重组蛋白的复性及浓度测定采用透析的方式进行CD59重组蛋白的复性。即将纯化后的CD59重组蛋白依次逐级经过以下透析液进行透析复性:透析液Ⅰ(Tris 25 mmol/L,NaCl 200 mmol/L,尿素5 mlo/L,EDTA 1 mmol/L,DTT 5 mmol/L)、透析液Ⅱ(Tris 25 mmol/L,NaCl 50 mmol/L,尿素4 mol/L,EDTA 1 mmol/L,GSSG 0.2 mmol/L,GSH 2 mmol/L)、透析液Ⅲ(Tris 25 mmol/L,NaCl 20 mmol/L,尿素2 mol/L,EDTA 1 mmol/L,GSSG 0.5 mmol/L GSH 1 mmol/L)、透析液Ⅳ(Tris 25 mmol/L,NaCl 10 mmol/L,尿素1 mol/L,EDTA 1 mmol/L,DTT 5 mmol/L,GSSG 1 mmol/L,GSH 1 mmol/L,甘油25 ml)、透析液Ⅴ(Tris 25 mmol/L,NaCl 10 mmol/L,尿素0.5 mol/L,EDTA 1 mmol/L,DTT 5 mmol/L,GSSG 1 mmol/L,GSH 1 mmol/L,甘油25 ml,甘氨酸5 g)、透析液Ⅵ(Tris 25 mmol/L,NaCl 10 mmol/L,DTT 5 mmol/L,甘油25 ml,甘氨酸5 g)和透析液Ⅶ(Tris 25 mmol/L,NaCl 10 mmol/L)。每一级均透析12 h,冰浴下搅拌进行。复性后的重组蛋白经超滤浓缩,用Super Bradford蛋白定量试剂盒(CWBIO,中国)测定蛋白浓度。
1.2.9 CD59重组蛋白的抑菌活性测定采用菌落计数法(Wang et al, 2011) 进行重组蛋白的抑菌实验。选取嗜水气单胞菌(Aeromonas hydrophila)、鳗弧菌、金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli) 4种致病指示菌与重组蛋白进行作用,检测其抑菌程度。CD59重组蛋白的抑菌活性计算公式为:
抑菌活性=(对照组菌落数-实验组菌落数)/对照组菌落数×100%
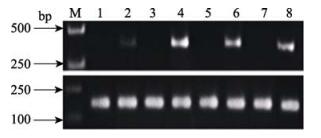
2 结果 2.1 CD59的表达模式对鳗弧菌攻毒后牙鲆的CD59基因进行了半定量分析。分别取实验组和对照组牙鲆各3条,检测4种免疫组织(肝脏、脾脏、肾脏、鳃)中CD59基因的相对表达量。成功扩增得到了356 bp的牙鲆CD59基因和171 bp的牙鲆18S RNA基因的片段(图 1)。由图 1可知,实验组中,牙鲆的CD59基因在4种免疫器官中均有表达,而对照组中该基因则均不表达。其中,牙鲆肾脏的CD59表达量最高,脾脏和鳃的表达量其次,肝脏中该基因的表达量则较低。
|
图 1 注射鳗弧菌后牙鲆的CD59基因在肝脏、肾脏、脾脏和鳃中的表达 Figure 1 Expression of CD59 in liver, kidney, spleen, and gill of Japanese flounder after V. anguillarum injection M:DL2000;1、3、5、7:对照组肝脏、肾脏、脾脏和鳃;2、4、6、8:实验组肝脏、肾脏、脾脏和鳃 M: DL2000; 1, 3, 5, and 7: Liver, kidney, spleen and gill in control group; 2, 4, 6, and 8: Liver, kidney, spleen and gill in experimental group |
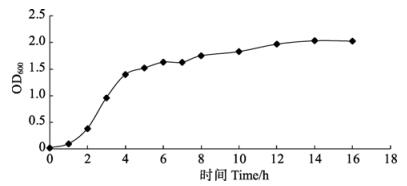
通过构建原核表达载体,获得了牙鲆CD59重组表达菌株,并进行了牙鲆CD59基因的原核表达。为确定加入诱导剂IPTG的最佳时间,即确定重组菌株的生长状态较好并对外源蛋白耐受力较高的时间,绘制了CD59重组菌株的生长曲线(图 2)。发现在震荡培养3 h左右时,重组菌株进入指数生长期的上升时期。由此可以判断,在后续的诱导中,可以选择在培养3 h左右时加入IPTG,此时菌体的生长状况最佳,对IPTG的加入及大量外源蛋白表达的耐受性也最高。因此,在后续的实验中将该时间点作为加入诱导剂的最佳时机。
|
图 2 重组菌株pET-32a-CD59的生长曲线 Figure 2 The growth curve of recombinant pET-32a-CD59 |
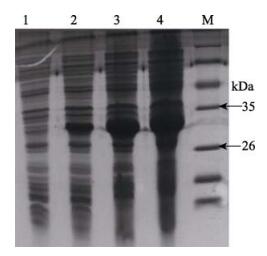
根据2.2中确定的最佳诱导剂添加时间,在重组菌株培养至3 h时,加入IPTG诱导,成功表达了牙鲆的pET-32a-CD59重组蛋白,SDS-PAGE检测获得的重组蛋白(图 3)。从图 3可以看出,在诱导1 h时有约为29 kDa的目的蛋白的表达,随着诱导时间的增加(3 h、6 h),表达量也有所增加,但在诱导3 h时蛋白的表达量就已经达到一定的丰度,与诱导6 h的蛋白量相差不大。因此,后续实验选择诱导3 h。
|
图 3 重组蛋白pET-32a-CD59在大肠杆菌中的诱导表达(目的蛋白约为29 kDa)
Figure 3 Expression of recombinant protein pET-32a-CD59 (target protein was 29 kDa approximately)
M:蛋白分子量标准;1:未诱导;2:诱导1 h; 3:诱导3 h;4:诱导6 h M: Protein relative molecular mass marker; 1: Before induction; 2: 1 h induction; 3: 3 h induction; 4: 6 h induction |
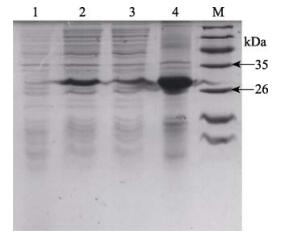
为了检测牙鲆pET-32a-CD59重组蛋白的表达形式,超声波破碎重组表达菌体,离心分离上清液和沉淀,并进行SDS-PAGE分析(图 4),发现pET-32a-CD59重组蛋白主要存在于沉淀中,即该蛋白主要以不溶性包涵体的形式存在。包涵体蛋白结构致密、无活性、易以颗粒状沉淀存在于细胞中。对CD59重组蛋白功能的探究需进行蛋白复性。
|
图 4 pET-32a-CD59重组蛋白的表达形式 Figure 4 The expression form of pET-32a-CD59 recombinant protein M:蛋白分子量标准;1:pET-32a空载体;2:pET-32a-CD59全菌;3:pET-32a-CD59超声破碎上清;4:pET-32a-CD59超声破碎沉淀 M: Protein relative molecular mass marker; 1: Negative control of BL21 transferred by pET-32a; 2: Whole cell of BL21 transferred by pET-32a-CD59; 3: Supernatant of pET-32a-CD59 after ultra-sonication; 4: Precipitate of pET-32a-CD59 after ultra-sonication |
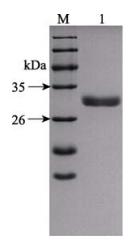
pET-32a-CD59重组蛋白带有His标签,本研究通过Ni离子亲和层析,得到了纯化的pET-32a-CD59重组蛋白。纯化后的重组蛋白分子量大小与预测的一致,条带单一,主带清晰(图 5)。
|
图 5 pET-32a-CD59重组蛋白的纯化 Figure 5 The purification of pET-32a-CD59 recombinant protein M:蛋白分子量标准;1:纯化的pET-32a-CD59重组蛋白 M: Protein relative molecular mass marker; 1: Purified recombinant pET-32a-CD59 |
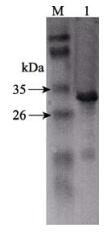
纯化后的pET-32a-CD59重组蛋白经SDS-PAGE电泳后转印到PVDF膜上,分别用His抗体和羊抗鼠IgG-HRP作为一抗和二抗进行Western blotting。结果显示,pET-32a-CD59重组蛋白在29 kDa处出现一条特异性条带,表明诱导纯化后的CD59重组蛋白正确表达(图 6)。
|
图 6 Western blotting检测重组蛋白 Figure 6 Western blotting analysis of the recombinant protein M:蛋白分子量标准;1:CD59重组蛋白 M: Protein relative molecular mass marker; 1: Recombinant pET-32a-CD59 |
透析复性后观察发现,重组蛋白无絮状析出或沉淀,复性成功。超滤后,对得到的浓缩蛋白进行蛋白浓度的测定,结果显示,蛋白浓度为1100 μg/ml。
2.8 CD59重组蛋白的抑菌活性为了检测牙鲆pET-32a-CD59重组蛋白的抑菌活性,本研究选择了4种致病指示菌,通过菌落计数法探究其抑菌活性(表 2)。从表 2可以看出,pET-32a-CD59重组蛋白仅对嗜水气单胞菌具有一定的抑菌效果,从100 μg/ml起,其抑菌活性就已达50%,但随着浓度的升高,其抑菌活性增幅不大。
|
|
表 2 重组蛋白pET-32a-CD59对嗜水气单胞菌的抑菌活性 Table 2 Antimicrobial activity of recombinant pET-32a-CD59 against A. hydrophila |
牙鲆生活在富含微生物的复杂水环境中,长期地适应生活形成了高效的自我防御机制,其先天性免疫系统高度发达。而补体系统是先天性免疫系统中的重要组成部分。CD59在补体系统中具有重要的调节作用,对于该基因的研究,有助于进一步了解牙鲆免疫系统的调节机制,并为将来其在提高牙鲆免疫防御力方面的提供理论支持。
本研究通过半定量PCR技术检测了牙鲆CD59基因在肝脏、肾脏、脾脏和鳃4种免疫组织中的表达模式。结果显示,牙鲆CD59基因在受到细菌感染之后的肾脏中表达量最高。而在其他鱼类中,类似的研究显示,尼罗罗非鱼和虹鳟的CD59基因广泛分布于肾、肝、脾、心、脑、肠等,其中,脑中的表达量最高,在肾中,其表达量在对照组和实验组间也有显著差异(Gan et al, 2015; Papanastasiou et al, 2007)。斑马鱼中,CD59基因表达分布广泛,且在脑中具有最高丰度的表达(Sun et al, 2013)。这种差异可能与鱼的种类有关。脑和肾脏是鱼体神经内分泌系统中的重要组织,且脑对免疫反应有调控作用(王文博等, 2002),而肾脏是鱼类重要的免疫器官,是鱼类抵御外来病原菌入侵过程中最先产生免疫调节作用的免疫器官之一;肾脏也是脊椎动物合成补体的主要场所之一。当牙鲆受到细菌感染后,补体系统激活产生膜攻击复合物(MAC),导致细胞肿胀、坏死、细胞因子释放,参与许多肾脏疾病的发病过程。而CD59基因可以通过抑制C9和C5b-8的结合及C9分子的延伸阻-断MAC的形成对肾脏内皮细胞系膜细胞起保护作用(王金泉等, 1996),本研究在牙鲆中CD59的半定量结果也显示,CD59基因在牙鲆免疫防御和补体系统激活/抑制中起重要作用,揭示了CD59是牙鲆抵抗细菌感染的重要免疫基因。
原核表达结果显示,牙鲆CD59重组蛋白是以包涵体形式存在的,形成包涵体主要有两方面原因:一方面,由于原核表达系统中缺乏真核细胞中天然存在的辅助蛋白折叠的分子伴侣等小分子物质,从而在空间上使来源于真核细胞的外源蛋白无法正确折叠。在本研究中,CD59重组蛋白本身具有多个二硫键结构,且其结构对于功能的发挥至关重要。因此,二硫键无法正确配对,无法形成正确的蛋白构象,导致无活性包涵体的产生。另一方面,高效的大肠杆菌表达系统使得表达菌株在加入诱导剂后几乎立即停止自身蛋白的表达,转而高效地大量表达转化入细胞内的外源蛋白,而这种蛋白合成速度往往过快,从而在时间上使重组蛋白来不及进行正确的折叠,进而导致重组蛋白以错误的折叠方式(结构致密的包涵体形式)存在。Sun等(2013) 报道了斑马鱼的CD59重组蛋白同样以包涵体形式存在,且需要经过复性后才表现出一定的抑菌活性。
为了研究牙鲆CD59重组蛋白的生物活性,作者对其进行了复性。复性过程采用透析方式,首先加入足量的变性剂(尿素)使包涵体蛋白充分溶解,致密的结构能够松散打开。随后,通过逐量减少变性剂、加入GSSG与GSH等氧化还原体系,使错误的二硫键打开,进而重新配对结合,形成正确的二硫键。最后一级的透析液中不添加变性剂,只是单纯的Tris-NaCl缓冲液,为重组蛋白提供一种适宜的生理环境,确保其生物活性的维持。
通过对牙鲆CD59重组蛋白的抑菌实验发现,重组蛋白在浓度为100 μg/ml时,对嗜水气单胞菌具有近50%的抑菌活性,随着蛋白浓度的提高最高可升至56.25%。斑马鱼的CD59重组蛋白对大肠杆菌具有一定的抑菌活性,对金黄色葡萄球菌具有轻微的抑菌活性(Sun et al, 2013),且有一定的浓度依赖效应。有趣的是,当重组蛋白浓度低于100 μg/ml时,对金黄色葡萄球菌反而起了促进生长的作用。这可能是由于低浓度的重组蛋白不但没有杀菌效果,反而作为一种碳氮营养源为细菌的生长提供了养分。而尼罗罗非鱼的CD59重组蛋白在浓度为100 μg/ml时,对无乳链球菌产生了一定的抑菌活性,且随着蛋白浓度的提高显示出明显的浓度依赖效应,当浓度达到800 μg/ml时,其对无乳链球菌的抑菌活性可达到44.2%(Gan et al, 2015)。Liu等(2007) 研究表明,大黄鱼的CD59重组蛋白在体外溶血系统中能够抑制红细胞的裂解。但这种作用只对来源于大黄鱼和罗非鱼的血清起作用,而对小鼠和鸡的血清无效果,这表明CD59对于补体激活的调节过程具有物种选择性。
CD59基因在牙鲆感染鳗弧菌前后的表达模式显示,牙鲆CD59基因参与了牙鲆对鳗弧菌感染的免疫防御,是牙鲆补体系统中重要的免疫基因。CD59可抑制补体调节过程中MAC的形成,这也意味着该基因可能在保护机体不受自身免疫系统攻击的同时,对于已经产生细胞溶解反应的正常细胞具有修复作用。这也提供了一个新的CD59基因在免疫防御方面的研究方向。本研究利用原核表达的方法获得了重组表达蛋白pET-32a-CD59,纯化、复性后的重组蛋白pET-32a-CD59对嗜水气单胞菌具有抑菌活性,且较低浓度(100 μg/ml)即具有一定的抑菌能力,结果可进一步用于牙鲆抗菌肽的开发与应用。但本研究所获得的蛋白为包涵体,表达后的蛋白纯化及复性过程复杂,且蛋白得量较低,这些因素限制了重组蛋白的大规模生产及应用。因此,下一步的研究中需构建更加合适的融合表达载体,并筛选大量表达且有活性的抗菌肽工程菌株,简化纯化过程,降低生产成本,以实现大规模生产。
| Davies A, Simmons DL, Hale G, et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. Journal of Experimental Medicine, 1989, 170(3): 637-654 DOI:10.1084/jem.170.3.637 | |
| Egidius E. Vibriosis: Pathogenicity and pathology. A review. Aquaculture, 1987, 67(1-2): 15-28 DOI:10.1016/0044-8486(87)90004-4 | |
| Gan Z, Wang B, Zhou W, et al. Molecular and functional characterization of CD59 from Nile tilapia (Oreochromis niloticus) involved in the immune response to Streptococcus agalactiae. Fish and Shellfish Immunology, 2015, 44(1): 50-59 DOI:10.1016/j.fsi.2015.01.035 | |
| Liu GZ, Zhang JZ, Chen XH. Molecular and functional characterization of a CD59 analogue from large yellow croaker Pseudosciana crocea. Molecular Immunology, 2007, 44(15): 3661-3671 DOI:10.1016/j.molimm.2007.04.006 | |
| Meri S, Morgan BP, Davies A, et al. Human protectin (CD59), an 18, 000-20, 000 MW complement lysis restricting factor, inhibits C5b-8 catalysed insertion of C9 into lipid bilayers. Immunology, 1990, 71(1): 1-9 | |
| Miwa T, Song WC. Membrane complement regulatory proteins: Insight from animal studies and relevance to human diseases. International Immunopharmacology, 2001, 1(3): 445-459 DOI:10.1016/S1567-5769(00)00043-6 | |
| Papanastasiou AD, Eleftheria G, Zarkadis IK. Cloning of a CD59-like gene in rainbow trout. Expression and phylogenetic analysis of two isoforms. Molecular Immunology, 2007, 44(6): 1300-1306 | |
| Seikai T. Flounder culture and its challenges in Asia. Reviews in Fisheries Science, 2002, 10(10): 421-432 | |
| Sun C, Wu J, Liu S, et al. Zebrafish CD59 has both bacterial-binding and inhibiting arnctivities. Developmental and Comparative Immunology, 2013, 41(2): 178-188 DOI:10.1016/j.dci.2013.05.008 | |
| Sun JC, Ugolini S, Vivier E. Immunological memory within the innate immune system. The EMBO Journal, 2014, 33(12): 1295-1303 | |
| Wang JQ. The relationship between CD59 and kidney disease. Foreign Medical Sciences(Urology and Nephrology Foreign Medical Sciences), 1996, 11061106(6): 249-252[王金泉. CD59与肾脏疾病. 国外医学:泌尿系统分册, 1996, 11061106(6): 249-252] | |
| Wang SH, Wang Y, Ma J, et al. Phosvitin plays a critical role in the immunity of zebrafish embryos via acting as a pattern recognition receptor and an antimicrobial effector. Journal of Biological Chemistry, 2011, 286(25): 22653-22664 DOI:10.1074/jbc.M111.247635 | |
| Wang WB, Li AH. The effect of environmental stress to fish immune system. Journal of Fisheries of China, 2002, 26(4): 368-374[王文博, 李爱华. 环境胁迫对鱼类免疫系统影响的研究概况. 水产学报, 2002, 26(4): 368-374] | |
| Yang SL, Wang YG, Dong SG. Progress of research on vibriosis in marine cultured fish. Marine Fisheries Research, 2005, 26(4): 75-83[杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展. 海洋水产研究, 2005, 26(4): 75-83] | |
| Yeh HY, Klesius PH. Molecular cloning and expression of channel catfish, Ictalurus punctatus, complement membrane attack complex inhibitor CD59. Veterinary Immunology and Immunopathology, 2007, 120(3-4): 246-253 DOI:10.1016/j.vetimm.2007.07.016 | |
| Zhou L, Gong QL, Yu KK. Diseases of Japanese flounder, Paralichthys olivaceus. Journal of Ocean University of Qingdao, 1997, 27(2): 173-180[周丽, 宫庆礼, 俞开康. 牙鲆的疾病. 青岛海洋大学学报, 1997, 27(2): 173-180] |



