2. 农业部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 大连海洋大学 大连 116023;
4. 烟台开发区天源水产有限公司 烟台 264000
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Dalian Ocean University, Dalian 116023;
4. Yantai Tianyuan Aquaculture Co., Ltd, Yantai 264000
人工育苗条件下,海水鱼类在早期仔鱼的口裂形成阶段、后期仔鱼的饵料转换期以及稚鱼快速生长期都会出现较高的死亡率(于海瑞等, 2003; Dadzie et al, 2000; 陈猛猛等, 2015),这与仔稚鱼的消化吸收密切相关。鱼体消化系统的不断发育与完善是其摄取外界营养与满足自身生长的基础(林强等, 2007)。分析研究鱼体消化系统的形态结构与组织特征有助于深入了解其对摄食饵料的分解、消化、吸收的内在机制,对改进饵料的种类和形状,提高营养吸收都有极积的意义。国内外学者已对军曹鱼(Rachycentron canadum) (初庆柱等, 2010)、湘华鲮(Sinilabeo decorus tungting) (梁志强等, 2011)、鲇鱼(Silurus asotus)(蒲红宇等, 2004)、北美牙鲆(Paralichthys californicus) (Gisbert et al, 2004a)、细鳞鲑(Brachymystax lenok)(徐革锋等, 2013)及斜带石斑鱼(Epinephelus coioides)(吴金英等, 2003)等不同鱼种早期发育阶段的消化道发育过程做了较为细致的研究,为这些品种的苗种培育、仔稚幼鱼的饵料开发提供了有益的数据资料。
美洲黑石斑鱼(Centropristis striata),俗称黑石斑,生活于美国的缅因州到佛罗里达州北部的大西洋沿岸及墨西哥湾水域(Stuart et al, 2003),该品种生长速度快、抗逆性强,2003年被引进中国(雷霁霖等, 2007)。李海燕等(2011)通过解剖和光镜技术对美洲黑石斑鱼幼鱼的消化道结构进行了详细描述,但其早期生长阶段的形态学和组织学构造、功能与摄食饵料间的相关关系尚未有报道。本研究通过连续组织切片,对1-34 d鱼苗的消化道及消化腺进行细致的观察分析,实验结果可为美洲黑石斑鱼早期生长阶段选择适口饵料、确定最佳投饵时间与最佳投饵量提供参考,为进一步提高苗种生长率及存活率提供理论支撑。
1 材料与方法 1.1 实验对象及培育条件本研究于2015年6-8月在烟台开发区天源水产有限公司开展,美洲黑石斑鱼受精卵是养殖5年以上、经强化培育后的亲鱼自然产卵受精所获得的。将受精卵置于14 m3的水泥池中,微流水充气孵化,布卵密度为15 g受精卵/m3,水温为(24±1)℃,盐度为30-32。美洲黑石斑鱼仔鱼孵出3 d后开口,以褶皱臂尾轮虫(Brachionus plicatilis)作为开口饵料,随着鱼苗的生长逐渐投喂桡足类、卤虫(Artemia salina)无节幼体以及适于不同生长时期鱼苗口径的配合饲料。生物饵料在投喂前用浓缩小球藻(Chlorella vulgaris)及营养强化剂进行强化。每天08:00和15:00投喂生物饵料,投饵密度为10-15个/ml。育苗前期,每天仅添加少量的新鲜海水。7 d后,每天定时更换少量的新鲜海水,随着日龄的增加,开始增加新鲜海水的换水量。自布池开始,每日向水池中均匀泼洒浓缩小球藻液改善水质。10 d后,每日上午吸底,清除排泄物、残饵及死鱼。
1.2 实验方法自美洲黑石斑鱼仔鱼孵出后,开始连续取样,每次随机取样30尾;15 d后隔天取样,每次随机取样15尾。样品先经Bouin氏液固定24 h,次日用70%乙醇小心清洗样品后置于常温条件下保存。取样结束后,样品经常规脱水、石蜡包埋处理后,再用Leica RM 2135型切片机进行连续切片(切片厚度约为5-6 μm),切片经HE染色后,用中性树胶封片,用于显微观察。在Olympus BX 40型显徽镜下,观察仔鱼消化系统组织器官结构。同时,用Olympus PM20显微镜进行拍照。
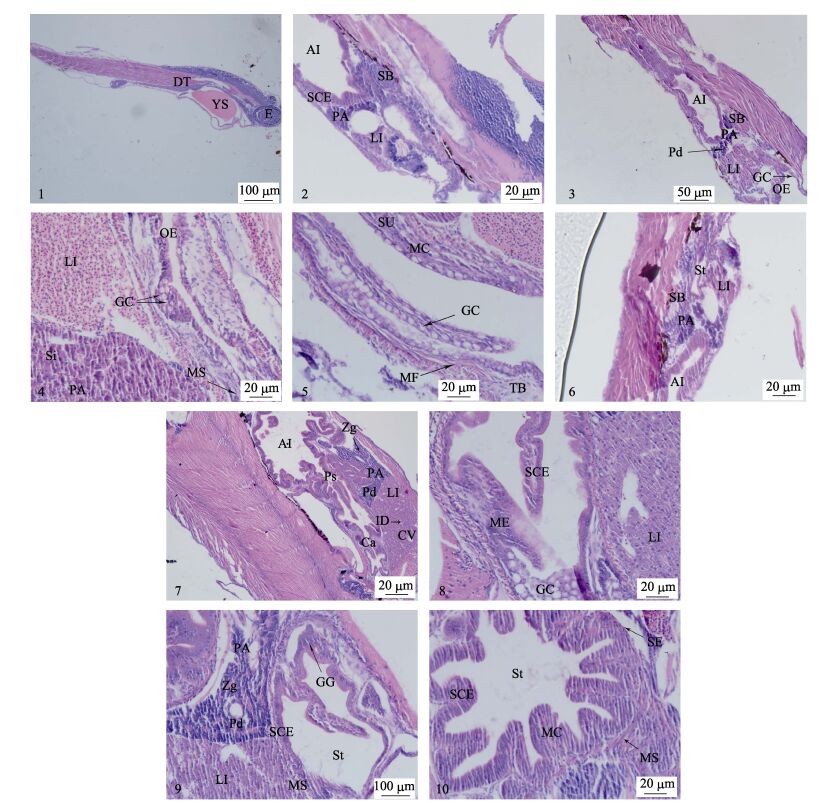
2 结果与分析 2.1 消化道美洲黑石斑鱼1 d仔鱼,消化道位于卵黄囊背侧,口和肛门未与外界连通,消化道尚未分化,中部略有凸起(图 1-1)。3 d仔鱼,消化道逐渐分化形成口腔咽、食道和肠,口裂形成,肛门开通(图 1-2)。
|
图 1 美洲黑石斑消化系统胚后发育组织学观察 Figure 1 Histological observation on post-embryonic development of digestive tract of C. striata 1:1 d仔鱼消化道纵切;2:3 d仔鱼腹部纵切;3:11 d仔鱼肝胰脏与前肠纵切;4:18 d仔鱼食道纵切;5:34 d仔鱼食道纵切;6:3 d仔鱼肝脏纵切;7:18 d仔鱼腹部纵切;8:20 d仔鱼贲门部纵切;9:27 d仔鱼胰脏与胃部纵切;10:34 d仔鱼胃部横切;AI:前肠;Ca:贲门括约肌;CV:中央静脉;DT:消化道;E:眼睛;ID:小叶间胆管;GC:杯状细胞;GG:胃腺;LI:肝脏;MC:黏膜层;ME:复层上皮;MF:黏膜褶皱;MS:肌肉层;OE:食道;PA:胰脏;Pd:胰管;Ps:幽门括约肌;SB:鱼鳔;SCE:单层柱状细胞;SE:浆膜层;Si:血窦;St:胃;SU:黏膜下层;TB:味蕾;YS:卵黄囊;Zg:酶原颗粒 1: Longitudinal section of 1 dph larva fish digestive tract; 2: Longitudinal section of 3 dph larva fish abdomen; 3: Longitudinal section of 11 dph larva fish liver, pancreas and anterior intestine; 4: Longitudinal section of 3 dph larva fish oesophagus; 5: Longitudinal section of 34 dph larva fish oesophagus; 6: Longitudinal section of 3 dph larva fish liver; 7: Longitudinal section of 18 dph larva fish abdomen; 8: Longitudinal section of 20 dph larva fish cardia; 9: Longitudinal section of 27 dph larva fish pancreas and stomach; 10: Cross section of 34 dph larva fish stomach; AI: Anterior intestine; Ca: Cardiac sphincter; CV: Central vein; DT: Digestive tract; E: Eye; ID: Interlobular bile duct; GC: Goblet cell; GG: Gastric gland; LI: Liver; MC: Mucosa; ME: Stratified epithelium; MF: Mucosal fold; MS: Muscle layer; OE: Oesophagus; PA: Pancreas; Pd: Pancreatic duct; Ps: Pyloric sphincter; SB: Swimbladder; SCE: Simple columnar epithelium; SE: Serosa; Si: Sinusoid; St: Stomach; SU: Submucosa; TB: Taste buds; YS: Yolk sac; Zg: Zymogen granules |
1 d仔鱼的全长为(3.11±0.14) mm,食道细胞紧密排列,尚未分化。2 d仔鱼的全长为(2.89± 0.25) mm,食道部位的细胞群中间观察到细小的腔隙,食道开始形成。3 d仔鱼的全长为(2.92±0.23) mm,食道中间可见明显空腔,食道上皮由多层立方细胞构成,细胞核呈圆形居于中央。此后,食道不断延伸,食道与胃交界处黏膜突起,纵向褶皱逐渐形成。11 d仔鱼的全长为(3.73±0.13) mm,食道黏膜上皮可见黏液细胞(图 1-3)。仔鱼孵出18 d时,全长为(4.30± 0.26) mm,食道肌层横纹肌纤维明显增多,上皮组织分布有大量黏液细胞(图 1-4)。随着仔鱼的生长发育,食道褶皱更加丰富,仔鱼食道组织结构趋于完善,34 d仔鱼全长为(9.56±1.79) mm,可以观察到黏膜层、黏膜下层、肌层和浆膜层,肌肉层发达,以横纹肌为主(图 1-5)。
2.1.2 胃仔鱼孵出3 d时,位于食道后的胃部开始形成,胃上皮由单层的柱状上皮细胞构成,核多位于细胞中央或基底部。胃壁结构只能观察到黏膜层和浆膜,中间的肌肉层不明显(图 1-6)。7 d仔鱼的全长为(3.51±0.13) mm,胃本体出现小的凸起,胃与前肠交接处开始显现幽门括约肌,贲门部括约肌尚不明显。11 d仔鱼的胃由贲门部、胃本体及幽门部构成,胃腔逐渐增大,胃内侧的黏膜褶皱不断加深。18 d仔鱼的纵向褶皱增高,胃壁增厚,并且胃壁厚度表现为幽门部 > 胃本体 > 贲门部(图 1-7)。20 d仔鱼的全长为(4.58±0.17) mm,胃部上皮细胞由矮柱状细胞构成,贲门部上端可见黏液细胞,胃本体胃腺出现(图 1-8)。27 d仔鱼的全长为(6.09±0.47) mm,黏膜柱状上皮细胞排列紧密,固有层胃腺数量明显增多,肌层逐渐增厚(图 1-9)。随着日龄的增加,仔鱼贲门部和基底部黏膜褶皱逐渐增加、伸长,黏膜下层结缔组织进一步完善,34 d仔鱼胃部结构分明,肌肉层同食道一致,环形肌较厚,纵形肌相对较薄(图 1-10)。
2.1.3 肠仔鱼1 d时,消化道基本为实管状结构,黏膜上皮主要为单层柱状细胞,细胞排列较为紧密,核呈圆形多位于细胞基底部;肠后端发生弯曲,消化道仍处于封闭状态。3 d仔鱼的肠道黏膜开始出现褶皱,肠瓣形成,将肠道隔开形成前肠与后肠,前肠相对膨大(图 2-1)。7 d仔鱼的黏膜柱状上皮细胞体积增大、排列紧密,肠道褶皱加深,出现纹状缘。仔鱼发育至11 d,肠道上皮出现杯状细胞。此外,可以观察到近腹部肠道褶皱明显多于近背部肠道褶皱(图 1-3)。随着日龄增加,肠道进一步分化发育,肠腔扩大,肠道褶皱逐渐延伸、增多,18 d仔鱼的肠道上皮出现一定数量的空泡细胞,肠道卷曲程度更加复杂,纹状缘密集排列(图 2-2)。20 d仔鱼的前肠开始出现次级肠黏膜褶皱(图 2-3)。仔鱼27 d时,肌肉层纤维明显,肠壁加厚,并且可以观察到后肠肠壁略薄于前肠与中肠(图 2-4)。32 d仔鱼的全长为(8.91±0.90) mm,肠道组织结构逐渐分明,自肠腔表面向里依次为黏膜层、黏膜下层、肌层与浆膜层;黏膜上皮细胞排列较为紧密、核大且圆,多位于细胞的基底部,细胞之间界限并不明显;次级黏膜褶皱丰富(图 2-5)。此后,肠道结构除了褶皱数量及长度的变化、杯状细胞的逐渐增加、肌层不断增厚外,随着仔鱼的生长发育,肠道组织学上没有显著性差异。

|
图 2 美洲黑石斑仔鱼消化系统组织结构观察 Figure 2 Histological observation on the structure of digestive system of larva C. striata 1:3 d仔鱼肠道纵切;2:18 d仔鱼肝脏纵切;3:20 d仔鱼腹部纵切;4:22 d仔鱼肠道纵切;5:32 d仔鱼肠道纵切;6:6 d仔鱼腹部纵切;7:20 d仔鱼肝胰脏与前肠纵切;8:27 d仔鱼胰脏纵切;AI:前肠;BV:血管;CV:中央静脉;FV:脂肪空泡;GC:杯状细胞;H:心脏;HE:肝细胞;ID:小叶间胆管;IL:胰岛;Ⅳ:瓣膜;LI:肝脏;MC:黏膜层;MF:黏膜褶皱;MI:中肠;MS:肌肉层;PA:胰脏;Pd:胰管;PI:后肠;Sb:纹状缘;SB:鱼鳔;SCE:单层柱状细胞;SE:浆膜层;St:胃;Zg:酶原颗粒 1: Longitudinal section of 3 dph larva fish digestive tract; 2: Longitudinal section of 18 dph larva fish liver; 3: Longitudinal section of 20 dph larva fish abdomen; 4: Longitudinal section of 22 dph larva fish digestive tract; 5: Longitudinal section of 32 dph larva fish digestive tract; 6: Longitudinal section of 6 dph larva fish abdomen; 7: Longitudinal section of 20 dph larva fish liver, pancreas and anterior intestine; 8: Longitudinal section of 27 dph larva fish pancreas; AI: Anterior intestine; BV: Blood vessel; CV: Central vein; FV: Fat vacuoles; GC: Goblet cell; H: Heart; HE: Hepatocyte; ID: Interlobular bile duct; IL: Islet; Ⅳ: Intestinal valvula; LI: Liver; MF: Mucosal fold; MI: Middle intestine; MS: Muscle layer; PA: Pancreas; Pd: Pancreatic duct; PI: Posterior intestine; Sb: Striated border; SB: Swimbladder; SCE: Simple columnar epithelium; SE: Serosa; St: Stomach; Zg: Zymogen granules |
仔鱼孵出3 d时,前肠外围的间充质细胞逐渐分化,形成细胞簇,此后,细胞簇间逐渐形成许多大小不一、形状不规则的空腔,产生导管与肝细胞索(图 1-2)。5 d仔鱼的全长为(3.25±0.30) mm,卵黄囊逐渐收缩,产生的空间主要被肝组织填充,肝细胞数量大量增加(图 2-6)。此后,肝脏细胞迅速分裂,仔鱼孵出7 d时,可见脂肪颗粒分布于肝脏组织中。11 d仔鱼的肝脏细胞紧密排列,细胞核较大,肝血窦与中央静脉明显,血细胞充斥于血管腔,可以看到肝脏开始分叶。仔鱼18 d的肝脏体积明显增大,肝细胞染色加深,小叶间动脉清晰,肝脏两叶间隙明显(图 2-2)。22 d仔鱼的全长为(4.71±0.22) mm,仔鱼肝脏细胞间分布有大量脂肪小颗粒,形状近似杯状的空泡结构(图 2-7)。仔鱼27 d时,肝细胞体积变小,数量进一步增多,肝脏血管间分布有丰富的血细胞(图 2-4)。随着仔鱼的生长,由肝细胞索形成的肝小叶排列更加紧密,血管系统日趋发达,窦状隙减少,肝脏组织结构近似成鱼。
2.2.2 胰腺胰腺是一个独立的消化腺,仔鱼3 d时,肝脏下方、卵黄囊背部出现胰腺细胞团,切片染色后,该部位呈现较深的蓝紫色,比周围器官染色更深(图 1-2)。胰腺细胞多为长形或不规则形,核膜与细胞界限明晰。仔鱼11 d时,胰腺细胞排列更为紧密,并可见血细胞与胰管分布于胰腺细胞之间(图 1-3)。仔鱼18 d后可以观察到胰脏中较多的酶原颗粒(图 2-2)。仔鱼发育至20 d时,胰腺体积明显增大,并逐渐向胃、肠方向延伸,胰岛与胰管明显,染色相对较浅,胰管开口于前肠,同胆管一样由立方上皮细胞组成(图 2-7)。仔鱼27 d时,胰脏中胰管与酶原颗粒数量大量增加(图 2-8)。
3 讨论 3.1 美洲黑石斑鱼仔鱼消化系统的发育特征 3.1.1 仔鱼口裂与肛门的形成美洲黑石斑鱼初孵仔鱼消化道为未分化的管状结构,口和肛门均保持封闭的状态。孵出3 d后,仔鱼口裂形成,上下颌能上下活动,肛门亦与外界打通,仔鱼开始摄取外界食物。仔鱼发育过程中,口裂及肛门的形成是其开口摄食的前提,而其形成时间在不同鱼类中存在一定的差异(蒲红宇等, 2004; 朱成德, 1986)。吴金英等(2003)研究发现,斜带石斑鱼(Epinephelus coioides)孵化4 d后肛门形成,同时口裂形成,仔鱼能够摄食。棱鲻(Mugil carinatus)仔鱼孵化出膜3 d后,肛门与外界连通,而口裂形成的时间比肛门打通的时间延迟了1 d,摄食行为则出现在5日龄(高小强, 2015)1);高露姣等(2007)指出,3日龄银鲳(Pampus argenteus)仔鱼口裂形成,但肛门在仔鱼孵出4 d后才与外界连通,仔鱼开始摄食。口裂与肛门形成时间的差异与不同鱼种的遗传特性、卵质以及外界条件(尤其是温度)等因素有关(殷名称, 1991b)。
1) Gao XQ. Study on the histological observation of early development and the physiological property in American shad, Alosa sapidissima. Doctoral Dissertation of Ocean University of China, 2015, 1-114 [高小强.美洲鲥Alosa sapidissima早期发育组织学及相关生理特性研究.中国海洋大学博士研究生学位论文, 2015, 1-114]
3.1.2 消化道与消化腺的形成与完善美洲黑石斑鱼仔鱼在口裂形成之前处于内源营养阶段,该时期仔鱼生命活动所需能量依赖于卵黄囊提供。随着日龄的增加,美洲黑石斑鱼仔鱼消化道逐渐发育分化,3 d后食道、原始胃以及肠道形成,此时,仔鱼口裂形成且肛门开通,仔鱼开始摄食。这在其他鱼种的研究中亦得到了证实(Mai et al, 2005; Kato et al; 2004; Zaiss et al, 2006)。仔鱼开口后,生命活动所需能量由卵黄囊及外界食物共同提供,即混合营养期。在此阶段,食道、胃部以及肠道黏膜褶皱开始形成,肝脏及胰脏的分化逐渐明显,肝组织中血窦出现,胰腺中已观察到酶原颗粒。这表明在卵黄囊完全吸收前,美洲黑石斑鱼仔鱼已经具备了基本的摄食、消化及吸收外源性营养的能力,实验结果与Segner等(1989)对白鲑(Coregonus lavaretus)的研究结论一致。卵黄囊消失后,后期仔鱼进行新陈代谢等生命活动所需的能量只能依赖于摄取外界营养物质,仔鱼进入了外源型营养阶段。仔鱼食道及肠道中出现杯状细胞,Ribeiro等(1999)研究发现,杯状细胞可以分泌黏液物质,在润滑消化道、保护表面黏膜以及防御外界细菌等多个方面具有重要作用。同时,杯状细胞可以协助消化酶参与食物的消化分解过程(Hirji et al, 1983; Arellano et al, 2002; Gisbert et al, 2004; Murray et al, 2011)。随着仔鱼日龄的增加,杯状细胞数量随之增加,特别是在食道前端以及后肠部位,这有利于食物的有效吞咽、消化产物的顺利运输以及排便。随着美洲黑石斑鱼仔鱼的发育,消化组织结构分化分明,食道、胃以及肠道黏膜褶皱逐渐增加、延长,肠道卷曲日趋复杂,这些结构以及组织发育分化,使其消化道日益成熟,仔鱼消化与吸收外界营养物质的能力逐渐提升(Hachero-Cruzado et al, 2009; Comabella et al, 2013)。同时,肝胰脏结构与功能日益完善,为美洲黑石斑鱼仔鱼对脂肪的高效吸收给与了重要保证。Zambonino-Infante等(2008)指出,鱼类早期生长发育过程中,肝脏贮存的脂肪含量呈先增加后减少的趋势,表明了消化道的迅速发育及胰腺与肠道分解、吸收脂肪能力的完善。
3.2 仔鱼期苗种“死亡高峰”原因分析苗种早期生长阶段是其发育过程中极为重要的时期,该时期消化道对摄取饵料的分解、消化与吸收的能力、鱼苗成活率及生长速度有着紧密的联系。早期生长阶段,鱼体消化系统的分化、发育以及逐渐完善是其将外界摄取物质转化为自身营养与能量的前提(殷名称, 1996)。本研究表明,美洲黑石斑鱼仔鱼在温度为(24±1)℃、盐度为30-32的养殖环境中,培育3 d后,口裂形成,仔鱼进入混合型营养阶段,该阶段卵黄囊中贮存的营养物质用于鱼体的生长发育,体积迅速减小。与此同时,鱼体消化道与消化腺快速发育完善。本研究以褶皱臂尾轮虫作为仔鱼的开口饵料,之后投喂大型轮虫,随着日龄的增加,逐渐投喂卤虫以及适合其口径的配合饲料等。饵料系列搭配合理,符合其生长、发育需求,鱼苗成活率较高。在海水鱼类养殖过程中,仔鱼由内源性营养向外源性营养过渡时期死亡率较高。一方面该时期仔鱼消化系统结构与功能没有完善,生物饵料大小、密度及质量与仔鱼器官发育阶段不协调,仔鱼无法摄取足够的食物,造成饥饿性死亡或从外界摄取的生物饵料不能正常消化使消化道阻塞;另一方面与内源性因素有关,如卵的质量(取决于物种的遗传特性和母体经历的生存环境压力以及所产卵中的营养成分等)(殷名称, 1991a)。在此阶段,应及时投喂适口、营养成分高、容易获得的饵料,褶皱臂尾轮虫是其较为理想的开口饵料。Zambonino-Infante等(2001)指出,早期仔鱼如果不能及时建立外源营养关系,就会先消耗贮存于组织中的营养物质,再利用重要组织器官以及运动系统的组成物质,以满足其正常生命活动代谢所需能量。当鱼体贮存的能量无法满足其自身需求时,仔鱼的生长便会受到明显的抑制。随着仔鱼的生长,其摄食与消化吸收的能力逐渐增强,鱼体对营养物质需求增大。饵料的选择对仔鱼的生长发育有很大的影响,饵料不适应会造成仔鱼新陈代谢能力下降,使鱼苗死亡率大大增加。当轮虫不能满足仔鱼后期阶段生长与营养的需求时,应当及时转换饵料,逐渐添加卤虫幼体、卤虫等生物饵料,以保证仔鱼对营养的需求(朱振乐, 2000)。
Sánchez-Amaya等(2007)和Moyano等(2005)指出,仔鱼胃腺的形成表明功能性胃的形成以及酸性消化的开始。Zambonino-Infante等(2008)指出,胃腺形成后,仔鱼开始具备分泌胃蛋白酶以及HCl的能力,这是其消化与吸收配合颗粒饲料的前提。同时,Segner(1993)和Verreth等(1992)也指出,胃腺的形成可以在一定程度上作为养殖鱼类转化饵料的标准。本研究中,在美洲黑石斑鱼培育30 d后开始驯化投喂微型配合饲料,此时,鱼体胃腺已经形成且结构与功能逐渐完善。可见,美洲黑石斑鱼转化饵料的时间与其胃组织学变化一致。因此可以得出,20 d后可以逐渐驯化美洲黑石斑鱼摄食配合饲料,进行转饵。另外,美洲黑石斑鱼胃腺的形成要晚于条石鲷(Oplegnathus fasciatus) (16 d) (何滔等, 2012)、绿翅鲐鱼(Thunnus thynnus) (11 d) (Yúfera et al, 2014)以及大菱鲆(Scoph-thalmus maximus L.) (23 d) (Hachero-Cruzado et al, 2009),但Elbal等(2004)研究表明,金头鲷(Sparus aurata L.)胃腺形成时间很晚(60 d)。在鱼类早期生长发育过程中,仔鱼如果能够较早地具有功能性的胃,就可以提前进行饵料的转化,从而大幅度降低培育生物饵料的成本。
| Arellano JM, Storch V, Sarasquete C. Ultrastructural study on the intestine of Senegal sole, Solea senegalensis. Journal of Applied Ichthyology, 2002, 18(3): 154-158 DOI:10.1046/j.1439-0426.2002.00332.x | |
| Chen MM, Luo J, Chen GH, et al. Embryonic development and morphologic observations of newly-hatched Cheilinus undulatus larvae. Progress in Fishery Sciences, 2015, 36(5): 38-44 DOI:10.11758/yykxjz.20150506[陈猛猛, 骆剑, 陈国华, 等. 波纹唇鱼(Cheilinus undulatus)的胚胎发育及初孵仔鱼的形态观察. 渔业科学进展, 2015, 36(5): 38-44] | |
| Chu QZ, Zhang JD, Chen G. Histological studies on postembryonic development of digestive system in Rachycentron canadum. Journal of Hydroecology, 2010, 3(4): 86-91[初庆柱, 张健东, 陈刚, 等. 军曹鱼消化系统胚后发育的组织学研究. 水生态学杂志, 2010, 3(4): 86-91] | |
| Comabella Y, Franyutti AH, Hurtado A, et al. Ontogenetic development of the digestive tract in Cuban gar (Atractosteus tristoechus) larvae. Reviews in Fish Biology and Fisheries, 2013, 23(2): 245-260 DOI:10.1007/s11160-012-9289-z | |
| Dadzie S, Abou-Seedo FS, Al-Shallal T. Reproductive biology of the silver pomfret, Pampus argenteus (Euphrasen), in Kuwait waters. Journal of Applied Ichthyology, 2000, 16(6): 247-253 DOI:10.1046/j.1439-0426.2000.00237.x | |
| Elbal MT, Garcia Hernandez MP, Lozano MT, et al. Development of the digestive tract of gilthead sea bream (Sparus aurata L.). Light and electron microscopic studies. Aquaculture, 2004, 234(1-4): 215-238 DOI:10.1016/j.aquaculture.2003.11.028 | |
| Gao LJ, Shi ZH, Yan Y. Histological studies on development of digestive system in larval Pampus argenteus. Journal of Fishery Sciences of China, 2007, 14(4): 540-544[高露姣, 施兆鸿, 严莹. 银鲳仔鱼消化系统的组织学研究. 中国水产科学, 2007, 14(4): 540-544] | |
| Gisbert E, Conklin DB, Piedrahita RH. Effects of delayed first feeding on the nutritional condition and mortality of California halibut larvae. Journal of Fish Biology, 2004a, 64(1): 116-132 DOI:10.1111/jfb.2004.64.issue-1 | |
| Gisbert E, Piedrahita RH, Conklin DE. Ontogenetic development of the digestive system in California halibut (Paralichthys californicus) with notes on feeding practices. Aquaculture, 2004b, 232(1-4): 455-470 DOI:10.1016/S0044-8486(03)00457-5 | |
| Hachero-Cruzado I, Ortiz-Delgado JB, Borrega B, et al. Larval organogenesis of flatfish brill Scophthalmus rhombus L.: Histological and histochemical aspects. Aquaculture, 2009, 286(1-2): 138-149 DOI:10.1016/j.aquaculture.2008.09.039 | |
| He T, Xiao ZZ, Liu QH, et al. Histological observation of eye ontogeny in rock bream larvae (Oplegnathus fasciatus). Marine Sciences, 2012, 36(3): 49-53[何滔, 肖志忠, 刘清华, 等. 条石鲷视觉器官早期发育的组织学观察. 海洋科学, 2012, 36(3): 49-53] | |
| Hirji KN, Courtney WAM. Non-specific carboxylic esterase activity in the digestive tract of the perch, Perca fluviatilis L. Journal of Fish Biology, 1983, 22(1): 1-7 DOI:10.1111/jfb.1983.22.issue-1 | |
| Kato K, Ishimaru K, Sawada Y, et al. Ontogeny of digestive and immune system organs of larval and juvenile kelp grouper Epinephelus bruneus reared in the laboratory. Fisheries Science, 2004, 70(6): 1061-1069 DOI:10.1111/fis.2004.70.issue-6 | |
| Lei JL, Lu JW. The breed predominance and culture prospects of Centropristis striata Linnaeus. Marine Fisheries Research, 2007, 28(5): 110-115[雷霁霖, 卢继武. 美洲黑石斑鱼的品种优势和养殖前景. 海洋水产研究, 2007, 28(5): 110-115] | |
| Li HY, Zhu JQ, Chen F, et al. The morphology of the digestive tract of Centropristis striata. Journal of Biology, 2011, 28(4): 31-34,46[李海燕, 竺俊全, 陈飞, 等. 美洲黑石斑鱼消化道的形态结构. 生物学杂志, 2011, 28(4): 31-34,46] | |
| Liang ZQ, Li CW, Liu MQ, et al. Morphological and histological observation of the digestive system in Sinilabeo decorus tungting (Nichols). Journal of Fishery Sciences of China, 2011, 18(5): 1051-1060[梁志强, 李传武, 刘明求, 等. 湘华鲮消化系统的形态学与组织学研究. 中国水产科学, 2011, 18(5): 1051-1060] | |
| Lin Q, Lv JY, Zhang B, et al. Histological studies on post-embryonic development of digestive system of seahorse Hippocampus kuda. Journal of Tropical Oceanography, 2007, 26(6): 46-51[林强, 吕军仪, 张彬, 等. 大海马消化系统胚后发育的形态学及组织学研究. 热带海洋学报, 2007, 26(6): 46-51] | |
| Mai K, Yu H, Ma H, et al. A histological study on the development of the digestive system of Pseudosciaena crocea larvae and juveniles. Journal of Fish Biology, 2005, 67(4): 1094-1106 DOI:10.1111/jfb.2005.67.issue-4 | |
| Moyano FJ, Barros AM, Prieto A, et al. Evaluación de la ontogenia de enzimas digestivas en larvas de hurta, Pagrus auriga (Pisces: Sparidae). Revista AquaTIC, 2005, 22(1): 39-47 | |
| Murray HM, Wright G, Golf GP. A study of the posterior esophagus in the winter flounder, Pleuronectes americanus, and the yellowtail flounder, Pleuronectes ferruginea: A morphological evidence of pregastric digestion?. Canadian Journal of Zoology, 2011, 72(7): 1191-1198 | |
| Pu HY, Zhai BX, Liu HL. Histological studies on post-embryonic development of digestive system in larval catfish Silurus asotus. Journal of Fishery Sciences of China, 2004, 11(1): 1-6[蒲红宇, 翟宝香, 刘焕亮. 鲇仔、稚鱼消化系统胚后发育的组织学观察研究. 中国水产科学, 2004, 11(1): 1-6] | |
| Ribeiro L, Sarasquete C, Dinis MT. Histological and histochemical development of the digestive system of Solea senegalensis (Kaup, 1958) larvae. Aquaculture, 1999, 171(3-4): 293-308 DOI:10.1016/S0044-8486(98)00496-7 | |
| Sánchez-Amaya MI, Ortiz-Delgado JB, García-López , et al. Larval ontogeny of redbanded seabream Pagrus auriga Valenciennes, 1843 with special reference to the digestive system. A histological and histochemical approach. Aquaculture, 2007, 263(1-4): 259-279 | |
| Segner H, R sch R, Schmidt H, et al. Digestive enzymes in larval Coregonus lavaretus L. Journal of Fish Biology, 1989, 35(2): 249-263 DOI:10.1111/jfb.1989.35.issue-2 | |
| Segner H, R sch R, Verreth J, et al. Larval nutritional physiology: Studies with Clarias gariepinus, Coregonus lavaretus and Scophthalmus maximus. Journal of the World Aquaculture Society, 1993, 24(2): 121-134 DOI:10.1111/jwas.1993.24.issue-2 | |
| Stuart KR, Smith TIJ. Development of nursery systems for black sea bass Centropristis striata. Journal of the World Aquaculture Society, 2003, 34(3): 359-367 DOI:10.1111/jwas.2003.34.issue-3 | |
| Verreth JAJ, Torrelle E, Spazier E, et al. The development of a functional digestive system in the African catfish, Clarias gariepinus. Journal of the World Aquaculture Society, 1992, 23(4): 286-298 DOI:10.1111/jwas.1992.23.issue-4 | |
| Wu JY, Lin HR. Histological studies on post-embryonic development of the digestive system of Epinephelus coioides. Journal of Fisheries of China, 2003, 27(1): 7-12[吴金英, 林浩然. 斜带石斑鱼消化系统胚后发育的组织学研究. 水产学报, 2003, 27(1): 7-12] | |
| Xu GF, Liu Y, Li YF, et al. Organogenesis of the digestive system in Brachymystax lenok during early development. Journal of Fishery Sciences of China, 2013, 20(4): 733-742[徐革锋, 刘洋, 李永发, 等. 细鳞鲑早期发育过程中的消化系统发生. 中国水产科学, 2013, 20(4): 733-742] | |
| Yin MC. Advance and studies on early life history of fish. Journal of Fisheries of China, 1991a, 15(4): 348-358[殷名称. 鱼类早期生活史研究与其进展. 水产学报, 1991a, 15(4): 348-358] | |
| Yin MC. Feeding ability and growth of the yolk-sac larvae of North Sea herring. Oceanologia et Limnologia Sinica, 1991b, 22(6): 554-560[殷名称. 北海鲱卵黄囊期仔鱼的摄氏能力和生长. 海洋与湖沼, 1991b, 22(6): 554-560] | |
| Yin MC. Natural mortality of early life stages of fish. Acta Hydrobiologica Sinica, 1996, 20(4): 363-372[殷名称. 鱼类早期生活史阶段的自然死亡. 水生生物学报, 1996, 20(4): 363-372] | |
| Yu HR, Mai KS, Duan QY, et al. Feeding habits and growth performance of larvae and juveniles of Pseudosciaena crocea under artificial rearing conditions. Journal of Fishery Sciences of China, 2003, 10(6): 495-501[于海瑞, 麦康森, 段青源, 等. 人工育苗条件下大黄鱼仔、稚、幼鱼的摄食与生长. 中国水产科学, 2003, 10(6): 495-501] | |
| Yúfera M, Ortiz-Delgado JB, Hoffman T, et al. Organogenesis of digestive system, visual system and other structures in Atlantic bluefin tuna (Thunnus thynnus) larvae reared with copepods in mesocosm system. Aquaculture, 2014, s426-427: 126-137 | |
| Zaiss MM, Papadakis IE, Maingot E, et al. Ontogeny of the digestive tract in shi drum (Umbrina cirrosa L.) reared using the mesocosm larval rearing system. Aquaculture, 2006, 260(1-4): 357-368 DOI:10.1016/j.aquaculture.2006.06.001 | |
| Zambonino-Infante JL, Cahu CL. Ontogeny of the gastro-intestinal tract of marine fish larvae. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2001, 103(4): 477-487 | |
| Zambonino-Infante JL, Gisbert E, Sarasquete C, et al. Ontogeny and physiology of the digestive system of marine fish larvae. In: Feeding and digestive functions of fishes. Plymouth: Science Publishers, 2008, 281-348 | |
| Zhu CD. Aspects on the first-feeding stage and foods of fish larvae. Acta Hydrobiologica Sinica, 1986, 10(1): 86-95[朱成德. 仔鱼的开口摄食期及其饵料综述. 水生生物学报, 1986, 10(1): 86-95] | |
| Zhu ZL. The artificial rearing technique of Pseudosciaena crocea. Journal of Shanghai Fisheries University, 2000, 9(2): 163-165[朱振乐. 大黄鱼人工育苗技术. 上海水产大学学报, 2000, 9(2): 163-165] |



