2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛中仁动物药品有限公司 青岛 266408
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Qingdao Zhongren Animal Pharmaceutical Co., Ltd., Qingdao 266408
自20世纪80年代刺参(Apostichopus japonicus)苗种规模化繁育技术突破以来,我国刺参养殖业迅猛发展。然而,随着刺参集约化养殖的扩展,刺参育苗、保苗和养殖过程中病害问题也日益严重。目前,已报道的育苗期刺参疾病主要有烂边病、烂胃病和化板症等,而保苗期和养成期则以腐皮综合征的危害最为严重(王印庚等, 2006、2012),目前尚未见刺参“肠炎病”及其病因的相关报道。2014年3月,山东省蓬莱某刺参育苗场保苗期刺参出现滞长现象,解剖后发现刺参肠道几乎为空肠,肠腔内有大量白色粘液或者脓状物质,肠道壁变脆、韧性差且易断裂,根据其发病症状,将此病命名为“肠炎病”。为了查找刺参“肠炎病”的病原并探讨其治疗方法,作者对该保苗场患病刺参进行了病理学观察和病原分离鉴定,并以对病原有明显抑制作用的水产用氟苯尼考为治疗药物,开展了不同用药方式对“肠炎病”治疗效果的评价,以期为刺参“肠炎病”的防治、健康养殖提供理论依据和技术参考。
1 材料与方法 1.1 实验材料2014年5月,患病刺参苗种取自山东省蓬莱某刺参保苗场,参苗平均规格为(8.25±1.57) g/头。选取发病症状明显的幼参30头,低温水运带回实验室,同时采集养殖池水源水、波纹板附着基沉积物以及投喂的饲料原料(藻粉、干海泥),用于致病原来源分析。
人工回接感染所用的健康刺参苗种采自青岛市某刺参育苗场,药敏纸片购自杭州微生物试剂有限公司,治疗实验所用水产用氟苯尼考药品购自青岛中仁动物药品有限公司,藻粉是该养殖场以海带(Laminaria japonica)、鼠尾藻(Sargassum thunbergii)、马尾藻(Sargassum)和石莼(Ulva pertusavar)为原料自行加工而成。
1.2 实验方法 1.2.1 病样检查与组织病理学观察肉眼观察病参的临床表现,在无菌条件下对病参进行解剖,取参苗体表、肠道、呼吸树等器官组织,制作水浸片,进行显微观察和记录,确定是否有寄生虫、霉菌和细菌。
取患病刺参的肠道组织,Davidson's固定液固定24 h后,经脱水、浸蜡、石蜡包埋、切片、苏木精-伊红(HE)染色等步骤,使用Nikon公司的Eclipse E800 Olympus显微镜观察,用Nikon DS-Fi1摄像头结合Nikon NIS-Elements图像分析软件对组织进行显微拍照(郝继光等, 2015)。
1.2.2 病原菌分离在无菌条件下,剪取少许肠道组织,研磨后取研磨液,在胰蛋白胨大豆肉汤培养基(TSB培养基)上,用平板划线法进行细菌分离,于28℃恒温生化培养箱培养24 h。挑取培养基上优势菌落,重复3次分离纯化培养,获得纯化菌株。
分别取养殖池水源水、池水、附着基沉积物、饵料(藻粉和干海泥)、肠道研磨液,用无菌海水进行10倍梯度稀释涂板,28℃培养24 h后,取合适稀释度的平板进行菌落形态特征观察,分类、计数,分离纯化优势度高的菌株。
1.2.3 人工感染实验实验用刺参苗暂养7 d后,选取健康、大小均匀的个体进行实验。将肠道中分离纯化的2株优势菌株分别接种于TSB液体培养基中,28℃培养24 h,离心获得菌泥,用无菌生理盐水按照比浊法配制成1.0×1011CFU/ml的菌悬液,与消毒后的刺参藻粉和干海泥一起配制成含菌量为1.0×106CFU/g的饲料(细菌浓度按照藻粉和干海泥总重计算),进行投喂攻毒实验。以投喂不添加分离优势菌的消毒藻粉和干海泥配制的饲料作为对照组,每组设3个平行,每个平行水槽(5 L)中放养20头刺参。实验期间,水温保持在18-20℃,盐度为30,每天换水量为50%,连续投喂15 d (感染组需补充细菌,维持感染浓度),观察并记录刺参的活动、摄食及死亡情况,从感染后出现症状的苗种肠道再次分离优势细菌,进行菌落形态观察,确定病原菌。
1.2.4 病原菌的分类鉴定将纯培养的细菌于28℃培养24 h后,按常规方法进行革兰氏染色和显微观察。采用青岛海博生物的细菌微量生化鉴定管对分离纯化的菌株进行生理生化指标测试。分子生物学鉴定流程为:挑取纯培养的单菌落于纯水中制备菌悬液,于100℃金属浴加热10 min,离心后,取上清液作为模板DNA。采用细菌16S rDNA通用引物(27F: 5'-AGAGTTTGATCCTGGCTCAG-3',1492R: 5'-TAC-GGCTACCTTGTTACGACTT-3')和gyrB通用引物(UP-1: 5'-GAAGTCATCATGACCGTTCTGCAYGC-NGGNGGNAARTTYGA-3',UP-2r: 5'-AGCAGGGT-ACGGATGTGCGAGCCRTCNACRTCNGCRTCNGT-CAT-3')(Yamamoto et al, 1995),对纯培养的细菌16S rDNA和gyrB进行PCR扩增,扩增产物交由青岛擎科梓熙生物技术有限公司进行测序。测序的结果登录GenBank进行Blast比对,从RDP数据库(http://rdp.cme.msu.edu/hierarchy/hb_intro.jsp)和GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)中选取与待分类菌株序列相似或相近的菌株,采用ClustalX2.1 (http://www.clustal.org/download/current/)软件进行多序列匹配分析后,用MEGA 6 (www.megasoftware.net)构建该菌的系统发育树。
1.2.5 病原菌的药敏实验选择常见的36种药物,采用药敏纸片扩散法进行药敏测试:配置浓度约为1×109CFU/ml的菌悬液,取0.1 ml均匀涂布于TSB培养基上,用无菌镊子将药敏纸片贴于该培养基表面,28℃恒温培养24 h后,观察有无抑菌圈产生,并测量抑菌圈直径。
1.2.6 不同用药方式对刺参“肠炎病”治疗效果对比选取该养殖场患刺参“肠炎病”的12个养殖池,将患病池苗种收集称重后,按照2.5 kg/m3的密度布池。用药方式共分为4组:药浴组、口服组、口服+药浴组、对照组,每组设3个平行。其中,药浴组的用药方法为:将氟苯尼考粉溶解后,按照15 g/m3的浓度进行全池泼洒,药浴2 h后,进行正常投饵,每日换水后,补加药物使药物浓度维持在15 g/m3;口服组的用药方法为:将氟苯尼考粉溶解后,添加到经煮沸消毒的干海泥和海藻粉中,充分混匀后,投喂刺参苗种,药物浓度为30 g/kg饲料(按照海藻粉和干海泥总重计算);口服+药浴组为口服方法和药浴方法同时使用;对照组为投喂未添加药物的正常消毒饲料,养殖用水也未添加药物。用药周期为3 d,药浴或口服用药结束后,所有实验组按照与对照组相同的养殖操作工艺进行养殖。养殖期间,3 d倒池1次,28 d换片前实验结束。实验期间,养殖用水为砂滤水,水温为16-21℃,盐度为28-32,每天换水量50%,充气,DO≥5 mg/L,每天投喂2次,日投喂量(以藻粉计)为刺参体重的2%,干海泥和海藻粉的配比为1:1。实验期间,每天巡池检查相应实验组刺参的生理状态和摄食情况。
实验结束后,自每个实验池中随机选取30头刺参,解剖后,称量体壁和内脏质量。计算脏壁比(Rate of viscera to body wall, RVBW),公式如下:
| ${\rm{PVBW}} = {W_{\rm{V}}}/{W_{\rm{W}}} \times 100\% $ |
式中,WV为内脏质量(g),WW为体壁质量(g)。
换片前停食1 d,使刺参苗种排空肠道内食物,收集养殖池内海参苗种,参照廖梅杰等(2010)方法进行称重,计算不同用药方式实验组刺参苗种的增重率(Weight gain rate,WGR)和体重特定生长率(Specific growth rate, SGR),公式如下:
| $\begin{array}{*{20}{l}} {{\rm{WGR}} = \left( {{w_{\rm{T}}} - {w_0}} \right)/{w_0} \times 100\% }\\ {{\rm{SGR}} = \left( {\ln {w_{\rm{T}}} - \ln {w_0}} \right)/t \times 100\% } \end{array}$ |
式中,wT为实验池终末刺参的总体重,w0为实验池初始刺参的总体重,t为实验时间。
1.2.7 数据统计分析实验结果采用平均值±标准误(Mean±SE)表示,采用SPSS 17.0软件进行统计分析。经方差分析之后,有显著差异的做Duncanxs多重比较,进行组间显著性差异的两两比较,显著水平P为0.05。
2 结果 2.1 刺参“肠炎病”发病症状与病理学观察刺参“肠炎病”的症状表现为摄食能力差、生长速度缓慢、附着力弱,苗种大部分脱落于池底,波纹板附着基上附着数量较少,发病率达到90%以上,但无化皮死亡现象。解剖观察后发现,刺参肠道内食物不连续,肠腔内有大量黄白色粘液或者脓状物质,肠道壁变脆、韧性差且易断裂(图 1)。显微镜下,所有病样体表、肠道、呼吸树等器官组织的水浸片均未发现霉菌和寄生虫,在肠道水浸片中存在大量细菌。

|
图 1 正常及患“肠炎病”刺参外观及解剖图 Figure 1 The appearance and anatomic image of healthy and enteritis disease infected sea cucumbers (A. japonicus) A:正常刺参外观;B:正常刺参解剖图;C:患病刺参外观;D:患病刺参解剖图;箭头示患病肠道 A: Appearance of healthy sea cucumber; B: Anatomic image of healthy sea cucumber; C: Appearance of sick sea cucumber; D: Anatomic image of sick sea cucumber; Arrows indicated infected intestine |
组织病理学观察显示,患病刺参肠腔游离面的绒毛膜散乱,分泌消化酶的能力减弱,染色较浅,消化道的粘膜层和粘膜下层发生组织分离,结缔组织层增生,外层肌肉层发生溃散,并且结缔组织与肌肉层分离较明显(图 2)。

|
图 2 患病刺参和正常刺参肠道组织结构的显微观察(横切)
Figure 2 Microscopic observation of the intestine of sick and healthy sea cucumbers (A. japonicus)(transverse sections)
A:患病刺参;B:正常刺参 A: Sick sea cucumber; B: Healthy sea cucumber ml:肌肉层(Muscular layer); ad:外膜层(Adventitia); il:肠腔(Intestine lumen); sb:纹状缘(Striated border); cc:柱状细胞(Columnar cell); ct:结缔组织(Connective tissue) |
从患病刺参肠道组织分离出2株优势菌In-1和In-2 (表 1),其中In-1的优势度为78%,在TSB培养基上的菌落形态为圆形,半透明,菌落光滑,中心部呈乳白色,菌落大小为1.0-1.2 mm,菌台呈米黄色;In-2的优势度为20%,在TSB培养基上的菌落形态为圆形,菌台与菌落均为透明至半透明,菌落≤1.0 mm,浅白色,表面光滑,圆润,边缘不规则。
|
|
表 1 患“肠炎病”刺参及其养殖系统的细菌分析 Table 1 Bacterial analysis of the enteritis disease infected sea cucumber (A. japonicus) and its rearing system |
对养殖系统中养殖池水源水、养殖池水、附着基沉积物、干海泥和藻粉等组成部分的细菌培养结果可知(表 1),养殖饲料原料——藻粉中含有大量的细菌(可达3.10×106 CFU/g),且藻粉中所分离得到的2株优势菌AP-1和AP-2的特征与患病刺参肠道组织中分离的优势细菌In-1和In-2以及养殖池水和附着基沉积物中的优势菌一致。养殖池水源水和干海泥中的细菌含量分别为150 CFU/ml和4.90×103 CFU/g,且这2个样本中均没有优势菌落,所分离的菌落与病灶处的优势菌不同。由此推测,水源和干海泥不是病原菌的来源,饵料所用藻粉可能是此次“肠炎病”病原菌的来源。
2.3 人工感染实验In-1和In-2采用投喂攻毒的方式进行人工感染。攻毒实验期间,对照组在15 d内表现正常,未出现病变和死亡现象;In-1攻毒投喂组刺参苗种自攻毒感染后第3天开始,出现拖便现象、摄食量下降,到第5天参苗伸展和附着能力下降、聚集于池底、活动能力减弱,解剖可见肠道内食物不连续、肠腔内有黄白色脓状物质、肠道壁变脆易断裂,攻毒感染实验15 d内,参苗未出现化皮、死亡现象;In-2菌株攻毒投喂组刺参苗种,未出现病变和死亡现象。从In-1人工感染实验发病的肠道组织中再次分离到与In-1菌落形态完全一致的细菌,符合科赫法则,证明所分离的In-1细菌为引起本次刺参“肠炎病”的致病菌。
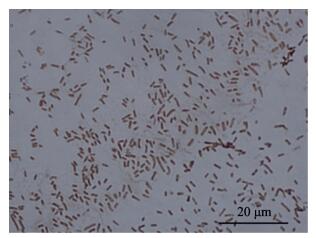
2.4 病原菌的分类鉴定In-1的革兰氏染色及观察结果显示(图 3),该菌为革兰氏阴性菌,短杆状,略有弯曲,长约为1.8-2.3 μm。In-1的生理生化测定结果显示(表 2),该菌株能在TCBS培养基上生长,能在3%和6% NaCl胰胨水中生长,在0和10% NaCl胰胨水中不生长,不能在半固体琼脂上生长;能分解葡萄糖、蔗糖、甘露醇、阿拉伯糖、肌醇、鼠李糖和蜜二糖和西蒙氏枸橼酸盐,不分解乳糖、山梨醇、木糖、苦杏仁苷和丙二酸盐;鸟氨酸脱羧酶反应阳性;邻硝基苯-β-D-半乳糖苷(ONPG)、尿素酶、赖氨酸脱羧酶反应阴性。利用PCR扩增得到In-1菌株的16S rDNA序列和gyrB基因序
|
图 3 菌株In-1的革兰氏染色 Figure 3 Gram-stain of bacterial strain In-1 |
|
|
表 2 In-1菌株生理生化特征 Table 2 Physiological and biochemical characteristics of bacterial strain In-1 |
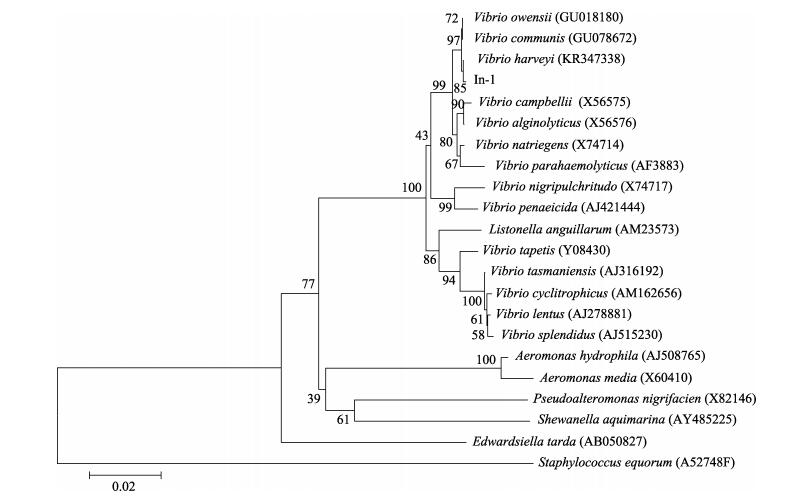
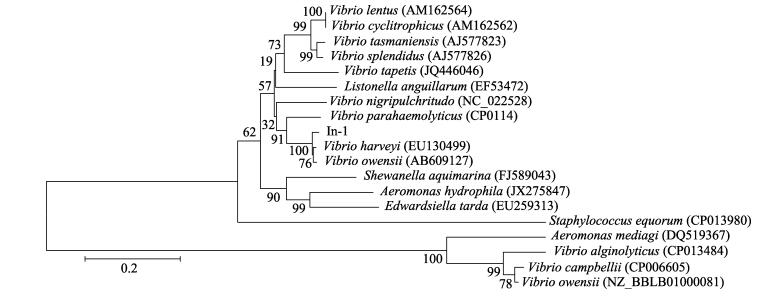
列可信区长度分别为1364 bp和1145 bp。将测序结果与NCBI核酸数据库进行比对分析发现,该菌株与哈维氏弧菌(Vibrio harveyi)同源性最高,同源性分别为99.92%和98.05%,系统发育树显示,In-1菌株与哈维氏弧菌聚为一支(图 4和图 5)。因此,将In-1菌株鉴定为哈维氏弧菌。
|
图 4 菌株In-1的16S rDNA基因序列聚类分析 Figure 4 Clustering analysis of bacterial strain In-1 based on the gene sequence of 16S rDNA 菌株后的编号为GenBank中的序列读取号,标尺表示每个碱基的替换率为0.02,下同 Numbers in parenthesis represented the sequencesx accession number in GenBank and the scale bar indicated 0.02 substitutions per nucleotide position, the same as below |
|
图 5 菌株In-1的gyrB基因序列聚类分析 Figure 5 Clustering analysis of bacterial strain In-1 based on the gene sequence of gyrB |
In-1菌株的药敏实验结果显示(表 3),该菌对氯霉素、头孢三嗪、四环素、氧氟沙星、头孢他啶、环丙沙星、罗美沙星、氟罗沙星、阿奇霉素、新生霉素、强力霉素和氟苯尼考12种抗菌素高度敏感;对利福平、红霉素、氟哌酸、克拉霉素、美满霉素、头孢唑肟、恩诺沙星、多黏霉素B和头孢氨噻肟9种抗菌素中度敏感;而对青霉素、新霉素、链霉素、吡哌酸、痢特灵、头孢氨苄、头孢拉定、丁胺卡那、庆大霉素、卡那霉素、苯唑青霉素、氨苄青霉素、复方新诺明、乙酰螺旋霉素、头孢哌酮15种抗菌素具有抗性。
|
|
表 3 In-1菌株的药敏实验结果 Table 3 Sensitivity of the bacterial strain ln-1 to some antibiotics |
根据病原菌药敏实验结果,选取水产养殖常用药物——氟苯尼考作为本次“肠炎病”防治药物,以3 d为药物使用周期,测定了药浴、口服、口服+药浴3种不同用药处理方式对刺参“肠炎病”防治效果的差异。对参苗生理活动观察结果显示:在用药3 d后,各用药处理组参苗的生理状态均有所改善,参体伸展,肉刺舒张,爬行摄食情况良好,波纹板上参苗附着量增加。未进行药物处理的对照组刺参患病状况没有改观,依然表现出运动摄食状况差、附着力弱等症状。3 d用药结束后,转为正常的生产管理,经过28 d的养殖周期,收集各实验养殖池苗种,进行称重和脏壁比计算。随机选取实验组的参苗个体,解剖观察到药物处理组刺参苗种肠道内均有食物。其中,药浴组和药浴+口服组刺参肠道食物充盈,说明刺参摄食旺盛;口服组刺参肠道有食物,但肠道不饱满;而未经药物处理的对照组刺参肠道内基本无食物,肠道内充有黄白色脓状液体。通过计算不同用药处理组参苗脏壁比可以看出(表 4),药浴组刺参苗种的脏壁比最高,达到(9.62±1.28)%,药浴+口服组为(8.23±0.58)%,口服组为(5.66±0.48)%,对照组为(4.33±0.36)%。对各处理组苗种的增重率统计结果显示(表 5),药浴处理组的平均增重最高,达(24.23±0.41)%,其次是药浴+口服处理组[平均增重为(19.96±0.61)%]和口服组[平均增重为(14.69±0.52)%],用药处理组的平均增重均显著高于对照组[平均增重为(2.90±0.39)%]。对各处理组苗种的特定生长率计算结果同样显示,药浴处理组的特定生长率最高达(0.77±0.01)%/d。由此可见,利用氟苯尼考作为治疗药物可以有效控制刺参保苗期“肠炎病”,不同药物使用方法对该疾病的治疗效果具有较大差异,对于刺参“肠炎病”的治疗,药浴处理可获得最佳治疗效果。
|
|
表 4 不同用药方式对患“肠炎病”刺参脏壁比的影响 Table 4 Effects of different therapeutic methods on the ratio of viscera to body wall of enteritis disease infected A. japonicus |
|
|
表 5 不同用药方式对患“肠炎病”刺参生长的影响 Table 5 Effects of different therapeutic methods on the growth of enteritis disease infected A. japonicus |
目前已报道的刺参疾病主要有育苗阶段的烂边症、烂胃症,保苗阶段的化板症、腐皮综合征、纤毛虫病、霉菌病、后口虫病(王印庚等, 2014)。由于“肠炎病”只会引起刺参苗种的滞长,在表观上患病苗种不会出现化皮的现象,且该病不会引起刺参苗种的大规模死亡,因此,前期未引起养殖业者的重视。本研究发现,刺参“肠炎病”会导致刺参苗种的“滞长”现象,而且会水平传播,给养殖生产带来了较大影响。本研究对保苗期的“肠炎病”进行病原病理分析,解剖发现肠道发生炎症,推测由于肠道炎症影响到苗种的摄食、消化和吸收是苗种发生“滞长”现象的根本原因。病原学检查排除了寄生虫和真菌的可能性,从其肠道组织水浸片观察到大量细菌,对所分离的优势菌株的人工攻毒感染实验证明,In-1菌株符合科赫法则,由此确定“肠炎病”为细菌性病原。
近年来,由于gyrB基因既弥补了16S rDNA的高保守性,也克服了16S-23S rDNA序列高变异性和复杂性,成为细菌系统发育及分类鉴定的新力量,目前已在细菌鉴定等方面得到广泛应用(毕建飞等, 2016; Nazina et al, 2015)。本研究同时利用16S rDNA和gyrB基因进行分子系统学分析,将该病原鉴定为
哈维氏弧菌。哈维氏弧菌是一种常见的条件致病菌,它有广泛的寄主范围,曾引起世界范围海水养殖虾类疾病(Pizzutto et al, 1995; Alvarez et al, 1998),也曾引起鲈鱼(Micropterus salmoides)(王保坤等, 2002)、大黄鱼(Pseudosciaena crocea)(徐晓津等, 2010)、石斑鱼(Epinephelus coioides)(李宁求等, 2005)、鲆鲽鱼类(宋靖芳等, 2004)等海水养殖鱼类的流行性疾病暴发,给海水养殖业造成了巨大的经济损失。在刺参病害方面,杨求华(2015)报道该菌可引起南移刺参体表溃疡症,谭德猛(2011)1)证明该菌可引起刺参腐皮综合征,本研究证明,该菌也可引发刺参“肠炎病”,表明该菌可引起刺参多组织发生病变。
1) Tan DM. Isolation and characterization of pathogenic bacteria and lytic bacteriophages from skin ulcer syndrome sea cucumber (Apostichopus japonicus). Master's Thesis of Dalian University of Technology, 2011, 1-73 [谭德猛.刺参腐皮综合症病原菌及其裂解性噬菌体的分离和鉴定.大连理工大学硕士研究生学位论文, 2011, 1-73]
3.2 刺参“肠炎病”传播途径分析刺参养殖系统包括养殖池水源水、养殖池水、附着基沉积物、干海泥和藻粉等部分,养殖系统污染是疾病发生和传播的重要原因。本研究对养殖系统进行了细菌学分析,通过各系统细菌总量和优势菌形态特征对比发现,藻粉、养殖池水和附着基沉积物中细菌菌量非常高,且优势菌特征与致病菌相同,可以推测饵料所用藻粉是病原菌的主要来源,病原菌随着饲料投喂过程被引入养殖系统。水产养殖中所暴发的多种疾病是由饲料引入的,刘朝阳等(2009)研究表明,颗粒饲料携带的细菌是大菱鲆(Scophthalmus maximus)白便症的直接病原;养殖者投喂消毒不彻底的海产小杂鱼携带的致病性诺卡氏菌(Nocardia seriolea)是导致乌鳢(Channa argus)患病的原因(Edgerton et al, 1999);王印庚等(2006)研究表明,饵料是养殖刺参保苗期重大疾病“腐皮综合征”病原菌的主要来源。刺参食性为沉积性食性,可通过摄食沉积到附着基上的含有大量病原菌的饲料而导致“肠炎病”,同时刺参苗种排泄物中含有的大量病原菌也在养殖池内沉积,进一步增加了养殖池水和附着基沉积物中致病菌的含量,导致了疾病的传播和蔓延。因此,在养殖期间,提供优质饵料是预防该疾病的重要措施;经常清理池底并保证水质清新,切断病原引入和传播途径是预防疾病发生的重要途径。
3.3 刺参“肠炎病”治疗药物选择在进行细菌性疾病治疗时,必须选择对病原有针对性的抗菌素,以避免滥用抗生素引发病原耐药性等问题,同时也必须选择农业部允许使用的药物进行疾病防治。综合药敏实验结果和农业部渔药固定及用药经济成本,本研究最终选择对该病原菌有良好抑菌效果的氟苯尼考作为防治药品。氟苯尼考具有抗菌谱广、吸收快、体内分布广、半衰期长、有效血药浓度时间长、无潜在的致再生障碍性贫血作用,无致畸、致癌和致突变等缺点,是国家二类新兽药,在国内外畜牧业和水产养殖业上有广泛应用(李梦影等, 2014)。本研究结果显示,与未用药组相比,用氟苯尼考治疗刺参“肠炎病”的实验组状况均有明显好转。治疗后,刺参增重率、特定生长率和脏壁比均显著高于未用药组,证明氟苯尼考在刺参哈维氏弧菌引起的疾病治疗中具有应用前景。
3.4 药物使用工艺对刺参“肠炎病”治疗效果差异在水产养殖疾病防控过程中,药物的使用工艺对疾病防控效果具有决定性作用。尽管刺参“肠炎病”属于刺参体内组织发生的疾病,本研究表明单纯药浴治疗的效果却显著优于药浴+口服组和口服组,究其原因,可能与刺参特殊的摄食习性、致病菌病原来源及饲料质量等因素密切相关。在保证饵料清洁的前提下,通过药浴控制养殖系统病原菌传播,无需进行口服用药即可达到高效治疗的目的。因此,在水产动物疾病防治过程中,要根据养殖动物生理习性、疾病发生原因、疾病病理特征进行综合分析,确定最适的给药方式,达到少量用药、精准治疗的效果(汪建国, 2014)。此外,随着中草药、微生态制剂、噬菌体等细菌性病原控制方法相关研究的深入,利用这些新兴技术进行细菌性疾病控制也取得了良好进展(王印庚等, 2009; Li et al, 2016; Zhao et al, 2016)。
本研究完成了刺参保苗阶段“肠炎病”的病理、病原和治疗方法初步研究,然而在养殖过程中,刺参疾病病原种类具有多样性和复杂性,今后仍需深入综合分析刺参“肠炎病”的致病菌种类。
| Alvarez JD, Austin B, Alvarez AM, et al. Vibrio harveyi: A pathogen of penaeid shrimps and fish in Venezuela. Journal of Fish Diseases, 1998, 21(21): 313-316 | |
| Bi JF, Kang YH, Chen HL, et al. Isolation and identification of man-animal-fish pathogenic Aeromonas hydrophila. Chinese Journal of Veterinary Medicine, 2016, 52(3): 118-121[毕建飞, 康元环, 陈亨利, 等. 1株人兽鱼共患病原菌嗜水气单胞菌的分离鉴定. 中国兽医杂志, 2016, 52(3): 118-121] | |
| Edgerton BF, Prior HC. Description of a hepatopancreatic rickettsia-like organism in the redclaw crayfish Cherax quadricarinatus. Diseases of Aquatic Organisms, 1999, 36(1): 77-80 | |
| Hao JG, Wang YG, Liao MJ, et al. The effects of three types of feed supplements on the growth of Apostichopus japonicus cultured in cages. Progress in Fishery Sciences, 2015, 36(5): 102-110[郝继光, 王印庚, 廖梅杰, 等. 饲料中添加3种不同投入品对筏式浅海网箱刺参(Apostichopus japonicus)养殖生长的影响. 渔业科学进展, 2015, 36(5): 102-110] | |
| Li MY, Xu LJ, Lu LQ. Integrated pharmacokinetics/ pharmacodynamics parameters of florfenicol in crucian carp (Carassius auratus) and grass carp (Ctenopharyngodon idella) and their significances in drawing medication regimen. Journal of Fisheries of China, 2014, 38(6): 892-900[李梦影, 徐丽娟, 吕利群. 氟苯尼考在鲫和草鱼体内的药代/药效动力学联合参数及其临床给药方案的研究. 水产学报, 2014, 38(6): 892-900] | |
| Li NQ, Bai JJ, Wu SQ, et al. Molecular classification of three kinds of pathogenic Vibrios in orange-spotted grouper, Epinephelus coioides. Journal of Fisheries of China, 2005, 29(3): 356-361[李宁求, 白俊杰, 吴淑勤, 等. 斜带石斑鱼3种致病性弧菌的分子生物学鉴定. 水产学报, 2005, 29(3): 356-361] | |
| Li Z, Li XY, Zhang JC, et al. Use of phages to control Vibrio splendidus, infection in the juvenile sea cucumber Apostichopus japonicus. Fish & Shellfish Immunology, 2016, 54: 302-311 | |
| Liao MJ, Wang YG, Hao ZK, et al. New method for weighting living sea cucumber. ZL 201010100781.3 [廖梅杰, 王印庚, 郝志凯, 等. 活体刺参体重测量方法. ZL 201010100781. 3] | |
| Liu ZY, Wang YG, Sun XQ. Correlation between bacteria associated with pellets and diseases of cultured turbot Scophthalmus maximus. South China Fisheries Science, 2009, 5(4): 13-21[刘朝阳, 王印庚, 孙晓庆. 颗粒饲料携带细菌与大菱鲆疾病发生的相关性. 南方水产, 2009, 5(4): 13-21] | |
| Nazina TN, Shumkova ES, Sokolova DS, et al. Identification of hydrocarbon-oxidizing Dietzia bacteria from petroleum reservoirs based on phenotypic properties and analysis of the 16S rRNA and gyrB genes. Microbiology, 2015, 84(3): 377-388 DOI:10.1134/S0026261715030145 | |
| Pizzutto M, Hirst RG. Classification of isolates of Vibrio harveyi virulent to Penaeus monodon larvae by protein profile analysis and M13 DNA fingerprinting. Diseases of Aquatic Organisms, 1995, 21(1): 61-68 | |
| Song JF, Huang WF, Zhang JY. Study on the pathogen of hemorrhage disease of Paralichthys olivaceus. Journal of Microbiology, 2004, 24(2): 51-53[宋靖芳, 黄文芳, 张剑英. 牙鲆出血病病原的初步研究. 微生物学杂志, 2004, 24(2): 51-53] | |
| Wang BK, Yu JH, Li Y, et al. Isolation and identification of pathogen (Vibrio harveyi) from sea perch, Lateolabrax japonicus. Journal of Fishery Sciences of China, 2002, 9(1): 52-55[王保坤, 余俊红, 李筠, 等. 花鲈弧菌病病原菌(哈维氏弧菌)的分离与鉴定. 中国水产科学, 2002, 9(1): 52-55] | |
| Wang JG. Progress and application of fishery drugs in China (47). Fishery Guide to be Rich, 2014(23): 63-66[汪建国. 我国渔药研究与应用综述(47). 渔业致富指南, 2014(23): 63-66] | |
| Wang YG, Fang B, Zhang CY, et al. Etiology of skin ulcer syndrome in cultured juveniles of Apostichopus japonicus and analysis of reservoir of the pathogens. Journal of Fishery Sciences of China, 2006, 13(4): 610-616[王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病"腐皮综合征"病原及其感染源分析. 中国水产科学, 2006, 13(4): 610-616] | |
| Wang YG, Guo WL, Rong XJ, et al. Isolation and identification of a pathogenic bacterium associated with off-plate syndrome from Apostichopus japonicus cultured in Liaoning Province. Progress in Fishery Sciences, 2012, 33(6): 81-86[王印庚, 郭伟丽, 荣小军, 等. 养殖刺参"化板症"病原菌的分离与鉴定. 渔业科学进展, 2012, 33(6): 81-86] | |
| Wang YG, Leng M, Chen X, et al. In vitro bacteriostatic effect of Chinese herbs against causative pathogens of skin ulcer syndrome in sea cucumber Apostichopus japonicus. Progress in Fishery Sciences, 2009, 30(2): 1-7[王印庚, 冷敏, 陈霞, 等. 中草药对刺参腐皮综合征病原菌的体外抑菌实验. 渔业科学进展, 2009, 30(2): 1-7] | |
| Wang YG, Rong XJ, Liao MJ, et al. Sea cucumber culture and disease control technology. China Agriculture Press, 2014, 120-127 [王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛解. 中国农业出版社, 2014, 120-127] | |
| Xu XJ, Xu B, Wang J, et al. Studies on blood chemistry indices and histopathology of Pseudosciaena crocea artificially challenged with Vibrio harveyi. Journal of Fisheries of China, 2010, 34(4): 618-625[徐晓津, 徐斌, 王军, 等. 大黄鱼感染哈维氏弧菌后血液生化指标的变化及组织病理学观察. 水产学报, 2010, 34(4): 618-625] | |
| Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains. Applied & Environmental Microbiology, 1995, 61(3): 1104-1109 | |
| Yang QH. Isolation, identification and antibiotic sensitivity analysis of bacterial pathogen from skin ulcer disease in Apostichopus japonicus cultured in South China. Journal of Fujian Fisheries, 2015, 37(2): 98-106[杨求华. 南移仿刺参体表溃疡症病原菌的分离鉴定及药敏分析. 福建水产, 2015, 37(2): 98-106] | |
| Zhao Y, Yuan L, Wan J, et al. Effects of potential probiotic Bacillus cereus, EN25 on growth, immunity and disease resistance of juvenile sea cucumber Apostichopus japonicus. Fish & Shellfish Immunology, 2016, 49: 237-242 |



