2. 深圳出入境检验检疫局动植物检验检疫技术中心 深圳 518045;
3. 深圳市检验检疫科学研究院 深圳 518001
2. Animal and Plant Inspection and Quarantine Technology Center, Shenzhen Entry-Exit Inspection and Quarantine Bureau, Shenzhen 518045;
3. Shenzhen Academy of Inspection and Quarantine Sciences, Shenzhen 518001
鲤疱疹病毒2型也称为金鱼造血器官坏死病病毒(Goldfish haematopoietic necrosis virus, GFHNV),因该病原是第2个自鲤科鱼类分离的疱疹病毒,按照国际病毒分类委员会(ICTV)的系统命名规则,正式命名为鲤疱疹病毒 2 型(Cyprinid herpesvirus 2,CyHV-2)。该病毒属于疱疹病毒目(Herpesvirales)、疱疹病毒科(Alloherpesviridae)、鲤疱疹病毒属(Cyprinivirus),该属还包括鲤疱疹病毒1型(CyHV-1)、鲤疱疹病毒3型(CyHV-3)和鳗鲡疱疹病毒1型(Anguillid herpesvirus 1,AngHV-1)。CyHV-2对金鱼(Carassius arratus)和鲫鱼(Carassius aumtus)养殖业危害巨大,主要发生在春、秋季节,发病率受水温影响较大,15-25℃时易发病,水温高于25℃时,发病率降低(Groff et al, 1998)。1992年,日本首次报道金鱼暴发该病,死亡率接近100% (Jung et al, 1995)。随后,在美国(Groff et al, 1998; Goodwin et al, 2006a)、澳大利亚 (Stephens et al, 2004)、英国(Jeffery et al, 2007)、匈牙利(Doszpoly et al, 2011)和我国台湾(Chang et al, 1999)均有相关报道。最近,在法国也有该病的相关报道(Boitard et al, 2015)。随着观赏鱼国际贸易全球化,该病毒在全球范围内流行的风险增高。
实时荧光定量PCR方法(Quantitative real-time PCR, qPCR)因其操作简便、灵敏性高、特异性强和快速高效等优点已得到广泛应用。但qPCR在定量时需依赖于标准曲线,而标准曲线的质量易受到引物和探针浓度、DNA纯度以及标准品等因素的影响,导致其精确性达不到绝对定量的要求(Cankar et al, 2006)。另外,qPCR易受反应抑制因子的影响而导致假阴性,从而干扰结果判断。
微滴式数字PCR方法(Droplet digital PCR,ddPCR)是近年发展起来的快速、准确、可实现绝对定量的新技术。与传统qPCR方法不同,它不依赖于标准曲线,因而定量结果更精确(Hayden et al, 2013)。ddPCR方法基于将样品系列稀释到一定浓度后,使其分布在一定数目的微滴中,从而使大部分微滴中的模板数为1或0,然后,以每个微滴为一个独立单位进行PCR扩增。在扩增结束后,对每个微滴中的荧光信号进行读取。根据泊松概率分布函数(Poisson distribution)计算出样品中的DNA拷贝数(Pinheiro et al, 2013)。该方法采用终点检测,不依赖Cq值,从而使ddPCR反应受扩增效率的影响大大降低,同时也提高了对反应抑制因子的耐受能力,提高了方法的准确性和重复性(Zimmermann et al, 2013; Pinheiro et al, 2013)。本研究旨在建立特异、准确、灵敏的CyHV-2 ddPCR定量检测方法,并与传统qPCR进行比较,以期为CyHV-2定量检测提供新方法和借鉴。
1 材料与方法 1.1 病毒临床样品共30份,包括23份患病鲫鱼样品和7份健康鲫鱼样品均采自江苏省各地区;CyHV-3(Koi herpesvirus)DNA由中山大学提供;斑点叉尾鮰病毒(Channel catfish virus, CCV)购自ATCC公司;流行性造血器官坏死病毒(Epizootic hematopoietic necrosis virus, EHNV)由悉尼大学OIE蛙病毒参考实验室提供;中华鳖虹彩病毒(Soft-shelled turtle iridovirus, STIV)由本实验室保存。
1.2 DNA的提取使用Dneasy Blood Tissue Kit(Qiagen,美国)抽提CyHV-2阳性样品、临床样品、CCV、EHNV、STIV的DNA,具体步骤详见试剂盒说明书。再用ddH2O对所抽提的CyHV-2阳性样品DNA进行20倍系列稀释,共7个稀释度,用于本实验方法灵敏性和重复性评价。
1.3 标准质粒的制备与稀释采用Goodwin等(2006b)设计的上下游引物进行普通PCR反应,扩增出170 bp产物,使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit对此PCR产物进行纯化,再连接到pMDTM18-T载体中,构建标准质粒。标准质粒的浓度使用分光光度计测定。标准质粒浓度计算公式如下:
质粒拷贝数(copies/μl)=6.02×1023(copies/mol)×质粒浓度(g/μl)/质粒分子量(g/mol)
本研究标准质粒浓度为2.3×1011 copies/μl。用ddH2O将标准质粒进行10倍系列稀释,共8个稀释度(2.3×108-2.3×101 copies/μl),以此构建qPCR标准曲线。
1.4 引物和探针 1.4.1 qPCR反应体系和条件本研究中,qPCR方法所引用为Goodwin等(2006b)中的引物。Goodwin等(2006b)在设计该引物时选取CyHV-2 DNA聚合酶基因的保守区域,该基因是病毒保守基因(李莉娟等,2013)。其中,上游引物序列为5'-TCGGTTGGACTCGGTTTGTG-3',Taqman探针序列为5'-FAM-CCGCTTCCAGTCTGGGCCACTACC-BHQ1-3',下游引物序列为5'-CTCGGTCTTGATGCGTTTCTTG-3' (Goodwin et al, 2006b)。qPCR总反应体系为20 μl,其中,10 μl 2× QuantiNovaTM (QN) Probe PCR Master Mix,上下游引物(900 nmol/L)各0.9 μl,探针(250 nmol/L) 0.5 μl。qPCR反应条件为95℃,2 min;95℃ 10 s,58℃ 45 s,共40个循环,是基于Goodwin等(2006b)方法和试剂盒推荐的温度,并且经过实验室优化确认的反应条件。每个样品设定3个重复。扩增结束后,使用7500 System Software软件分析实验数据。
1.4.2 ddPCR反应体系和条件优化使用QX100TM型微滴式数字PCR系统(Bio-Rad,美国) (包括微滴发生板、微滴发生器、PCR仪、微滴分析仪)进行实验。ddPCR实验步骤包括配制体系、生成微滴、扩增循环和信号读取(Hindson et al, 2013)。ddPCR使用的引物和探针与qPCR相同。ddPCR总反应体系为20 μl,其中,10 μl 2×ddPCR SupermixTM for Probes (Bio-Rad,美国),上下游引物(900 nmol/L)各0.9 μl、探针(250 nmol/L) 0.5 μl,DNA模板2.5 μl。微滴生成使用配套的微滴生成卡(Bio-Rad,美国)和微滴生成仪(Bio-Rad,美国),将20 μl PCR体系和70 μl微滴生成油(Droplet generation oil)分别加入微滴生成卡,覆盖专用胶垫后置入微滴生成仪,将生成的微滴转移至96孔板中,并置于PCR仪(Bio-Rad,美国)进行扩增,扩增程序如下:95℃ 10 min;95℃ 10 s,58℃ 60 s,共40个循环;扩增结束后,98℃热失活10 min。每个模板设置3个重复。扩增结束后,将96孔板放入微滴读取仪中读取信号,并使用QuantaSoft软件(Bio-Rad,美国)分析数据。
为了优化ddPCR反应条件,使用温度梯度PCR仪(Bio-Rad,美国),设置反应温度梯度为65.0℃、63.8℃、62.0℃、59.1℃、55.7℃、52.9℃、51.0℃、50.0℃,对退火温度进行优化。其他步骤同ddPCR反应过程,最后使用QuantaSoft软件分析实验数据,选取最佳退火温度。
2 结果 2.1 qPCR方法标准曲线的建立将标准质粒的8个稀释度作为模板进行qPCR反应,以此构建了标准曲线(图 1)。构建的标准曲线为: y = 0.741x + 1.0454,线性相关系数为R2=0.994,qPCR扩增效率E=134%。根据该标准曲线,根据未知样品的Ct值即可计算样品中的CyHV-2起始拷贝数。
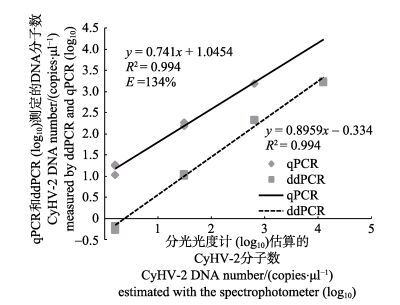
|
图 1 ddPCR和qPCR方法对系列稀释CyHV-2 DNA的定量 Figure 1 Quantification of serially diluted CyHV-2 DNA standard by ddPCR and qPCR |
ddPCR方法检测结果见图 2和表 1。从图 2和表 1可以看出,ddPCR反应中,微滴生成仪生成的油滴数大于10000,油滴数能够满足实验要求,保证了模板DNA分子的分布符合泊松概率分布函数。空白对照中没有检测到阳性微滴,表明该体系没有污染或非特异性扩增。
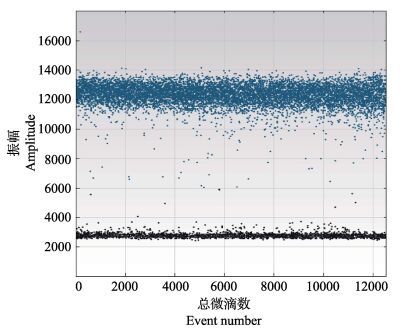
|
图 2 ddPCR方法扩增CyHV-2 DNA的一维散点 Figure 2 One-dimensional scatter plot of selected wells/ CyHV-2 DNA fluorescent droplet amplified by ddPCR |
|
|
表 1 ddPCR和qPCR的灵敏性实验 Table 1 Sensitivity test of the ddPCR and qPCR assays |
对ddPCR反应的退火温度进行了优化筛选。结果表明,在 50.0-59.1℃之间,随着温度的升高,荧光强度的信号逐渐增强,阳性微滴和阴性微滴界限逐渐明显,中间弥散的微滴数减少。当温度由59.1℃依次升高到65℃时,阳性微滴总数和阴性微滴总数趋于稳定,但二者中间弥散的微滴数逐渐变多(图 3)。因而,本研究最终将ddPCR定量检测CyHV-2 DNA的最佳退火温度确定为59.1℃。
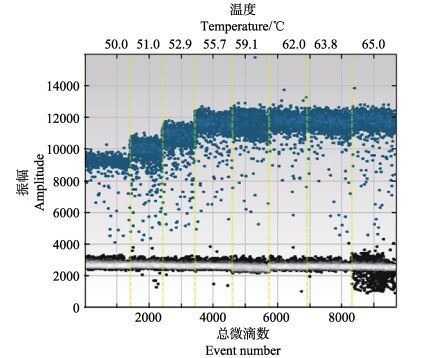
|
图 3 ddPCR反应温度优化 Figure 3 Optimization of reaction temperature in ddPCR |
以临床样品中抽提的CyHV-2 DNA (1.25×104- 0.2×10-3 copies/μl)为模板,评价ddPCR方法的灵敏性。ddPCR检测CyHV-2 DNA下限为1.6 copies/μl,而qPCR检测CyHV-2的DNA下限为0.08 copies/μl (表 1)。由此可见,ddPCR检测CyHV-2 DNA的灵敏性比qPCR低20倍。ddPCR和qPCR方法间的定量值呈正相关(R2=0.989) (图 4),但在定量检测相同稀释度的CyHV-2 DNA时,qPCR方法的定量值始终比ddPCR方法高10倍(表 1)。ddPCR方法的线性相关系数为R=0.994,qPCR方法的线性相关系数为R2 = 0.994,表明2种方法的线性关系良好(图 1)。
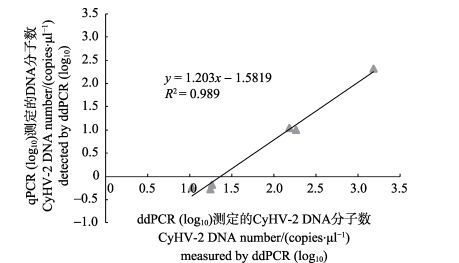
|
图 4 测定CyHV-2 DNA时ddPCR方法和qPCR方法之间的线性相关性 Figure 4 Correlation between measured CyHV-2 numbers of CyHV-2 DNA standard using ddPCR and qPCR |
通过组内重复实验和组间重复实验比较分析qPCR和ddPCR方法的重复性,结合定量结果的变异系数(Coefficients of variation, CV)对方法的准确性进行判定。组内重复实验中,同一次实验中的4个CyHV- 2 DNA稀释度作为模板进行ddPCR和qPCR实验,每个样品3个重复。结果显示,ddPCR定量检测中CV最小值为0.59%,最大值为11.26%;qPCR的CV最小值为16.57%,最大值为27.56% (表 1)。在组间重复实验时,用上述同样的模板,以相同的qPCR和ddPCR反应条件分不同时间进行3次组间重复实验,ddPCR定量检测的CV范围为6.55%-23.21%;qPCR检测的CV范围为22.31%-56.73% (表 2)。结果表明,ddPCR方法具有更好的重复性。
|
|
表 2 ddPCR和qPCR组间重复实验 Table 2 Replicate of the intra-assay using ddPCR and qPCR |
采用CyHV-3、CCV、EHNV和STIV共4种水生DNA病毒,和CyHV-2比较验证ddPCR和qPCR的特异性。结果表明,这2种方法均能检出CyHV-2。其他4种病毒和空白对照的检测结果均为阴性(表 3),表明所建立的ddPCR方法与qPCR方法检测结果一致,具有相同的特异性。
|
|
表 3 ddPCR和qPCR的特异性实验 Table 3 Specificity of the ddPCR and qPCR assays |
运用ddPCR和qPCR对江苏省各地区采集的23份患病鲫鱼样品和7份无症状的鲫鱼样品进行定量检测,每份样品3个重复。检测结果用阳性检出率(Positive percentage,即检测呈阳性的样品在总样品中所占的比例)分析2种方法检测结果的差异性。结果显示,23份患病鲫鱼样品经ddPCR检测均为阳性。而qPCR检出22份阳性,1份阴性。2种方法均未从7份健康鲫鱼样品中检测到CyHV-2核酸。因此,ddPCR方法的阳性检出率为76.67%,qPCR方法的阳性检出率为73.33%,表明ddPCR方法在CyHV-2定量检测中具有一定实际应用优势。
3 讨论定量检测是病毒致病机理研究、病毒载量测定及免疫基因表达等的重要手段。qPCR作为一种定量检测技术已经被应用于上述领域(安伟等, 2015; 王瑞等, 2015; 陈雪峰等, 2015)。ddPCR作为一种新兴的定量技术,将模板随机分布于20000个微滴中,每个含有模板的微滴均是一个独立的PCR反应体系,实现了不依赖标准曲线而对目标样本的绝对定量,同时也使体系受反应抑制因子的影响大大降低(Hindson et al, 2013)。目前,已经有一些研究报道了定量检测CyHV-2的qPCR方法(Goodwin et al, 2006b; 周勇等, 2013; 徐晔等, 2014; 于力等, 2015),但qPCR方法因其定量结果依赖于标准曲线,以及PCR反应体系中引物与模板、探针与模板之间错配对结果精确性的影响(Strain et al, 2013),方法的应用受到一定限制(Purcell et al, 2013)。
本研究建立了一种定量检测CyHV-2 的ddPCR方法,同时,利用ddPCR和qPCR这2种检测方法对CyHV-2 DNA进行测定,就灵敏性、重复性、特异性和临床样品检测4个方面做了比较。在定量检测相同稀释度CyHV-2 DNA时,ddPCR与qPCR的定量值呈线性正相关,但qPCR方法的定量值始终比ddPCR方法高10倍,推断可能是由于用于qPCR方法的标准质粒起始浓度被高估。因为标准质粒溶液中存在的其他DNA、RAN或蛋白会影响分光光度计测定值的准确性,导致标准质粒浓度测定值偏大或偏小(Jones et al, 2014)。在定量不同稀释度CyHV-2 DNA时,ddPCR方法的灵敏性比qPCR方法低20倍。然而,在实际应用过程中,ddPCR方法的检出率却高于qPCR方法。分析其原因可能与qPCR Cq值的有效性判定有关。qPCR能够检测到更低稀释度的CyHV-2 DNA (0.8×10-1copies/μl),但Cq值>35。根据qPCR方法的定量原理,Cq值与起始模板浓度的对数呈线性关系,在分析qPCR方法定量结果时通常认为,Cq值在15-35为可信,太大或太小都会导致定量结果不准确(Schmittgen et al, 2008)。因此,根据2种方法在定量检测CyHV-2 DNA的灵敏性和临床样品的检出率结果,ddPCR和qPCR方法的灵敏性相当。
本研究在进行方法特异性分析时,由于资源限制,使用病毒种类有限,没有使用CyHV-1进行验证。但这对ddPCR方法应用于临床样品CyHV-2的定量检测影响不大。原因是ddPCR使用的引物和探针与qPCR相同(Goodwin et al, 2006b),Goodwin等(2006b)在进行qPCR特异性分析时,已经确认了其对CyHV-1没有非特异性扩增。另外,CyHV-2主要感染金鱼和鲫鱼,而CyHV-1主要感染鲤鱼,在分析结果时应注意结合样品种属,有助于避免CyHV-1非特异性检出的分析。因此,在检测金鱼和鲫鱼的临床样品时,ddPCR受到CyHV-1干扰有限。本研究建立了一种快速、准确、灵敏的定量检测CyHV-2的ddPCR方法,能够很好地应用于CyHV-2定量分析,对CyHV-2致病机理和组织定量检测等具有参考价值。
| An W, Xiao Y, Zhang MH, et al. Develompment of a SYBR GreenⅠbased real-time RT-PCR assay for rapid diagnosis of spring viremia of carp virus. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(9): 699-702 [安伟, 肖雨, 张明辉, 等. 鲤春病毒血症病毒SYBR GreenⅠ荧光定量RT-PCR方法的建立. 中国预防兽医学报, 2015, 37(9): 699-702] | |
| Boitard PM, Baud M, Labrut S, et al. First detection of Cyprinid Herpesvirus 2 (CyHV-2) in goldfish (Carassius auratus) in France. Journal of Fish Diseases, 2015, 39(6): 673-680 | |
| Cankar K, Štebih D, Dreo T, et al. Critical points of DNA quantification by real-time PCR-effects of DNA extraction method and sample matrix on quantification of genetically modified organisms. BMC Biotechnology, 2006, 6(4): 1-15 | |
| Chang PH, Lee SH, Chiang CH, et al. Epizootic of herpes-like virus infection in goldfish, Carassius auratus in Taiwan. Fish Pathology, 1999, 34(4): 209-210 DOI:10.3147/jsfp.34.209 | |
| Chen XF, Yang GL, Gao Q, et al. Development and application of the PCR detection method of pathogenic enterobacters in the larvae of the giant freshwater prawn, Macrobrachium rosenbergii. Progress in Fishery Sciences, 2015, 36(4): 99-105 DOI:10.11758/yykxjz.20150414 [陈雪峰, 杨国梁, 高强, 等. 罗氏沼虾(Macrobrachium rosenbergii)幼体病原肠杆菌PCR检测技术的建立与应用. 渔业科学进展, 2015, 36(4): 99-105] | |
| Doszpoly A, Benko M, Csaba G, et al. Introduction of the family Alloherpesviridae: The first molecular detection of herpesviruses of cyprinid fish in Hungary. Magyar Allatorvosok Lapja, 2011, 133(3): 174-181 | |
| Hayden RT, Gu Z, Ingersoll J, et al. Comparison of droplet digital PCR to real-time PCR for quantitative detection of cytomegalovirus. Journal of Clinical Microbiology, 2013, 51(2): 540-546 DOI:10.1128/JCM.02620-12 | |
| Hindson CM, Chevillet JR, Briggs HA, et al. Absolute quantification by droplet digital PCR versus analog real- time PCR. Nature Methods, 2013, 10(10): 1003-1005 DOI:10.1038/nmeth.2633 | |
| Goodwin A, Khoo L, LaPatra S, et al. Goldfish hematopoietic necrosis herpesvirus (Cyprinid herpesvirus 2) in the USA: Molecular confirmation of isolates from diseased fish. Journal of Aquatic Animal Health, 2006a, 18(1): 11-18 DOI:10.1577/H05-007.1 | |
| Goodwin AE, Merry GE, Sadler J. Detection of the herpesviral hematopoietic necrosis disease agent (Cyprinid herpesvirus 2) in moribund and healthy goldfish: Validation of a quantitative PCR diagnostic method. Diseases of Aquatic Organisms, 2006b, 69(2-3): 137-143 | |
| Groff JM, LaPatra SE, Munn RJ, et al. A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology. Journal of Veterinary Diagnostic Investigation, 1998, 10(4): 375-378 DOI:10.1177/104063879801000415 | |
| Jeffery K, Bateman K, Bayley A, et al. Isolation of a cyprinid herpesvirus 2 from goldfish,Carassius auratus (L.), in the UK. Journal of Fish Diseases, 2007, 30(11): 649-656 DOI:10.1111/jfd.2007.30.issue-11 | |
| Jung SJ, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.). Journal of Fish Diseases, 1995, 18(3): 211-220 DOI:10.1111/jfd.1995.18.issue-3 | |
| Jones M, Williams J, Grtner K, et al. Low copy target detection by Droplet Digital PCR through application of a novel open access bioinformatic pipeline, ‘efinetheraind’. Journal of Virological Methods, 2014, 202(100): 46-53 | |
| Li LJ, Luo YZ, Liu XQ, et al. Molecular surveillance of Cyprinid herpesvirus 2 in goldfish cultured in China. Journal of Huazhong Agricultural University, 2013, 32(1): 92-96 [李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断. 华中农业大学学报, 2013, 32(1): 92-96] | |
| Pinheiro LB, Coleman VA, Hindson CM, et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Analytical Chemistry, 2012, 84(2): 1003-1011 DOI:10.1021/ac202578x | |
| Purcell MK, Thompson RL, Garver KA, et al. Universal reverse-transcriptase real-time PCR for infectious hematopoietic necrosis virus (IHNV). Diseases of Aquatic Organisms, 2013, 106(2): 103-115 DOI:10.3354/dao02644 | |
| Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols, 2008, 3(6): 1101-1108 DOI:10.1038/nprot.2008.73 | |
| Strain MC, Lada SM, Luong T, et al. Highly precise measurement of HIV DNA by droplet digital PCR. PLoS One, 2013, 8(4): e55943 DOI:10.1371/journal.pone.0055943 | |
| Stephens FJ, Raidal SR, Jones B. Haematopoietic necrosis in a goldfish (Carassius auratus) associated with an agent morphologically similar to herpesvirus. Australian Veterinary Journal, 2004, 82(3): 167-169 DOI:10.1111/j.1751-0813.2004.tb12650.x | |
| Wang R, Li LP, Huang T, et al. Real-time quantitative PCR for detection of Streptococcus agalactiae from tilapia tissue. South China Fisheries Science, 2015(3): 41-46 [王瑞, 李莉萍, 黄婷, 等. 罗非鱼组织内无乳链球菌实时荧光定量PCR检测方法建立. 南方水产科学, 2015(3): 41-46] | |
| Xu Y, Duan HA, Zhou Y, et al. Establishment of real-time PCR assay for detection of Cyprinid herpesvirus 2. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(12): 952-956 DOI:10.3969/j.issn.1008-0589.2014.12.09 [徐晔, 段宏安, 周毅, 等. 鲤科疱疹病毒2型TaqMan荧光定量PCR检测方法的建立. 中国预防兽医学报, 2014, 36(12): 952-956] | |
| Yu L, Wang JJ, Shi XJ, et al. Establishment of Taqman real-time PCR for Cyprinid Herpesvirus 2. Chinese Journal of Animal Health. Chinese Journal of Animal Health, 2015, 32(10): 80-84 [于力, 王津津, 史秀杰, 等. 鲤科疱疹病毒2型Taqman实时荧光PCR方法的建立. 中国动物检疫, 2015, 32(10): 80-84] | |
| Zimmermann BG, Grill S, Holzgreve W, et al. Digital PCR: A powerful new tool for noninvasive prenatal diagnosis. Prenatal Diagnosis, 2008, 28(12): 1087-1093 DOI:10.1002/pd.v28:12 | |
| Zhou Y, Zeng LB, Zhang H, et al. Establishment of a TaqMan real-time PCR assay for detecting the Cyprinid herpesvirus Ⅱ. Journal of Fisheries of China, 2013, 37(4): 607-613 DOI:10.3724/SP.J.1231.2013.38441 [周勇, 曾令兵, 张辉, 等. 鲤疱疹病毒Ⅱ型TaqMan real-time PCR检测方法的建立及应用. 水产学报, 2013, 37(4): 607-613] |



