2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 大连海洋大学水产与生命学院 大连 116023
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023
聚β-羟基丁酸酯(Poly-β-hydroxybutyrate, PHB)的结构单体是β-羟基丁酸,原核微生物在受到外界胁迫时,碳氮营养比例失衡,形成直径为0.2-0.5 μm的脂溶性聚酯颗粒,通过调节微生物培养基的碳氮比,也可以实现其体内PHB的调节(杨宇等, 2006)。目前,PHB主要通过生物合成法产生,有机溶剂萃取法分离获取(钱永雨等, 2010)。由于PHB具有良好的生物相容性和降解性,最终代谢为CO2和H2O,对于机体不产生副作用(高爽, 2012),其在环境保护、材料、农业、医学领域都有广泛的应用(魏茂繁等, 2014)。β-羟基丁酸是PHB在动物肠道内水解产生的单体,通过H+、Na+、K+、HCO3-之间的相互耦联作用(刘松珍等, 2013),进入肠道细胞或者G-细菌的细胞膜,同时释放质子,降低肠道环境或者菌体细胞本身的pH,pH的降低,刺激菌体在维持自身内环境的稳态平衡方面,产生较大的能量分配,而且使得酶反应最佳水平受到抑制,有效限制有害菌的生长,发挥其免疫的效果(邓康裕等, 2014、2015)。此外,β-羟基丁酸作为一种短链脂肪酸,在肠道环境中处于游离状态,能够直接被机体肠道上皮细胞吸收,起到营养的作用。吸收的短链脂肪酸,还可以通过其弱酸性来维持电解质的平衡(陈燕等, 2006),从而,更好地维持肠道的健康状态,发挥肠道作为免疫器官的作用,降低动物染病概率。因为PHB所具有的生物相容性、营养和免疫效果,可以尝试作为一种新型的饲料添加剂使用。目前,在水产领域,对PHB的研究主要集中在生长促进和免疫增强两大方面,在卤虫(Artemia franciscana)(孙慧贤等, 2011)、中华绒螯蟹(Eriocheir sinensis)(刘玉等, 2013)、凡纳滨对虾(Litopenaeus vannamei)(邓康裕等, 2014)、罗氏沼虾(Macrobrachium rosenbergii)(Dinh-The et al, 2010)中,均获得了良好的效果。此外,针对欧洲鲈鱼(Dicentrarchus labrax)(Dr Schryver et al, 2010)的研究发现,PHB可以提高肠道有益菌群的丰度。
合理的营养供给和免疫调节是促进亲虾快速生长、维持亲虾健康状态的基础。同时,产卵的质量与亲虾生长和健康状态直接相关,也是决定对虾育苗成败的关键因素。短链脂肪酸对于亲虾的卵巢发育、性腺成熟和生长都具有明显效果(Lawrence et al, 1979)。因此,本研究通过对中国对虾(Fenneropenaeus chinensis)亲虾饲喂PHB,来探索其对中国对虾亲虾的繁殖性能和幼体发育的影响,为PHB在水产养殖行业中的应用提供理论基础。
1 材料与方法 1.1 实验材料实验中国对虾亲虾取自中国水产科学研究院黄海水产研究所遗传育种中心,共获取10个核心家系的中国对虾亲虾,雌虾270尾、雄虾360尾。雌虾初始体重为(21.33±3.17) g,雄虾初始体重为(16.40±3.08) g,放置于345 cm×345 cm×275 cm室内水泥池(水体8 m3)中暂养7 d,暂养期间,投喂不含PHB的基础饲料。实验海水为砂滤海水,盐度为25-30,溶氧 > 4 mg/L,pH为7.3-8.3,氨氮 < 0.6 mg/L。越冬温度控制在(9.0±0.5)℃;育苗时期,产卵温度为正常水温,孵化温度控制在(14.0±0.5)℃,连续充气。
1.2 实验饲料基础饲料配方由中国水产科学研究院黄海水产研究所食品工程与营养研究室提供,原料购于山东青岛市国家海洋科学研究中心。实验饲料是在基础饲料配方上添加PHB制成。基础饲料采用鱼粉、虾糠、谷朊粉、酵母粉、豆饼、高筋粉、磷脂、胆碱、鱼油、磷虾粉、磷酸二氢钙、维生素(多维)、矿物质(多矿)、黏合剂等原料预混。饲料原料经过60目粉碎,搅拌混匀,切割,烘干,制成直径为2 mm、长度为3 mm的颗粒。制成品储存在密封袋,于干燥通风环境条件下保存。PHB干粉由宁波天安生物材料有限公司提供。
1.3 实验分组及管理实验于2014年11月28日在国家海洋科学研究中心黄海水产研究所遗传与育种中心(青岛)进行。将暂养7 d之后的中国对虾亲虾,按照家系进行分类,每个家系中国对虾尾节具有特定荧光标记,并且每尾亲虾具有各自的眼柄标记。将10个家系的中国对虾亲虾按照荧光标记平均分为6组,每组包含雌虾45尾、雄虾60尾,并完成每个浓度组亲虾眼标号的统计,随后分别对应按照浓度组,混养放置于6个345 cm × 345 cm × 275 cm室内水泥池(水体8 m3),暂养完成后,每个浓度组分成3个平行组进行实验,开始PHB的投喂。实验设置1个对照组C,即对应饲喂PHB浓度为0;5个实验组(E0.5, E1.0, E2.0, E3.0, E5.0),即分别对应饲喂PHB浓度为0.5%、1.0%、2.0%、3.0%、5.0%的饲料,同时,为保证中国对虾亲虾发育时期充分的营养供给,每组严格控制投喂相同重量的沙蚕(Nereis succinea)。将鲜活沙蚕准确称重之后,放入150×10-6的K2MnO4溶液中消毒10 min,冲洗干净后进行投喂。实验中,每天投喂4次(05:00, 11:00, 17:00, 23:00),其中,05:00和23:00投喂添加PHB的饲料,2次投喂总量为对虾平均体重的2.5%;11:00和17:00投喂沙蚕,2次投喂量为对虾平均体重的4.0%,日投喂量随着实验进行相关的调整。
实验周期为192 d,前期持续时间为110 d,伴随PHB的饲喂,进行亲虾的养殖,获得亲虾生长、存活和性腺发育周期的相关数据;后期通过亲虾繁殖的操作获得亲虾产卵量、产卵周期、孵化率、孵化时间以及变态发育时间的数据。实验期间,每日换水1次,换水量为总水量的1/2,采用虹吸法清除粪便和残饵,实验期间保持对水体的充气状态。
1.4 实验方法 1.4.1 生长指标将中国对虾亲虾在实验初始和实验结束后分别饥饿24 h,对每个实验组的个体进行称重测定。每天进行生存状态观察,统计每组死亡的个体数量。实验结束后计算各组死亡率、相对免疫保护率(RPS)、增重率(WGR)和特定生长率(SGR)。
死亡率(Death rate, %)=对虾死亡数/初始对虾数×100
相对免疫保护率(Relative percent survival, RPS)= (对照组死亡率-实验组死亡率)/对照组死亡率
增重率(Weight gain rate, WGR, %)=(终末体重-初始体重)(g)/初始体重(g)×100
特定增长率(Specific growth rate, SGR, %/d)= (lnW1-ln W0)/饲养时间(d)
式中,W1、W0分别为平均终末体重(g)和平均初始体重(g)。
1.4.2 性腺发育周期每个实验组的雌虾,从饲喂PHB饲料开始到第1次产卵为止,经历的时间长度作为衡量性腺发育周期的指标。
卵巢发育周期(d)=初次产卵时刻(d)-饲喂PHB饲料开始时刻(d)。
1.4.3 人工授精每个实验组内部的雌、雄虾,按照相同的组内家系配种方案,以保证每个实验组交配的亲本具有相同的遗传信息,采用精荚移植的方法,进行人工授精,获取后代家系。受精完成的雌虾,暂养4-5 d。随后将雌虾放至100 L水体的白桶内,进行产卵孵化,记录产卵时间。将雌虾的眼标号作为每个亲虾产生后代的记录标记,统计每尾亲虾产卵数量。获得的卵在白桶内进行下一步的孵化。
1.4.4 幼体孵化和变态发育将每个雌虾繁殖的卵,用500×10-6聚维酮碘消毒10 s,转移到100 L水体的白桶内。采用抽样法统计产卵量,使用搅卵棒将卵在水体中搅拌均匀,取200 ml水体统计卵的数量,在上部、中部和下部水层分别均匀取样3次,用于计算100 L水体产卵的数量。
以1 h为时间单位,搅动水体,使沉性卵上浮,控制水温为(14.0±0.5)℃,完成由卵变态发育成无节幼体的过程,同时记录时间。待孵化完成之后,捞取无节幼体,50×10-6消毒5 s,置于5 L水体的白桶内,采用抽样法,取200 ml水体3次,统计计算无节幼体的数量。
每个实验组亲虾获得的后代,完成由卵到无节幼体、溞状幼体、糠虾幼体及仔虾的变态发育过程。统计每期变态发育所需要的时间。
孵化率(Hatchmg rate, %)=孵化的无节幼体数量/产卵量×100
1.5 数据处理死亡率、生长、性腺发育周期和幼体变态发育的数据使用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),数据以平均值±标准差(Mean±SD)表示,相对免疫保护率图片用Origin 9.0处理。
2 结果 2.1 中国对虾亲虾死亡率以24 h为时间单位,记录各组对虾每个家系雌雄个体的死亡数量,以每组死亡个体总数来计算该组存活率,具体数值见表 1。从表 1可以看出,实验中对虾的死亡率均随浓度的增加呈先下降后上升的趋势。在饲喂停止后,对各组内不同家系的死亡率进行多重比较分析,发现在雌虾组,E2.0组的死亡率最低,与C、E0.5、E3.0、E5.0组相比差异均显著(P < 0.05),与E1.0组相比差异不显著。雄虾E2.0的死亡率最低,并且E2.0、E3.0与C、E5.0组相比差异显著(P < 0.05)。
|
|
表 1 PHB添加剂对亲虾死亡率的影响 Table 1 The effect of PHB additives on the mortality of parental shrimp |
各组的相对免疫保护率的平均值见图 1。从图 1可以看出,图中横轴代表PHB浓度的变化,各组RPS均随浓度的增加基本呈先上升后下降的趋势,雌、雄虾有所不同。雌虾E0.5、E3.0、E5.0组RPS出现负值,表明该浓度PHB促进对虾的死亡;E1.0、E2.0组RPS高于对照组,且E2.0组RPS最高;E2.0与E0.5、E3.0、E5.0组相比具有差异显著(P < 0.05)。雄虾E5.0组RPS<0,表明该浓度的PHB对于雄虾无保护作用;E0.5、E1.0、E2.0、E3.0组RPS均高于对照组,且E2.0组RPS最高;E2.0与C、E5.0组相比具有显著性差异(P < 0.05)。
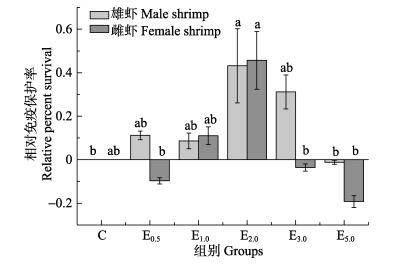
|
图 1 PHB添加剂对中国对虾亲虾相对免疫保护率的影响 Figure 1 Effect of PHB additives on relative percent survival of F. chinensis 柱状图数据以平均值表示,相同类别柱形图标注不同字母表示差异显著(P < 0.05) Each pillar represents the mean value, data (Mean) with different letters significantly differ in the same pillar (P < 0.05) |
统计每组雌、雄个体的初始体重和终末体重的平均值,计算WGR和SGR,得到对虾的生长数据,雌虾生长数据见表 2。从表 2可以看出,雌虾实验组终末体重的平均值都高于对照组。E2.0与C、E3.0组相比差异显著(P < 0.05),E0.5、E1.0、E3.0、E5.0组与C组无显著性差异(P > 0.05);WGR和SGR中,E2.0组平均值最高,与其他组相比均差异显著(P < 0.05),另外,WGR中的E5.0组与C、E0.5、E1.0、E3.0组相比具有显著性差异(P < 0.05);SGR中的E5.0组与C、E3.0组相比差异性显著(P < 0.05)。表明E2.0组PHB浓度对于雌虾的生长促进效果最好。
|
|
表 2 PHB添加剂对雌虾生长的影响 Table 2 Effect of PHB additives on the growth of the female shrimp |
从表 3可以看出,雄虾E0.5、E1.0、E2.0、E3.0组终末体重的平均值高于C组,E5.0组低于对照组。E2.0与C、E5.0组相比差异显著(P < 0.05),E0.5、E1.0、E3.0、E5.0组与C组无显著性差异;在WGR和SGR中,E2.0组平均值最高,与其他组相比均差异显著(P < 0.05),另外,WGR的C、E0.5、E1.0组平均值高于E5.0组,并且与E5.0相比显著性差异(P < 0.05);SGR的C、E0.5、E1.0、E3.0组平均值大于E5.0组,并且较E5.0组具有显著性差异(P < 0.05)。表明E2.0组PHB浓度对雄虾的生长具有更好的效果。
|
|
表 3 PHB添加剂对雄虾生长的影响 Table 3 Effect of PHB additives on the growth of the male shrimp |
每组性腺发育周期的平均值见表 4。从表 4可以看出,C组与其他各组相比无显著差异(P > 0.05);E0.5、E1.0、E3.0、E5.0组的平均值小于C组。
|
|
表 4 PHB添加剂对雌虾性腺发育周期的影响 Table 4 Effect of PHB additives on gonadal development cycle of female shrimp |
统计每组雌虾的产卵量和无节幼体数量的平均值,同时计算孵化率见表 5。从表 5可以看出,实验组产卵量和无节幼体数量的平均值高于C组。E2.0组产卵量与C组相比差异显著(P < 0.05);其他实验组与C组相比无显著性差异。表明E2.0组PHB浓度对于雌虾的产卵具有促进作用。E2.0组无节幼体数量与C组相比差异性显著(P < 0.05);其他实验组与C组无显著差异。在排卵时间与孵化率方面,C组与其他实验组相比无显著差异,表明PHB对于排卵时间和幼体孵化不产生影响。
|
|
表 5 PHB添加剂对幼体孵化的影响 Table 5 Effect of PHB additives on the fecundityand larvael hatching rate |
实验期间,每24 h观察幼体的状态,分别统计受精卵-无节幼体、无节幼体-溞状幼体、溞状幼体-糠虾幼体、糠虾幼体-仔虾的变态发育时间以及总变态发育时间长度见表 6。从表 6可以看出,C组与各实验组无显著性差异(P > 0.05),表明PHB对幼体变态发育周期未产生显著影响。
|
|
表 6 PHB添加剂对幼体变态发育周期的影响 Table 6 Effects of PHB additives on the larval metamorphosis cycle (d) |
PHB可以通过提高机体对营养物质的利用效率,
达到促进生长的作用(Partanen et al, 1999)。PHB通过水解产生β-羟基丁酸单体,起到增加肠道益生菌丰度的效果。Nichols等(2003)的研究发现,双歧杆菌(Bifidobacterium sp.)等有益菌通过代谢能够合成并分泌维生素和胞外酶,为机体提供营养和外源酶,促进个体生长。同时,短链脂肪酸也是蛋白质降解为氨基酸后发酵的主要产物,梭杆菌(Fusobacterium)、消化链球菌(Peptostreptococcus)和氨基酸球菌(Acidaminococcus rogosa)等肠道益生菌,可利用多种氨基酸发酵产生丁酸(陈燕等, 2006)。产生的丁酸又可以起到调节肠道菌群、维持体液和电解质的平衡,为肠道上皮细胞提供营养成分,在细胞分化和生长中起到非常重要的作用(许友卿等, 2010)。短链脂肪酸和肠道细胞以及生物个体之间,形成一种良性的依附和循环作用,更好地促进生物体的健康、快速生长。经过研究表明,无论雌、雄对虾,E2.0组与C组相比差异显著(P < 0.05),能起到促进生长的作用。
3.2 PHB添加剂对中国对虾亲虾免疫保护率的影响PHB对生物体的抗病作用主要在于它能降解形成β-羟基丁酸单体(Defoirdt et al, 2006)。脂溶性、非游离态的β-羟基丁酸能穿过革兰氏阴性细菌(G-)的细胞膜,在偏碱性的胞质中转变为游离态并释放H+,而较低的pH抑制酶活性,使微生物利用能量释放质子,进而抑制G-的生长(邓康裕等, 2014)。对虾的非特异性免疫可以通过血液和体液中的因子发挥作用来实现,如溶菌酶、过氧化物酶、超氧化物歧化酶和血液中的多肽、凝集素等。在血液方面,Chim等(2001)研究发现,红额角对虾(蓝对虾, Litopenaeus stylirostris)饲喂含有n-3不饱和脂肪酸的饲料后,在面对温度和盐度的应激反应时抵抗力增强,同时提高了血液的凝集作用和呼吸爆发强度;Dr Sheldon等(1991)研究发现,不饱和脂肪酸可以提高斑点叉尾鮰(Ietalurus punetaus)血液中巨噬细胞的杀菌活性。在体液因子方面,不饱和脂肪酸可以通过影响水生动物溶菌酶等水解酶类的活力,达到免疫的效果,溶菌酶能水解革兰氏阳性细菌的细胞壁中黏性多肽的乙酰氨基多糖并使之裂解。不饱和脂肪酸通过影响机体水解酶体系的活力,破坏和消除侵入机体内的异物,从而发挥防御的机能(许友卿等, 2010)。Lin等(2005)研究发现,不饱和脂肪酸的饲喂能使马拉巴石斑鱼(Epinephelus malabaricus)幼鱼血清溶菌酶活力显著提高。通过本研究中对于雌、雄亲虾相对免疫保护率的统计分析,可以得到E2.0组与C组和高浓度E5.0组相比差异性显著(P < 0.05)。此外,徐后国(2013)1)对鲈鱼(Lateolobrax japonicas)幼鱼的研究发现,过量的饲喂n-3不饱和脂肪酸,产生的氧化产物(如肌肉脂肪氧化的产物丙二醛和蛋白质氧化的产物蛋白质羰基等)较多,对机体造成的氧化压力较大。这表明饲料的不饱和脂肪酸的含量并非越多越好。为本研究中雌、雄虾E5.0浓度组的死亡率平均值不低于对照组,以及雄虾E5.0组增重率与C组相比无显著性差异的结果提供了依据。
1) Xu HG. Effects of dietary fatty acids on growth performance, health and accumulation of lipids and fatty acids in juvenile Japanese seabass (Lateolobrax japonicas). Doctoral Dissertation of Ocean University of China, 2013, 11-20 [徐后国.饲料脂肪酸对鲈鱼幼鱼生长、健康及脂肪和脂肪酸累积的影响.中国海洋大学博士研究生学位论文, 2013, 11-20]
3.3 PHB添加剂对中国对虾亲虾繁殖性能和幼体孵化的影响健康的亲虾是获得优质苗种的关键,PHB通过水解成β-羟基丁酸单体,增加肠道益生菌丰度,起到促进生长和免疫调节的作用。作为短链脂肪酸,还可以通过作用于非特异性的免疫系统,达到对个体的免疫保护。在对虾对于脂肪的需求方面,季文娟等(1994)研究表明,伴随着对虾由幼虾到成虾,虾体脂肪中的不饱和脂肪酸含量比例增加。不饱和脂肪酸作为对虾组织中的细胞膜、磷脂的重要组成部分,伴随着虾体的生长发育,需求的比例不断地增大。
Teshima等(1982)对日本对虾(Penaeus japonicus)的研究发现,在对虾的卵巢发育开始到成熟期,脂肪含量逐渐增加,到产卵后,单不饱和脂肪酸的含量降到最低。受精卵通过积累的脂肪酸为孵化提供能量,因此,雌虾积累的脂肪酸含量对于后代的产卵和孵化可能会产生一定的影响。β-羟基丁酸单体除去可以增加益生菌的丰富度,促进营养物质的吸收,进而促进生长之外;作为丁酸的衍生物可能具有与丁酸类似的功能,通过作用于肠道上皮细胞,诱导细胞分化、促进消化道细胞生长等作用,来实现个体的生长和脂肪酸的积累,进而对产卵和孵化产生影响。
Harrison等(1990)的研究发现,饲喂不同的脂肪酸,对于对虾的性成熟和产卵会产生影响。同时,Kanazawa等(1979)的研究发现,虾类的n-3多不饱和脂肪酸需要在外界摄取,自身不具备合成的能力。PHB可以通过影响肠道对营养物质的吸收,同时为机体提供不饱和脂肪酸单体来促进性成熟和产卵。本实验在PHB对中国对虾产卵的研究方面,E2.0与C组相比差异显著(P < 0.05),但在性成熟周期的研究方面并未产生显著性的差异。季文娟(1998)研究表明,饲喂不同脂肪源饲料的亲虾,获得的受精卵饱和脂肪酸含量的差别很小,说明对虾受精卵的饱和脂肪酸含量维持相对稳定的状态;而不饱和脂肪酸的含量,受饲料中脂肪酸种类组成的影响较为明显。
进一步说明,不同浓度组的雌虾饲喂相同种类的脂肪酸,产生的脂肪酸积累,对于卵的脂肪积累不会产生明显影响,进而不会影响孵化。这与本研究中不同浓度的PHB添加剂对后代幼体孵化影响的研究结果相一致,各组之间的孵化率无显著差异,与季文娟等(1994)的研究结果相一致。
综上所述,适量的PHB对于中国对虾亲虾的生长、免疫保护和繁殖性能的提高具有一定的作用,但对幼体变态发育并无效果,结果显示,最适PHB浓度为2.0%。但PHB在对虾体内代谢具体机制以及高浓度PHB对中国对虾的存活产生副作用,需要进一步探究。
| Chen Y, Cao YS, Liu XH. Short chain fatty acids and intestinal microflora. Jingxi Science, 2006, 24(1): 38-69 [陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群. 江西科学, 2006, 24(1): 38-69] | |
| Chim L, Lemaire P, Delaporte M, et al. Could a diet enriched with n-3 highly unsaturated fatty acids be considered a promising way to enhance the immune defences and the resistance of Penaeid prawns to environmental stress. Aquaculture Research, 2001, 32(2): 91-94 DOI:10.1046/j.1365-2109.2001.00534.x | |
| Defoirdt T, Halet D, Sorgeloos P, et al. Short-chain fatty acids protect gnotobiotic Artemia franciscana from pathogenic Vibrio campbellii. Aquaculture, 2006, 261(2): 804-808 DOI:10.1016/j.aquaculture.2006.06.038 | |
| Deng KY, Kong J, Meng XH, et al. Effects of poly-β-hydroxybutyrate on the ability of anti-WSSV in Fenneropenaeus chinensis. Journal of Fisheries of China, 2014, 38(8): 1167-1174 [邓康裕, 孔杰, 孟宪红, 等. 聚-β-羟基丁酸酯对中国明对虾抗WSSV能力的影响. 水产学报, 2014, 38(8): 1167-1174] | |
| Deng KY, Meng XH, Kong J, et al. Effects of Poly-β-Hydroxybutyrate on non-specific immunity and expression of immune gene under the ammonia stress of Litopenaeus vannamei. Progress in Fishery Sciences, 2015, 36(6): 71-79 DOI:10.11758/yykxjz.20150611 [邓康裕, 孟宪红, 孔杰, 等. 聚β-羟基丁酸酯对凡纳滨对虾(Litopenaeus vannamei)非特异性免疫力及氨氮胁迫后免疫基因表达量的影响. 渔业科学进展, 2015, 36(6): 71-79] | |
| De Schryver P, Sinha AK, Kunwar PS, et al. Poly-b-hydroxybutyrate (PHB) increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax. Applied Microbiology and Biotechnology, 2010, 86(5): 1535-1541 DOI:10.1007/s00253-009-2414-9 | |
| Dinh-The N, Mathieu W, Peter DC, et al. The effect of poly β-hydroxybutyrate on larviculture of the giant freshwater prawn Macrobrachium rosenbergii. Aquaculture, 2010, 302(1): 76-81 | |
| Gao S. Poly-β-hydroxybutyrate PHB. China Science and Technology Panorama Magazine, 2012(14): 188-189 [高爽. 聚-β-羟基丁酸酯PHB. 中国科技纵横, 2012(14): 188-189] | |
| Harrison KE. The role of nutrition in maturation, reproduction and embryonic development of decapod crustaceans: A review. Journal of Shellfish Research, 1990, 9(1): 1-28 | |
| Ji WJ, Xu XL. Fatty acid changes during larval development of Penaeus chinensis. Journal of Fishery Sciences, 1994, 3(4): 1-9 [季文娟, 徐学良. 中国对虾(Penaeus chinensis)幼体发育各阶段脂肪酸组成的研究. 中国水产科学, 1994, 3(4): 1-9] | |
| Ji WJ. Effects of highly unsaturated fatty acids in broodstock diets on spawning and egg quality of Penaeus chinensis. Journal of Fisheries of China, 1998, 22(3): 49-55 [季文娟. 高度不饱和脂肪酸对中国对虾亲虾的产卵和卵质的影响. 水产学报, 1998, 22(3): 49-55] | |
| Kanazawa A, Teshima S, Ono K. Relationship between essential fatty acid requirements of aquatic animals and the capacity for bioconversion of linolenic acid to highly unsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1979, 63(3): 295-298 DOI:10.1016/0305-0491(79)90251-7 | |
| Lawrence AL, Ward D, Missler S, et al. Organ indices and biochemical levels of ova from penaeid shrimp maintained in captivity versus those captured in the wild. Journal of the World Aquaculture Society, 1979, 10(1-4): 453-463 | |
| Lin YH, Shiau SY. Dietary vitamin E requirement of grouper, Epinephelus malabaricus, at two lipid levels, and their effects on immune responses. Aquaculture, 2005, 248(1-4): 235-244 DOI:10.1016/j.aquaculture.2005.04.020 | |
| Liu SZ, Zhang Y, Zhang MW, et al. Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids. Guangdong Agricultural Sciences, 2013(11): 99-103 DOI:10.3969/j.issn.1004-874X.2013.11.029 [刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展. 广东农业科学, 2013(11): 99-103] | |
| Liu Y, Sui LY, Deng YH, et al. Effect of poly-β-hydroxybutyrate on growth and hepat opan creatic enzy me activities of Eriocheir sinensis juveniles. Oceanologia et Limnologia Sinica, 2013, 44(5): 1333-1338 [刘玉, 隋丽英, 邓元浩, 等. 聚-β-羟基丁酸酯(PHB)对中华绒螯蟹(Eriocheir sinensis)幼蟹生长和肝胰腺酶活力的影响. 海洋与湖沼, 2013, 44(5): 1333-1338] | |
| Nichols DS. Prokaryotes and the input of polyunsaturated fatty acids to the marine food web. FEMS Microbiology Letters, 2003, 219(1): 1-7 DOI:10.1016/S0378-1097(02)01200-4 | |
| Partanen KH, Mroz Z. Organic acids for performance enhancement in pig diets. Nutrition Research Reviews, 1999, 12(1): 117-145 DOI:10.1079/095442299108728884 | |
| Qian YY, Zhao M, Pan JB, et al. Research progress of a new kind of biodegradable plastics poly-β-hydroxybutyrate(PHB). Heilongjiang Medicine Journal, 2010, 23(6): 895-898 [钱永雨, 赵敏, 潘俊波, 等. 新型可降解塑料聚-b-羟基丁酸(PHB)的研究进展. 黑龙江医药, 2010, 23(6): 895-898] | |
| Sheldon Jr WM, Blazer VS. Influence of dietary lipid and temperature on bactericidal activity of channel catfish macrophages. Journal of Aquatic Animal Health, 1991, 3(2): 87-93 DOI:10.1577/1548-8667(1991)003<0087:IODLAT>2.3.CO;2 | |
| Sun HX, Sui LY. Artemia nauplii enrichment with poly-β-hydroxybutyrate. Journal of Shanghai Ocean University, 2011, 20(3): 392-398 [孙慧贤, 隋丽英. 聚β-羟基丁酸酯对卤虫幼体的强化作用. 上海海洋大学学报, 2011, 20(3): 392-398] | |
| Teshima S I, Kanazawa A, テ シマ, シン イチ, et al. Variation in lipid compositions during the larval development of the prawn (Penaeus japonicus). Nihon-Suisan-Gakkai-Shi, 1982, 49(6): 957-962 | |
| Wei MF, Shao YH, Zhong WH. Reasearch status of biosynthesis poly-β-hydroxybutyrate(PHB) and application prospect. Heilongjiang Science, 2014, 5(6): 24-25 [魏茂繁, 邵云海, 钟卫鸿. 生物合成聚-β-羟基丁酸(PHB)的研究现状与应用前景. 黑龙江科学, 2014, 5(6): 24-25] | |
| Xu YQ, Li WF, Ding ZK. Effects of polyunsaturated fatty acids on immunity and survival of fish and their mechanisms. Chinese Journal of Animal Nutrition, 2010, 22(3): 551-556 [许友卿, 李伟峰, 丁兆坤. 多不饱和脂肪酸对鱼类免疫与成活的影响及机理. 动物营养学报, 2010, 22(3): 551-556] | |
| Yang Y, Xu AL, Zhang YF, et al. Advances in PHB synthesized by microorganism. Life Science Research, 2006, 10(4): 61-67 [杨宇, 徐爱玲, 张燕飞, 等. 生物合成材料聚b-羟基丁酸(PHB)的研究进展. 生命科学研究, 2006, 10(4): 61-67] |



