2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
脊尾白虾(Exopalaemon carinicauda),隶属于甲壳纲(Crustacea),十足目(Decapoda),长臂虾科(Palaemonidae),白虾属(Exopalaemon)。脊尾白虾是我国近海重要经济虾类(李新正等, 1995),其肉质细嫩、味道鲜美,己成为重要的海水养殖和渔业捕捞对象。但是,脊尾白虾在养殖及运输过程中,时常涉及到幼苗或成体离水干露的现象。干露状态下,脊尾白虾脱离了自身赖以生存的水生环境,其呼吸结构鳃丝无法在空气中获取氧气,面临着严重的低氧胁迫。低氧胁迫会阻碍虾体代谢能力,影响一系列的生理活动,最终引起死亡(Madenjian et al, 1987)。本研究阐明脊尾白虾对干露胁迫的生理响应,以期获取增加干露胁迫下脊尾白虾存活时间的科学方法,是其养殖过程中必须面临的课题。
目前,甲壳动物的干露胁迫研究已见报道,王琦等(2013)研究发现,在脊尾白虾干露胁迫的耐受范围内,HSP70和ferritin基因发挥抗氧化功能。陈百尧等(2013)研究表明,NO含量可以作为三疣梭子蟹(Portunus trituberculatus)家系是否耐受干露的一个指标。但是,在干露胁迫下,脊尾白虾呼吸代谢能力的变化机制尚不清楚。呼吸代谢反映了动物自身的生理状况、代谢特征、营养状况以及对外界环境条件的适应能力,在动物生命过程中起着举足轻重的作用(林小涛等, 2000)。本研究采取常规急性实验的方法(3 h干露胁迫),以琥珀酸脱氢酶(SDH)、细胞色素氧化酶(CCO)、延胡索酸还原酶(FRD)、乳酸脱氢酶(LDH)的活力和乳酸含量为指标,研究了干露胁迫下脊尾白虾呼吸代谢能力的变化,旨在探究干露胁迫下脊尾白虾对于代谢类型的需求,为进一步深入研究脊尾白虾耐干露机理打下基础。
1 材料与方法 1.1 实验材料脊尾白虾300尾于2015年9月取自山东日照海辰水产有限公司,均为健康活泼个体,体长为(5.82± 0.41) cm,体重为(2.9±0.3) g。在200 L的PVC桶中暂养,每桶30尾。暂养海水盐度为31,pH为7.8,温度为(20±2)℃,持续充氧。每天分早晚投喂2次,换水1/3,连续暂养10 d。
1.2 实验设计实验在封闭无风的室内进行,室温为22–24℃,室内湿度为20%–30%。实验分为2个实验组和1个对照组,每组90尾脊尾白虾,设置3个平行,每个平行30尾。2个实验组分别为常温干露组(将虾体置于铺有保鲜膜的解剖盘上,不做任何处理)和低温干露组(将虾体置于铺有保鲜膜的解剖盘上,并将带有虾体的解剖盘置于4℃恒温冰箱中)。1个对照组,将虾暂养于PVC桶中充氧养殖。在实验开始后0、60、90、120、180 min,随机挑选6尾存活的脊尾白虾取肝胰腺、鳃和肌肉,保存在液氮中。在上述时刻记录每个实验组的死亡个数,计算死亡率。死亡的标准是实验虾体出现侧翻,碰触后无反应,放入海水中失去活性自然下沉。
1.3 样品处理分别取0.2 g肝胰腺、鳃和肌肉,剪碎,加入9倍体积预冷的匀浆缓冲溶液,超声波冰浴破碎组织,于4℃下1000 r/min离心10 min后,取上清液,4℃下10000 r/min离心15 min(王金发等, 2004),吸取上清液用于LDH活性测定,剩余沉淀用预冷的匀浆缓冲液超声波重悬,重悬液用于SDH、CCO、FRD活性测定。另取0.2 g肌肉用于乳酸含量测定,样品处理方法参考南京建成科技有限公司试剂盒。
1.4 SDH、CCO、FRD、LDH和乳酸活力的测定SDH测试盒、乳酸(LD)测试盒、蛋白定量测试盒购自南京建成科技有限公司;还原性细胞色素C、NADH购自上海生工生物工程有限公司。
CCO活力的测定参考Affonso等(2004)的方法,10 ml粗酶液加750 ml 0.1 mol/L的磷酸缓冲液,15 ml 0.1 mol/L的K3Fe(CN)6溶液,30℃预热2 min。加入2 mg/ml还原性细胞色素C 50 ml。在550 nm处测定吸光度,记录1 min内吸光度下降值。每分钟A550下降0.001定义为一个酶活单位。
FRD活力测定参考Xiao等(1993)的方法,取450 ml用双蒸水定容的6 mmol/L延胡索酸二钠盐和450 ml用PBS定容的2 mmol/L NADH,30℃水浴10 min后加入60 ml粗酶液,在340 nm波长处测定1、2、3 min时的吸光度。由吸光度的变化计算出FRD活力的变化。
LDH活力测定参考张龙翔等(1997)方法,将丙酮酸溶液(2.5 mg用29 ml PBS定容)及NADH溶液(3.5 mg用1 ml PBS定容)于25℃预热。取2只石英比色杯,1只加入PBS调零,另1只依次加入丙酮酸溶液2.9 ml、NADH溶液0.1 ml和10 ml经稀释的粗酶液,混匀后立即计时。在340 nm处每隔0.5 min测1次,连续测定3 min。以A340 nm对时间作图,取反应最初线性部分,计算每分钟A340的下降值。由此计算酶活力。考虑到反应体系偏中性,易催化丙酮酸为乳酸,因而仅用于肌肉组织测定。
SDH、肌肉乳酸活力的测定和蛋白含量测定参考南京建成科技有限公司的试剂盒说明书。
1.5 统计分析实验数据以平均值±标准差(Mean±SD)表示,利用SPSS13.0统计软件进行单因素方差分析(One-way ANOVA),P < 0.05为显著性差异。
2 结果 2.1 干露胁迫对脊尾白虾存活率的影响实验从14 : 00开始,脊尾白虾刚离水时表现出很强的活力,约10 min后安静下来,随着干露时间的延长,虾体开始出现死亡。海水对照组脊尾白虾未表现出异常。在实验开始后0、60、90、120、180 min分别统计实验组及对照组存活个数,并计算存活率。
从表 1可以看出,干露胁迫下的脊尾白虾均有死亡,同一干露时刻,低温干露组脊尾白虾存活率高于常温干露组。
|
|
表 1 干露胁迫对脊尾白虾存活率的影响 Table 1 Effects of Dry exposure on survival rate of E. carinicauda |
从图 1可以看出,随着干露时间的延长,低温干露组中肝胰腺、鳃和肌肉SDH活力呈降低趋势,各组织在干露胁迫60 min时,SDH活力与对照组无显著差异(P > 0.05),在干露为90、120、180 min时,SDH活力显著低于对照组(P < 0.05);常温干露组中肝胰腺、鳃和肌肉SDH活力随着时间的延长呈下降趋势,各组织在干露为60、90、120 min时显著低于对照组(P < 0.05)。比较不同实验组同一时刻SDH的活力,除90 min常温干露组鳃SDH活力与低温干露组无显著差异(P > 0.05) 和120 min常温干露组肝胰腺SDH活力与低温干露组无显著差异(P > 0.05) 外,其余时刻常温干露组各组织SDH活力均显著低于低温干露组(P < 0.05)。180 min时常温干露组脊尾白虾已无存活率,不予比较。

|
图 1 干露胁迫对脊尾白虾SDH活力的影响 Figure 1 Effects of dry exposure on the SDH activities of E. carinicauda 同一时刻不同组不同字母上标表示差异显著(P < 0.05),下同 Different letters indicated significant difference at the same time point, the same as follow |
从图 2可以看出,随着干露时间的延长,低温干露组中肝胰腺、鳃和肌肉CCO活力呈降低趋势。但各组织在干露胁迫60 min时,CCO活力与对照组无显著差异(P > 0.05),在干露为90、120、180 min时,CCO活力显著低于对照组(P < 0.05),在180 min时CCO活力达到最低值;常温干露组中肝胰腺、鳃和肌肉CCO活力随着时间的延长呈下降趋势,其中,肝胰腺和肌肉CCO活力在干露60 min时与对照组无显著差异(P > 0.05),在90、120 min时显著低于对照组(P < 0.05),且在干露120 min时达到最低值。鳃CCO活力在60、90、120 min时显著低于对照组(P < 0.05),且在120 min时达到最低值。比较不同实验组同一时刻CCO的活力,60 min时常温干露组肝胰腺、肌肉CCO活力与低温干露组无显著差异(P > 0.05),120 min时常温干露组肌肉CCO活力与低温干露组无显著差异(P > 0.05),其余时刻常温干露组各组织CCO活力均显著低于低温干露组(P < 0.05)。

|
图 2 干露胁迫对脊尾白虾CCO活力的影响 Figure 2 Effects of dry exposure on the CCO activities of E. carinicauda |
从图 3可以看出,随着干露时间的延长,低温干露组中肝胰腺、鳃和肌肉FRD活力大致呈先升高后降低趋势。但各组织在干露胁迫60 min时FRD活力与对照组无显著差异(P > 0.05),90、120、180 min时,FRD活力显著高于对照组(P < 0.05),于120 min时FRD活力达到最高值;常温干露组中肝胰腺、鳃和肌肉FRD活力随着时间的延长呈先上升后下降趋势,60、90、120 min时各组织FRD活力显著高于对照组(P < 0.05),且在90 min时达到最高值。比较不同实验组同一时刻FRD的活力,在60、90 min时,常温干露组各组织FRD活力普遍高于低温干露组,但是120 min时,其各组织FRD相较于低温干露组表现出较低的活力。
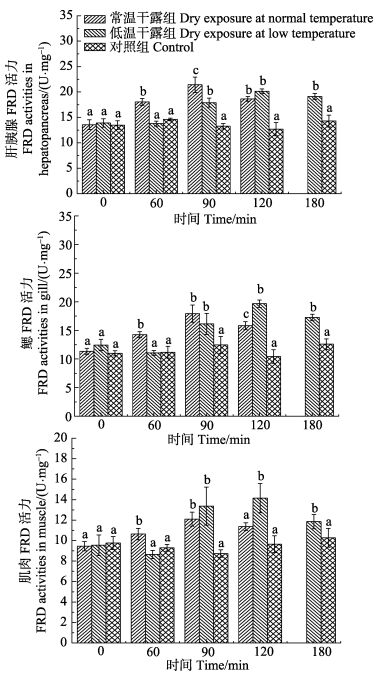
|
图 3 干露胁迫对脊尾白虾FRD活力的影响 Figure 3 Effects of dry exposure on the FRD activities of E. carinicauda |
从图 4可以看出,随着干露胁迫时间的延长,低温干露组肌肉LDH活力呈先升高后降低趋势。干露胁迫60 min时,肌肉LDH活力与对照组无显著差异(P > 0.05),在90、120、180 min时,肌肉LDH活力显著高于对照组(P < 0.05),且在120 min时达到最大值;常温干露组肌肉LDH活力随着胁迫时间的延长同样呈先升高后降低趋势,在60、90、120 min时,肌肉LDH活力显著高于对照组(P < 0.05),且在90 min时达到最大值。比较不同实验组同一时刻肌肉LDH活力,干露胁迫60 min时,常温干露组肌肉LDH活力显著高于低温干露组(P < 0.05),90 min时常温干露组与低温干露组无显著差异(P > 0.05),120 min时常温干露组显著低于低温干露组(P < 0.05)。

|
图 4 干露胁迫对脊尾白虾肌肉LDH活力的影响 Figure 4 Effects of dry exposure on the LDH activities in muscle of E. carinicauda |
从图 5可以看出,常温干露组脊尾白虾3种组织SDH/FRD的变化规律相同。干露胁迫阶段,该比值呈下降趋势,于120 min时达到最低点。其中,肝胰腺和鳃SDH/FRD的变化幅度比肌肉大。

|
图 5 干露胁迫(常温)对脊尾白虾各组织SDH/FRD的影响 Figure 5 Effects of dry exposure (normal temperature) on SDH/FRD levels in different tissues of E. carinicauda |
由图 6可以看出,低温干露组脊尾白虾3种组织SDH/FRD的变化规律,干露胁迫在0–60 min时,肝胰腺和肌肉略有上升,鳃略有下降;干露胁迫在60– 90 min时,该比值呈下降趋势,于180 min达到最低点。其中,肝胰腺和鳃SDH/FRD的变化幅度大于肌肉变化幅度。
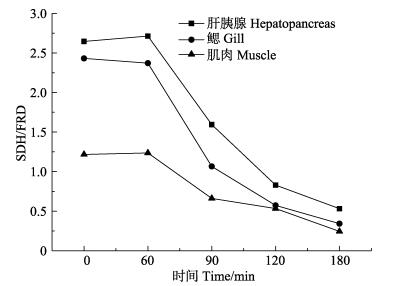
|
图 6 干露胁迫(低温)对脊尾白虾各组织SDH/FRD活力的影响 Figure 6 Effects of dry exposure (low temperature) on SDH/FRD levels in different tissues of E. carinicauda |
从图 7可以看出,随着干露胁迫时间的延长,低温干露组肌肉乳酸含量呈先升高后降低趋势。在干露胁迫60 min时,肌肉乳酸含量与对照组无显著差异(P > 0.05),在90、120、180 min时,肌肉乳酸含量显著高于对照组(P < 0.05),且在120 min时达到最大值。常温干露组肌肉乳酸含量随胁迫时间的延长同样呈先升高后降低趋势。在干露胁迫60、90、120 min时,常温干露组肌肉乳酸含量显著高于对照组(P < 0.05),且在90 min时达到最大值。对比同一时刻不同实验组乳酸含量,胁迫60、90 min时,常温干露组肌肉乳酸含量显著高于低温干露组(P < 0.05);胁迫120 min时,常温干露组肌肉乳酸含量显著低于低温干露组(P < 0.05)。

|
图 7 干露胁迫对脊尾白虾肌肉乳酸含量的影响 Figure 7 Effects of dry exposure on the content of lactate in E. carinicauda muscle |
有氧呼吸是动物进行呼吸作用的主要形式,其共分为糖酵解、三羧酸循环和氧化磷酸化(电子传递链)(陈阅增, 1997)。Rustin等(1994)研究发现,SDH作为参与三羧酸循环和电子传递链上的关键酶,其活性一般可作为评价有氧呼吸运行程度的指标;CCO是电子传递链末端的酶,是有氧呼吸的限速酶(Simon et al, 1971)。在低氧条件下,由于细胞内氧气含量变低,电子缺少受体,该反应不能正常进行,导致CCO活性变低;同时,SDH所参与的三羧酸循环因电子传递链末端反应受阻而速率降低,最终导致SDH和CCO活性均变低。李利(2010)1)研究低氧胁迫下的日本沼虾(Macrobrachium nipponense)发现,水体中低溶解氧导致了日本沼虾SDH和CCO活力的降低。李泽健(2012)2)在研究中华绒螯蟹(Eriocheir sinensis)低氧胁迫下的呼吸代谢情况得到了同样的结论。本研究中,常温干露组脊尾白虾各组织SDH和CCO活力随着干露时间的延长呈下降趋势,表明了干露胁迫导致虾体细胞缺氧,从而阻碍了电子传递,最终使有氧呼吸代谢效率下降,表现为2个标志酶活力降低。低温干露组脊尾白虾各组织SDH和CCO活力表现出与常温干露组相同的趋势,但各时间点二者活力普遍高于常温干露组。结合低温干露组和常温干露组虾体存活率,推测是低温下脊尾白虾机体的相应生理活动比常温干露下低迷,对氧气的需求量较少,血淋巴中存储的氧气能够满足机体一定时间的有氧代谢(Morris et al, 1999)。处于干露状态的虾体通过鳃丝上残存的水分获取氧气,空气中的氧以溶解氧的形式进入残存的水中再被虾体利用(张义浩等, 1996)。相较于常温干露下的脊尾白虾,处于低温干露状态的脊尾白虾鳃丝表面的水分保留的更为持久,因而可能通过增加颚舟片的摆动频率来提高氧气的供应(Taylor et al, 1997),从而在细胞内表现出SDH和CCO活力高于常温干露组脊尾白虾。
1) Li L. Effects of hypoxia on respiratory metabolism, energy metabolism and antioxidant capability of Macrobrachium miponense. Master's Thesis of Hebei University, 2010, 26-35 [低氧胁迫对日本沼虾呼吸代谢、能量代谢和抗氧化能力的影响.河北大学硕士研究生学位论文, 2010, 26-35]
2) Li ZJ. Effects of hypoxia on energy metabolism, respiratory metabolism and antioxidant metabolism of Eriocheir sinensis. Master's Thesis of Hebei University, 2012, 30-45 [李泽健.低氧胁迫对中华绒螯蟹能量代谢、呼吸代谢及抗氧化代谢的影响.河北大学硕士研究生学位论文, 2012, 30-45]
缺氧或低氧条件下,机体会通过无氧呼吸产生能量以满足机体对能量的需求。甲壳动物无氧呼吸代谢的最终产物是乳酸,且虾类耐受低氧能力低的原因之一是无氧呼吸强度有限(Spicer et al, 1990)。FRD与SDH在结构上相似,但功能相反。FRD作为电子受体,主要催化延胡索酸还原为琥珀酸,在无氧代谢中起着重要作用(Ellington, 1983)。LDH可以催化无氧代谢重要产物乳酸为丙酮酸,释放出能量,其活力在一定程度上可以反映无氧代谢能力的强弱(Viru, 1994)。管越强等(2009)在研究硫化物对日本沼虾呼吸代谢的影响时指出,随着硫化物胁迫的时间延长,日本沼虾SDH、CCO活力下降,FRD与LDH活力上升,推测日本沼虾为适应硫化物胁迫,机体无氧代谢能力增强。本研究中,常温干露组各组织FRD活力随着干露时间的延长呈先升高后降低趋势,与肌肉LDH活力和乳酸含量的变化趋势相同。表明了脊尾白虾应对干露胁迫时,无氧呼吸代谢能力增强,产物乳酸逐渐积累,而乳酸的积累反过来又会促使LDH活力的上升,形成了一种调节机制。但是在胁迫120 min时,三者均下降。可能是胁迫时间过长导致机体的代谢系统受到一定程度的影响,且机体为应对严重的低氧胁迫将乳酸转化为葡萄糖来维持内环境平衡和能量供应(Oliveira et al, 2004),从而使乳酸含量下降。低温干露组FRD、LDH活力和乳酸含量与常温干露组有所不同,可以推测在60 min时,低温干露组虾体尚可通过一定程度的有氧代谢提供能量,无氧代谢提高的并不明显;90 min时,常温干露组虾体细胞内缺氧严重,无氧代谢强度急剧提高,乳酸开始大量积累;120 min时,常温干露组虾体代谢系统可能受到损害,无氧代谢强度下降,积累的乳酸被迫转化为葡萄糖来维持机体平衡。此时,低温干露组乳酸逐渐积累,无氧代谢强度上升,形成调节机制。
SDH和FRD是呼吸代谢相关的重要酶,正因为这2种酶的关键性,许多科研人员将SDH/FRD的比值用来判断物种的呼吸代谢类型。Anilkumar等(1996)发现,平分大额蟹(Metopograpsus messor)的精子SDH/FRD是5.7:1,推测其为兼性代谢。丁银娣等(2009)研究发现,红螯螯虾(Cherax quadricarinatus)精子SDH/FRD的比值趋近0,推测为无氧代谢类型。本研究中,常温干露组随着胁迫时间的延长,SDH/FRD比值随之下降,表明无氧代谢增强,有氧代谢能力下降。低温干露组SDH/FRD比值在干露60 min时无明显变化,随后呈下降趋势,表明至少有一段时间虾体仍然进行有氧呼吸,之后虾体开始进行无氧呼吸来应对严重的干露胁迫。相较于肌肉SDH/ FRD的变化幅度,肝胰腺和鳃的变化幅度较大,可能是由于肝胰腺作为虾体的代谢中心及鳃作为主要呼吸器官对干露胁迫较为敏感。
综上所述,干露胁迫下的脊尾白虾通过提高机体无氧代谢的能力来应对自身所处的逆境。低温干露下的脊尾白虾至少有一段时间仍然以有氧代谢来维持生命活动。随着干露时间的延长,低温干露的脊尾白虾无氧代谢相关酶相较于常温干露的脊尾白虾表现出较高的活力,这是低温干露的虾体存活率较高的原因之一。因而,在其他条件相同的情况下,低温可以延长脊尾白虾的干露存活时间。
| Affonso EG, Polez VLP, Correa CF, et al. Physiological responses to sulfide toxicity by the air-breathing catfish, Hoplosternum littorale (Siluriformes, Callichthyidae). Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2004, 139(4): 251-257 DOI:10.1016/j.cca.2004.11.007 | |
| Anilkumar G, Sudha K, Anitha E, et al. Aspects of sperm metabolism in the spermatheca of the brachyuran crab Metopograpsus messor. Journal of Crustacean Biology, 1996, 16(2): 310-314 DOI:10.1163/193724096X00117 | |
| Chen BY, Fu GH, An J, et al. Analysis of the activity differences of immune factors among different parentages in Portunus trituberculatus at different desiccation temperatures. Journal of Shanghai Ocean University, 2013, 22(2): 194-199 [陈百尧, 伏光辉, 安健, 等. 干露下三疣梭子蟹家系间血淋巴免疫因子活性差异分析. 上海海洋大学学报, 2013, 22(2): 194-199] | |
| Chen YZ. General Biology. Beijing: Higher Education Press, 1997. [陈阅增. 普通生物学. 北京: 高等教育出版社, 1997.] | |
| Ding YD, Jia LZ, Ma Q, et al. The structure of vas deferens and formation of spermatophore in crayfish, Cherax quadricairnatus. Journal of Fisheries of China, 2009, 33(1): 78-86 [丁银娣, 贾林芝, 马强, 等. 红螯螯虾输精管的结构及精荚的形成. 水产学报, 2009, 33(1): 78-86] | |
| Ellington WR. The recovery from anaerobic metabolism in invertebrates. Journal of Experimental Zoology, 1983, 228(3): 431-444 DOI:10.1002/(ISSN)1097-010X | |
| Guan YQ, Wang HC, Li L. Effects of sulphide on the enzyme of respiratory metabolism and energy metabolism of Macrobrachium nipponense. Ecology and Environmental Sciences, 2009, 18(6): 2017-2012 [管越强, 王慧春, 李利. 硫化物胁迫对日本沼虾呼吸代谢和能量代谢酶的影响. 生态环境学报, 2009, 18(6): 2017-2012] | |
| Li XZ, Liu RY, Liang XQ. The zoogeogra phy of Chinese Palaemonoidea fauna. Biodiversity Science, 2003, 11(5): 393-406 [李新正, 刘瑞玉, 梁象秋. 中国长臂虾总科的动物地理学特点. 生物多样性, 2003, 11(5): 393-406] | |
| Lin XT, Zhang QM, Xu ZN, et al. Advancement of the study on respiratory metabolism of decapod crustaceans. Journal of Fisheries of China, 2000, 24(6): 575-580 [林小涛, 张秋明, 许忠能, 等. 虾蟹类呼吸代谢研究进展. 水产学报, 2000, 24(6): 575-580] | |
| Madenjian CM, Rogers GL, Fast AW. Predicting night-time dissolved oxygen loss in prawn pond of Hawaii: Part Ⅰ. Evaluation of traditional methods. Aquaculture Engineering, 1987, 6(3): 191-208 | |
| Morris S, Oliver S. Circulatory, respiratory and metabolic response to emersion and low temperature of Jasus edwardsii: Simulation studies of commercial shipping methods. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 1999, 122(3): 299-308 DOI:10.1016/S1095-6433(99)00003-3 | |
| Oliveira GT, Eichler P, Rossi IC, et al. Hepatopancreas gluconeogenesis during anoxia and post-anoxia recovery in Chasmagnathus granulata crabs maintained on high-protein or carbohydrate-rich diets. Journal of Experimental Zoology Part A: Comparative Experimental Biology, 2004, 301(3): 240-248 | |
| Rustin P, Chretien D, Bourgeron T, et al. Biochemical and molecular investigations in respiratory chain deficiencies. Clinica Chimica Acta, 1994, 228(1): 35-51 DOI:10.1016/0009-8981(94)90055-8 | |
| Simon LM, Robin ED. Relationship of cytochrome oxidase activity to vertebrate total and organ oxygen consumption. International Journal of Biochemistry, 1971, 2(11): 569-573 DOI:10.1016/0020-711X(71)90026-7 | |
| Spicer JI, Hill AD, Taylor AC, et al. Effect of aerial exposure on concentrations of selected metabolites in blood of the Norwegian lobster Nephrops norvegicus (Crustacea: Nephropidae). Marine Biology, 1990, 105(1): 129-135 DOI:10.1007/BF01344278 | |
| Taylor HH, Waldron FM. Respiratory responses to air-exposure in the southern rock lobster, Jasus edwardsii (Hutton) (Decapoda: Palinuridae). Marine and Freshwater Research, 1997, 48(8): 889-898 DOI:10.1071/MF97071 | |
| Viru M. Differences in effects of various training regimens on metabolism of skeletal muscles. The Journal of Sports Medicine and Physical Fitness, 1994, 34(3): 217-227 | |
| Wang JF, He YM. Experimental course of cell biology. Beijing: Science Press, 2004: 47-51. [王金发, 何炎明. 细胞生物学实验教程. 北京: 科学出版社, 2004: 47-51.] | |
| Wang Q, Li J, Li JT, et al. The effect of dry exposure on HSP70 and ferritin gene expression level in Exopalaemon carinicauda. Oceanologia et Limnologia Sinica, 2013, 44(2): 409-414 DOI:10.11693/hyhz201302023023 [王琦, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾(Exopalaemon carinicauda) HSP70和ferritin基因表达的影响. 海洋与湖沼, 2013, 44(2): 409-414] | |
| Xiao SH, Feng JJ, Guo HF, et al. Effects of mebendazole, albendazole, and praziquantel on succinate dehydrogenase, fumarate reductase, and malate dehydrogenase in Echinococcus granulosus cysts harbored in mice. Acta Pharmacologica Sinica, 1993, 14(2): 151-154 | |
| Zhang LX, Zhang TF, Li LY. Experimental Biotechnology. Beijing: Higher Education Press, 1997. [张龙翔, 张庭芳, 李玲媛. 生化实验方法和技术. 北京: 高等教育出版社, 1997.] | |
| Zhang YH, Mei WX, Wang CL, et al. Live Squilla testing of dissociated water and dry exposure. Journal of Zhejiang College of Fisheries, 1996, 15(1): 43-48 [张义浩, 梅文骧, 王春琳, 等. 活虾蛄离水干露试验. 浙江海洋学院学报(自然科学版), 1996, 15(1): 43-48] |



