2. 青岛农业大学 青岛 266109
2. Qingdao Agricultural University, Qingdao 266109
刺参(Apostichopus japonicus)是经济价值极高的海洋性温带种,其养殖产业近年来蓬勃发展(李成林等, 2010)。鼠尾藻(Sargassum thunbergii)等大型经济海藻是刺参的天然优良饵料,在刺参饲料配方中一直占有重要配比,成为不可缺少的主要成分。然而,刺参养殖产业的迅猛拓展导致了大型经济海藻的过度开发利用,致其价格上扬,大幅提升了刺参饲料成本。寻求来源广、成本低、绿色环保、投喂效果好的陆生植物源饲料,在近年的刺参饲料研究中正在陆续开展(姜森颢等, 2012; 刘旭佳等, 2013; 王维新等, 2013; 赵斌等, 2016, 张德瑞等, 2016)。
甘薯(Ipomoea batatas)是在中国广泛分布的经济作物,其种植规模约占全世界的80% (杜连起等, 2006)。目前,已有较多有关其各部位丰富营养价值的研究成果(何川, 2003; 伍军, 2004; 王文亮等, 2009)。在水产养殖中,甘薯干制粉可作为鱼类的饲料进行投喂,而在其他种类养殖中的应用研究尚未广泛开展。本研究分析了在饲料中按不同比例添加甘薯2个不同部位的干制粉对大规格刺参生长的影响,同时分析研究了刺参体腔液中溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)及碱性磷酸酶(AKP)等非特异性免疫指标的变化。旨在拓展刺参的营养学研究范围,探索开发陆生植物蛋白源饲料的可行性,为研制高效、绿色、成本低廉的优质刺参饲料提供参考。
1 材料与方法 1.1 实验材料实验用甘薯饲料原料分别为甘薯块根与茎蔓部分经晾干后制成的干粉,粉碎粒径至150 μm以内。其中,甘薯块根粉中粗蛋白、粗脂肪、粗灰分与水分等主要成分的组成分别为10.76%、3.64%、10.35%、6.91%;甘薯茎蔓粉中粗蛋白、粗脂肪、粗灰分与水分的组成分别为5.65%、1.18%、3.36%、13.68%。实验用刺参为山东省海洋生物研究院种质资源研究中心培育的健康苗种,平均体重为(25.60±1.40) g。
1.2 实验设计与日常管理实验使用配合饲料购自青岛朗格生物技术有限公司(主要营养成分组成为粗蛋白16.0%、粗脂肪5.0%、粗纤维8.0%、总磷6.0%、粗灰分25.0%、赖氨酸0.8%、水分10.0%),根据甘薯块根粉与茎蔓粉的不同添加比例分别设计6个处理组,添加水平分别为10%(A)、20%(B)、30%(C)、40%(D)、50%(E)、60%(F),以投喂商品配合饲料的为对照组(CK)。将甘薯块根粉与茎蔓粉等原料按以上比例称重,与配合饲料一起入搅拌机中混合均匀后,放入超微粉碎机中进行超微粉碎至200目以上,制成粉状饲料,烘干后密封保存。
投喂添加甘薯的配合饲料总重为刺参总重的5%,同时按饲料与海泥重量比为1:4的比例搭配投喂优质干海泥。实验刺参饲养于80 cm×60 cm×48 cm的塑料整理箱中,每个整理箱中放养刺参20头,每个实验组各设5个平行,每天17:00投喂饲料l次。实验海水盐度为30.8–31.6,pH为7.8–8.3,水温为15–20℃,连续微量充气,每天全量换水。实验自2015年4月12日开始共进行50 d。
1.3 测定方法与数据统计 1.3.1 刺参生长指标的测定本研究以刺参生长50 d后的体重及体重特定生长率(Spectific growth rate,SGR)作为主要的生长指标。实验开始时,将每个整理箱内刺参取出称其湿体重,为初始体重W0(g);实验结束后,同样取出刺参称其湿体重,为终末体重Wt(g)。称重时,首先将刺参取出阴干10 min,然后用吸水纸将刺参体表水分吸干,尽量避免体表水分所引起的称量误差。t为实验持续的时间(d)。刺参SGR(%/d)采用以下公式:
| ${\rm{SGR}}\left( {\% /{\rm{d}}} \right) = 100 \times \left( {{\rm{ln}}{W_{\rm{t}}} - {\rm{ln}}{W_0}} \right)/t$ |
测定体重:实验开始前1 d停止投喂,测其体重初始值,实验50 d结束时,同样停止投喂1 d,测其体重最终值。
1.3.2 刺参免疫指标的测定本研究测定了不同甘薯添加水平下刺参体腔液中的免疫指标。刺参体腔液的采集参考董晓亮等(2013)的方法并做改进,方法如下:取各组实验刺参,置于灭菌玻璃培养皿中,在刺参腹部切口1 cm,用灭菌枪头收集刺参体腔液,同组内刺参体腔液混匀后,经4℃ 1000 r/min离心10 min,取上清液,分装后保存在–80℃冰箱内待测。
LZM、CAT、T-SOD、ACP和AKP等免疫指标均采用南京建成生物工程研究所研制的试剂盒测定。LZM含量测定采用比浊法,每80 U/ml相当于1 μg/ml含量;T-SOD活性测定采用黄嘌呤氧化酶法,以1 ml体腔上清液中SOD抑制率达50%时所对应的SOD量为1个活力单位;CAT活性测定采用钼酸铵法,以1 ml体腔上清液每秒分解1 μmol的H2O2的量为1个活力单位;ACP活性测定采用磷酸苯二钠法,以100 ml体腔上清液在37℃与基质作用30 min产生1 mg酚为1个活力单位;AKP活性测定采用磷酸苯二钠法,以100 ml体腔上清液在37℃与基质作用30 min产生1 mg酚为1个金氏单位。
1.3.3 数据统计实验数据利用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)和多重比较,以P < 0.05作为差异显著水平。
2 结果 2.1 添加2种甘薯饲料对刺参生长的影响饲料中添加甘薯块根在50 d内可不同程度的促进刺参生长(表 1)。50 d实验结束时,添加甘薯块根的实验组中体重最高的为B组,平均体重达43.54 g,显著高于对照组(P < 0.05);A、C、D组与CK组差异不显著(P > 0.05),平均体重分别为41.76、40.13和38.80 g;E、F组平均体重均显著低于CK组(P < 0.05),F组体重最低,为30.74 g。
|
|
表 1 不同甘薯块根粉添加水平对刺参生长的影响 Table 1 Effects of different diets supplemented with tuber powder of sweet potato on sea cucumber |
当甘薯块根粉添加水平在30%以下时,随着添加比例的提高,刺参体重SGR有升高趋势(表 1)。添加甘薯块根粉B组刺参的SGR最高,为1.061%/d,除A组和CK组外,与其他实验组相比显著差异(P < 0.05);A、C与D组SGR与CK组无显著差异(P > 0.05);E、F组SGR显著低于CK组(P < 0.05),F组SGR最低,为0.371%/d,显著低于其他各组SGR水平。
饲料中添加甘薯茎蔓粉的实验刺参体重在50 d内有不同程度的增长(表 2)。50 d实验结束时,添加甘薯茎蔓粉的实验组中体重最高为A组,平均体重为40.31 g,与CK组无显著差异(P > 0.05),同时显著高于其他各实验组(P < 0.05);F组平均体重最低,为28.59 g。当甘薯茎蔓粉添加水平在20%以下时,A、B组的刺参SGR与CK组差异不显著(P > 0.05),其余实验组SGR与CK组比较有显著降低(P < 0.05),F组SGR最低,为0.219 %/d,显著低于其他各组SGR水平。
|
|
表 2 不同甘薯茎蔓粉添加水平对刺参特定生长率的影响 Table 2 Effects of different diets supplemented with stem powder of sweet potato on sea cucumber |
投喂添加不同比例甘薯块根粉实验组刺参体腔液CAT、T-SOD、ACP、AKP和LZM的免疫指标变化见图 1。从图 1-A可以看出,实验结束时,添加甘薯块根粉对刺参体腔液中CAT有显著影响(P < 0.05),A、B组显著提高体腔液中CAT活性,而添加比例在30%–60%时的C、D、E、F组与CK组无显著差异(P > 0.05)。从图 1-B可以看出,与CK组相比,饲料中添加甘薯块根粉对刺参体腔液中的T-SOD活力没有显著影响。从图 1-C、图 1-D可以看出,添加甘薯块根粉对刺参体腔液中的ACP和AKP活力有显著性影响(P < 0.05),A、B组的ACP与AKP活性均显著高于CK组(P < 0.05),ACP最高值为B组的2.94(U/100ml),AKP最高值为A组的2.74(金氏单位/100ml),其余各组的ACP与AKP活性与CK组相比基本无显著差异(P > 0.05)。从图 1-E可以看出,饲料中添加甘薯块根粉对刺参体腔液中LZM含量有显著影响(P < 0.05),随着添加比例的增加,LZM呈现先上升后下降趋势,最高值为B组的263.6 (U/100ml,显著高于对照组(P < 0.05),C、D、E、F组与CK组相比出现显著降低,其中,C组LZM含量显著高于D、E、F组(P < 0.05)。
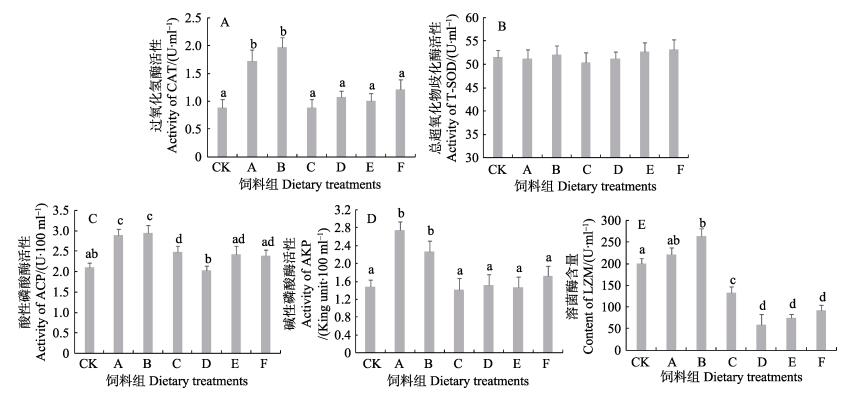
|
图 1 添加甘薯块根粉组刺参非特异性免疫酶活性的变化 Figure 1 Changes of non-specific immune enzyme activities of sea cucumber fed with tuber powder of sweet potato 不同字母表示显著性差异(P < 0.05),下同 Different letters indicated significant difference (P < 0.05), the same as below |
投喂添加不同比例甘薯茎蔓粉实验组刺参体腔液LZM、CAT、T-SOD、ACP和AKP的免疫指标变化见图 2。从图 2-A可以看出,实验结束时,饲料中添加甘薯茎蔓粉对刺参体腔液中LZM含量有显著影响(P < 0.05),A、B组的LZM含量与CK组无显著差异(P > 0.05),C、D、E、F组LZM含量显著低于CK组(P < 0.05)。从图 2-B可以看出,与对照组相比,饲料中添加甘薯茎蔓粉对刺参体腔液中的T-SOD活力没有显著影响(P > 0.05)。从图 2-C可以看出,添加甘薯茎蔓粉对刺参体腔液中CAT有显著影响(P < 0.05),在A组添加比例下,CAT活力平均值高于CK组,为1.06(U/ml),但方差分析显示,其差异未达显著水平(P > 0.05),其余各实验组CAT活力显著低于CK组(P < 0.05)。从图 2-D可以看出,添加甘薯茎蔓粉对刺参体腔液中的ACP有显著性影响(P < 0.05),B组的ACP活性显著高于CK组(P < 0.05),D组的ACP活性显著低于CK组(P < 0.05),其余各组与CK组无显著差异(P > 0.05)。从图 2-E可以看出,添加甘薯茎蔓粉对刺参体腔液中的AKP活力有显著性影响(P < 0.05),A、B、C、D组的AKP活性与CK组无显著差异(P > 0.05),E、F组AKP显著低于CK组。
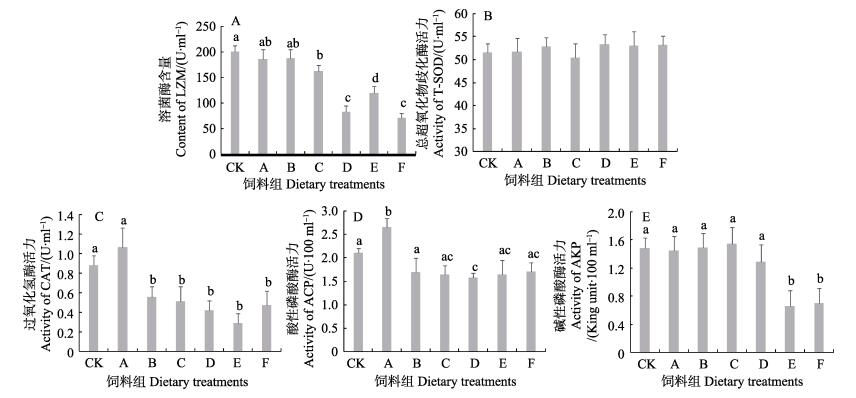
|
图 2 添加甘薯茎蔓粉组刺参非特异性免疫酶活性的变化 Figure 2 Changes of non-specific immune enzyme activities of sea cucumber fed with different levels of stem powder of sweet potato |
近年来,国内外对甘薯营养价值及功能性成分的研究工作十分活跃(王建中等, 2007)。甘薯富含淀粉、蛋白质和少量的脂肪,还含有胡萝卜素、维生素B1、维生素B2、维生素C、维生素E以及Ca、Fe、P、Se等矿物质(王宪昌等, 2005),是较为理想的陆生植物添加饲料。赵斌等(2016)研究表明,在6 g左右刺参幼参饲料中按一定比例分别添加2种甘薯饲料原料,当甘薯块根粉添加比例不超过30%、茎蔓粉添加比例不超过10%时,可有效促进刺参摄食与生长。本研究的刺参规格与养殖时间均高于上述实验,添加2种甘薯饲料原料的刺参生长呈现出相似规律,说明甘薯块根与茎蔓在刺参大规格苗种培育中,同样可作为2种完全可行的原料以适当比例添加替代部分高值藻粉饲料。同时,本研究还发现,添加相同比例甘薯块根对刺参生长的促进作用优于甘薯茎蔓,其原因可能是甘薯块根中的蛋白、粘多糖等含量高于甘薯茎蔓,且甘薯块根粉更易吸附水体里配合饲料中的藻粉,并与海泥结合形成配合饲料中其他成分的载体,加速其沉降,减少了营养散失率,有利于刺参的摄食,提高了饲料的利用率和转化率,从而促进了刺参生长。
3.2 饲料中添加不同比例甘薯成分对刺参免疫力的影响刺参属无脊椎动物,缺乏脊椎动物所具有的获得性免疫,主要依靠非特异性免疫对外部刺激进行防御(Eliseikina et al, 2002; 李丹彤等, 2011)。刺参非特异性免疫酶活性防御体系包括体壁防御和体内免疫,而体内免疫又分为细胞免疫和体液免疫(孙永欣, 2008)1)。刺参体腔液担负着细胞免疫和体液免疫作用,有效清除侵入体腔液的外源异物,并可产生细胞毒素反应、凝血及产生抗菌活性物质等防御作用(Kudriavtsev et al, 2004)。在刺参的体壁防御和体内免疫中,LZM、SOD、CAT、ACP和AKP都发挥着重要生理作用(江晓路等, 2009)。有研究表明,壳寡糖等添加剂(韩丽蓉等, 2014)、山药粉等陆源植物蛋白源饲料(王吉桥等, 2010)均可提高刺参体内免疫因子的活性,甘薯的茎尖、叶片、块根中含有的多种胶原和粘多糖物质,其提取物可有效促进机体免疫力(伍军, 2004; 徐龙权等, 2011)。
1) Sun YX. Improving effects of astragalus polysaccharides (APS) on non-specific immune responses and productive performance of sea cucumber (Apostichopus japonicus). Doctoral Dissertation of Dalian University of Technology, 2008, 3-5 [孙永欣.黄芪多糖促进刺参免疫力和生长性能的研究.大连理工大学博士研究生学位论文, 2008, 3-5]
LZM广泛存在于脊椎动物、无脊椎动物、细菌及植物体内,它是非特异性免疫的重要组成部分,可使细菌细胞裂解并可能刺激机体吞噬细胞的吞噬作用(Johnson, 1969; 田相利等, 2015)。在本研究中,当甘薯块根粉添加量在20%时,可显著提高LZM含量,推测可能在此比例下甘薯块根粉可以诱导出刺参体腔液中较高溶菌活力和吞噬活性,而添加20%甘薯茎蔓粉时,刺参体腔液中的溶菌酶含量可维持常规水平,超过此比例时溶菌活力和吞噬活性均会下降。
SOD是生物体内重要的抗氧化酶类之一,它能清除吞噬过程产生的高浓度O2–及生化过程中产生的氧自由基(Fridovich, 1989; Nichols et al, 2000)。本研究中,添加甘薯块根粉与甘薯茎蔓粉实验组刺参体腔液中的T-SOD活性均没有显著差异,说明刺参摄食甘薯原料成分的配合饲料,在抗氧化酶体系上没有受到显著影响,类似现象在刀鲚(Coilia nasus)幼鱼摄食活饵和配合饲料时也曾出现过(施永海等, 2014)。在生物的抗氧化酶体系中,CAT是组成生物体活性氧防御体系的重要因子,可使H2O2发生歧化生成水和氧(任秀芳等, 2013)。本研究中,添加10%、20%甘薯块根粉实验组的刺参体腔液CAT活性显著高于CK组,说明在饲料中添加一定量的甘薯块根粉可对降低刺参体内的超氧阴离子自由基有一定的助益作用;而添加20%以上甘薯茎蔓粉实验组的CAT活性显著低于CK组,说明其添加量超过20%时长期投喂会降低刺参消除超氧阴离子自由基,保护细胞损伤的能力。
AKP在动植物体内广泛存在,是一种含锌的糖蛋白,在碱性环境下(最适pH为10左右)可以催化各种醇和酚的磷酸酯进行水解反应(Zhang et al, 2000)。与之相对应的是ACP,一般认为,ACP主要存在于吞噬细胞,位于溶酶体内,是溶酶体的标志酶(Bertheussen, 1982; 常杰等, 2011)。ACP和AKP能够杀死外来入侵的病原体,并能通过修改病原表面分子来加速吞噬细胞的吞噬以及异物的降解速度(陈家长等, 2012)。本研究表明,添加10%–20%甘薯块根粉的刺参配合饲料可显著提高刺参体腔液中ACP和AKP活性,同时,当甘薯块根粉添加量在60%以内时,不会显著降低刺参体内ACP和AKP的免疫应答。添加10%甘薯茎蔓粉的刺参配合饲料可显著提高刺参体腔液中ACP活性,当甘薯茎蔓粉添加量在60%以内时,不会显著降低刺参体内ACP的免疫应答;添加甘薯茎蔓粉在40%以下时,刺参体腔液中AKP活性不会显著降低,超过40%时AKP活性降低,机体防御能力下降。
王轶南等(2013)研究发现,不同规格刺参体腔液中的酚氧化酶(PO)活性不同,总体呈现随体重增加活性增强的趋势。本研究中生长较好的实验组其非特异性免疫酶活性往往也高于其他组,说明刺参体腔液中的CAT、ACP、AKP和LZM免疫酶也存在这种规律。
本研究发现,饲料中添加一定比例甘薯块根与甘薯茎蔓对刺参的生长与非特异性免疫力均可产生不同程度的促进作用,尤其是甘薯块根的效果更为显著。综合各项生长与免疫指标可得出,刺参配合饲料中甘薯块根的最适添加量为20%左右,以不超过30%为宜;甘薯茎蔓的最适添加量为10%左右,以不超过20%为宜。今后对甘薯这一陆生植物蛋白源饲料在刺参养殖生产中的潜在应用价值仍有必要进一步研究与开发。
| Bertheussen K. Receptors for complement on echinoid phagocytes Ⅱ. Purified human complement mediates echinoid phagocytosis. Developmental and Comparative Immunology, 1982, 6(4): 635-642 | |
| Chang J, Niu HX, Zhang WB. Advances in the immune system of sea cucumber (Apostichopus japonicus) and immun o stimulants evaluation indicators. Feed China, 2011(6): 8-12 [常杰, 牛化欣, 张文兵. 刺参免疫系统及其免疫增强剂评价指标的研究进展. 中国饲料, 2011(6): 8-12] | |
| Chen JC, Zang XL, Meng SL, et al. Effect of nitrite nitrogen stress on the activities of nonspecific immune enzymes in serum of tilapia (GIFT Oreochromis niloticus). Ecology and Environmental Sciences, 2012, 21(5): 897-901 [陈家长, 臧学磊, 孟顺龙, 等. 亚硝酸盐氮胁迫对罗非鱼(GIFT Oreochromis niloticus)血清非特异性免疫酶活性的影响. 生态环境学报, 2012, 21(5): 897-901] | |
| Dong XL, Li CL, Zhao B, et al. Effects of low salinity stress on non-specific immune enzyme activities and antibacterial activity of sea cucumber Apostichopus japonicus. Progress in Fishery Sciences, 2013, 34(3): 82-87 [董晓亮, 李成林, 赵斌, 等. 低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响. 渔业科学进展, 2013, 34(3): 82-87] | |
| Du LQ, Zhao YG, Li RF. Analysis and evaluation on the nutritional components in stem apex of sweet potato. Chinese Agricultural Science Bulletin, 2006, 22(6): 99-101 [杜连起, 赵永光, 李润丰. 甘薯茎尖营养成分分析及评价. 中国农学通报, 2006, 22(6): 99-101] | |
| Eliseikina MG, Magarlamov TY. Coelomocyte morphology in the holothurians Apostichopus japonicus (Aspidochirota: Stichopodidae) and Cucumaria japonica (Dendrochirota: Cucumariidae). Russian Journal Marine Biology, 2002, 28(3): 197-202 DOI:10.1023/A:1016801521216 | |
| Fridovich I. Superoxide dismutases: An adaptation to apar magnetic gas. Journal Biological Chemistry, 1989, 264(14): 7761-7764 | |
| Han LR, Xu W, Wang DF, et al. Effect of dietary chitosan oligosaccharide on the growth, immune response and resistance against Vibrio splendidus infection of sea cucumber. Periodical of Ocean University of China, (Natural Science), 2014, 44(3): 34-39 [韩丽蓉, 徐玮, 汪东风, 等. 壳寡糖对刺参生长、免疫反应和抗病力的影响. 中国海洋大学学报(自然科学版), 2014, 44(3): 34-39] | |
| He C. Nutrition of sweet potato and its development and usage. China Western Cereals and Oils Technology, 2003(5): 44-46 [何川. 红薯的营养价值及开发利用. 西部粮油科技, 2003(5): 44-46] | |
| Jiang SH, Liang J, Sun X. Study on biochemical compositions of Ophiopholis mirabilis and its influence on growth and survival of Apostichopus japonicus as feed ingredients. Feed Industry, 2012, 33(16): 13-17 DOI:10.3969/j.issn.1001-991X.2012.16.004 [姜森颢, 梁峻, 孙欣. 紫蛇尾的生化成分及作为饲料原料对刺参幼参生长和存活的影响. 饲料工业, 2012, 33(16): 13-17] | |
| Jiang XL, Du YS, Wang P, et al. Effects of alginate-derived oligosaccharide on the activities of immunoenzymes in the coelomic fluid and body wall of sea cucumber (Apo stichopus japonicus). Periodical of Ocean University of China (Natural Science), 2009, 39(6): 1188-1192 [江晓路, 杜以帅, 王鹏, 等. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响. 中国海洋大学学报(自然科学版), 2009, 39(6): 1188-1192] | |
| Johnson PT. The coelomic elements of sea urchins (Stron glyocentrotus). 3. In vitro reaction to bacteria. Journal of Inver tebrate Pathology, 1969, 13(1): 42-62 | |
| Kudriavtsev I, Polevshchikov A. Comparative immunological analysis of echinoderm cellular and humoral defense factors. Zhurnal Obshchei Biologii, 2004, 65(3): 218-231 | |
| Li CL, Song AH, Hu W, et al. Status analysis and sustainable development strategy of sea cucumber Apostichopus japonicus selenka aquaculture industry in Shandong Province. Progress in Fishery Sciences, 2010, 31(4): 126-132 [李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策. 渔业科学进展, 2010, 31(4): 126-132] | |
| Li DT, Xie GC, Li HF. Effects of two lectins from Undaria pinnatifida and Scytosiphon lomentarius on the activities of immunoenzymes in Apostichopus japonicas. Journal of Fisheries of China, 35(4): 524-530 | |
| 李丹彤, 谢广成, 李洪福. 裙带菜和萱藻凝集素对刺参组织主要免疫酶活性的影响. 水产学报, 35(4): 524-530 | |
| Liu XJ, Zhou Y, Yang HS, et al. Evaluation of eelgrass debris as a food source for Apostichopus japonicas. Marine Sciences, 2013, 37(10): 32-38 [刘旭佳, 周毅, 杨红生, 等. 大叶藻碎屑作为刺参食物来源的实验研究. 海洋科学, 2013, 37(10): 32-38] | |
| Nichols TL, Whitehouse CA, Austin FE. Transcriptional analysis of a superoxide dismutase gene of Borrelia burgdorferi. Fems Microbiology Letters, 2000, 183(1): 37-42 DOI:10.1111/fml.2000.183.issue-1 | |
| Ren XF, Bo AX, Zhang P, et al. Effects of chitosan on water quality and non-specific immune enzyme of Procambarus clarkii postlarvae. Jiangsu Agricultural Sciences, 2013, 41(9): 202-204 [任秀芳, 柏爱旭, 张萍, 等. 壳聚糖对水质和克氏原螯虾仔虾非特异性免疫酶的影响. 江苏农业科学, 2013, 41(9): 202-204] | |
| Shi YH, Zhang GY, Zhang HM, et al. Effects of compound feed and live feed on the growth, survival, and the activities of digestive enzyme, nonspecific immunity enzyme, metabolic enzyme, and antioxidant enzyme of young fish Coilia nasus. Journal of Fisheries of China, 2014, 38(12): 2030-2038 [施永海, 张根玉, 张海明, 等. 配合饲料和活饵料对刀鲚幼鱼生长、存活和消化酶、非特异性免疫酶、代谢酶及抗氧化酶活性的影响. 水产学报, 2014, 38(12): 2030-2038] | |
| Tian XL, Zhao K, Wang J, et al. Influence of water additive and feed supplementary Bacillus cereus on the growth and activity of digestive and immune relating enzyme of sea cucumber. Periodical of Ocean University of China (Natural Science), 2015, 45(1): 18-25 [田相利, 赵坤, 王军, 等. 泼洒和投喂芽孢杆菌对刺参生长以及消化和免疫相关酶活性的影响. 中国海洋大学学报(自然科学版), 2015, 45(1): 18-25] | |
| Wang JQ, Zhang K, Jiang YS, et al. Effects of dietary supplementation of coated amino acids as sea weed meal substitution on the growth, dietary digestibility and immune indices of juvenile sea cucumber Apostichopus japonicus Selenka. Marine Sciences, 2010, 34(9): 36-43 [王吉桥, 张坤, 姜玉声, 等. 在无藻粉饲料中添加包膜氨基酸对幼刺参生长、消化和免疫指标的影响. 海洋科学, 2010, 34(9): 36-43] | |
| Wang JZ, Zhang J. Advances in the polysaccharide in roots neck of sweet potato. Journal of Shangqiu Vocational and Technical College, 2007, 6(2): 90-92 [王建中, 张霁. 甘薯根茎多糖研究进展. 商丘职业技术学院学报, 2007, 6(2): 90-92] | |
| Wang WL, Du FL, Xu TC. Research about nutrition, deve lopment and utilization of the leaves and stems of sweet potato. Food and Nutrition in China, 2009(7): 29-31 [王文亮, 杜方岭, 徐同成. 甘薯茎叶的营养价值及其开发利用研究. 中国食物与营养, 2009(7): 29-31] | |
| Wang WX, Bai Y, Hou WJ, et al. Application of Eichhornia crassipes sioms in Apostichopus japonicus feed. Cereal and Feed Industry, 2013(8): 51-54 [王维新, 白燕, 侯文久, 等. 凤眼莲在刺参饲料中的应用研究. 饲料及饲养试验, 2013(8): 51-54] | |
| Wang XC, Hu XS, Wang JZ. Study on polysaccharide extracting technology from stem of sweet potato (Ipomoea batatas (L. ) Lam.). Journal of Agricultural University of Hebei, 2005, 28(2): 51-60 [王宪昌, 呼晓姝, 王建中. 甘薯Ipomoea batatas (L. ) Lam.茎蔓多糖提取技术研究.河北农业大学学报, 2005, 28(2): 51-60] | |
| Wang YN, Mu XH, Feng NS, et al. Analysis of phenoloxidase activity in the coelomic fluid of sea cucumber Apostichopus japonicas. Journal of Dalian Ocean University, 2013, 28(4): 319-322 [王轶南, 穆晓虎, 封妮莎, 等. 仿刺参体腔液中酚氧化酶活性的分析. 大连海洋大学学报, 2013, 28(4): 319-322] | |
| Wu J. Nutrition and utilization of sweet potato. Grain and Oil, 2004(1): 18-19 [伍军. 红薯营养保健价值及综合利用. 粮食与油脂, 2004(1): 18-19] | |
| Xu LQ, Lu J, Ge LL, et al. Bacteriostasis of polysaccharides extractive of sweet potato stem and leaf. Food Science and Technology, 2011, 36(1): 163-166 [徐龙权, 陆军, 葛丽丽, 等. 红薯茎叶多糖提取物抑菌研究. 食品科技, 2011, 36(1): 163-166] | |
| Zhang DR, Zhang LM, Ma JJ, et al. Effect of dietary Dried Distiller's Grains with Solubles (DDGS) on the growth, body composition, and immune enzymes activities of sea cucumber (Apostichopus japonicus). Progress in Fishery Sciences, 2016, 37(6): 115-122 DOI:10.11758/yykxjz.20150811001 [张德瑞, 张利民, 马晶晶, 等. 配合饲料中添加玉米DDGS对刺参(Apostichopus japonicus)生长、体组成及免疫指标的影响. 渔业科学进展, 2016, 37(6): 115-122] | |
| Zhang RQ, Chen QX, Zheng WZ, et al. Inhibition kinetics of green crab (Scylla serata) alkaline phosphatase activity by dithiothreitol or 2-mercptoethanol. International Journal of Biochemistry and Cell Biology, 2000, 32(8): 865-872 DOI:10.1016/S1357-2725(00)00030-3 | |
| Zhao B, Hu W, Li CL, et al. Nutrition components analysis of two feedstuffs from sweet potato and effects on feeding and growth of sea cucumber Apostichopus japonicus. Progress in Fishery Sciences, 2016, 37(1): 80-86 DOI:10.11758/yykxjz.20150514001 [赵斌, 胡炜, 李成林, 等. 两种甘薯饲料原料的营养成分及其对仿刺参(Apostichopus japonicus)摄食与生长的影响. 渔业科学进展, 2016, 37(1): 80-86] |



