2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006
2. Shandong Marine Resource and Environment Research Institute, Shandong Province Key Laboratory of Restoration for Marine Ecology, Yantai 264006
随着农业现代化的发展,越来越多的农药被应用于农业生产中,除草剂作为农药的重要组成部分一直被广泛使用。在施药过程中,真正作用于作物上的农药仅占施用量的10%-30%,其余全部进入土壤、大气、湖泊和海洋,进而对海洋环境及海产品产生影响。由于除草剂大多数具有一定的残效期,并且在生物体内富集,因此,其对生态环境和食品安全的影响已经引起世界各国的广泛关注。Zupan等(2003)研究表明,环境水体中的阿特拉津(Atrazine)会对蚌(Anodonta woodianawoodiana)产生慢性肝毒素作用,并会在鲫鱼(Carassius auratus)体内产生富集效应(陈家长等, 2009)。Danion等(2012、2014) 对长期暴露于二甲戊乐灵的120头虹鳟鱼(Oncorhynchus mykiss)的解毒过程和抗氧化防御系统进行了评估,结果表明,腮和肝脏由于长期接触产生了抗氧化防御。生物体中除草剂还可以通过食物链进入人体影响健康。其中,阿特拉津易危害人体生殖系统和心血管系统,对哺乳动物有致癌与免疫毒性作用(储晓刚, 2007)1),氟乐灵会对大鼠(Rattus norvegicus)肝、肾微粒体酶产生影响。目前,动物源性水产品中除草剂残留的检测主要集中在单一物质上,对于多残留同时检测相对较少,并且动物源性水产品中仅有9种三嗪类除草剂(张华威等,2015)可进行同时检测,研究内容还不够完善。随着国民生活水平的提高和近年来食品安全事件的频发,人们对于食品安全的关注度也在不断提高,而我国尚未制定动物源性水产品中除草剂的标准分析方法和残留限量,因此,建立动物源性水产品中除草剂的多残留检测方法非常必要。本研究拟采用凝胶渗透色谱与固相萃取法联合对样品进行净化处理,气相色谱-质谱联用法对动物源性水产品中16种除草剂进行同时检测,以期达到更好的净化及分离检测目标化合物的目的。
1) Chu XG. Study on qualitative and quantitative analysis technology for herbicide residues in soybean. Doctoral Dissertation of Jiangnan University, 2007, 8-20 [储晓刚.大豆中除草剂残留定性定量检测技术研究.江南大学博士研究生学位论文, 2007, 8-20]
1 材料与方法 1.1 仪器与试剂6890N/5973N气相色谱-质谱联用仪:美国Agilent公司;Milli-Q Gradient超纯水仪:法国Millipore公司;KQ-600E超声波清洗器:昆山市超声仪器有限公司;H2050R冷冻离心机:长沙湘仪离心机仪器有限公司;Laborota 4001旋转蒸发仪:德国Heidolph公司;Accuprep Mps凝胶色谱仪:美国J2 Scientific公司;N-EVAPTM112氮吹仪:美国Organomation Associates公司。
乙酸乙酯、丙酮、甲醇、正己烷(色谱纯):美国Merck公司;二氯甲烷(色谱纯):美国J.T.Baker公司;环己烷(色谱纯):美国Tedia公司;实验用水均为去离子水。
乙草胺(Acetochlor)、异丙甲草胺(Metolachlor)、丙草胺(Pretilachlor)、丁草胺(Butachlor)、甲草胺(Alachlor)、二甲戊乐灵(Pendimethalin)、环草津(Cyprazine)、扑草净(Prometryn)、西玛津(Simazine)、阿特拉津、西草净(Simetryn)、莠灭净(Ametryn)、草净津(Cyanizine)、特丁津(Terbutylazine)、扑灭津(Propazine)和敌草净(Desmetryn)标准品,德国Dr. Ehrenstorfer公司产品。16种目标物的结构式见图 1。
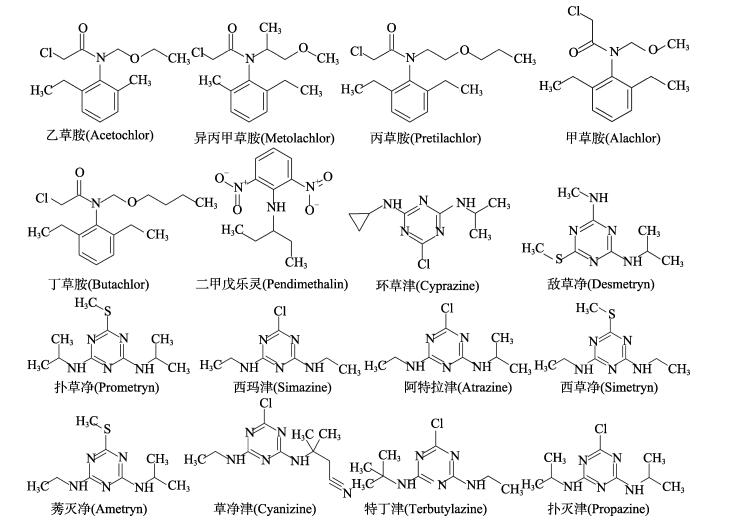
|
图 1 16种除草剂结构式 Figure 1 Chemical structures of 16 herbicides |
标准溶液的配制:准确称取0.01 g标准品,用甲醇溶解,定容至100 ml,配制成100 mg/L标准储备液,使用前用乙酸乙酯稀释至所需质量浓度。
凝胶色谱柱:玻璃柱(300 mm×25 mm);凝胶填料:Bio Beads(S-X3),200-400目,25 g;固相萃取柱:Oasis HLB(60 mg/3 ml),Waters公司。
1.2 样品前处理称取5 g(精确到0.01 g)匀浆后的样品于50 ml塑料离心管中,加入25 ml二氯甲烷-乙酸乙酯(2:3, v/v),摇匀后超声提取20 min,冷冻离心机10℃下4000 r/min离心20 min,将上清液转移至150 ml鸡心瓶中,再加入20 ml二氯甲烷-乙酸乙酯(2:3, v/v)重复提取1次,合并上清液,于40℃旋转蒸干后,使用环己烷-乙酸乙酯(1:1, v/v)复溶并定容至10 ml,然后通过凝胶色谱仪净化,凝胶色谱条件:流动相为环己烷-乙酸乙酯(1:1, v/v);流速4.7 ml/min;流出液收集时间为8-23 min。收集流出液并于40℃旋转蒸干,以1 ml甲醇复溶,加入20 ml水待固相萃取净化,HLB小柱用3 ml甲醇、3 ml水活化,样品过柱后以3 ml水淋洗,5 ml正己烷-丙酮(1:1, v/v)洗脱,收集洗脱液,于氮吹仪上40℃吹至近干,用乙酸乙酯定容至0.5 ml,上机测定。
1.3 仪器条件 1.3.1 色谱条件色谱柱:J & W DB-17石英毛细柱(30 m×0.25 mm, 0.25 µm);升温程序:50℃保持1 min,以20℃/min升至200℃,保持10 min,再以10℃/min升至240℃,最后以30℃/min升至300℃,保持3 min;载气(He)流速1.0 ml/min;进样口温度260℃,不分流进样,进样量1 µl。
1.3.2 质谱条件电子轰击离子源;电子能量70 eV;接口温度280℃;离子源温度230℃;四极杆温度:150℃;溶剂延迟10 min,选择离子监测(SIM)模式。
2 结果与分析 2.1 特征离子的选择分别对16种目标物的标准溶液进行全扫描,得到16种目标物在本实验条件下的质谱图,选择丰度高、干扰少的离子作为特征离子。初步建立SIM模式的测定方法,再根据样品基质干扰情况对所选择的特征离子进一步优化,以丰度高、没有干扰的离子作为定量离子,建立完整的SIM模式的测定方法。16种目标物的定性、定量离子见表 1。
|
|
表 1 16种除草剂的保留时间、监测离子、线性方程、相关系数及检出限(LOD)、定量限(LOQ) Table 1 Retention time, monitoring ions, linear equations, correlation coefficient, limit of detection and limit of quantification of 16 triazine herbicides |
气相色谱-质谱测定方法定性的依据首先是保留时间,柱温是影响目标物保留时间的关键参数,程序升温是多组分同时测定的常用方式。本研究对柱升温程序进行了优化,使16种物质得到了很好的分离,峰形良好,且有效避免了样品中杂质的干扰。标准溶液总离子流图见图 2。海湾扇贝(Argopecten irradias)全贝空白及其加标样品总离子流图见图 3、图 4。

|
图 2 标准溶液总离子流 Figure 2 Total ions chromatogram of 16 herbicides (40.0 μg/L) 1:扑灭津;2:阿特拉津;3:特丁津;4:西玛津;5:乙草胺;6:甲草胺;7:环草津;8:敌草净;9:扑草净;10:莠灭净;11:异丙甲草胺;12:西草净;13:二甲戊乐灵;14:丁草胺;15:草净津;16:丙草胺,同图 4 1: Propazine; 2: Atrazine; 3: Terbutylazine; 4: Simazine; 5: Acetochlor; 6: Alachlor; 7: Cyprazine; 8: Desmetryn; 9: Prometryn; 10: Ametryn; 11: Metolachlor; 12: Simetryn; 13: Pendimethalin; 14: Butachlor; 15: Cyanizine; 16: Pretilachlor, the same as Fig. 4 |
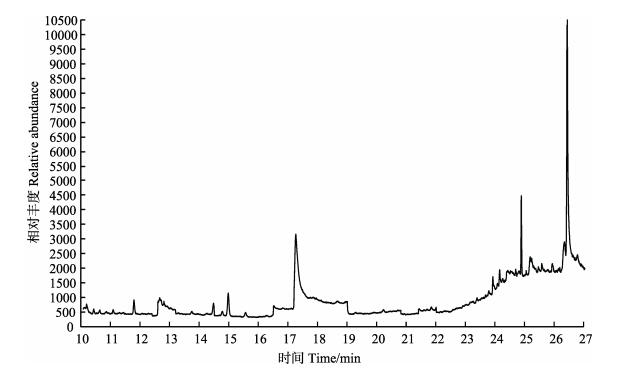
|
图 3 海湾扇贝全贝空白样品总离子流 Figure 3 Chromatograms of blank sample of scallop |

|
图 4 海湾扇贝全贝加标样品总离子流图(加标量16种目标物分别为10 μg/kg) Figure 4 Chromatograms of spiked sample of scallop(Spiked level: 10 μg/kg, respectively) |
取二甲戊乐灵、草净津质量浓度分别为4、10、20、40、100、200 μg/L,其余14种目标物质量浓度分别为2、5、10、20、40、100 μg/L的混合标准工作溶液,在上述优化的色谱、质谱条件下进行分析。以定量离子峰面积为纵坐标,对应的质量浓度为横坐标进行线性回归分析,以信噪比(S/N)≥3计算检出限(LOD),信噪比(S/N)≥10且回收率在70%-120%范围内计算定量限。结果表明,二甲戊乐灵、草净津在4-200 μg/L质量浓度范围内与其响应值呈良好的线性关系,相关系数(r)不低于0.9970,其余14种在2-100 μg/L质量浓度范围内与其响应值呈良好的线性关系,相关系数(r)不低于0.9970,16种目标物的检出限、线性方程、相关系数见表 1。
2.4 回收率与精密度称取若干海参(Apostichopus japonicus)、海湾扇贝空白样品5 g (精确到0.01 g),分别取100 μg/L的混合标准工作溶液250、500、1000 μl添加到空白样品中,进行5、10、20 μg/kg共3种质量浓度水平的加标回收实验。以海湾扇贝为例,平行测定6次,结果见表 2。从表 2可以看出,3个加标质量浓度下,加标回收率的范围为67.2%-103.0%,相对标准偏差在5.1%-9.5%之间,表明该方法的精密度和准确度符合残留分析的要求。
|
|
表 2 16种除草剂的平均加标回收率及相对标准偏差(n=6) Table 2 Average recovery rates and relative standard deviation (RSD) of 16 herbicides in aquatic products (n=6)(%) |
用本方法检测了2015年11月部分海参、牡蛎(Crassostrea gigas)、栉孔扇贝(Chlamys gloriosa)等水产品中除草剂残留量,检出率最高的是莠灭净,其次是扑草净、阿特拉津、西草净、乙草胺(表 3)。
|
|
表 3 水产品样品中除草剂残留量 Table 3 Detections of herbicide residues in aquatic products |
用于除草剂的提取剂主要有正己烷(李晓玉等, 2011; 陈溪等, 2013)、乙酸乙酯(宋业萍等, 2014; 兰腾芳等, 2013)、乙腈(王莉等, 2014; 王建华等, 2007)、丙酮、二氯甲烷及其混合溶剂(张华威等, 2015)等,不同的样品基质与目标物提取剂的种类也不同。本研究在此基础上,针对所检测的除草剂均有一定极性的特点,根据相似相溶原理,选择有极性的溶剂作为提取剂。由于动物源性水产品样品水分含量一般较高,用乙腈或丙酮提取,提取液中会含有大量水分,后期浓缩困难,因此,选用乙酸乙酯、二氯甲烷进行提取实验,结果表明,乙酸乙酯对三嗪类除草剂提取效果好,但部分酰胺类除草剂回收率不能满足要求;二氯甲烷对酰胺类和二硝基苯胺类除草剂提取效果较好,而部分三嗪类除草剂回收率低。因此,尝试采用乙酸乙酯、二氯甲烷混合溶剂进行提取,由于二氯甲烷密度较大,混合溶剂中二氯甲烷所占比例高,会导致离心后提取液分离困难,经实验,采用二氯甲烷-乙酸乙酯(2:3, v/v)得到了很好的提取效果,且离心后容易分离得到提取液。
3.2 净化方法的选择动物源性水产品样品基质复杂,待测物含量很低,提取液需经过充分的净化才能提高检测的灵敏度。用于除草剂残留检测的净化方法主要有固相萃取法(李孝军等, 2011, 刘慧慧等, 2012)、凝胶渗透色谱法(刘栋等, 2013; 屠海云等, 2010)、基质固相分散法(Li et al, 2015; Rodríguez-González et a, 2014、2015) 等。固相萃取是一种基于色谱分离的样品前处理技术,近几年在国内迅速普及,已成为残留检测中重要的净化方法,通过选择适当的固相萃取柱及过柱方法,使目标物得到有效的富集和净化,从而提高分析的灵敏度,延长分析仪器的使用寿命。HLB固相萃取柱填料是一种新型大孔聚合物,既有亲脂性的官能团,具有反相吸附特性,又有亲水性的官能团,具备保留极性化合物的能力,并且容量比传统的C18填料高很多,目前已广泛应用。然而,动物源性水产品中含有较多的蛋白质、脂肪等大分子物质,单采用HLB固相萃取柱,在本研究的淋洗和洗脱条件下,对16种除草剂的净化不够充分。凝胶渗透色谱净化已成为近年来常用的净化技术,能有效去除样品提取液中的大分子干扰物质。然而,本研究样品提取液经凝胶净化后,仍含有部分杂质,给目标物的测定带来干扰,因此,将凝胶色谱净化与固相萃取净化联合使用,在凝胶净化后,采用HLB固相萃取柱进一步净化,2种不同原理的分离过程互为补充,去掉了大部分的干扰物质,提高了目标物的信噪比,从而保证了方法的灵敏度。
3.3 基质效应对检测结果的影响基质效应对GC-MS测定中等和强极性物质有很大的影响,也是目前残留检测中常遇到的问题之一,基质匹配标准溶液虽能有效解决基质效应问题,但对每种样品使用与其基质匹配的标样,在检测任务繁重的常规实验室中应用起来并不实际,本研究通过先进样品后进标准的方式来解决基质效应问题,使16种待测组分回收率在67.2%-103.0%、相对标准偏差5.1%-9.5%,满足残留检测的要求。
4 结论本研究建立了动物源性水产品中16种除草剂的GC/MS测定方法。样品经乙酸乙酯-二氯甲烷混合溶剂提取、依次用凝胶色谱和固相萃取法净化,GC/MS选择离子监测模式测定。该方法重现性好,回收率高,在精密度、准确度方面能满足残留检测要求,同时为进一步探讨除草剂污染对水产品质量安全的影响打下基础。
| Chen JZ, Meng SL, Hu GD, et al. Bioaccumulation of herbicide atrazine in Carassius auratus. Journal of Agro-Environment Science, 2009, 28(6): 1313-1318 [陈家长, 孟顺龙, 胡庚东, 等. 鲫鱼对除草剂阿特拉津的生物富集效应研究. 农业环境科学学报, 2009, 28(6): 1313-1318] | |
| Chen X, Liu MY, Qu SH, et al. Determination of Prometryne residues in seafood, sediment, seawater by liquid chromatography Tandem Mass Spectrocmetry. Chemistry, 2013, 76(2): 183-186 [陈溪, 刘梦遥, 曲世超, 等. 海产品、底泥、海水中扑草净药物残留量的液相色谱-串联质谱检测. 化学通报, 2013, 76(2): 183-186] | |
| Danion M, Floch SL, Kanan R, et al. Effects of in vivo chronic exposure to pendimethalin/Prowl 400® on sanitary status and the immune system in rainbow trout (Oncorhynchus mykiss). Science of the Total Environment, 2012, 424(4): 143-152 | |
| Danion M, Floch SL, Lamour F, et al. Effects of in vivo chronic exposure to pendimethalin on EROD activity and antioxidant defenses in rainbow trout (Oncorhynchus mykiss). Ecotoxicology and Environmental Safety, 2014, 99(1): 21-27 | |
| Lan TF, Zheng ZT, Li W, et al. Simultaneous determination of residues of eight amide herbicides in fresh ginger. Chinese Journal of Pesticide Science, 2013, 15(1): 113-116 [兰腾芳, 郑尊涛, 李薇, 等. 生姜中8种酰胺类除草剂残留的分析方法. 农药学学报, 2013, 15(1): 113-116] | |
| Li N, Wu LJ, Li N, et al. Dynamic microwave assisted extraction coupled with dispersive micro-solid-phase extraction of herbicides in soybeans. Talanta, 2015, 142: 43-50 DOI:10.1016/j.talanta.2015.04.038 | |
| Li XJ, Lin XJ, Wang YN, et al. Determination of residual trifluralin in Eel by UPLC. Chinese Journal of Veterinary Drug, 2011, 45(5): 17-19 [李孝军, 林仙军, 王亚楠, 等. 超高效液相色谱法测定鳗鱼中氟乐灵残留量. 中国兽药杂志, 2011, 45(5): 17-19] | |
| Li XY, Fu J, Sui T, et al. Determination of trifluralin residues in imported and exported aquatic products by gas chromatography-mass spectrometry. Food Science, 2011, 32(16): 315-317 [李晓玉, 付建, 隋涛, 等. 气相色谱-质谱联用检测进出口水产品中氟乐灵残留. 食品科学, 2011, 32(16): 315-317] | |
| Liu D, Li RJ, Chen XD, et al. Determination of prometrynresidues in shellfish by gel permeation chromatography purification-high performance liquid chromatography-tandem mass spectrometry. Food Research and Development, 2013, 34(24): 205-208 DOI:10.3969/j.issn.1005-6521.2013.24.055 [刘栋, 李蓉娟, 陈晓东, 等. GPC-HPLC-MS/MS法检测贝类中扑草净残留. 食品研究与开发, 2013, 34(24): 205-208] | |
| Liu HH, Ren CB, Gong XH, et al. Determination of trifluralin residues in aquatic products by Gas Chromatography. Food Science, 2012, 33(22): 214-216 [刘慧慧, 任传博, 宫向红, 等. 气相色谱法测定水产品中的氟乐灵. 食品科学, 2012, 33(22): 214-216] | |
| Rodríguez-González N, González-Castro M J, Beceiro-González E. Development of a matrix solid phase dispersion methodology for the determination of triazine herbicides in mussels. Food Chemistry, 2015, 173: 391-396 DOI:10.1016/j.foodchem.2014.09.153 | |
| Rodríguez-González N, González-Castro MJ, Beceiro-González E, et al. Determination of triazine herbicides in seaweeds: Development of a sample preparation method based on matrix solid phase dispersion and solid phase extraction clean-up. Talanta, 2014, 121: 194-198 DOI:10.1016/j.talanta.2013.12.063 | |
| Song YP, Zong WL, Yu ZF, et al. Determination of prometryne residue in shellfish by gas chromatography. Journal of Hygiene Research, 2014, 43(5): 790-792 [宋业萍, 宗万里, 于忠飞, 等. 气相色谱法测定贝类中扑草净的残留量. 卫生研究, 2014, 43(5): 790-792] | |
| Tu HY, Jiang H, Li W. Determination of fice herbicide residues in cereals by gas chromatography-mass spectrometry. Food Science, 2010, 31(16): 217-219 [屠海云, 姜荷, 李玮. 气相色谱-质谱法测定粮谷中5种除草剂残留. 食品科学, 2010, 31(16): 217-219] | |
| Wang JH, Chu XG. Determination of residual acetochlor in peanut by gel permeation chromatography and gas chromatography/mass spectrometry. Chinese Journal of Analysis Laboratory, 2007, 26(12): 31-34 DOI:10.3969/j.issn.1000-0720.2007.12.008 [王建华, 储晓刚. 凝胶渗透色谱-气相色谱-质谱测定花生中乙草胺的残留量. 分析试验室, 2007, 26(12): 31-34] | |
| Wang L, Xia GH, Shen WJ, et al. Determination of trifluralin residue in aquatic products and edible oils by gas chromatography-negative chemical ionization mass spectrometry. Chinese Journal of Chromatography, 2014, 32(3): 314-317 [王莉, 夏广辉, 沈伟健. 气相色谱-负化学源质谱联用法测定水产品及食用油中氟乐灵的残留量. 色谱, 2014, 32(3): 314-317] | |
| Zhang HW, Liu HH, Tian XH, et al. Determination of 9 triazine herbicides in aquatic products by GPC-SPPE-GC-MS/MS. Journal of Chinese Mass Spectrometry Society, 2015, 36(2): 177-184 DOI:10.7538/zpxb.youxian.2014.0054 [张华威, 刘慧慧, 田秀慧, 等. 凝胶色谱-固相萃取-气相色谱-串联质谱法测定水产品中9种三嗪类除草剂. 质谱学报, 2015, 36(2): 177-184] | |
| Zupan I, Kalafatic M. Histological effects of low atrazine concentration on zebra mussel (Dreissena polymorpha Pallas). Bulletin of Environmental Contamination and Toxicology, 2003, 70(4): 688-695 DOI:10.1007/s00128-003-0039-8 |



