2. 上海海洋大学水产与生命学院 上海 201306;
3. 浙江省淡水水产研究所 湖州 313001
2. College of Aquatic and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Zhejiang Institute of Freshwater Fisheries, Huzhou 313001
拟穴青蟹(Scylla paramamosain)是广泛分布在我国沿海地区的青蟹属优势种(林琪等, 2007),因其适应力强、肉质鲜美、营养丰富,成为高经济价值的理想养殖种类。近些年,随着人工养殖规模的扩大,弧菌病、黑斑病、黄水病等细菌性疾病的暴发屡见不鲜,严重威胁到青蟹的健康养殖和发展(黄诗婷等, 2012)。复方磺胺嘧啶粉是我国国标渔用抗菌药物之一(中华人民共和国兽药典, 2011),适用于海水虾蟹细菌病防治,科学合理地使用抗菌药已经成为防治水产细菌病的重要手段。国内外有关复方磺胺嘧啶(磺胺嘧啶SD:甲氧苄啶TMP=5:1) 在畜禽动物体内药动学的研究报道较多(Gustafsson et al, 1999; Baert et al, 2001; Abu-Basha et al, 2009; 钱建中等, 2013; Nouws et al, 1993; 肖贺等, 2014; 王伟利等, 2016),在水产动物中相对较少且主要集中在鱼类,如复方磺胺嘧啶静脉注射给药下在鲤鱼(Cyprinus carpio L.)体内(Nouws et al, 1993)、单剂量(肖贺等, 2014)和多剂量(王伟利等, 2016)药饵给药下在罗非鱼(Oreochromis niloticus)体内和鳜鱼(Siniperca chuatsi)体内等药动学和组织消除规律(Wang et al, 2016),在水生甲壳动物中仅见SD在中国对虾(Fenneropenaeus chinensis)体内药动学的报道(李金宝等, 2014、2015)。我国水产养殖种类繁多,而国标渔药中规定的用药方案和休药期十分笼统,并未考虑鱼虾蟹等不同水产动物之间的差异,亟需更多实验来指导药物的合理有效使用。本文研究了单剂量口灌复方磺胺嘧啶在拟穴青蟹体内药动学,了解SD和TMP在拟穴青蟹体内的吸收、代谢过程以及在鳃、肌肉和肝胰腺中的分布和消除规律,为药物的安全有效使用提供基础数据。
1 材料与方法 1.1 实验材料和试剂拟穴青蟹采购于上海崇明某养殖场,未使用过SD和TMP。暂养于盐度为10、水温为(27±1)℃的人工低盐度海水中,水体pH为8.2-8.5,保持24 h充气,期间投喂新鲜螺蛳肉,7 d后挑选健康、体重为(140±20) g的青蟹用于实验。
SD和TMP标准品(纯度≥99.5%)购于德国Dr. Ehrenstorfer公司,SD和TMP原粉(纯度≥98.0%)购于潍坊三江医药集团。甲醇、乙腈和正己烷均为HPLC级,德国Merck公司产品;乙酸为优级纯,乙酸铵为分析纯,均购自国药集团上海化学试剂公司。
1.2 仪器和设备高效液相色谱仪(Waters 2695, 美国);紫外检测器(Waters 2487, 美国);色谱柱为Aglient Zorbax SB-C18(4.6 mm×150 mm,5 μm)(Aglient, 美国);超纯水仪(Millipore Milli-Q Advantage, 美国);电子分析天平(Mettler Toledo AL204, 瑞士);高速冷冻离心机(HITACHI CF16RXⅡ, 日本);微量移液器(Eppendorf, 德国);0.22 μm针式过滤器(Rephile, 中国)。
1.3 给药和取样准确称取8.33 g SD原粉和1.67 g TMP原粉,与适量精细研磨鱼粉混合均匀,加水至200 ml,搅拌成50 mg/ml(SD+TMP)糊状药饵。复方磺胺嘧啶(SD:TMP=5:1) 给药剂量为100 mg/kg蟹体重,每只蟹称重后计算口灌药饵量,用1 ml注射器(连接尖端磨钝12#针头)从蟹口器插入约1.5 cm,灌入到胃中,口灌后不漏液、不反吐的蟹用于实验采样。
采样时间为口灌给药后0.5、1、2、4、8、12、24、48、96、192、240、360、480、600 h,每个时间点采样6只。用1 ml注射器从关节膜抽取血淋巴0.5–0.8 ml以上,转移到装有0.001 g草酸铵的2 ml离心管,振荡混匀,5000 r/min离心5 min,取上清液保存;取出鳃、肌肉和肝胰腺装入塑料密封袋。样品贮存于-40℃低温冰箱中,留待药物分析。
1.4 样品前处理血淋巴样品置室温解冻后,10000 r/min离心5 min,取0.4 ml上清液于2 ml离心管中,加入3倍体积乙腈,涡旋振荡2 min后,12000 r/min离心5 min,取上清液转移至5 ml离心管中,40℃水浴氮吹,吹干后加入0.4 ml流动相复溶,经0.22 μm微孔滤膜过滤,滤液用于HPLC分析。
肌肉、肝胰腺和鳃样品室温解冻后,取适量样品于均质器中均质;准确称取均质后样品1.00 g于10 ml离心管中,加入5 ml乙腈,振荡5 min,于10000 r/min转速离心5 min,收集上清液;残渣再重复提取2次,合并3次上清液于100 ml具塞茄形蒸发瓶中,于40℃旋蒸至干;加入1 ml流动相和1 ml正己烷,盖上塞子置超声波清洗仪超声15 min,瓶底残留物完全溶解,将混合液体转移至2 ml离心管中,12000 r/min离心5 min,吸取下层液体,经0.22 μm微孔滤膜过滤,滤液用于HPLC分析。
1.5 色谱条件流动相:乙腈和0.01 mol/L乙酸铵(乙酸调节pH为3.8);柱温为35℃;进样量为10 μl,流速为1.0 ml/min;紫外检测器波长为245 nm。为使药峰和杂峰更好分开,不同组织样品的流动相比例有所不同,血浆和肌肉的流动相比例为乙腈:0.01 mol/L乙酸铵(pH为3.8)=12:88(V/V),肝胰腺和鳃的流动相比例为13:87(V/V)。
1.6 数据处理拟穴青蟹血药浓度-时间关系曲线方程采用房室模型进行拟合分析,血淋巴、肌肉、鳃和肝胰腺的药动学参数采用统计矩原理推算。模型拟合和药动学参数推算采用药物与统计软件(DAS 3.1) 进行分析,休药期(WDT)采用WT1.4软件进行计算(栗柱等, 2003)。
2 结果 2.1 口灌给药后拟穴青蟹血淋巴中SD、TMP药动学 2.1.1 口灌给药后拟穴青蟹血淋巴中SD、TMP浓度-时间曲线关系复方磺胺嘧啶口灌给药后,拟穴青蟹血淋巴中SD、TMP浓度与时间关系曲线见图 1。从图 1可以看出,给药后血淋巴中SD浓度快速升高,4 h达到最高,峰浓度(Cmax)为49.56 mg/L;随后开始快速下降,24 h已经低于峰浓度的1/2,48 h后进入缓慢消除阶段,240 h低于0.1 mg/L。口灌给药后TMP浓度变化趋势与SD相似,但Cmax远低于SD,为2.79 mg/L,达峰时间(Tmax)为2 h;给药后240 h,血淋巴TMP浓度低于0.05 mg/L。
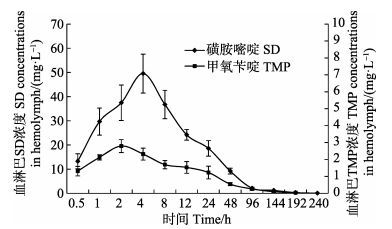
|
图 1 方磺胺嘧啶药饵给药后拟穴青蟹血淋巴药物浓度-时间关系曲线(n=6) Figure 1 SD and TMP concentration-time curve in hemolymph of S. paramamosain following oral administration (n=6) |
采用房室模型对血淋巴SD、TMP浓度与时间关系曲线进行拟合,血药浓度-时间关系曲线均适合采用一级吸收二室模型来描述,拟合的药动学方程为:
| $\begin{gathered} {\text{SD}}:\quad {C_t} = 184.943{e^ - }^{0.300t} + 29.228{e^ - }^{0.025{\text{ }}t} \hfill \\ \begin{array}{*{20}{l}} {\quad \quad \quad \;\;\; - 219.426{e^ - }^{0.458t}\quad \;\;\left( {{R^2} = 0.986} \right)} \\ {{\text{TMP}}:\quad {C_t} = 2.191{e^ - }{{^{0.171}}^t} + 1.356{e^ - }^{0.020t}} \\ {\quad \quad \quad \;\;\; - 4.256{e^ - }^{1.463t}\quad \;\;\left( {{R^2} = 0.989} \right)} \end{array} \hfill \\ \end{gathered}$ |
用统计矩原理对血淋巴药物浓度与时间关系进行药动学分析,所得参数见表 1。
|
|
表 1 磺胺嘧啶和甲氧苄啶在拟穴青蟹血淋巴中药动学参数 Table 1 Pharmacokinetic parameters of SD and TMP in hemolymph of S. paramamosain |
拟穴青蟹肝胰腺、鳃和肌肉中SD浓度与时间关系曲线见图 2。从图 2可以看出,拟穴青蟹肌肉、鳃和肝胰腺中SD浓度变化趋势与血淋巴相似,都呈现出给药后迅速升高至峰浓度,随后开始下降。肝胰腺、鳃和肌肉中SD峰浓度分别为44.95、51.89和59.36 mg/kg,Tmax均为4 h;给药后240 h肌肉和鳃中SD残留低于0.10 mg/kg,给药后360 h肝胰腺中SD残留低于0.10 mg/kg。
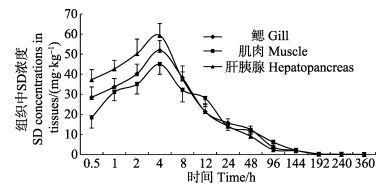
|
图 2 药饵给药后拟穴青蟹组织中磺胺嘧啶浓度-时间关系曲线(n=6) Figure 2 SD concentration-time curve in tissues of S. paramamosain following oral administration (n=6) |
口灌给药后,拟穴青蟹肝胰腺、鳃和肌肉中TMP浓度与时间关系曲线见图 3。从图 3可以看出,TMP在不同组织中的浓度变化均呈先上升后下降趋势,但浓度差异明显。肝胰腺中TMP峰浓度最高,为74.82 mg/kg,在鳃和肌肉中的峰浓度分别为42.58 mg/kg和10.09 mg/kg,3种组织中TMP达峰时间分别为2 h、2 h和1 h;360 h后3种组织中TMP残留量均低于0.05 mg/kg。
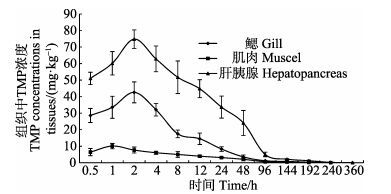
|
图 3 药饵给药后拟穴青蟹组织中甲氧苄啶浓度-时间关系曲线(n=6) Figure 3 TMP concentration-time curve in tissues of S. paramamosain following oral administration (n=6) |
采用统计矩原理对拟穴青蟹组织中SD和TMP浓度与时间关系曲线进行分析,药动学参数见表 2。
|
|
表 2 拟穴青蟹不同组织中磺胺嘧啶和甲氧苄啶的药动学参数 Table 2 Pharmacokinetic parameters of SD and TMP in the tissues of S. paramamosain |
根据中华人民共和国农业部(2002)标准[无公害食品水产品中渔药残留限量(NY5070-2002)]的规定,将SD、TMP在水产品中的最高残留限(MRL)分别设定为0.1 mg/kg和0.05 mg/kg,采用休药期计算软件WT1.4处理拟穴青蟹肌肉和肝胰腺中SD、TMP消除阶段的浓度与时间关系,设置信区间为95%,拟穴青蟹肌肉中SD和TMP的休药期分别为290.6 h和302.8 h,肝胰腺中SD和TMP的休药期分别为340.4 h和377.0 h。
3 讨论 3.1 SD和TMP在拟穴青蟹血淋巴中的药动学本研究中,采用了房室模型对血药浓度-时间关系曲线进行拟合分析,血淋巴中SD和TMP浓度-时间关系曲线均能很好地采用一级吸收二室开放模型来描述。有关复方磺胺嘧啶在水产动物体内药动学的报道较少。欧洲鳗鲡(Anguilla anguilla)口灌SD(林丽聪等, 2010)和中国对虾口服SD药饵(李金宝等, 2015),其血药浓度-时间关系均为一级吸收二室开放模型,同时还报道了磺胺二甲嘧啶(SM2)、磺胺对甲氧嘧啶(SMD)在中国对虾血淋巴中也适用二室模型描述。Fu等(2016)研究了复方新诺明在三疣梭子蟹(Portunus trituberculatus)体内的药动学,口灌给药后,血淋巴中磺胺甲唑(SMZ)的浓度-时间曲线符合二室模型。可见通过房室模型拟合分析,二室模型更适合于描述磺胺类药物在甲壳动物中的药动学过程。
达峰时间(Tmax)、峰浓度(Cmax)和曲线下面积(AUC)是有效反映药物在体内吸收快慢和程度的重要参数(王广基等, 2005)。本研究中,复方磺胺嘧啶口灌给药拟穴青蟹后,SD和TMP达峰快,与中国对虾(李金宝等, 2015)和三疣梭子蟹相似,其达峰明显快于罗非鱼(Tmax=11 h)(肖贺等, 2014)和欧洲鳗鲡(Tmax=21.5 h),这可能是与虾蟹等甲壳动物的开放式循环系统有关(Bliss, 1983)。拟穴青蟹血淋巴SD峰浓度明显高于罗非鱼和中国对虾的Cmax(分别为22.48μg/ml和1.17μg/ml),AUC大于罗非鱼和中国对虾,由此可见,拟穴青蟹对SD吸收较好。拟穴青蟹对TMP的吸收明显优于同剂量同给药途径下的三疣梭子蟹,与罗非鱼(肖贺等, 2014)较为接近,但与SD相比,TMP进入拟穴青蟹血液循环系统的量明显偏少(Cmax_SD/Cmax_TMP=17.8:1,AUC0-t_SD/AUC0-t_TMP=17.1:1),这可从TMP的表观分布容积(Vd)得到解释,Vd是反应药物在体内的分布情况,Vd值越大,药物穿透进入组织越多,分布越广,血药浓度越低(陈杖榴, 2001)。
消除半衰期和平均驻留时间是评价药物消除快慢的重要参数。拟穴青蟹血淋巴中药物消除快于中国对虾血淋巴中的SD(t1/2β= 46.45 h)、连续给药的鳜鱼(Siniperca chuatsi)血浆SD和TMP的t1/2β=68.8–139.8 h、MRT=93.3–201.7 h和t1/2β= 34.0–56.1 h、MRT= 49.1–81.0 h(Wang et al, 2016);慢于罗非鱼血液中SD的t1/2β=16.9 h,TMP的t1/2β=5.99 h(肖贺等, 2014);而与中国对虾血淋巴中SM2(t1/2β= 25.81 h) (李金宝等, 2015)、三疣梭子蟹血淋巴中SMZ和TMP的消除速率(t1/2z分别为25.12 h和44.63 h)(Fu et al, 2016)差别不大。由此可见,磺胺药物在不同动物体内的消除速率存在着种属差异,对拟穴青蟹而言,SD和TMP在其体内消除较快。
3.2 SD和TMP在拟穴青蟹组织中的分布与消除相对于人类和畜禽,水产动物可以对组织进行采样并测定其药物浓度,利于全面了解药物在动物组织中的分布和消除规律,为制定合理给药方案和休药期提供理论依据。本研究中,拟穴青蟹口灌给药后,肝胰腺是SD和TMP峰浓度和AUC最高的组织,且肝胰腺中SD消除半衰期最大,这与罗非鱼(肖贺等, 2014)的研究结果相一致,其肝脏中SD峰浓度高于血液和肌肉,但消除速率慢于后者。同为磺胺类的SD、SM2和SMD在药饵给药中国对虾后,也是肝胰腺组织中的峰浓度和AUC为最高(李金宝等, 2014);磺胺甲基异恶唑和TMP口灌给药三疣梭子蟹,同样是肝胰腺中峰浓度和AUC最大。由此可见,药饵或口灌给药途径下,大量药物在肝脏(肝胰腺)蓄积,肝脏(肝胰腺)是主要的代谢和解毒器官。值得关注的是,本研究中,TMP给药剂量仅为SD的1/5,但肝胰腺中TMP峰浓度却高于SD;此现象同样出现在三疣梭子蟹口灌SMZ和TMP、凡纳滨对虾(Litopenaeus vannamei)投喂磺胺二甲嘧啶和奥美普林(OMP)的药物代谢研究中(Park et al, 1995)。大量TMP在肝胰腺中蓄积,导致进入血液循环的TMP或OMP显著减少。与磺胺嘧啶相比,TMP和OMP不仅具有亲水的氨基基团(-NH2),而且还有亲脂的甲氧基基团(-OCH3),可见TMP和OMP具有亲水亲脂双重结构,有着很好的生物膜通透性;脂溶性越高的药物越容易透过生物膜,可以透过血脑屏障和胎盘屏障(李晓天等, 2006);再者,本研究中,TMP的表观分布容积远大于1.0 L/kg,由此可以解释肝胰腺、鳃和肌肉等组织中TMP浓度均明显高于血药浓度。
在药物组织分布中,拟穴青蟹鳃组织SD和TMP峰浓度和AUC仅次于肝胰腺,而Tmax与肝胰腺的相同,这与三疣梭子蟹中SMZ和TMP相一致(Fu et al, 2016),且鳃组织中SD和TMP消除较快;从解剖结构来看,蟹鳃由8对叶状鳃组成,每个叶状鳃上有许多鳃叶,显著增大了鳃与水接触的表面积(Bliss, 1983),由此看来,鳃很可能是药物从体内外排的重要组织。
3.3 休药期不同国家和地区对水产品中SD和TMP最高残留限量的规定是不同的。FDA、欧盟及我国农业行业标准(中华人民共和国农业部,2002)(NY5070-2002) 规定动物源食品中磺胺药的最大残留限量(MRL)为0.10 mg/kg,TMP的MRL为0.05 mg/kg。肌肉和肝胰腺是蟹可食组织,因此,本研究按SD和TMP分别为0.10 mg/kg和0.05 mg/kg的最高残留限量来计算休药期。中国兽药典——兽药使用指南中建议水产用复方磺胺嘧啶休药期500度日,但磺胺药和TMP在不同水产动物中的休药期存在着明显的种属差异,SD在鳜鱼、中国对虾(李金宝等,2014)和欧洲鳗鲡可食肌肉组织中的休药期分别为36 d、22 d和21 d,复方磺胺嘧啶在吉富罗非鱼(Oreochromis niloticus)肌肉组织中的休药期为12 d (王伟利等, 2016);本研究计算得到SD和TMP在拟穴青蟹肌肉组织中休药期分别为290.6 h和302.8 h,在肝胰腺中休药期分别为340.4 h和377.0 h,考虑到药物在水产养殖体内消除受养殖环境、健康状况、水温等因素的影响,建议复方磺胺嘧啶在拟穴青蟹体内的休药期为480 d。
| Abu-Basha EA, Gehring R, Hantash TM, et al. Pharmacokinetics and bioavailability of sulfadiazine and trimethoprim following intravenous, intramuscular and oral administration in ostriches (Struthio camelus). Journal of Veterinary Pharmacology and Therapeutics, 2009, 32(3): 258-263 DOI:10.1111/jvp.2009.32.issue-3 | |
| Baert K, Baere SDe, Croubels S, et al. Pharmacokinetics and bioavailability of sulfadiazine and trimethoprim (Trimazin 30%) after oral administration in non-fasted young pigs. Journal of Veterinary Pharmacology and Therapeutics, 2001, 24(4): 295-298 DOI:10.1046/j.1365-2885.2001.00337.x | |
| Bliss DE. The biology of crustacea. Volume 5: Internal anatomy and physiological regulation, edited by Mantel L.H. Academic Press, 1983: 3-25. | |
| Chen ZL. Veterinary Pharmacology (The second edition). Beijing: China Agricul tural Press, 2001, 3-20 [陈杖榴主编. 兽医药理学(第二版). 北京: 中国农业出版社, 2001, 3-20] | |
| Commission of Chinese Veterinary Pharmacopeia. Pharmacopoeia of the People's Republic of China Guide for the use of veterinary drugs The volume of chemical drugs 2010 Edition. Beijing: China Agricul tural Press, 2011: 374. [中国兽药典委员会编. 中华人民共和国兽药典兽药使用指南化学药品卷2010年版. 北京: 中国农业出版社, 2011: 374.] | |
| Fu GH, Peng JH, Wang Y, et al. Pharmacokinetics and pharmacodynamics of sulfamethoxazole and trimethoprim in swimming crabs (Portunus trituberculatus) and in vitro antibacterial activity against Vibrio: PK/PD of SMZ-TMP in crabs and antibacterial activity against Vibrio. Environmental Toxicology and Pharmacology, 2016, 46: 45-54 DOI:10.1016/j.etap.2016.06.029 | |
| Gustafsson A, Baverud V, Franklin A, et al. Repeated administration of trimethoprim/sulfadiazine in the orse-pharmacokinetics, plasma protein binding and influence on the intestinal microflora. Journal of Veterinary Pharmacology and Therapeutics, 1999, 22(1): 20-26 DOI:10.1046/j.1365-2885.1999.00183.x | |
| Huang ST, Chen RY, Liu KS, et al. Comparative study of aquatic bacterial community from 4 ponds farming mud crabs, Scylla paramamosain. Journal of Oceanography in Taiwan Strait, 2012, 31(3): 387-395 [黄诗婷, 陈荣元, 刘克韶, 等. 四个拟穴青蟹养殖池水环境中细菌群落结构的比较研究. 台湾海峡, 2012, 31(3): 387-395] | |
| Li JB, Chang ZQ, Li J, et al. Pharmacokinetics of three sulfa-drugs in the Fenneropenaeus chinensis. Progress in Fishery Sciences, 2015, 36(2): 113-117 DOI:10.11758/yykxjz.20150215 [李金宝, 常志强, 李健, 等. 3种磺胺类药物在中国对虾(Fenneropenaeus chinensis)体内的药代动力学特征. 渔业科学进展, 2015, 36(2): 113-117] | |
| Li JB, Li J. Pharmacokinetics of sulfa drugs in the three tissues of Fenneropenaeus chinensis. Chinese Fishery Quality and Standards, 2014, 4(4): 56-62 [李金宝, 李健. 磺胺类药物在中国对虾3种组织中的代谢情况. 中国渔业质量与标准, 2014, 4(4): 56-62] | |
| Li XT, Zhao YX. Biopharmaceutics and Pharmacokinetics, Zhengzhou: Zhengzhou University Press, 2006, 18-20 [李晓天, 赵永星主编. 生物药剂学与药物动力学. 郑州: 郑州大学出版社, 2006, 18-20] | |
| Li Z, Zong HB. Application of software WT1.4 in the calculation of withdrawal time. Feed China, 2003(18): 40-41 DOI:10.3969/j.issn.1002-8358.2003.18.019 [栗柱, 宗海兵. 休药期计算软件WT1.4的使用. 饲料广角, 2003(18): 40-41] | |
| Lin LC, Fan HB, Liao BC, et al. Pharmacokinetics of sulfadiazine in European eels (Anguilla anguilla). Journal of Inspection and Quarantine, 2010, 20(4): 14-17 [林丽聪, 樊海平, 廖碧钗, 等. 磺胺嘧啶在欧洲鳗鲡体内的药代动力学研究. 检验检疫学刊, 2010, 20(4): 14-17] | |
| Lin Q, Li SJ, Li ZB, et al. Species composition in genus Scylla from the coast of southeast China. Journal of Fisheries of China, 2007, 31(2): 211-219 [林琪, 李少菁, 黎中宝, 等. 中国东南沿海青蟹属(Scylla)的种类组成. 水产学报, 2007, 31(2): 211-219] | |
| Nouws JFM, van Ginneken VJT, Grondel JL, et al. Pharmacokinetics of sulphadiazine and trimethoprim in carp (Cyprinus carpio L.) acclimated at two different temperatures. Journal of Veterinary Pharmacology and Therapeutics, 1993, 16(1): 110-113 DOI:10.1111/j.1365-2885.1993.tb00297.x | |
| Park ED, Lightner DV, Milner N, et al. Exploratory bioavailability and pharmacokinetic studies of sulphadimethoxine and ormetoprim in the penaeid shrimp, Penaeus vannamei. Aquaculture, 1995, 130(2): 113-128 | |
| Qian JZ, Li HS, Xu XM, et al. Pharmacokinetics and bioequivalence of compound sulfadiazine in Broilers. China Poultry, 2013, 35(13): 19-23 DOI:10.3969/j.issn.1004-6364.2013.13.007 [钱建中, 李寒松, 徐学梅, 等. 两种复方磺胺嘧啶混悬液在肉鸡体内药动学及生物等效性研究. 中国家禽, 2013, 35(13): 19-23] | |
| The Ministry of Agriculture of the People's Republic of China. The people's Republic of China agriculture industry standard in non-pollution food Limits of fishery drug residues in fishery products (NY 5070-2002). Beijing: Standards Press of China, 2002. [中华人民共和国农业部. 中华人民共和国农业行业标准无公害食品水产品中渔药残留限量(NY 5070-2002). 北京: 中国标准出版社, 2002.] | |
| Wang GJ. Pharmacokinetic. Beijing: Chemical Industry Press, 2005, 235 [王广基主编. 药物代谢动力学. 北京: 化学工业出版社, 2005, 235] | |
| Wang W, Luo L, Xiao H, et al. A pharmacokinetic and residual study of sulfadiazine/trimethoprim in mandarin fish (Siniperca chuatsi) with single and multiple-dose oral administrations. Journal of Veterinary Pharmacology and Therapeutics, 2016, 39(3): 309-314 DOI:10.1111/jvp.2016.39.issue-3 | |
| Wang WL, Xiao H, Jiang L, et al. Pharmacokinetic and residues of compound sulfadiazine in GIFT (Oreochromis niloticus) at single and multiple dosage. Chinese Fishery Quality and Standards, 2016, 6(1): 29-35 [王伟利, 肖贺, 姜兰, 等. 单次和连续药饵投喂方式下复方磺胺嘧啶在吉富罗非鱼体内的代谢消除规律. 中国渔业质量与标准, 2016, 6(1): 29-35] | |
| Xiao H, Wang WL, Jiang L, et al. Pharmacokinetic of compound sulfadiazine in Oreochromis niloticus at different temperatures. Journal of South China Agricultural University, 2014, 35(6): 13-18 DOI:10.7671/j.issn.1001-411X.2014.06.003 [肖贺, 王伟利, 姜兰, 等. 不同温度下复方磺胺嘧啶在罗非鱼体内的药代动力学. 华南农业大学学报, 2014, 35(6): 13-18] |



