2. 南京市水产科学研究所 南京 210036
2. Institute of Fisheries Science of Nanjing city, Nanjing 210036
动物体内大多需要通过氧化还原反应分解有机物供能,尤其在氧化磷酸化反应旺盛的细胞器,如线粒体等部位往往产生大量的活性氧(Reactive oxygen species, ROS)(Ray et al, 2012)。活性氧的性质不稳定,可以通过链式反应造成细胞内生物大分子的大规模损伤,如损害蛋白质、核酸、破坏脂膜结构和糖类物质(张文玲等, 2000; Kohen et al, 2002; Bhor et al, 2004)。体内多余的活性氧通过抗氧化系统来清除。超氧化物歧化酶(SOD)被认为是生物体抗氧化的第一道屏障(Kulkarni-Narla et al, 1997),在消除线粒体内活性氧的过程中起重要的作用(Mollnau et al, 2006)。
河川沙塘鳢(Odontobutis potamophila)属鲈形目(Perciformes)、沙塘鳢科(Odontobutidae)、沙塘鳢属(Odontobutis)。其肉质鲜美细嫩,市场价格坚挺,已成为一种具有较高经济价值的水产养殖品种(伍汉霖等, 1993)。目前,对SOD基因的结构、功能以及在抗氧化系统中的作用研究在高等动物如鸡(Gallus gallus)(卜友泉等, 2001)、人(Homo sapiens)(凌敏等, 2005)、豚鼠(Cavia porcellus)(Yuan et al, 1996)中研究较多,在水生动物中研究较少,但越来越受到重视。Gomez-Andum等(2012)对细胞质Mn-SOD基因在凡纳滨对虾(Litopenaeus vannamei)不同器官中表达差异的研究,结果显示,细胞质Mn-SOD基因在鳃和附肢中表达量最高,在心和肌肉中表达最低。唐学玺等(2000)对黑鲪(Sebastodes fuscescens)的研究表明,不同组织的SOD活性在蒽胁迫下的变化规律不同。洪美玲等(2007)用NaNO2胁迫可导致中华绒螯蟹(Eriocheir sinensis)肝脏SOD活性下降,幼体血细胞总数减少,从而加剧机体内脂质过氧化反应而降低机体的免疫力。目前,对河川沙塘鳢Mn-SOD基因的研究尚未见报道。本研究首次克隆得到河川沙塘鳢Mn-SOD基因的全长,采用qRT-PCR技术对其组织分布及胚胎发育不同阶段的表达进行分析,并研究了其应对NaNO2胁迫下mRNA水平表达变化规律,以期为今后河川沙塘鳢大规模养殖时的水质管理、健康养殖提供有价值的参考资料。
1 材料与方法 1.1 实验材料1龄河川沙塘鳢,体重为(30.0±1.5) g,取自江苏南京市水产科学研究所周岗基地。暂养于玻璃循环缸中7 d,确定健康无病后开始实验。高纯总RNA快速抽提试剂盒(离心柱型)购自百泰克公司,反转录试剂盒HiScriptTM QRT SuperMix for qPCR (+gDNA wiper)购自诺唯赞公司,SMARTer™ RACE cDNA Amplification Kit购自Clontech公司,荧光定量试剂盒Faststart Universal SYBR Green Master购自罗氏公司,PCR引物由上海捷瑞生物工程有限公司合成。
1.2 总RNA的提取及cDNA第一链的合成用高纯总RNA快速抽提试剂盒(离心柱型)提取健康河川沙塘鳢脾组织总RNA,用RNA浓度测定仪测定每个样品的RNA浓度及纯度,用1%琼脂糖凝胶电泳检测其完整性。以总RNA为模板,根据HiScript™ 1ST Strand cDNA Synthesis Kit的说明进行反转录,获得cDNA第一条链。
1.3 Mn-SOD基因片段cDNA全长克隆根据从河川沙塘鳢转录组测序的cDNA文库中分别筛选得到765 bp的Mn-SOD基因的cDNA中间EST序列,采用Invitrogen公司的5'RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒获得基因的5'端序列。采用Clontech公司的SMARTer™ RACE cDNA Amplification Kit试剂盒获得目的基因的3'端序列。克隆基因所需引物见表 1。
|
|
表 1 克隆Mn-SOD基因的所用引物 Table 1 Primers used for Mn-SOD genes cloning |
测序结果的序列总长使用DNAStar软件统计分析。核苷酸和氨基酸序列的同源性使用BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行检索。蛋白质分析专家系统(Expert Protein Analysis System, ExPASy)(http://www.expasy.org/)确定其开放阅读框进而预测氨基酸序列,理论分子量(MW)和等电点(pI)用ExPASy-ProtParam在线工具(http://www.expasy.org/tools/protparam.html)进行预测。使用在线软件SMART(http://smart.embl-heidelberg.de/)对预测到的氨基酸序列进行结构和功能的分析,使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽的预测。使用MITOPROT软件(http://ihg.gsf.de/ihg/mitoprot.html)进行蛋白定位的预测。使用在线软件ClustalW2 (http://www.ebi.ac.uk/Tools/msa/clustalo/)进行多序列比对。二级结构经Predictprotein(https://www.predictprotein.org/)进行在线预测。使用同源建模网站Swiss-model(http://swissmodel.expasy.org/)预测蛋白三维结构。用MEGA 5.0软件重复1000次构建N-J系统发育树(Kumar et al, 2004)。
1.5 河川沙塘鳢Mn-SOD基因的表达分析随机取3尾健康实验鱼的8种组织(肾、肝、肌肉、脑、脾、鳃、眼、心脏)和8个发育阶段(受精卵期、桑椹胚期、原肠胚期、神经胚期、体节期、口裂期、出膜后1 d、出膜后3 d)的材料,提取总RNA后,反转录获得cDNA第一链。根据已获得的Mn-SOD基因cDNA全长序列分别设计特异性引物Mn-SOD-F、Mn-SOD-R,以及作为内参基因的河川沙塘鳢β-actin基因特异性上下游引物β-actin-F、β-actin-R(表 2)。分别以8种组织和8个发育时期的cDNA为模板,进行实时荧光定量PCR分别检测其mRNA的表达。PCR反应体系为20 μl,Faststart Universal SYBR Green Master 10 μl,正反向引物各3 μl,cDNA模板4 μl。反应程序为95℃ 10 min;95℃ 10 s,55℃ 30 s,40个循环,4℃保存。其中,每条引物配置成浓度为2 μmol/μl的工作液,cDNA模板浓度为5 ng/μl。
|
|
表 2 实时荧光定量PCR引物 Table 2 Primers used for quantitative real-time PCR |
为进一步研究河川沙塘鳢在受到NaNO2胁迫后不同组织中Mn-SOD基因表达水平的变化规律,实验参考半静水方式水生生物急性毒性实验法进行刺激。预实验在50 L的水族箱中进行,每个水族箱放入经暂养的河川沙塘鳢10条,共设6个NaNO2浓度梯度(210、220、230、240、250、260 mg/L),每个浓度设3个平行,实验期间不喂食。在0、1、3、6、12、24、48、72 h分别观察测定并记录鱼的活动及死亡情况。实验确定河川沙塘鳢72 h NaNO2半致死浓度为250 mg/L。以预实验的结果为基础,实验用鱼随机分为实验组和对照组,每组设3个平行。实验于相同规格的水族箱中进行,每个水族箱放入实验用鱼10条,对照组注入20 L曝气自来水,实验组注入等量的250 mg/L的NaNO2溶液。为保持水中浓度稳定,每6 h换水1次,换水量为50%,实验过程中持续充氧。
NaNO2溶液处理后,各实验组分别在0、1、3、6、12、24、48、72 h随机取3条鱼的肝组织和鳃组织,液氮速冻10 min后于–80℃保存。提取总RNA并检测Mn-SOD基因相对表达量。
1.7 数据处理与分析实验结果数据采用2–△△Ct法来计算目的基因的相对表达量(Schmittgen et al, 2008),应用SPSS软件对实验数据进行统计分析、差异显著性检验分析。用t检验计算P值,当P < 0.05时为差异显著,P < 0.01为差异极显著。数值采用平均值±标准差(Means±SD)表示。使用Origin 8.6软件绘制柱状图。
2 结果 2.1 Mn-SOD基因的全长序列分析利用RACE技术克隆得到河川沙塘鳢Mn-SOD基因的cDNA全长序列为1008 bp(GenBank登录号:KU845215),包括678 bp开放阅读框(ORF)、15 bp的5'UTR区和315 bp的3'UTR区,共编码225个氨基酸,其中,3'UTR区域具有脊椎动物典型的加尾信号AATAAA和31 bp的PolyA尾巴,表明获得的该cDNA全长序列3'末端序列完整(图 1)。

|
图 1 河川沙塘鳢Mn-SOD cDNA序列及推导的氨基酸序列 Figure 1 Nucleotide and deduced amino acid sequences of O.potamophila Mn-SOD cDNA 推导的氨基酸序列显示在核苷酸序列下方,为大写字母;星号为终止密码子;预测的MTS用青色高亮表示;下划线为多聚核苷酸信号;双下划线为poly(A)尾巴;N-糖基化位点用粗体表示;预测的特征片段用黄色标出;预测的Mn2+结合位点用方框框出 Translated amino acid sequence is shown under nucleotide sequence as uppercase; The stop codon was marked by an asterisk. Predicted MTS was shown in cyan highlights. Polyadenylation signal was underlined; The poly(A) signal sequence was double-underlined; Potential N-glycosylation sites were in bold; Putative family signature motifs were in yellow; Potential Mn2+-binding sites were boxed |
ExPASy软件预测的氨基酸分子量为25153.50,理论等电点为8.30。同时在N-端还预测到1个27 bp的线粒体定位靶序列(Mitochondrial targeting sequence,MTS)(MLCRASQIRRCATGLSHSLSQVTTSRQ)。MI-TOPROT软件进一步证明该序列导向线粒体(概率为0.9714)。Mn-SOD编码区经SignalP软件分析发现,其不存在信号肽序列,不属于分泌蛋白。利用SMART软件对Mn-SOD氨基酸序列分析表明,包含有2个保守的结构域Sod_Fe_N(28-109) 和Sod_Fe_C(116-219)。此外,1个Mn-SOD基因的特征片段(186DVWEHAYY193)和包括1个酪蛋白激酶Ⅱ磷酸化位点(30SLPD33),3个N-豆蔻酰基化位点(14GLSHSL19,96GGHINH101,147GSGWGW152)的4个蛋白激酶C-磷酸化位点(24TSR26,159SGR161,217SDR219,222TAK224)也被预测到,并且4个介导其催化活性的Mn2+结合位点(H53,H101,D186,H190)位置依然保守。
使用在线软件ClustalW2将河川沙塘鳢的Mn-SOD氨基酸序列与另外7种已知的Mn-SOD序列进行对比分析和同源性检测。结果显示,Mn-SOD的氨基酸序列除线粒体靶向序列之外,相似性很高。锰离子结合位点(H53,H101,D186,H190)、特征片段(DVWEHAYY)等特征都很保守。河川沙塘鳢的Mn-SOD氨基酸序列与另外7种已知物种的Mn-SOD序列相似性较高,为88.5%-78.9%(图 2)。
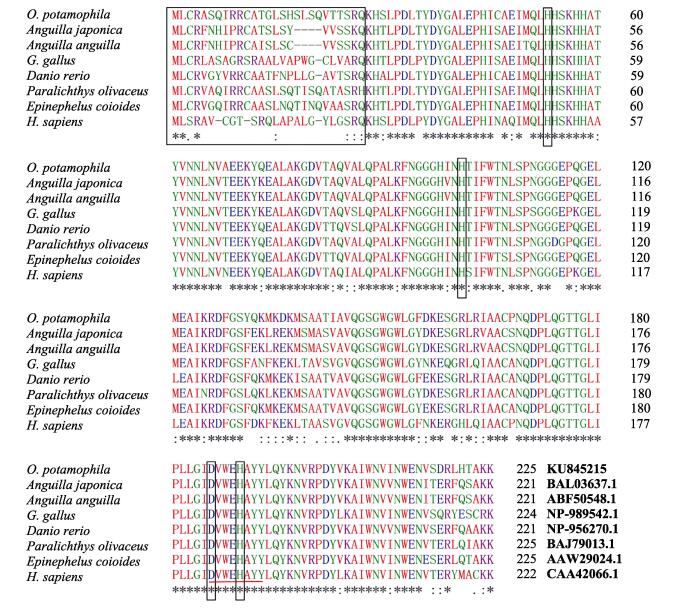
|
图 2 河川沙塘鳢Mn-SOD氨基酸序列与其他已知同源序列对比 Figure 2 Multiple alignment of O.potamophila Mn-SOD polypeptide sequences with other known orthologs 氨基酸序列优化对齐后的空白位置用连字符代替,用(*)和(或者:)表示氨基酸残基相同和类似。在每个序列的末端标注有GenBank登录号。Mn-SOD特征序列用红色下划线标识。用方框框出MTS序列。预测的Mn2+结合位点用矩形框出 Gaps introduced for optimal alignment were indicated with hyphens. Identical and similar aa residues were indicated by "*" and ":" respe ctively. GenBank accession number of each sequence were listed last. Conserved Mn-SOD family signature motifs were underlined in red. MTS were boxed. Putative Mn2+-binding sites were enclosed in a rectangle |
推导得到的河川沙塘鳢Mn-SOD氨基酸序列分析表明,河川沙塘鳢和其他物种Mn-SOD的氨基酸序列同源性在51.6%–90.3%之间,其中,与同为鲈形目的条石鲷(Oplegnathus fasciatus)和线鳢(Channa striata)的同源性最高为90.3%,与鱼类中斑马鱼(Barchydanio rerio var)同源性最低为87.1%。
采用MEGA 5.0以N-J法构建基于Mn-SOD氨基酸序列的分子系统进化树(图 3)。进化树聚类结果显示,所有的脊椎动物聚为一个大的分支,无脊椎动物聚为另外的分支,植物构成一个分支。脊椎动物分支中,所有鱼类聚成一支,两栖类鸟类和哺乳类动物聚类为另外的分支。这与传统的分类系统是一致的。
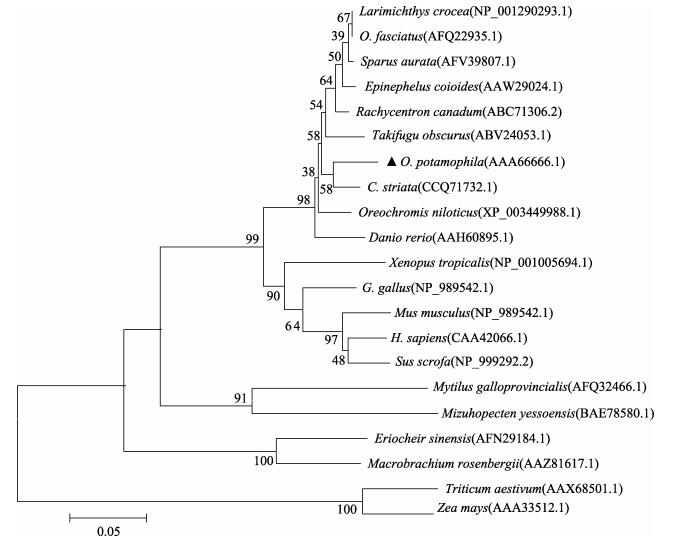
|
图 3 河川沙塘鳢与其他物种Mn-SOD基因的系统进化树 Figure 3 Phylogenetic tree of Mn-SOD gene of O.potamophila and other vertebrates |
使用同源建模网站Swiss-model,以人类Mn-SOD三维结构为模板(PDB, 2adqB)与河川沙塘鳢Mn-SOD基因推导的氨基酸序列联配构建其三维结构,结果显示,河川沙塘鳢Mn-SOD有59%的α-螺旋,10%的β-折叠,16%的无规则卷曲。其蛋白结构三维飘带结构图与人类的十分相似,都是N端2个反向平行螺旋和C端3个折叠片的α+β结构(图 4)。
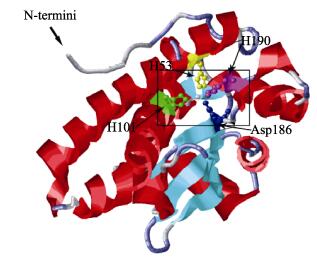
|
图 4 河川沙塘鳢Mn-SOD三维结构 Figure 4 Three-dimension structure of O.potamophila Mn-SOD 基于人Mn-SOD (PDB, 2adqB)预测的河川沙塘鳢Mn-SOD蛋白三维结构;α-螺旋标为红色,β-折叠标为青色;Mn2+结合位点的位置已标出 Three-dimensional structure of O.potamophila Mn-SOD based on human MnSOD (PDB, 2adqB); α-helixes are in red and β-strands are in cyan; Ribbon diagram of O.potamophila Mn-SOD and location of Mn2+ligand active sites are indicated |
qRT-PCR结果显示,Mn-SOD基因在河川沙塘鳢8个组织中均有表达,具有广泛分布表达的特点,其表达量由高到低依次为肌肉>肝>心>脑>眼>脾>鳃>肾。其中,在肌肉中的表达量最高,约为肾、脾、鳃组织中Mn-SOD表达量的71.01、27.49、61.29倍(图 5)。
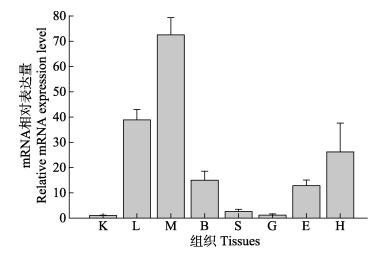
|
图 5 Mn-SOD在健康河川沙塘鳢不同组织中的表达 Figure 5 Mn-SOD gene expressions in various tissues of healthy O.potamophila K、L、M、B、S、G、E和H分别为肾、肝、肌肉、脑、脾、鳃、眼、心脏 K, L, M, B, S, G, E and H denoted kidney, liver, muscle, brain, spleen, gill, eye, and heart |
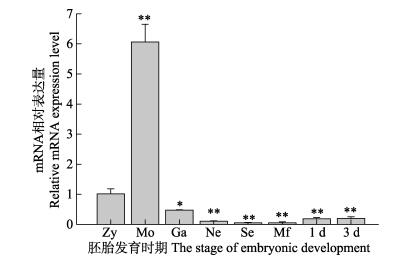
河川沙塘鳢Mn-SOD基因在胚胎到仔鱼不同发育时期都有表达,表达量随着沙塘鳢发育进程呈先上升后下降的趋势,在桑椹胚时期达到最高值,极显著地高于其他发育阶段(P < 0.01),之后才逐渐降低,并显著低于受精卵时期,仔鱼孵化后表达量有上升的趋势(图 6)。
|
图 6 Mn-SOD在河川沙塘鳢胚胎和仔鱼发育过程中的表达 Figure 6 Mn-SOD gene expressions during the embryonic and larval development of O.potamophila Zy、Mo、Ga、Ne、Se、Mf、1 d和3 d分别为受精卵、桑椹胚、原肠胚、神经胚、体节期、口裂期、出膜后1 d、出膜后3 d。*为显著性差异(P < 0.05),**为极显著差异(P < 0.05) Zy, Mo, Ga, Ne, Se, Mf, 1 d and 3 d denoted zygote, morula, gastrula, neural, segmentation, mouth forming stage, 1 d after hatching and 3 d after hatching. * indicated significant different, ** indicated highly significant different. |
急性NaNO2胁迫后,肝组织Mn-SOD基因的mRNA表达呈先升高后降低的趋势。在胁迫1 h后,表达水平升高,但不显著,在3 h后表达量显著升高,并达到最高值,之后表达量略有降低,6–24 h内相对稳定的保持在较高水平,48 h之后表达量开始持续下降,72 h后达到最低值(图 7)。

|
图 7 急性NaNO2胁迫后Mn-SOD基因在河川沙塘鳢肝组织中的表达变化 Figure 7 Changes of expression levels of Mn-SOD gene in liver of O.potamophila after NaNO2 challenge 注:图中以β-actin为内参基因,柱状图显示为平均值±标准差(n=3),*为显著性差异(P < 0.05),**为极显著差异(P < 0.01),下同 Note: Mn-SOD gene mRNA levels were expressed as a ratio relative to β-actin levels in the same samples after real-time PCR. The bars indicate the Mean ± SD(n=3). Statistical significance was considered at *(P < 0.05), and **(P < 0.01) when compared with that of the control, the same as below |
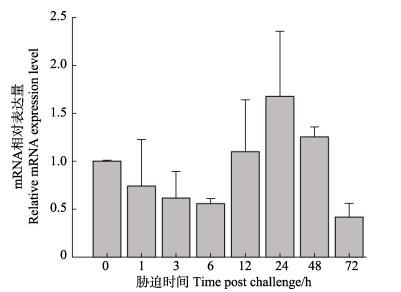
急性NaNO2胁迫后,鳃组织内Mn-SOD基因的mRNA表达呈先降低后升高然后再降低的变化。其中,0–6 h之内的表达量持续降低,12–48 h之内略有上升,在24 h其表达量达到最高值,之后又开始降低,72 h之后达到最低值(图 8)。
|
图 8 急性NaNO2胁迫后Mn-SOD基因在河川沙塘鳢鳃组织中的表达变化 Figure 8 Changes of expression levels of Mn-SOD gene in gill of O.potamophila after NaNO2 challenge |
Mn-SOD作为催化超氧阴离子自由基发生歧化反应生成H2O2和O2的酶类抗氧化剂之一,在生命体抗氧化应激反应过程中和消除机体中活性氧对细胞的损伤中扮演了重要的角色(Whang et al, 2012)。本研究首次获得了河川沙塘鳢Mn-SOD基因cDNA的全长序列,ORF区序列长度为678 bp,编码225个氨基酸。经过序列分析发现,河川沙塘鳢Mn-SOD基因在分子进化上具有高度的保守性。尤其是保守的序列特征和保守的金属离子结合位点。通过氨基酸序列比对分析,Mn-SOD的氨基酸序列与鲈形目的条石鲷和线鳢相似性高达90.3%,与其他哺乳类和鸟类的Mn-SOD氨基酸序列相比也表现出了高度的同源性,进一步证实了河川沙塘鳢Mn-SOD在其序列和功能域上非常保守。利用Mn-SOD编码氨基酸序列构建的系统树中,沙塘鳢首先与线鳢聚为一支,再与暗纹东方鲀(Takifugu obscurus)和军曹鱼(Rachycentron canadum)聚为一支,聚类分析产生的进化树基本上与各参考物种的分类进化地位相吻合,由此可以在一定程度上推测河川沙塘鳢的系统进化地位。
河川沙塘鳢Mn-SOD基因具有广泛表达的特点(Zelko et al, 2002)。其中,在肌肉、肝、心、脑、眼等组织的表达量较高,在肾、脾、鳃中的表达量较低。张志伟(2011)1)对鲢(Hypophthalmichthys molitrix)的研究表明,Mn-SOD基因在鳃中的表达量最高;Cho等(2009)对朝鲜䱻(Hemibarbus mylodon)的研究表明,Mn-SOD基因表达量大小依次为心脏、脑、鳃、肌肉,其表达量的差异是由氧化应激承受能力及各组织的能量需求水平决定的;Sun等(2014)对团头鲂(Megalobrama amblycephala)的研究结果显示,Mn-SOD基因在肝组织中的表达量最高,这与Cheng等(2006)对罗氏沼虾(Macrobrachium rosenbergii)、Zhang等(2007)对中国明对虾(Fenneropenaeus chinensis)的研究结果相一致,但与本研究的结果不一致,推测可能是因为河川沙塘鳢是一种极耐低氧的鱼类。朱永安等(2005)的研究表明,水温为25℃时,沙塘鳢的窒息点为0.78 mg/L。肌肉的高SOD表达量可能与其耐低氧的习性相适应。另外,对河川沙塘鳢胚胎到仔鱼不同发育时期Mn-SOD基因的表达研究显示,受精后的桑椹胚期表达量最高,之后逐渐降低,并显著低于受精卵时期。这与Mouatassim等(1999)、Lin等(2009)、张志伟(2011)1)的研究结果相吻合,受精卵中SODs基因主要产生于卵母细胞,而在后续的发育过程中其表达水平会逐渐降低。本研究中,Mn-SOD基因的表达量到桑椹胚期达到最高,之后才逐渐降低,说明了在胚胎早期形成过程中,ROS主要产生于细胞分裂旺盛的时期。但在细胞分化和器官形成的早期阶段胚胎的氧化应激水平相对较低。造成这种现象的另外一个原因可能是,成熟的卵子从鱼体排入水中,脱离了原来在母体内相对稳定的环境,经过受精过程等的刺激,打破了原有的ROS平衡,从而使得抗氧化基因受到诱导表达(Kadomura et al, 2006)。本研究表明了Mn-SOD在沙塘鳢胚胎早期中可能扮演重要的角色。
1) Zhang ZW. Molecular clcning and differential expression patterns of hypoxic stress related genes in Silver carp. Master's Thesis of Huazhong Agricultural University, 2011, 31-42 [张志伟.鲢低氧应激相关基因的克隆与表达分析.华中农业大学硕士研究生学位论文, 2011, 31-42]
水体中过量的NaNO2不仅会消耗水体的溶解氧,还会进入水生生物体内造成更严重的危害。肝脏是维持生物体内环境稳态的重要器官,鱼类的生活环境多变,对肝脏的依赖程度更高。本研究的结果显示,急性NaNO2胁迫可显著诱导河川沙塘鳢肝脏中的Mn-SOD基因的表达,3 h后达到最高值。随着胁迫时间的推移,表达量开始下降,72 h后表达恢复到开始时的水平,但不会造成其死亡。这与Sun等(2014)对团头鲂、Xian等(2012)对斑节对虾(Penaeus monodon)、Jensen等(1990)对克氏原鳌虾(Astacus astacus)的研究结果相似。这说明河川沙塘鳢受到NaNO2胁迫的初期,其对细胞内稳态的扰乱导致了ROS的升高,机体启动抗氧化防御机制来对抗体内ROS的升高。但是随着胁迫时间的延长,体内的抗氧化平衡被打破,解剖发现72 h胁迫后的河川沙塘鳢肝脏都出现了不同程度的损伤。体内器官的损坏也是Mn-SOD基因表达量下降的重要原因。鳃是鱼类的呼吸器官和先天免疫的重要器官,是鱼类直接与外界接触最紧密的器官,鳃因其对生命的重要性而被广泛的报道过(Rankin et al, 1982; Anderson et al, 1997; Lang et al, 1987; Smart et al, 1976)。河川沙塘鳢Mn-SOD基因在鳃中的表达趋势与肝差别很大,NaNO2胁迫后先降低,到12 h后表达量开始上升,24 h达到最高值后开始下降,72 h后达到最低值。在本研究中,亚硝酸盐胁迫的初期Mn-SOD基因表达量就下降,12 h才表现出升高,体现了鳃对环境变化的敏感性,而肝组织Mn-SOD基因的表达量在NaNO2胁迫1 h即表现出升高。鳃和肝中Mn-SOD基因表达量和敏感性的不同,可能与它们的不同生理功能有关。随着刺激时间的延长,河川沙塘鳢Mn-SOD的表达量在24 h后又出现下降,可能是在NaNO2长时间胁迫下,鳃组织中较多的ROS超过了Mn-SOD清除的能力范围,使酶蛋白受损,细胞的新陈代谢能力下降而造成的。这与肝组织在NaNO2胁迫24 h后的变化趋势相一致,体现了鳃与肝在应对NaNO2长时间胁迫下其自身代谢水平和抗氧化系统都受到了一定程度的影响,72 h后解剖发现河川沙塘鳢的鳃组织颜色变暗,有出血现象。组织的损伤造成器官功能的紊乱甚至丧失,必然会导致基因表达量的下降。
NaNO2急性胁迫处理过后的河川沙塘鳢Mn-SOD基因在不同器官表现出不同的变化趋势,但长时间处理后都会造成表达量的下降和鱼体的损伤,这为以后控制河川沙塘鳢养殖水体NaNO2含量提供了理论依据。
| Anderson DP. 7-Environmental factors in fish health: Immunological aspects. Fish Physiology, 1997, 15: 289-310 | |
| Bhor VM, Raghuram N, Sivakami S. Oxidative damage and altered antioxidant enzyme activities in the small intestine of streptozotocin-induced diabetic rats. International Journal of Biochemistry and Cell Biology, 2004, 36(1): 89-97 DOI:10.1016/S1357-2725(03)00142-0 | |
| Bu YQ, Lu C, Li YW, et al. Cloning and sequence analysis of Manganese-containing superoxide dismutase (MnSOD) cDNA of chickens. Chinese Journal of Biochemistry and Molecular Biology, 2001, 17(4): 463-467 [卜友泉, 鲁成, 李英文, 等. 鸡含锰超氧化物歧化酶cDNA克隆及序列分析. 中国生物化学与分子生物学报, 2001, 17(4): 463-467] | |
| Cheng W, Tung YH, Chiou TT, et al. Cloning and characterisation of mitochondrial manganese superoxide dismutase (mtMnSOD) from the giant freshwater prawn Macrobrachium rosenbergii. Fish Shellfish Immunol, 2006, 21(4): 453-466 DOI:10.1016/j.fsi.2006.02.005 | |
| Cho YS, Lee SY, Bang IC, et al. Genomic organization and mRNA expression of manganese superoxide dismutase (Mn-SOD) from Hemibarbus mylodon (Teleostei, Cypriniformes). Fish and Shellfish Immunology, 2009, 27(4): 571-576 DOI:10.1016/j.fsi.2009.07.003 | |
| Gomez-Anduro GA, Ascencio-Valle F, Peregrino-Uriarte AB, et al. Cytosolic manganese superoxide dismutase genes from the white shrimp (Litopenaeus vannamei) are differentially expressed in response to lipopolysaccharides, white spot virus and during ontogeny. Comparative Biochemistry and Physiology Part B: Biochemistry Molecular Biology, 2012, 162(4): 120-125 DOI:10.1016/j.cbpb.2012.03.003 | |
| Hong ML, Chen LQ, Gu SZ, et al. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (Eriocheir sinensis). Journal of Fishery Sciences of China, 2007, 14(3): 412-418 [洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412-418] | |
| Jensen FB. Sublethal physiological changes in freshwater crayfish, Astacus astacus, exposed to nitrite: haemolymph and muscle tissue electrolyte status, and haemolymph acid-base balance and gas transport. Aquatic Toxicology, 1990, 18(1): 51-60 DOI:10.1016/0166-445X(90)90035-N | |
| Kadomura K, Nakashima T, Kurachi M, et al. Production of reactive oxygen species (ROS) by devil stinger (Inimicus japonicus) during embryogenesis. Fish and Shellfish Immunology, 2006, 21(2): 209-214 DOI:10.1016/j.fsi.2005.11.006 | |
| Kohen R, Nyska A. Oxidation of biological systems: Oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification. Toxicol Pathol, 2002, 30(6): 620-650 DOI:10.1080/01926230290166724 | |
| Kulkarni-Narla A, Getchell TV, Getchell ML. Differential expression of manganese and copper-zinc superoxide dismutases in the olfactory and vomeronasal receptor neurons of rats during ontogeny. Journal of Comparative Neurology, 1997, 381(1): 31-40 DOI:10.1002/(ISSN)1096-9861 | |
| Kumar S, Tamura K, Nei M. MEGA 3: Integrated software for molecular evolutionary genetics analysis and sequence alignment. Brief Bioinform, 2004, 5(2): 150-163 DOI:10.1093/bib/5.2.150 | |
| Lang T, Peters G, Hoffmann R, et al. Experimental investiga-tions on the toxicity of ammonia: Effects on ventilation frequency, growth, epidermal mucous cells, and gill structure of rainbow trout Salmo gairdneri. Diseases of Aquatic Organisms, 1987, 3(3): 85-109 | |
| Li YH. Cloning and bioinfor matics analysis of the full cDNA quence of MnSOD from phascolosoma esculenta bodywall. Journal of Quanzhou Normal University, 2012, 30(6): 38-42 [李裕红. 泉州湾可口革囊星虫MnSOD全长cDNA的克隆及其生物信息学分析. 泉州师范学院学报, 2012, 30(6): 38-42] | |
| Lin CT, Tseng WC, Hsiao NW, et al. Characterization, molecular modelling and developmental expression of zebrafish manganese superoxide dismutase. Fish and Shellfish Immunology, 2009, 27(2): 318-324 DOI:10.1016/j.fsi.2009.05.015 | |
| Ling M, Lai XJ, Xie K. Cloning and expression of human manganese superoxide dismutase cDNA in Pichia pastoris. Chinese Journal of Biotechnology, 2005, 21(3): 478-481 [凌敏, 赖祥进, 谢柯. 人Mn-SOD cDNA的克隆及其在巴斯德毕赤酵母中的表达. 生物工程学报, 2005, 21(3): 478-481] | |
| Mollnau H, Wenzel P, Oelze M, et al. Mitochondrial oxidative stress and nitrate tolerance-comparison of nitroglycerin and pentaerithrityl tetranitrate in Mn-SOD +/-mice. Bmc Cardiovascular Disorders, 2006, 6(1): 44 DOI:10.1186/1471-2261-6-44 | |
| Mouatassim SE, Guérin P, Ménézo Y. Expression of genes encoding antioxidant enzymes in human and mouse oocytes during the final stages of maturation. Molecular Human Reproduction, 1999, 5(8): 720-725 DOI:10.1093/molehr/5.8.720 | |
| Rankin JC, Stagg RM, Bolis L. Effects of pollutants on gills. Gills. London: Cambridge University Press, 1982: 207-220. | |
| Ray PD, Bo-Wen H, Yoshiaki T. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling. Cellular Signalling, 2012, 24(5): 981-90 DOI:10.1016/j.cellsig.2012.01.008 | |
| Rost B, Liu JF. The predict protein server. Nucleic Acids Research, 2004, 32(3): 3300-3304 | |
| Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols, 2008, 3(6): 1101-1108 DOI:10.1038/nprot.2008.73 | |
| Smart G. The effect of ammonia exposure on gill structure of the rainbow trout (Salmo gairdneri). Journal of Fish Biology, 1976, 8(6): 471-475 DOI:10.1111/jfb.1976.8.issue-6 | |
| Sun S, Zhu J, Ge X, et al. Identification and mRNA expression of antioxidant enzyme genes associated with the oxidative stress response in the Wuchang bream (Megalobrama amblycephala Yih) in response to acute nitrite exposure. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2014, 159(2): 69-77 | |
| Sun S, Zhu J, Jiang X, et al. Molecular cloning, tissue distribution and expression analysis of amanganese superoxide dismutase in blunt snout bream Megalobrama amblycephala. Fish and Shellfish Immunology, 2014, 38(2): 340-347 DOI:10.1016/j.fsi.2014.03.036 | |
| Tang XX, Zhang PY. Effects of anthracene on activity of superoxide dismutase in Sebastodes fuscescens. Journal of Fisheries of China, 2000, 24(3): 217-220 [唐学玺, 张培玉. 蒽对黑鲪超氧化物歧化酶活性的影响. 水产学报, 2000, 24(3): 217-220] | |
| Whang I, Choi YC, Lee J, et al. A manganese superoxide dismutase (MnSOD) from Ruditapes philippinarum: Comparative structural-and expressional-analysis with copper/zinc superoxide dismutase (Cu/Zn SOD) and biochemical analysis of its antioxidant activities. Fish and Shellfish Immunology, 2012, 33(4): 753-765 DOI:10.1016/j.fsi.2012.06.024 | |
| Wu HL, Wu XQ, Xie YH. A revision of the genus Odontobutis from China with description of a new species. Journal of Shanghai Fisheries University, 1993, 2(1): 52-61 [伍汉霖, 吴小清, 解玉浩. 中国沙塘鳢属鱼类的整理和一新种的叙述. 上海水产大学学报, 1993, 2(1): 52-61] | |
| Xian JA, Wang AL, Hao XM, et al. In vitro toxicity of nitrite on haemocytes of the tiger shrimp, Penaeus monodon, using flow cytometric analysis. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2012, 156(2): 75-79 DOI:10.1016/j.cbpc.2012.04.001 | |
| Yuan HT, Bingle CD, Kelly FJ. Differential patterns of antioxidant enzyme mRNA expression in guinea pig lung and liver during development. Biochimica et Biophysica Acta, 1996, 1305(3): 163-171 DOI:10.1016/0167-4781(95)00214-6 | |
| Zelko IN, Mariani TJ, Folz RJ. Superoxide dismutase multigene family: A comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression. Free Radical Biology and Medicine, 2002, 33(3): 337-349 DOI:10.1016/S0891-5849(02)00905-X | |
| Zhang Q, Li F, Wang B, et al. The mitochondrial manganese superoxide dismutase gene in Chinese shrimp Fenneropenaeus chinensis: Cloning, distribution and expression. Developmental and Comparative Immunology, 2007, 31(5): 429-440 DOI:10.1016/j.dci.2006.08.005 | |
| Zhang WL, Wei LQ, Wang LS, et al. Oxidative damage of active oxygen on biomacromolecules. Journal of Henan Normal University (Natural Science), 2000, 28(4): 69-71 [张文玲, 魏丽勤, 王林嵩, 等. 活性氧对生物大分子的氧化性损伤. 河南师范大学学报(自然科学版), 2000, 28(4): 69-71] | |
| Zhu YA, Wang NM, Yang DX. The measurement of oxygen consumption rate and choke point in Odontobutis potamophila. Inland Fisheries, 2005, 30(9): 35-36 [朱永安, 王南明, 杨德先. 沙塘鳢耗氧率与窒息点的测定. 内陆水产, 2005, 30(9): 35-36] |



