2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
Marine Cage Using Siganus oramin in Northern China
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
在北方网箱养殖过程中,高温季节网衣附着藻类的大量着生一直是困扰广大从业者的主要问题之一。大量的附着藻类导致网箱的自身重量增大,对海水的阻力变大,自身浮力变小,致使网绳的负重增加,缩短了网具的使用寿命,夏季生物量高峰时期会造成网具的网眼堵塞,影响水体的内外交换(王建军等, 1996),严重时甚至会阻碍养殖对象的生长,甚至导致死亡(Cronin et al, 1999)。在我国北方主要通过曝晒法进行清除附着藻类,但该过程费时费力,对网具也会造成不同程度的机械损伤。因此,寻求一种合理的附着藻类防除方法对北方网箱养殖业具有积极意义。
黄斑篮子鱼(Siganus oramin),亦称长鳍篮子鱼,广泛分布于太平洋西部和印度洋以及我国的东海南部和南海(马强等, 2006)。黄斑篮子鱼主要栖息于水体中下层,活动能力较强,喜结群,易受惊,具有争抢食物的习性,喜摄食网衣上附着的藻类,可清洁网衣(陆忠康, 1996)。针对北方海水网箱养殖藻类附着盛期主要集中在夏、秋季节,本研究以桑沟湾楮岛海域为研究区域,选择黄斑篮子鱼作为底播刺参苗种网箱中间培育期(4–11月)网衣附着藻类的生物清除工具种,探讨了适温条件下黄斑篮子鱼对附着藻类优势种海头红(Plocamium telfairiae)的摄食能力,旨在为北方海水网箱养殖过程中附着藻类的清除提供一种新的思路。
1 材料与方法 1.1 实验地点与材料实验地点选在山东省荣成市桑沟湾楮岛海域,此处为荣成网箱养殖的密集区域,主要品种为许氏平鲉(Sebastes schlegelii)、大泷六线鱼(Hexagrammos otakii)(养殖时段为5月初至10月中旬)及保苗期的刺参(Stichopus japonicus)(养殖时段为5月中旬至10月底),养殖期间日均水温范围为15–24℃,盐度为30.9±1.1,pH为8.1±0.7,溶氧大于6.0 mg/L。渔排为木制框架,网箱规格为3.0 m×3.0 m×3.0 m,单层聚乙烯网衣,网目规格为1.0 cm。实验用黄斑篮子鱼从福建近海捕获,苗种于2015年6月12日运到实验海区网箱中暂养,苗种平均体长为(39.0±6.5) mm,平均体重为(1.4±0.6) g,共放养4000尾。
1.2 实验内容及方法 1.2.1 网箱附着藻类群落变化用聚丙烯材料制藻类附着框(长×宽为45.0 cm×45.0 cm,附着框上网衣网目为6.5),研究6–11月网箱养殖区附着藻类的数量和优势种。附着框于6月15日投放,于7月16日、8月7日、9月15日、10月15日和11月14日分别回收,并更换新的附着框,这5个月包含了北方网衣藻类“少量附着—大量附着—少量附着”的全过程。附着框挂在养殖黄斑篮子鱼的渔排上,实验设置3个平行,每个平行包括自上而下的3个附着框,深度分为0.5 m、1.4 m和2.3 m。底部挂有1.0 kg的配重。回收的附着框带回实验室后,进行附着藻类的种类鉴定(非藻类生物单独取下,烘干处理),鉴定完成后,将网衣剪下,放入干净的托盘中,65℃条件下烘干48 h,将烘干后的网衣进行称重(精确到0.1 g),记为W1,将网衣上的藻类清除干净后,再次称量网衣的重量,记为W2,W1–W2即为附着藻类的干重。自然状态下,网箱区不同月份网衣附着藻类生物量,用附着框上藻类的日均增长量(文章中涉及的藻类重量均为干重)来估算。实验有关参数计算依据公式:
| $ 日均增重量({\rm{g}}){\rm{ = }}({W_2} - {W_1})/t $ |
式中,W1和W2分别为实验开始和结束时的藻类干重(g),t为实验持续时间(h)。
1.2.2 适温条件下黄斑篮子鱼对海头红的摄食能力和碳收支在8月17日,进行了23℃条件下黄斑篮子鱼对网衣附着藻类优势种海头红的碳收支实验,实验用鱼的全长为(79.5±7.5) mm。本实验共设3个平行,实验开始前每个平行选取4条活力较强、体色正常、大小均匀的黄斑篮子鱼转移至49.0 cm×23.5 cm× 29.0 cm(长×宽×高)的玻璃缸流水槽中,水量保持在距底部24.0 cm处,暂养驯化7 d后开始实验(驯化期间投喂海头红)。沿岸的自然海水经砂滤后作为实验用水,实验水温为(23.0±0.5)℃,以冷水机(HXLS 1000, 大连)控制,盐度为30.9±1.1,溶氧量保持在6.0 mg/L以上。实验开始的同时,每组平行取出1条鱼进行呼吸、排泄的相关实验,剩余3条进行摄食实验。实验持续24 h,上午06:00开始,根据预实验的实验结果,一次性投喂过量的海头红,为了防止粪便在水中溶失,分别在1 h、6 h、14 h、24 h用虹吸法吸取粪便,将收集的粪便与残饵烘干、称重。干燥后的残饵与粪便,经过研磨、过筛、酸化、干燥后,各称取一定质量(1.5–2.0 mg)包膜,样品中的碳含量用元素分析仪(Vario EL cube; Elementar, 德国)进行分析。得出的数据用于计算摄入总碳和粪便总碳,代谢碳(碳代谢率)和排泄碳(碳排泄率)用耗氧率和排氨率的数据转换得出。
耗氧率和排氨率的测定:设置3个平行、3个空白对照组,所用容器为可容纳5.8 L海水的白色聚乙烯实验瓶,每个瓶中放1条鱼。实验用鱼放入实验瓶后,流水暂养2 h后,用保鲜膜密封,开始实验。实验过程中23℃水浴,实验持续2 h,实验结束后,虹吸法取水样进行耗氧率和排氨率的测定。
溶解氧(DO)的测定采用(Winkler)碘量法,根据实验前后溶解氧的浓度变化计算单位干重耗氧率[OR,mg/(g·h)]:
| $ {\rm{OR}} = [({\rm{D}}{{\rm{O}}_0}--{\rm{D}}{{\rm{O}}_{\rm{t}}}) \times V]/(W \times t) $ |
式中,DO0和DOt分别为实验开始和结束时实验水中溶解氧含量(mg/L),V为实验用水的体积(L),W为实验鱼体干重(g),t为实验持续时间(h)。
氨氮(NH4-N)采用次溴酸钠氧化法测定,根据实验前后氨氮浓度变化计算单位干重排氨率[NR,μmol/(g·h)]:
| $ {\rm{NR}} = [({N_{\rm{t}}} - {N_0}) \times V]/(W \times t) $ |
式中,N0和Nt分别为实验开始和结束时实验水中氨氮浓度(μmol/L),V为实验用水的体积(L),W为实验鱼体干重(g),t为实验持续时间(h)。
黄斑篮子鱼在23℃下的碳收支中:
| $ \begin{array}{l} {\rm{IR}} = {W_1}/({W_2} \times t), {C_{\rm{c}}} = {\rm{IR}} \times {C_1}\% {\rm{ }}\\ {\rm{FR}} = {W_3}/({W_2} \times t), {F_{\rm{c}}} = {\rm{FR}} \times {C_2}\% \\ {U_{\rm{c}}} = \left({12/28} \right) \times {\rm{NR}}\\ {R_{\rm{c}}} = {\rm{RQ}} \times \left({12/32} \right) \times {\rm{OR}}\\ {G_{\rm{c}}} = {C_{\rm{c}}}-{F_{\rm{c}}}-{U_{\rm{c}}}-{R_{\rm{c}}} \end{array} $ |
式中,IR为摄食率,FR为排粪率,NR为排氨率,OR为耗氧率[单位均为mg/(g·h)];Cc为摄入碳,Fc为粪便碳,Uc为排泄碳,Rc为代谢碳,Gc为生长碳[单位均为mg/(g·h)];RQ为呼吸熵,本研究采用经验常数0.85(毛兴华等, 1997)。
W1为实验时间内摄食海头红干重,W2为实验鱼体干重,W3为实验时间内排出粪便干重(单位均为g);t为实验持续时间(h);C1为海头红中含碳量,C2为粪便中含碳量。
1.2.3 黄斑篮子鱼在6–11月的生长情况及其对网衣清除效果的对比黄斑篮子鱼自6月12日放入网箱后,投喂海头红等野生藻类暂养,在6月15日随机捞取400条放入已长有杂藻的网箱(规格为3.0 m× 3.0 m×3.0 m)内,设置3个平行,用未放养黄斑篮子鱼的相同规格网箱作为对照,隔30 d左右测量水温、溶氧、盐度、pH,随机取黄斑篮子鱼10条,测量其体长、全长、体宽和体重,体长、全长、体宽均精确到0.1 mm,体重精确到0.1 g。每个实验和对照网箱均随机设5个采样点,跟踪不同季节篮子鱼对附着藻类的清除率,采样点面积为20.0 cm2,且位于相同位置。实验有关参数计算公式:
| $ \begin{array}{l} 日均增长量({\rm{mm}}) = ({L_2} - {L_1})/t\\ 日均增重量({\rm{g}}){\rm{ = }}({W_2} - {W_1})/t \end{array} $ |
式中,L1和L2分别为实验开始和结束时鱼体体长,W1和W2分别为实验开始和结束时鱼体湿重(g),t为实验持续时间(h)。
1.2.4 数据统计与处理数据处理采用Excel 2007,统计分析采用SPSS 19.0,对所得数据进行单因素方差分析(One-way ANOVA)和Duncan多重比较,以P < 0.05作为差异显著水平。
2 结果 2.1 6–11月网衣附着藻类生物量的月际变化规律及优势种类6–11月网衣附着藻类生物量的月际变化见图 1。结果显示,相同月份、不同深度的藻类附着量存在差异。7月16日–8月6日,下层附着框上附着的藻类重量显著低于上层和中层(P < 0.01),上层和中层差异不显著(P > 0.05);8月7日–9月14日,上层与中层及下层差异显著(P < 0.01),中层及下层无差异(P > 0.05);9月15日–10月14日,下层与上层及中层差异显著(P < 0.01),上层和中层无差异(P > 0.05);10月15日–11月14日三层均差异不显著(P > 0.05)。相同深度、不同月份的附着藻类日均增长量差异显著,8月7日– 9月14日时间段内,各层的藻类日均增长量都显著高于其他月份。从附着藻类的日均附着量来看,其生长受水温影响显著(P < 0.05)。

|
图 1 不同深度附着藻类日均增长量的月际变化 Figure 1 Monthly variation of average daily weight gain of fouling macroalgae in different depth 由于6月15日–7月15日实验海域有台风经过,仅存上层一个附着框,因此,这段时间的上、中、下藻类附着量均用此附着框的数据代替。不同字母表示差异显著(P < 0.05) Due to the typhoon in the test sea area during 15th June to 15th July, only one frame in the upper layer remained, as the result, the data of this frame were applied to other different layer frames. Different letters indicated significant differences (P < 0.05) |
各个月份网衣附着生物的种类统计结果见表 1。结果显示,实验期间的每个月均有海头红,而玻璃海鞘仅在8月出现,且海头红的干重占比始终在90%以上,是网衣附着藻类的优势种。
|
|
表 1 6–11月桑沟湾楮岛海域网衣附着生物的种类 Table 1 Species of biofouling in cage culture area of Chudao, Sanggou Bay from June to November |
23℃条件下,黄斑篮子鱼对海头红的摄食能力见表 2。结果显示,摄食率可达(10.91±0.69) mg/(g·h),从碳收支结果来看,以海头红为食物来源的黄斑篮子鱼每天摄入的碳为(2.31±0.15) mg/(g·h),其中,约有71.43%用于代谢,11.69%用于生长。由图 2得出的碳收支方程“100摄入碳=11.69生长碳+10.82粪便碳+6.06排泄碳+71.43代谢碳”中可以看出:摄入碳的大部分以代谢碳的形式输出,排泄碳的占比最小,生长碳的比重略大于粪便碳。

|
图 2 23℃黄斑篮子鱼摄食海头红的碳收支 Figure 2 Carbon budget of S. oramin feeding with P. telfairiae at 23℃ |
|
|
表 2 23℃条件下黄斑篮子鱼对海头红的摄食及代谢生理(n=3) Table 2 Data of feeding and metabolic physiology of S. oramin and its feeding of P. telfairiae at 23℃ (n=3) |
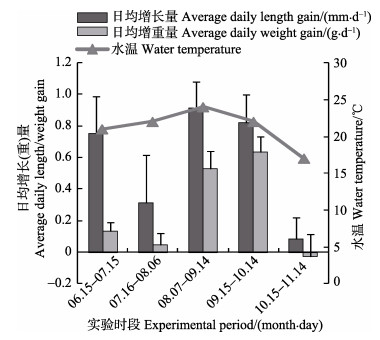
从6月中旬–11月中旬黄斑篮子鱼生长过程来看(图 3),其生长受水温影响明显,在取样阶段平均水温约24℃时,日均增长量达到最高,为0.91 mm/d。当平均水温降到17℃时,日均增长量和日均增重量均出现最低值,分别为0.08 mm/d和–0.03 g/d,水温较高的8月7日–10月14日时间段内生长较快。
|
图 3 黄斑篮子鱼在不同月份的日均增长/重量 Figure 3 Average daily length/weight gain of S. oramin during the experimental period |
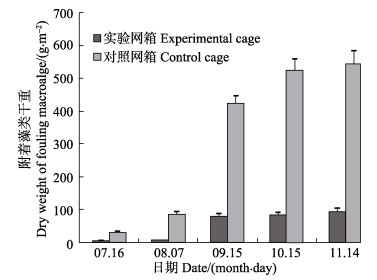
黄斑篮子鱼对附着藻类生长的控制作用非常明显(图 4),实验期间,清除率在80.28%–90.15%之间,在附着藻类生物量最多的8月,清除率达到81.25%。
|
图 4 不同月份篮子鱼对附着藻类的清除率 Figure 4 Removal rate of fouling macroalage by S. oramin in different month |
目前,附着生物的防除主要通过物理措施、化学手段及生物学方法(刘姗姗等, 2006)。相对于生物学方法,物理措施与化学手段存在多种弊端,如物理措施费时费力,且容易造成网具不同程度的磨损,影响使用寿命(Holm et al, 2003; 阎斌伦等, 2005);化学手段中的有毒物质对海洋生物的生长发育有不同程度的负面影响等(Evans, 1999; 陈纪国, 2016)。而生物防治方法对环境友好,清除附着生物时不会对海洋环境和生态造成不良的影响。
与桑沟湾其他区域的附着生物相比,桑沟湾南部楮岛海域的附着生物具有非常明显的特点:首先,附着生物的多样性低,实验期间的大型附着生物种类只有2种,而桑沟湾北部的寻山贝藻养殖区,2007年5月–2008年4月鉴定出的大型附着生物达23种(齐占会等, 2010);其次,优势种的组成简单,以红藻门的海头红为主,各月份的生物量均占到总生物量的90%以上,该藻藻体扁平,丛生,基部有匍匐枝,向上生出扁平直立的羽状分枝,分枝上有齿状小枝,形态特征符合篮子鱼的摄食特点。本研究黄斑篮子鱼对海头红的摄食结果显示,黄斑篮子鱼对海头红的摄食速度较快,且摄食海头红能够满足黄斑篮子鱼正常的生理生长需要。Pillans等(2004)发现,褐篮子鱼(Siganus fuscescens)对不同藻类摄食选择性的结果也显示,褐篮子鱼对红藻门的刺枝鱼栖苔(Acanthophora spicifera)和帚状江蓠(Gracilaria edulis)的摄食能力显著高于对褐藻门网地藻(Dictyota dichotoma)、匍扇藻(Lobophora variegata)和绿藻门银白钙扇藻(Udotea argentea)的摄食,对2种红藻的同化效率分别达到54.16%和39.51%。这些特点为实施篮子鱼生物清除提供了良好的自然条件。
碳收支是研究生物体内能量循环的有效手段,通过碳收支方程,可以进一步了解黄斑篮子鱼摄食海头红的能量分配策略。由于涉及篮子鱼的碳收支方面的研究较少,选择了梭鱼(Sphyraenus)和真鲷(Pagrosomus major) 2种海水鱼与其进行对比,2种鱼自由摄食状态下的碳收支分别为:100摄入碳=9.29生长碳+9.69粪便碳+81.03非粪便流失碳(排泄碳+代谢碳)(康斌等, 2007),100摄入碳=13.99生长碳+12.34粪便碳+8.33排泄碳+65.35代谢碳(李军等, 1998)。对比23℃下黄斑篮子鱼对海头红的碳收支方程“100摄入碳=11.69生长碳+10.82粪便碳+6.06排泄碳+71.43代谢碳”,可以看出本研究结果与上述研究相似,因为碳收支与能量收支类似,只是用碳作为计量单位,因此,可以推测黄斑篮子鱼的能量分配为:大部分的能量用于维持其代谢需求,较多的能量伴随着代谢产物排出体外,从而导致用于生长的能量较低。相比饲料喂养的黄斑篮子鱼日均增重0.27 g (冯广朋等, 2008),摄食附着藻类的篮子鱼,日均增重仍达到了0.26 g,这说明只摄食藻类的能量摄入足以满足其自身的正常生长。
国内外很多关于篮子鱼的研究集中在食性、生长、繁殖、分子生物学等方面(Hoque et al, 1999; Pillans et al, 2004; 沈卓坤等, 2003; 陈傅晓等, 2006),把黄斑篮子鱼应用于网衣清洁的深入研究并不多见。实验发现,黄斑篮子鱼对网衣上附着藻类的平均清除率达80%以上,充分利用其对网衣上藻类的清除作用,就可以在相同的养殖时间内,做到少换或者不换网衣。因此,选择黄斑篮子鱼与合适物种混养,既能有效抑制藻类的附着,降低人力成本,还可以为养殖户带来额外的收入,具有显著的生态和经济效益。
| Chen FX, Feng QY. Cage culture technique of Siganus oramin. Fishery Modernization, 2006, 33(5): 19-20 [陈傅晓, 冯全英. 莹斑篮子鱼网箱养殖技术. 渔业现代化, 2006, 33(5): 19-20] | |
| Chen JG. Construction proposal of anti-fouling coatings in nuclear power plants. Overall Corrosion Control, 2016, 30(1): 83-86 [陈纪国. 核电站防海生物涂料施工建议. 全面腐蚀控制, 2016, 30(1): 83-86] | |
| Cronin ER, Cheshire AC, Clarke SM, et al. An investigation into the composition, biomass and oxygen budget of the fouling community on a tuna aquaculture farm. Biofouling, 1999, 13(4): 279-299 DOI:10.1080/08927019909378386 | |
| Evans SM. TBT or not TBT: That is the question. Biofouling, 1999, 14(2): 17-129 | |
| Feng GP, Zhang LZ, Zhuang P, et al. Feeding habit and growth characteristics of Siganus canaliculatus cultured in sea net cage. Marine Fisheries, 2008, 30(1): 37-42 [冯广朋, 章龙珍, 庄平, 等. 海水网箱养殖长鳍篮子鱼的摄食与生长特性. 海洋渔业, 2008, 30(1): 37-42] | |
| Holm ER, Haslbeck EG, Horinek AA. Evaluation of brushes for removal of fouling from fouling-release surfaces, using a hydraulic cleaning device. Biofouling, 2003, 19(5): 297-305 DOI:10.1080/0892701031000137512 | |
| Hoque MM, Takemuar A, Matsuyama M, et al. Lunar spawning in Siganus canaliculatus. Journal of Fish Biology, 1999, 55(6): 1213-1222 DOI:10.1111/jfb.1999.55.issue-6 | |
| Kang B, Xian WW, Wu YF. Carbon budget of redlip mullet (Liza haematocheila T. & S.) under different feeding rates. Periodical of Ocean University of China (Natural Science Edition, 2007, 37(2): 247-250 [康斌, 线薇微, 武云飞. 不同摄食水平条件下鮻的碳收支研究. 中国海洋大学学报(自然科学版), 2007, 37(2): 247-250] | |
| Li J, Xu CA, Xu SH, et al. Study on energy budget, nitrogen and carbon budget in young red sea bream. Marine Sciences, 1998, 22(2): 46-48 [李军, 徐长安, 徐世宏, 等. 真鲷能量收支和氮与碳收支的初步研究. 海洋科学, 1998, 22(2): 46-48] | |
| Liu SS, Yan T. Present situation and development prospects of prevention of marine biofouling. Journal of Marine Sciences, 2006, 24(4): 53-60 [刘姗姗, 严涛. 海洋污损生物防除的现状及展望. 海洋学研究, 2006, 24(4): 53-60] | |
| Lu ZK. The status and prospect for rabbitfish farming. Modern Fisheries Information, 1996, 11(3): 20-23 [陆忠康. 篮子鱼(Rabbitfish farming)养殖现状及其发展前景. 现代渔业信息, 1996, 11(3): 20-23] | |
| Mao XH, Hao YW, Yang XL. Carbon metabolism and energy metabolism of Argopecten irradians and Chlamys ferrari. Acta Oceanologica Sinica, 1997, 19(4): 132-137 [毛兴华, 郝亚威, 杨小龙. 海湾扇贝和栉孔扇贝的碳代谢及能量代谢. 海洋学报, 1997, 19(4): 132-137] | |
| Ma Q, Liu J. Introduction and prospect of the systematic study of Siganidae in China. South China Fisheries Science, 2006, 2(4): 68-74 [马强, 刘静. 篮子鱼科的系统研究概况及我国篮子鱼科的研究展望. 南方水产, 2006, 2(4): 68-74] | |
| Pillans RD, Franklin CE, Tebbetts IR. Food choice in Siganus fuscescens: Influence of macrophyte nutrient content and availability. Journal of Fish Biology, 2004, 64(2): 297-309 DOI:10.1111/jfb.2004.64.issue-2 | |
| Qi ZH, Fang JG, Zhang JH, et al. Seasonal succession of fouling communities in the poly-culture area of scallop Chlamys farreri and kelp Laminaria japonica in Sanggou Bay. Progress in Fishery Sciences, 2010, 31(4): 72-77 [齐占会, 方建光, 张继红, 等. 桑沟湾贝藻养殖区附着生物群落季节演替研究. 渔业科学进展, 2010, 31(4): 72-77] | |
| Shen ZK, Chen S. Co-culture technique of tiger shrimp and rabbitfish in the pond. Journal of Aquaculture, 2003, 24(6): 12-13 [沈卓坤, 陈赛. 篮子鱼与斑节对虾的池塘混养技术. 水产养殖, 2003, 24(6): 12-13] | |
| Wang JJ, Huang ZG, Li CY, et al. Investigation of cage farms biofouling in Xiamen port. Acta Oceanologica Sinica, 1996, 18(5): 93-102 [王建军, 黄宗国, 李传燕, 等. 厦门港网箱养殖场污损生物的研究. 海洋学报, 1996, 18(5): 93-102] | |
| Yan BL, Hu XL, Qiao JY. Culture technology of anti-wave cage in deep sea. China Fisheries, 2005, 11061106(6): 60-62 [阎斌伦, 胡希亮, 乔进友. 深海抗风浪网箱养殖技术. 中国水产, 2005, 11061106(6): 60-62] | |
| Yan T, Yan WX, Dong Y, et al. Investigation of biofouling in offshore areas east of Hainan Island. Oceanologia et Limnologia Sinica, 1998, 29(4): 374-380 [严涛, 严文侠, 董钰, 等. 海南岛东部海域生物污损的研究. 海洋与湖沼, 1998, 29(4): 374-380] |



