2. 农业部海洋渔业可持续发展重点实验室 青岛市海水鱼类 种子工程与生物技术重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 大连海洋大学 大连 116023;
4. 烟台开发区天源水产有限公司 烟台 261418
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Dalian Ocean University, Dalian 116023;
4. Yantai Tianyuan Fisheries Corporation, Yantai 261418
美洲黑石斑鱼(Centropristis striata)属鮨科(Serranidae)、石斑鱼亚科(Serraninae),又名条纹锯鮨、黑锯鮨,通称黑石斑,有翡翠斑、珍珠斑、天星斑、宝石斑等多种美名,是美国东部沿海重要的商业捕捞对象、游钓鱼种和观赏鱼类,曾是我国北方工厂化和南方网箱重要的养殖品种之一(王波等, 2003)。随着我国石斑鱼产业逐渐进入规模化养殖阶段,石斑鱼的各种病害也随着养殖规模的扩大呈现迅速上升的势头,经常造成大面积死亡,给养殖业主带来巨大经济损失,严重制约了石斑鱼养殖业的发展。我国已报道的养殖石斑鱼致病性细菌有创伤弧菌(Vibrio vulnificus)、溶藻弧菌(V. alginolyticus)、河流弧菌(V. fluvialis)、哈维氏弧菌(V. harveyi)、产气单胞杆菌(Aeromonas sp.)、鲨鱼弧菌(V. cardhariae)、假单胞菌(Pseudomonas spp.)、不动杆菌(Acinetobacter spp.)等(刘秀珍等, 1994; 朱传华等, 2000; 鄢庆枇等, 2001; 覃映雪等, 2004; 吴定虎等, 1989)。
2015年6月,烟台天源水产有限公司养殖的一批2龄美洲黑石斑鱼,患有“突眼病”症。本研究对其“突眼症”的病灶部位、肝脏、脾脏、肾脏等组织器官取样,通过生理生化及分子生物学技术手段鉴定,揭示了诱发美洲黑石斑鱼“突眼症”的病原体,为其健康养殖及综合防治提供理论支撑。
1 材料与方法 1.1 实验动物 1.1.1 患病美洲黑石斑鱼2015年8月10日,选取5尾患病的体重为(250±10) g、体长为(22±2) cm的2龄美洲黑石斑鱼个体,暂养于烟台天源水产养殖有限公司。
1.1.2 健康美洲黑石斑鱼感染实验选用体重为(8.65±1.15) cm、体长为(11.365±4.415) g的健康美洲黑石斑鱼幼鱼,共计420尾。
1.2 病原菌的分离和纯化取患“突眼症”的濒死美洲黑石斑鱼,在无菌条件下,用75%酒精棉对鱼体消毒后,取出眼球、肝脏、脾脏、肾脏等器官组织,用1.5%的无菌生理盐水冲洗后剪碎。取剪碎的组织,在无菌TSA培养基和TCBS培养基上分别划线分离,在28℃条件下,培养24 h。从眼球、肝脏、脾脏、肾脏等器官组织中,分别分离得到形态特征一致的4株优势菌。经鉴定,它们属同一种(定名为CJG01),连续纯化培养3代。挑取纯化后的单菌落于TSB液体培养基扩增,在28℃条件下,培养10 h。按照菌液:80%甘油=8:2的比例,将扩增后的菌液保存于灭菌后的80%甘油中,置于–80℃超低温冰箱保种备用。
1.3 致病菌株的电镜观察先用PBS冲洗菌株,再用3%戊二醛固定10 min,碳网沾取后晾干5 min,1%磷钨酸染色3 min,自然状态晾15 min,用日本JEOL电子公司JEM-1200EX透射电镜观察(范文辉等, 2005)。对患有“突眼症”美洲黑石斑鱼个体的眼球、脾脏、肝脏、肾脏等器官组织样品,采用透射电镜和扫描电镜结合检查病毒颗粒(陈超等, 2010)。
1.4 人工感染实验将致病菌株用1.5%无菌生理盐水制成3.0× 108 CFU/ml菌悬液(采用酶标仪和平板稀释计数法结合计算),10倍浓度系列稀释后备用。设6个浓度组(A1、A2、A3、A4、A5和A6),每个浓度下,设3个平行组(A1.1、A1.2、A1.3; A2.1、A2.2、A2.3; A3.1、A3.2、A3.3; A4.1、A4.2、A4.3; A5.1、A5.2、A5.3; A6.1、A6.2、A6.3),每平行组20尾幼鱼,共计360尾。空白对照设3个平行组(B1、B2和B3),每组20尾幼鱼,共计60尾。有效水体19 L的泡沫箱,每天换水1/2,充气暂养7 d后开始实验。养殖环境:水温26–33℃,盐度26–32,溶氧6.1–6.7 mg/L,pH值7.4–8.1。实验组采用肌肉注射攻毒,注射0.1 ml相应浓度的菌液;对照组肌肉注射0.1 ml的1.5%无菌生理盐水,观察并记录幼鱼发病症状及每日死亡尾数,统计3个平行组幼鱼的平均死亡数。取濒死美洲黑石斑鱼幼鱼的眼球、肝脏、脾脏、肌肉等器官组织,再次分离纯化,方法同上。将再次分离纯化的优势菌株制成高浓度(3.0×108CFU/ml),采用肌肉注射法注射对照组,最后将第2次分离的优势菌株与原菌株一起进行细菌鉴定(范文辉等, 2005)。采用寇氏法计算菌株的半致死浓度LD50(邹玉霞等, 2004):
| $ {\rm{lgL}}{{\rm{D}}_{50}} = {X_{\rm{k}}} - d({P_i} - 0.5) $ |
式中,Xk为最大对数值,d为相邻两组对数值差,Pi为死亡率,i为分组号。
1.5 生理生化鉴定采用API-20NE和API-20NE自动鉴定系统进行鉴定。并结合生理生化测试盒及相关生理生化鉴定管(青岛海博生物技术有限公司)补充鉴定(吕俊超等, 2009)。
1.6 细菌16S rDNA序列测定 1.6.1 PCR模板DNA的制备用灭菌牙签挑取单菌落悬浮于50 μl无菌去离子水中,100℃水浴5 min,12000 r/min离心20 min,取1 μl上清液作为PCR反应所用模板DNA(范文辉等, 2005)。
1.6.2 PCR扩增与测序采用扩增16S rDNA序列通用引物,正向引物27F:5'-AGAGTTTGATCCTGG CCTGGCTCAG-3',反向引物1492R:5'-TACGGCTA CCTTGTTACGACTT-3'。PCR反应条件:94℃预变性10 min;94℃变性40 s,55℃复性30 s,72℃延伸90 s,35个循环;最后72℃温育7–10 min。PCR产物由上海桑尼生物科技有限公司纯化、测序。根据测序结果,在GenBank中使用BLAST(http://www.ncbi.nlm.nih.gov/blast)进行同源性比较,在网站(http://www.bacterio.net/vibrio.html)选取与哈维氏弧菌同源性较高的10株代表菌株的16S rDNA序列,采用MEGA5.05软件构建系统发育树(Tamura et al, 2011)。
1.7 药物敏感实验将培养24 h的细菌制成浓度为1.0×108 CFU/ml菌悬液(陈超等, 2010),取50 μl涂布于TSA培养基平板中(平板直径为90 mm,培养基厚度为4 mm)。用无菌镊子将抗菌素纸片(杭州微生物试剂有限公司)贴于平板中央,每个平板1片,28℃恒温培养24 h。
结果判读:记录纸片周围抑菌圈直径,根据美国临床实验室标准化协会CLSI (Clinical and Laboratory Standards Institute)标准,报告细菌对该抗生素是敏感(Susceptible, S)、耐药(Resistant, R)、中介(Intermediate, Ⅰ) (陈佳玉等, 2010)。
2 结果与分析患病的美洲黑石斑鱼表现为眼球充血、肿大等症状。病鱼游动、摄食能力下降,最终眼球脱落,患病鱼死亡。经统计分析,美洲黑石斑鱼的“突眼症”死亡率高达90%。用电镜扫描眼球、肝脏、脾脏、肾脏、等器官组织部位,未发现病毒颗粒。在光学显微镜下观察未发现寄生虫。pH、光照、盐度、温度、氨氮、亚硝酸盐等环境因子指标均符合美洲黑石斑鱼的生理生态条件。
2.1 病原菌株的形态特征CJG01菌落在TCBS平板上呈黄色,边缘光滑,有黏性。革兰氏阴性菌。菌株经电镜负染后观察,菌株呈短杆状,端生单鞭毛。菌株CJG01大小约(2.3–3.4)×(1.52–1.58) μm,鞭毛长约6.0–7.8 μm(图 1)。
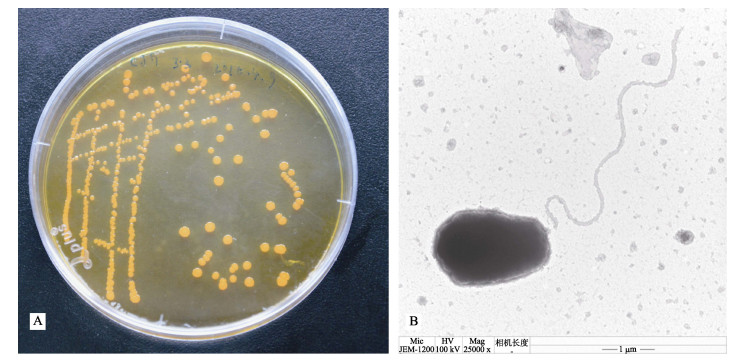
|
图 1 CJG01的菌落和菌体形态 Figure 1 Colonies and cell morphology of the strain CJG01 A.菌株CJG01在TCBS培养基上形成边缘光滑整齐的黄色菌落;B.菌株CJG01的电镜照片(bar=1 μm) A. CJG01 in TCBS medium, bright yellow colonies; B. Electron microscope photograph of CJG01 (bar=1 μm) |
菌株CJG01感染美洲黑石斑鱼幼鱼1–2 d,高浓度感染组的幼鱼大量死亡,低浓度感染组下的幼鱼游泳能力、摄食能力下降,肌肉注射部位红肿、鳞片脱落。感染3–5 d,幼鱼肌肉注射部位溃烂,眼球增生;感染6–7 d,肌肉腐烂,眼球脱落,幼鱼死亡(图 2)。

|
图 2 感染菌株CJG01后的幼鱼发病症状 Figure 2 Symptoms of the C. sriata juvenile infected with CJG01 A.脱鳞;B.皮肤溃烂;C.眼球突出;D.眼球脱落,幼鱼死亡 A. Desquamation; B. Skin eruptions; C. Exophthalmos; D. Eyeball fell off, the fry died |
取濒死幼鱼病灶部位显微镜镜检,发现有大量运动细菌(表 1)。解剖观察发现,患病幼鱼的肝脏、肾脏红肿,脾脏肿大,肠道内有淡黄色液体。从患病美洲黑石斑鱼幼鱼的病灶部位处,再次分离得到的优势菌株,其形态和生理生化反应与菌株CJG01一致,将其制成浓度为3.0×108 CFU/ml的菌悬液,感染对照组的美洲黑石斑鱼幼鱼,结果幼鱼全部死亡。优势菌株CJG01诱发了美洲黑石斑鱼“突眼症”,肌肉注射的菌株CJG01的半致死浓度LD50为2.67×105 CFU/ml。
|
|
表 1 CJG01对美洲黑石斑鱼幼鱼人工感染实验结果 Table 1 Results of healthy C. sriata juvenile infected with CJG01 |
菌株CJG01生理生化特性为革兰氏阴性,对弧菌抑制剂O/129敏感。生长温度为28–37℃,最适温度为28℃,在含盐量为0–5%的TSB培养基可生长,氧化酶反应阳性,鸟氨酸脱羧酶反应阳性,V-P反应阴性,可同化甘露醇、麦芽糖、苹果酸,不能同化葡萄糖、阿拉伯糖、甘露糖、癸酸、已二酸、柠檬酸、苯乙酸等,其他理化性质见表 2。参考《伯杰氏细菌鉴定手册》(第九版)、《一般细菌常用鉴定方法》以及相关文献(Cano-Gomez et al, 2009; 毛芝娟等, 2002)等资料,证实菌株CJG01与哈维氏弧菌的各项生理生化特性一致。
|
|
表 2 菌株CJG01生理生化特征 Table 2 Physiological and biochemical characteristics of CJG01 |
菌株CJG01的16S rDNA序列长度为1424 bp (图 3),BLAST同源比对结果显示,其与哈维氏弧菌的同源性高达99%。从NCBI核酸数据库中,选取10株水产动物致病菌株的16S rDNA基因序列进行系统发育树分析,并采用MEGA5.05软件构建发育树(图 4)。可以看出,该菌株于哈维氏弧菌的亲缘关系最为接近。可认定菌株CJG01为哈维氏弧菌。
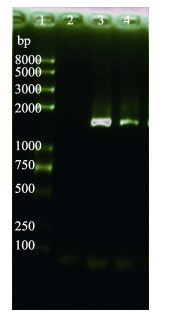
|
图 3 菌株CJG01的16S rDNA PCR产物琼脂糖电泳 Figure 3 Agarose electrophoresis of 16S rDNA amplified products of CJG01 1. DNA marker;2.阴性对照;3.鳗弧菌阳性对照;4. 16S rDNA产物 1. DNA marker; 2. Negative control; 3. Vibrio anguillarum positive control; 4. 16S rDNA product |

|
图 4 基于菌株CJG01的16S rDNA序列构建的系统发育树 Figure 4 Phylogenetic tree based on 16S rDNA sequence of CJG01 |
菌株CJG01对28种药物的敏感性结果显示(表 3),该菌株对氨苄西林、头孢氨苄、头孢拉定、诺氟沙星、青霉素、多粘菌素B、阿奇霉素等药物不敏感,对头孢唑林、恩诺沙星、链霉素、红霉素、克拉霉素等药物中度敏感,对头孢哌酮、头孢曲松、头孢他啶、氧氟沙星、洛美沙星、氟罗沙星、环丙沙星、氯霉素、新生霉素、新霉素、庆大霉素、卡那霉素、呋喃唑酮、利福平、四环素、米诺环素等药物敏感。
|
|
表 3 菌株CJG01对抗菌药物的敏感性 Table 3 The sensitivity of CJG01 to antimicrobial agents |
弧菌是海洋环境中最常见的细菌群之一,广泛分布于河口近岸、海区、淡水和生物体中(何苹萍等, 2013),其致病性受宿主的生理状态及水质环境条件等综合因素的影响较大,是一类条件致病菌(郑天伦等, 2002)。在养殖过程中,因过量投饵和养殖鱼类的排泄物引起底质极端恶化,使水体中的氨氮、硫化氢含量显著升高,养殖水体溶氧显著下降,在恶劣的气候条件下,如夏季闷热无风或突降暴雨的天气,盐度和pH值急剧变化;宿主受到病毒、真菌、寄生虫等的感染和侵害,宿主机能下降,病原弧菌大量侵入宿主,弧菌疾病的暴发(胡超群等, 2010; 金珊等, 2005; 杨少丽等, 2005)。海水鱼类弧菌疾病流行温度为25–32℃(赵桂林等, 2014)范围。本研究证实,环境温度低于15℃时,哈维氏弧菌的增殖得到抑制,当温度达到28–37℃时,菌落迅速扩增,在含有0–5% NaCl的TSB培养基能够生长。
本研究的菌株CJG01经过电镜负染,观察到菌株CJG01呈短杆状,端生单鞭毛;革兰氏染色为阴性,在TCBS培养基上为黄色,边缘透明,中间隆起,有黏性;对弧菌抑制剂O/129敏感,氧化酶反应阳性。采用API-20NE鉴定系统以及相关生理生化鉴定管对分离的菌株CJG01进行生理生化特征比较分析,得出其生理生化特性与哈维氏弧菌一致(陈献稿等, 2004; 林克冰等, 1999)。为进一步确认菌株CJG01的分类学地位,采用BLAST比对其16S rDNA序列,证实菌株与哈维氏弧菌的同源性高达99%,确认菌株CJG01为哈维氏弧菌。最新16S rDNA系统发育学分析比较细菌核糖体DNA基因片段的同源性,实现对细菌的分类学鉴定,理论上具有很好的可靠性,但截止到1996年,只测定了3500余种细菌的完整16S rDNA序列,给鉴定结果的准确性带来很大的影响,如果没有生理生化鉴定结果作为佐证,可能无法得出准确的结论。因此,在进行生物物种鉴定时采用多种方法,取长补短,相互补充,保证鉴定结果的客观性和科学性(陈晓燕等, 2003; 范文辉等, 2005)。本次致病菌的感染实验证实了哈维氏弧菌是引发美洲黑石斑鱼突眼病的条件致病菌之一。
养殖过程中弧菌病害时有发生,且流行于多个国家和地区,是许多养殖鱼类的病原菌(Harikrishnan et al, 2010; 黄志坚等, 2002; 金珊等, 2005; 林克冰等, 2014; 罗鸣等, 2013)。研究表明,哈维氏弧菌通过分泌溶血素、蛋白酶及脂多糖来破坏宿主组织(王海阳等, 2014)。本研究证实,哈维氏弧菌侵染肌肉组织后,染病部位出现脱鳞、肌肉溃烂,严重的可见骨骼外露;伴随烂尾、突眼等症状。解剖鱼的内脏,可在肝脏、肾脏、脾脏等组织中分离出致病菌。解剖发现,肝脏、脾脏、肾脏充血严重,小肠内有黄色液体流出。有研究证实,哈维氏弧菌可导致鱼的病变组织,如头肾、脾、胸腺、肝、粘膜淋巴组织和肠的上皮细胞出现不同程度的变性及坏死,细胞超微病变观察发现,这些组织的线粒体出现空泡化(任红梅等, 2011)。肾小管上皮细胞变性、坏死;颗粒细胞的细胞核核膜部分溶解;脾窦和脾索分界不明显;脾颗粒细胞核核膜溶解,胸腺中有较多空泡;肝细胞胞浆内脂滴积累多;肠绒毛萎缩,肠上皮细胞胞质多数线粒体、内质网等相互聚集固缩,粘膜上皮细胞坏死、脱落(徐晓津等, 2009)等现象。本人工感染实验中,采用肌肉注射攻毒美洲黑石斑鱼幼鱼,出现了较高的死亡率,半致死浓度LD50=2.67×105 CFU/ml。证实了哈维氏弧菌是毒性很强的致病菌,具有很强的致病性。哈维氏弧菌引起石斑鱼突眼病的病原体的研究报道较少,国内外主要是对其生理生化特性以及病理做了研究,对于其致病因子,致病机理等需要今后做进一步的研究。
| Cano-Gomez A, Bourne DG, Hall MR, et al. Molecular identification, typing and tracking of Vibrio harveyi in aquaculture systems: Current methods and future prospects. Aquaculture, 2009, 287(1-2): 1-10 DOI:10.1016/j.aquaculture.2008.10.058 | |
| Chen C, Cheng B, Wang YG, et al. Isolation and identification of a pathogenic bacterium from Epinephelus septemfasciatus with exophthalmic disease. Progress in Fishery Sciences, 2010, 31(1): 25-32 [陈超, 程波, 王印庚, 等. 七带石斑鱼繁殖群体"突眼"症病原菌的分离与鉴定. 渔业科学进展, 2010, 31(1): 25-32] | |
| Chen JY, Liang Y. Clinical test series (microbiology test booklet). Hangzhou: Zhejiang University Press, 2010, 35-36 [陈佳玉, 梁勇. 临床检验系列教程(微生物学检验分册). 杭州: 浙江大学出版社, 2010, 35-36] | |
| Chen XG, Wu SQ, Shi CB, et al. Isolation and identification of pathogenetic Vibrio harveyi from estuary cod Epinephelus coioides. Journal of Fishery Sciences of China, 2004, 11(4): 313-317 [陈献稿, 吴淑勤, 石存斌, 等. 斜带石斑鱼病原菌(哈维氏弧菌)的分离与鉴定. 中国水产科学, 2004, 11(4): 313-317] | |
| Chen XY, Hu CQ, Chen C. Characteristics of pathogenic bacteria of vibriosis in caged Malabar grouper, Epinephelus malabaricus. Marine Sciences, 2003, 27(6): 68-71 [陈晓燕, 胡超群, 陈偿. 人工养殖点带石斑鱼弧菌病病原菌的分离及鉴定. 海洋科学, 2003, 27(6): 68-71] | |
| Fan WH, Huang J, Wang XH, et al. Identification and phylogenetic study of pathogenic bacteria causing ulcer disease of cultured Turbot (Scophthalmus maximus). Acta Microbiologica Sinica, 2005, 45(5): 665-670 [范文辉, 黄倢, 王秀华, 等. 养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析. 微生物学报, 2005, 45(5): 665-670] | |
| Harikrishnan R, Balasundaram C, Heo MS. Molecular studies, disease status and prophylactic measures in grouper aquaculture: Economic importance, diseases and immunology. Aquaculture, 2010, 30(9): 1-14 | |
| He PP, Zhao YZ, Chen XL, et al. Isolation and identification of Vibrio in cultured Litopenaeus vannamei. Jiangsu Agricultural Sciences, 2013, 41(6): 199-202 [何苹萍, 赵永贞, 陈秀荔, 等. 凡纳滨对虾及养殖水体中弧菌的分离鉴定. 江苏农业科学, 2013, 41(6): 199-202] | |
| Hu CQ, Tao BH. Penaeid shrimp vibriosis and immune prevention: A review. Tropic Oceanology, 2010, 19(3): 84-92 [胡超群, 陶保华. 综述:对虾弧菌病及其免疫预防的研究进展. 热带海洋, 2010, 19(3): 84-92] | |
| Huang ZJ, He JG. Isolation, identification and pathogenicity of the bacterial pathogen in Epinephlus fario. Acta Scientiarum Naturalium Universitatis Sunyatseni,, 2002, 41(5): 64-67 [黄志坚, 何建国. 鲑点石斑鱼细菌病原的分离鉴定和致病性. 中山大学学报(自然版), 2002, 41(5): 64-67] | |
| Jin S, Wang GL, Zhao QS, et al. Epidemiology of vibriosis in large yellow croaker Pseudosciaena crocea (Richardson) in marine cage culture. Fisheries Science, 2005, 24(1): 17-19 [金珊, 王国良, 赵青松, 等. 海水网箱养殖大黄鱼弧菌病的流行病学研究. 水产科学, 2005, 24(1): 17-19] | |
| Lin KB, Wu JS, Huang ZB, et al. Isolation and identification of a bacterial pathogen from Epinephelus coioides. Journal of Fujian Fisheries, 2014, 36(6): 419-427 [林克冰, 吴建绍, 黄兆斌. 一株斜带石斑鱼(Epinephelus coioides)病原菌的分离与鉴定. 福建水产, 2014, 36(6): 419-427] | |
| Lin KB, Zhou C, Liu JF, et al. Studies on the pathogenic bacteria of Pseudosciaena crocea in marine cage culture. Marine Sciences, 1999, 11061106(4): 58-68 [林克冰, 周宸, 刘家富, 等. 海水网箱养殖大黄鱼病原菌研究. 海洋科学, 1999, 11061106(4): 58-68] | |
| Liu XZ, Zou XL, Mo XY, et al. A study on the pathogen of vibriosis isolated from diseased Epinephelus sp. in cage mariculture. Tropic Oceanology, 1994, 13(1): 81-86 [刘秀珍, 邹晓理, 莫小燕, 等. 海水网箱养殖石斑鱼病原菌研究. 热带海洋, 1994, 13(1): 81-86] | |
| Luo M, Chen FX, Liu LL, et al. Progress in disease research of grouper aquaculture in China. Fisheries Science, 2013, 32(9): 549-553 [罗鸣, 陈傅晓, 刘龙龙, 等. 我国石斑鱼养殖疾病的研究进展. 水产科学, 2013, 32(9): 549-553] | |
| Lv JC, Zhang XH, Wang Y, et al. Isolation and identification of bacterial pathogen: Aeromonas salmonicida subsp. achromogenes in cultured turbot and histopathological study. Periodical of Ocean University of China (Natural Science), 2009, 39(1): 91-95 [吕俊超, 张晓华, 王燕, 等. 养殖大菱鲆病原菌:杀鲑气单胞菌无色亚种的分离鉴定和组织病理学研究. 中国海洋大学学报(自然科学版), 2009, 39(1): 91-95] | |
| Mao ZJ, Liu GY, Chen CF. Isolation and identification of pathogenic bacteria causing ulcerosis in large yellow croaker (Pseudosciaena crocea). Journal of Anhui Agricultural University, 2002, 29(2): 178-181 [毛芝娟, 刘国勇, 陈昌福. 大黄鱼溃疡病致病菌的初步分离与鉴定. 安徽农业大学学报, 2002, 29(2): 178-181] | |
| Qin YX, Chi XC, Su YQ, et al. The pathogeny of ulcer disease in Epinephlus awoara. Journal of Fisheries of China, 2004, 28(3): 297-302 [覃映雪, 池信才, 苏永全, 等. 网箱养殖青石斑鱼的溃疡病病原. 水产学报, 2004, 28(3): 297-302] | |
| Ren HM, He Z, Yang DY, et al. Pathological study on rice field eel artificial infected by Aeromonas sobria. Journal of Hydroecology, 2011, 32(1): 118-120 [任红梅, 何智, 杨德英, 等. 黄鳝人工感染温和气单胞菌的组织病理学研究. 水生态学杂志, 2011, 32(1): 118-120] | |
| Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739 DOI:10.1093/molbev/msr121 | |
| Wang B, Zhu MY, Mao XH. The new variety-Centropristis striata for artificial culture. Hebei Fisheries, 2003, 11061106(5): 26-27 [王波, 朱明远, 毛兴华. 养殖新品种-美洲黑石斑鱼. 河北渔业, 2003, 11061106(5): 26-27] | |
| Wang HY, Huang YC, Ding Y, et al. Construction and protection evaluation of DNA vaccine of Vibrio harveyi GST genes on orange-spotted grouper (Epinephelus coioides). Journal of Guangdong Ocean University, 2014, 34(4): 50-55 [王海阳, 黄郁葱, 丁燏, 等. 哈维氏弧菌GST核酸疫苗制备及其对斜带石斑鱼的免疫保护作用. 广东海洋大学学报, 2014, 34(4): 50-55] | |
| Wu DH. The preliminary research for the prevention and cure of diseases in Epinephelus akaara. Journal of Fujian Fisheries, 1989, 11061106(3): 59-64 [吴定虎. 赤点石斑鱼的病害及其防治的初步研究. 福建水产, 1989, 11061106(3): 59-64] | |
| Xu XJ, Xu B, Wang Jun, et al. Effect of V. harveyi on the main organs of P. crocea (Electronic microscope section). Journal of Xiamen University (Natural Science), 2009, 48(2): 281-284 [徐晓津, 徐斌, 王军, 等. 哈维氏弧菌人工感染大黄鱼的组织病理学研究. 厦门大学学报(自然科学版), 2009, 48(2): 281-284] | |
| Yan QP, Su YQ, Wang J, et al. Studies on vibriosis (Vibrio fluvialis) in cultured Epinephelus awoara. Marine Sciences, 2001, 25(10): 17-19 DOI:10.3969/j.issn.1000-3096.2001.10.006 [鄢庆枇, 苏永全, 王军, 等. 网箱养殖青石斑鱼河流弧菌病研究. 海洋科学, 2001, 25(10): 17-19] | |
| Yang SL, Wang YG, Dong SG. Progress of research on vibriosis in marine cultured fish. Marine Fisheries Research, 2005, 26(4): 75-82 [杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展. 海洋水产研究, 2005, 26(4): 75-82] | |
| Zheng TL, Wang GL, Jin S. Prevention and cure of vibriosis in aquatic animals: A review. Journal of Oceanography in Taiwan Strait, 2002, 21(3): 372-376 [郑天伦, 王国良, 金珊. 海水养殖动物弧菌病防治的研究进展. 台湾海峡, 2002, 21(3): 372-376] | |
| Zhu CH, He JG, Huang ZJ. Identification and pathogenicity of pathogen of Epinephalus fario and E. awoara ulceration disease. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(3)(Suppl): 278-282 [朱传华, 何建国, 黄志坚. 网箱养殖石斑鱼暴发性溃疡病病原菌分离鉴定及致病性研究. 中山大学学报, 2000, 39(3)(增刊): 278-282] | |
| Zou YX, Zhang PJ, Mo ZL, et al. Isolation and identification of the pathogenic bacteria from Scophthalmus maximus. High Technology Letters, 2004, 11061106(4): 89-93 [邹玉霞, 张培军, 莫照兰, 等. 大菱鲆出血症病原菌的分离和鉴定. 高技术通讯, 2004, 11061106(4): 89-93] |



