2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
脊尾白虾(Exopalaemon carinicauda)是我国特有的海洋经济虾类,以黄、渤海产量为最高,具有生长速度快、繁殖能力强、环境适应性广等优点(段亚飞等, 2013a、b)。此外,脊尾白虾成虾体型相对较小,便于实验操作,且世代周期短,一年可多次繁殖,具备作为甲壳类研究模式生物的潜力(冯宁宁等, 2014)。近年来,随着养殖规模的不断扩大,虾类细菌性病害问题日益严重,尤其以“早期死亡综合征”或“急性肝胰腺坏死综合征”最为突出,成为阻碍虾类养殖产业健康发展的瓶颈之一(Joshi et al, 2014)。因此,虾类细菌病及其免疫机制的研究显得极为关键。
粪肠球菌(Enterococcus faecalis)属于革兰氏阳性菌,具有较强的环境抵抗力。研究表明,部分粪肠球菌属于动物肠道正常菌群,作为益生菌用于调节肠道微生态(Lee et al, 2000; Ricke, 2003)。但部分粪肠球菌具有多重耐药性、致病性毒力因子,以及人与动物间复杂的感染传递机制等,当动物受伤、体弱、抗病力降低和环境条件恶化时,其会分泌毒性物质破坏细胞组织,引发感染性疾病(刘燕霏等, 2013;狄婷婷等, 2012)。Huycke等(2002) 发现,95%的致病性粪肠球菌在人体肠道内会产生大量细胞外过氧化物和氧化自由基,引起细胞DNA损伤,破坏肠道屏障结构。因此,粪肠球菌是医院临床感染的重要致病菌和环境中粪便污染的指示菌。
粪肠球菌作为益生菌在水产养殖中的应用日益增多,但携带毒力因子的菌株可能会造成养殖动物感染性疾病发生,具有成为水产病原菌的可能性(李斌等, 2011;房海等, 2009)。例如,粪肠球菌可以在虾夷扇贝(Pactinopecten yessoensis)组织中大量累积,且显著影响其免疫酶活性(李斌等, 2011);当环境因子如盐度、pH、温度和氨氮等发生变化时,罗氏沼虾(Macrobrachium rosenbergii)对肠球菌的易感性显著增加(Cheng et al, 1998、2002a、b)。研究表明,粪肠球菌的致病性是多功能和多因子协同作用的结果,不同来源粪肠球菌所携带毒力因子的种类不同,且致病毒力因子的携带率及表达也因宿主或地区的不同而各有差异,引起的感染类型不同,可在人与动物中进行水平传播(马立艳等, 2005;刘燕霏等, 2013)。因此,粪肠球菌对虾类的致病性以及免疫相关基因表达变化特征的研究具有重要意义。本研究通过对脊尾白虾注射感染致病性粪肠球菌,测定不同时间点免疫相关基因如酚氧化酶原(proPO)、C型凝集素(CTL)、超氧化物歧化酶(SOD)、组织蛋白酶D (Cat D)和组织蛋白酶L (Cat L)表达量变化,初步探讨致病性粪肠球菌感染对脊尾白虾免疫机制的影响,以期为虾类应答致病性粪肠球菌感染的免疫机制研究提供基础数据。
1 材料与方法 1.1 材料本研究所用健康脊尾白虾取自浙江宁波象山,平均体长为(5.81±0.32) cm,平均体重为(1.18±0.35) g;于200 L PVC桶中暂养7 d,每桶40尾。实验期间,水温为24℃,盐度为25,pH=8.2,不间断充气,每天换水1/3,投喂对虾配合饲料。
TRIzol Reagent购自Invitrogen公司;M-MLV反转录酶、DNaseⅠ、SYBR® Premix Ex TaqTM Ⅱ均购自TaKaRa公司;本实验所用引物均由生工生物工程(上海)股份有限公司合成;其他试剂均为国产分析纯。
1.2 粪肠球菌感染实验实验用人源致病性粪肠球菌菌种(ATCC29212) 购自广东省微生物菌种保藏中心。感染前,营养琼脂平板上活化菌种;挑取单菌落于TSB液体培养基中,36℃扩大培养24 h;4℃ 3000 r/min离心15 min,取沉淀,用0.86%无菌生理盐水稀释至1×108 CFU/ml的菌悬液,4℃保存备用。
将暂养7 d的脊尾白虾随机分为2组,即对照组和感染组,每组3个平行,每个平行50尾虾。感染组每尾虾注射粪肠球菌菌悬液20 μl (约2×106 CFU),对照组注射0.86%无菌生理盐水20 μl,注射部位均为虾的第2腹节。分别于注射后0、3、6、12、24、48和72 h,取血细胞和肝胰腺组织于液氮中冷冻保存,用于基因表达分析。以内含抗凝剂(0.45 mol/L NaCl,0.1 mol/L葡萄糖,30 mmol/L柠檬酸钠,26 mmol/L柠檬酸,10 mmol/L EDTA,pH=4.6) 的无菌注射器活体采取血液,离心(4℃, 800 r/min, 15 min)收集血细胞沉淀。同一时间点每个平行组分别取3尾虾,将血细胞或肝胰腺组织分别混合作为一组样品,即每个时间点感染组或对照组共有3组样品。
1.3 免疫基因表达分析TRIzol试剂提取脊尾白虾感染粪肠球菌后各时间点血细胞和肝胰腺组织的总RNA,核酸定量仪检测其纯度和浓度,1.0%琼脂糖凝胶电泳检测其质量及完整性。利用DNaseⅠ去除总RNA中残留的DNA,使用M-MLV反转录酶将RNA反转录为cDNA,具体操作按照说明书进行,cDNA保存于–20℃备用。
根据本实验室提交至GenBank中的脊尾白虾proPO、CTL、SOD、Cat D和Cat L和内参基因18S rRNA的cDNA序列,使用Primer premier 5.0软件分别设计1对正反特异性引物(表 1),利用Real-time PCR对不同时间粪肠球菌感染后的脊尾白虾血细胞和肝胰腺中上述几种基因的表达量进行检测,每个样品3个平行,按照SYBR Premix Ex TaqTM Ⅱ (TaKaRa)试剂盒说明书进行。
|
|
表 1 本研究所用引物序列 Table 1 The sequence of primers used in this study |
反应体系为20 μl,包括10 μl SYBR Premix Ex TaqTM Ⅱ(2×),0.8 μl 10 μmol/L正向引物,0.8 μl 10 μmol/L反向引物,0.4 μl ROX Reference Dye Ⅱ (50×),2.0 μl cDNA,6.0 μl DEPC水。反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。采用2-△△Ct法计算各基因的相对表达量。
1.4 数据分析所得实验数据均以平均值±标准差(Mean±SD)表示,用SPSS 11.0进行单因素方差分析(One-way ANOVA),P<0.05表示差异显著。
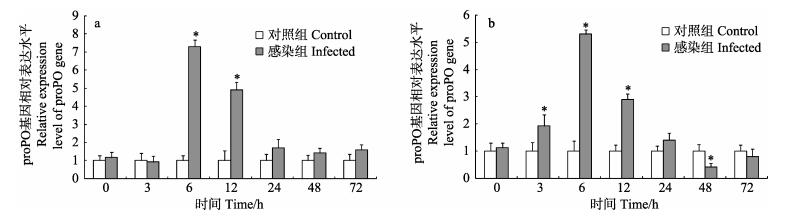
2 结果 2.1 粪肠球菌感染对脊尾白虾proPO基因表达的影响与对照组相比,脊尾白虾感染粪肠球菌后6 h,血细胞中proPO基因相对表达量显著上升至最大值,为对照组的7.30倍(P < 0.05);随后相对表达量逐渐下降,并于24 h下降至对照组水平(图 1-a)。肝胰腺中proPO基因相对表达量于感染后3 h开始上升,并于6 h达到最大值,为对照组的5.30倍(P < 0.05);随后相对表达量逐渐下降,并于48 h显著低于对照组(P < 0.05)(图 1-b)。
|
图 1 脊尾白虾感染粪肠球菌后血细胞(a)和肝胰腺(b)中proPO基因表达情况 Figure 1 Expression of proPO gene in hemocytes(a) and hepatopancreas (b) of E. carinicauda after E. faecalis challenge “*”表示同一时间点感染组与对照组之间差异显著(P < 0.05)。下同 "*" indicated significant differences (P < 0.05) between the infected group and control group at the same time. The same as below |
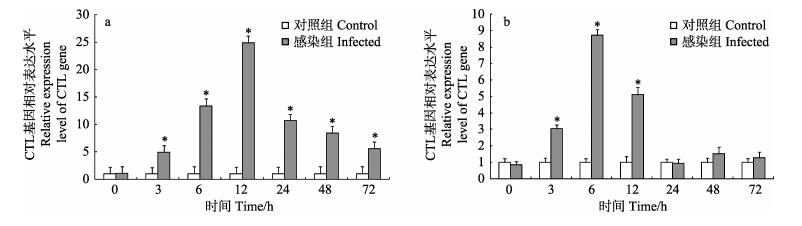
与对照组相比,感染粪肠球菌后3 h,血细胞和肝胰腺中CTL基因相对表达量显著上升,并分别于12 h和6 h达到最大值,为对照组的24.90倍和8.71倍(P < 0.05);随后相对表达量逐渐下降。感染24–72 h,肝胰腺中CTL基因相对表达量恢复至对照组水平,而血细胞中相对表达量虽呈下降趋势,但仍显著高于对照组(P < 0.05) (图 2)。
|
图 2 脊尾白虾感染粪肠球菌后血细胞(a)和肝胰腺(b)中CTL基因表达情况 Figure 2 Expression of CTL gene in hemocytes(a) and hepatopancreas (b) of E. carinicauda after E. faecalis challenge |
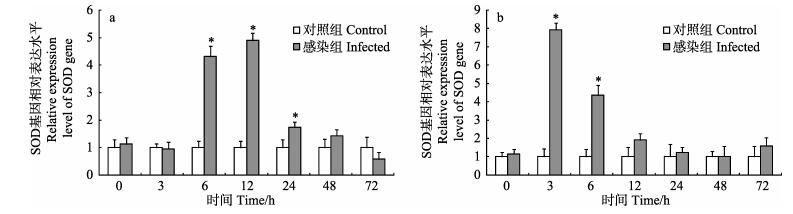
与对照组相比,感染粪肠球菌后6 h,血细胞中SOD基因相对表达量显著上升,并于12 h达到最大值,为对照组的4.90倍(P < 0.05);随后相对表达量逐渐下降,并于48 h恢复至对照组水平(图 3-a)。肝胰腺中SOD基因相对表达量于3 h显著上升至最大值,为对照组的7.93倍(P < 0.05),随后相对表达量逐渐下降,并于12 h恢复至对照组水平(图 3-b)。
|
图 3 脊尾白虾感染粪肠球菌后血细胞(a)和肝胰腺(b)中SOD基因表达情况 Figure 3 Expression of SOD gene in hemocytes(a) and hepatopancreas (b) of E. carinicauda after E. faecalis challenge |
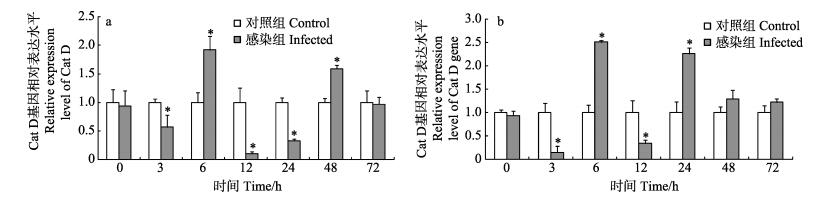
与对照组相比,感染粪肠球菌后脊尾白虾血细胞和肝胰腺中Cat D基因相对表达量变化趋势基本一致,均于3 h显著下降,然后于6 h达到最大值,分别为对照组的1.92倍和2.51倍(P < 0.05);随后于感染后12 h相对表达量显著下降,分别于48 h和24 h再次上升至较高值(P < 0.05),最后均于72 h恢复至对照组水平(图 4)。
|
图 4 脊尾白虾感染粪肠球菌后血细胞(a)和肝胰腺(b)中Cat D基因表达情况 Figure 4 Expression of Cat D gene in hemocytes(a) and hepatopancreas (b) of E. carinicauda after E. faecalis challenge |
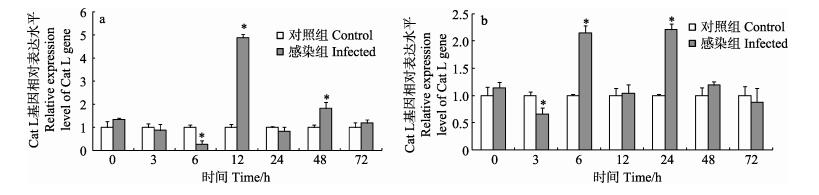
与对照组相比,感染粪肠球菌后6 h,脊尾白虾血细胞中Cat L基因的相对表达量显著下降,为对照组的0.28倍(P < 0.05);随后显著上升至最大值,为对照组的4.89倍(P < 0.05);最后于72 h逐渐下降至对照组水平(图 5-a)。肝胰腺中Cat L基因的相对表达量于感染后3 h显著下降,然后逐渐上升并于24 h时达到最大值,为对照组的2.21倍(P < 0.05);最后于48 h和72 h恢复至对照组水平(图 5-b)。
|
图 5 脊尾白虾感染粪肠球菌后血细胞(a)和肝胰腺(b)中Cat L基因表达情况 Figure 5 Expression of Cat L gene in hemocytes(a) and hepatopancreas (b) of E. carinicauda after E. faecalis challenge |
动物养殖生产中,粪肠球菌常被用作益生菌饲料添加剂来调节动物肠道菌群(Lee et al, 2000; Ricke, 2003)。但许多研究已经证实,粪肠球菌为条件性致病菌,是一种新的人畜共患病病原体,会在长期进化中出现毒力基因。当动物免疫力降低或肠道菌群失调时,粪肠球菌通过大量繁殖并侵入宿主非寄居器官,黏附于细胞并分泌毒性物质破坏细胞组织,引起感染性疾病(狄婷婷等, 2012;刘燕霏等, 2013)。本研究中,脊尾白虾注射致病性粪肠球菌后3 h未出现死亡现象,大部分虾趴于桶底,活动减弱,摄食不积极;6 h开始出现死亡现象,濒死虾肌肉乳白色,尾肢微红,软壳;感染72 h后,虾活动增强,摄食率增加。由此表明,致病性粪肠球菌感染能够对脊尾白虾健康状况产生显著影响。
3.1 粪肠球菌对脊尾白虾proPO基因表达的影响proPO系统是甲壳动物一种重要的“非己”识别系统,可以有效识别革兰氏阴性菌的脂多糖、真菌的β-1, 3-葡聚糖和革兰氏阳性菌的肽聚糖等,在甲壳动物的伤口愈合、黑化包被、细胞吞噬和表皮硬化等免疫过程中发挥重要作用。PO通常以无活性的酶原形式proPO存在,proPO通过一系列级联反应转化成具有活性的PO,从而在清除病原的免疫反应中发挥重要作用(田丹等, 2013)。
研究表明,利用RNAi技术敲除proPO基因后的虾类,其对病原的抵抗力均显著降低(Piti et al, 2009; Yeh et al, 2009)。感染金黄色葡萄球菌(Staphylococcus aureus)后,拟穴青蟹(Scylla paramamosain)血细胞中proPO基因表达水平显著上升(杜志强等, 2013)。嗜水气单胞菌(Aeromonas hydrophila)在体内(in vivo)可显著诱导proPO基因表达水平,且其变化趋势与PO活性变化基本一致,但基因表达水平的升高早于酶活性(王文锋等, 2012)。本研究中,脊尾白虾血细胞和肝胰腺中proPO基因相对表达量于感染粪肠球菌后6 h和12 h显著升高,表明粪肠球菌感染诱导proPO基因转录,产生大量PO以抵抗粪肠球菌对机体的感染;感染后期,proPO基因相对表达量逐渐恢复至对照组水平,可能与脊尾白虾处于感染后恢复期有关。
3.2 粪肠球菌对脊尾白虾CTL基因表达的影响甲壳动物的模式识别受体也可以识别与病原体相关的模式分子,如细菌和真菌糖蛋白、脂多糖和由于受伤和感染所释放的细胞成分等,从而激活其固有免疫系统。作为一种重要的模式识别受体,CTL具有多种重要功能,如细胞粘附、内吞作用和免疫识别等,能够识别并结合各种病原微生物,引起机体特异性免疫反应,从而促进机体清除病原(仉晓文, 2011)1)。
[1]) Ji XW. Functional studies of C-type lectins from crustacean. Doctoral Dissertation of Shandong University, 2011 [仉晓文. 甲壳类C-型凝集素的功能研究. 山东大学博士研究生学位论文, 2011]
研究表明,从对虾血液中分离纯化到的CTL对于多种细菌都有强烈的凝集活性,且经CTL孵育过的对虾血细胞吞噬活性显著增强(孙杰, 2009)2)。凡纳滨对虾(Litopenaeus vannamei)感染溶壁微球菌(Micrococcus lysodeikticus)后,其肝胰腺CTL基因表达量显著提高(罗展等, 2010);此外,中国对虾(Fenneropenaeus chinensis)重组CTL能通过紧密结合鳗弧菌(Vibrio anguillarum)进而将其清除(Wang et al, 2009)。本研究中,脊尾白虾感染粪肠球菌后6 h,其血细胞和肝胰腺中CTL基因相对表达量均显著上升,表明可能机体高水平转录用来合成并补充参与细菌结合的蛋白,是机体应对病原菌侵染的一种防御机制。但是,感染后期(24-72 h),血细胞中CTL基因相对表达量虽有下降,但仍均显著高于对照组,可能与粪肠球菌大量繁殖导致机体细胞受损有关。
2) Sun J. Purification, cDNA cloning and relationship study on three kind of immune-related factors in shrimp Fenneropenaeus chinensis. Doctoral Dissertation of Institute of Oceanology of Chinese Academy of Sciences, 2009 [孙杰. 中国明对虾(Fenneropenaeus chinensis)几种免疫相关因子的分离纯化、基因克隆及相互关系研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2009]
3.3 粪肠球菌对脊尾白虾SOD基因表达的影响外界病原入侵动物机体时,会诱发机体免疫反应产生大量活性氧(ROS),如H2O2、·O2–和·OH等;但过量的ROS会损坏机体生理机能和免疫功能(段亚飞等, 2015;于天基等, 2015)。机体抗氧化酶系统,可以有效清除机体多余的ROS,保护机体免受氧化损伤。SOD作为抗氧化酶系统的标志酶,其首先将·O2-歧化为H2O2和O2,其活性可以用于评价机体清除ROS的能力(赵曼曼等, 2015;肖炜等, 2015;孙盛明等, 2016)。
研究表明,感染鳗弧菌后的中国对虾血淋巴SOD酶活性于1 h显著升高至最大值,随后呈先升高再降低的趋势(葛倩倩, 2013)1)。凡纳滨对虾感染溶藻弧菌(Vibrio alginolyticus)后,其SOD基因表达水平显著上升(Liu et al, 2007)。本研究中,感染初期,脊尾白虾血细胞和肝胰腺中SOD基因相对表达量呈上升趋势,表明粪肠球菌感染刺激机体抗氧化酶系统,使得SOD基因表达量升高,以清除机体在应对病原侵染过程中产生的大量ROS;感染后期,SOD基因相对表达量逐渐下降,可能是由于粪肠球菌的大量繁殖抑制了机体抗氧化酶活性,机体因累积大量ROS而导致组织细胞受损,抗氧化防御系统下降。
[1]) Ge QQ. Effects on the Imd pathway genes expression and non-specific immunity of Fenneropenaeus chinensis and Exopalaemon carinicauda by Vibrio anguillarum. Master's Thesis of Ocean University of China, 2013 [葛倩倩. 鳗弧菌感染对Imd免疫通路相关基因表达及非特异性免疫因子的影响. 中国海洋大学硕士研究生学位论文, 2013]
3.4 粪肠球菌对脊尾白虾Cat D和Cat L基因表达的影响当外来病原入侵机体时,细胞通过吞噬作用将致病菌与溶酶体融合,利用各种水解酶将致病菌等大颗粒物质消化成生物大分子,然后通过外排作用排出细胞(Press et al, 1990)。Cat D和Cat L是溶酶体的重要组成部分,除细胞内发挥蛋白质降解和整合蛋白水解的功能外,Cat D还具有激活酶原、激素原与生长因子,参与细胞凋亡等功能,而Cat L参与激素原的激活、抗原呈递、组织再生、肿瘤入侵和转移、细胞凋亡等过程(段亚飞等, 2013a、b)。
Cho等(2002) 研究发现,鲶鱼(Parasilurus asotus) Cat D前体与抗菌肽ParasinⅠ的形成相关。家蚕(Bombyx mori)感染藤黄微球菌(Micrococcus luteus)后,其血细胞中Cat L基因的表达水平和Cat L蛋白酶活性均显著上调(刘敏敏等, 2015);此外,被弧菌感染后,水产动物Cat D和Cat L基因表达量显著上升(段亚飞等, 2013a、b; 潘俐伶等, 2012; Li et al, 2010),表明其在水产动物免疫反应中发挥重要作用。本研究中,Cat D和Cat L基因表达量在感染初期出现显著下降现象,可能是由于粪肠球菌感染抑制了其
基因的表达;随后基因表达量先上升后下降,表明Cat D和Cat L基因的升高是脊尾白虾应对粪肠球菌感染机体的一种免疫防御机制。
综上所述,致病性粪肠球菌对脊尾白虾免疫相关基因proPO、CTL、SOD、Cat D和Cat L相对表达量影响显著,会导致其机体生理功能紊乱。鉴于粪肠球菌在食品和益生菌制剂中的应用日益增多,在使用前应对其携带耐药质粒和毒力因子的菌株进行严格鉴别,防止造成养殖动物感染性疾病发生。目前,关于致病性粪肠球菌感染水产动物的研究相对较少,尚无免疫相关基因表达的研究。本研究可为虾类应答致病性粪肠球菌感染的免疫基因表达机制研究提供理论依据。
| Cheng W, Chen JC. The virulence of Enterococcus to freshwater prawn Macrobrachium rosenbergii and its immune resistance under ammonia stress. Fish and Shellfish Immunology, 2002b, 12(2): 97-109 DOI:10.1006/fsim.2001.0363 | |
| Cheng W, Chen JC. Enterococcus-like infections Macrobrachium rosenbergii are exacerbated by high pH and temperature but reduced by low salinity. Diseases of Aquatic Organisms, 1998, 34(2): 103-108 | |
| Cheng W, Liu CH, Hsu JP, et al. Effect of hypoxia on the immune response of giant freshwater prawn Macrobrachium rosenbergii and its susceptibility to pathogen Enterococcus. Fish and Shellfish Immunology, 2002a, 13(5): 351-365 DOI:10.1006/fsim.2001.0411 | |
| Cho JH, Park IY, Kim HS, et al. Cathepsin D produces antimicrobial peptide parasin I from histone H2A in the skin mucosa of fish. Faseb Journal, 2002, 16(1): 429-431 | |
| Di TT, Gao Y. Advances in research on pathogenicity islands of Enterococcus faecalis. Journal of Pathogen Biology, 2012, 7(3): 231-234 [狄婷婷, 高原. 粪肠球菌主要毒力因子研究进展. 中国病原生物学杂志, 2012, 7(3): 231-234] | |
| Du ZQ, Lin T, Li XC. Study on antibacterial immunity response of prophenoloxidase gene in Scylla paramamosain. Guangdong Agricultural Sciences, 2013, 40(19): 138-155 DOI:10.3969/j.issn.1004-874X.2013.19.046 [杜志强, 林涛, 李新苍. 拟穴青蟹酚氧化酶原基因的抗菌免疫反应研究. 广东农业科学, 2013, 40(19): 138-155] | |
| Duan YF, Dong HB, Wang Y, et al. Effect of desiccation on antioxidant enzyme activities of kuruma shrimp (Marsupenaeus japonicus). South China Fisheries Science, 2015, 11(4): 102-108 [段亚飞, 董宏标, 王芸, 等. 干露胁迫对日本囊对虾抗氧化酶活性的影响. 南方水产科学, 2015, 11(4): 102-108] | |
| Duan YF, Liu P, Li JT, et al. Cloning and expression analysis of Cathepsin L cDNA of Exopalaemon carinicauda. Zoological Research, 2013a, 34(1): 39-46 DOI:10.3724/SP.J.1141.2013.01039 [段亚飞, 刘萍, 李吉涛, 等. 脊尾白虾组织蛋白酶L基因的克隆及其表达分析. 动物学研究, 2013a, 34(1): 39-46] | |
| Duan YF, Liu P, Li JT, et al. Cloning and expression of cathepsin D gene in Exopalaemon carinicauda. Oceanologia et Limnologia Sinica, 2013b, 44(3): 599-605 [段亚飞, 刘萍, 李吉涛, 等. 脊尾白虾(Exopalaemon carinicauda)组织蛋白酶D基因的克隆及其表达分析. 海洋与湖沼, 2013b, 44(3): 599-605] | |
| Fang H, Chen CZ, Zhang XJ, et al. Aquacultural animal pathogenic bacteriology. Beijing: China Agriculture Press, 2009: 629-631. [房海, 陈翠珍, 张晓君. 水产养殖动物病原细菌学. 北京: 中国农业出版社, 2009: 629-631.] | |
| Feng NN, Sun YM, Wen R, et al. Analysis on the activity of immune related enzymes in survived Exopalaemon carinicauda from WSSV infection. Marine Sciences, 2014, 38(3): 75-79 DOI:10.11759/hykx20130301002 [冯宁宁, 孙玉苗, 温荣, 等. 脊尾白虾白斑综合征病毒耐受群体重要免疫相关酶的活性分析. 海洋科学, 2014, 38(3): 75-79] | |
| Huycke MM, Abrams V, Moore DR. Enterococcus faecalis produces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DNA. Carcinogenesis, 2002, 23(3): 529-536 DOI:10.1093/carcin/23.3.529 | |
| Joshi J, Srisala J, Truong VH, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 2014, 428: 297-302 | |
| Lee YK, Lim CY, Teng WL, et al. Quantitative approach in the study of adhesion of lactic acid bacteria to intestinal cells and their competition with enterobacteria. Applied and Environmental Microbiology, 2000, 66(9): 3692-3697 DOI:10.1128/AEM.66.9.3692-3697.2000 | |
| Li B, Chen BJ, Qi ZH, et al. Accumulation of Enterococcus faecalis and variation of SOD and ACP activities in scallop Pactinopecten yessoensis tissues. Journal of Fishery Sciences China, 2011, 18(1): 89-95 [李斌, 陈碧鹃, 齐占会, 等. 粪肠球菌累积对虾夷扇贝免疫酶活性的影响. 中国水产科学, 2011, 18(1): 89-95] | |
| Li WW, Jin XK, He L, et al. Molecular cloning, characterization, expression and activity analysis of cathepsin L in Chinese mitten crab, Eriocheir sinensis. Fish and Shellfish Immunology, 2010, 29(6): 1010-1018 DOI:10.1016/j.fsi.2010.08.007 | |
| Liu CH, Tseng MC, Cheng W. Identification and cloning of the antioxidant enzyme, glutathione peroxidase, of white shrimp, Litopenaeus vannamei, and its expression following Vibrio alginolyticus infection. Fish and Shellfish Immunology, 2007, 23(1): 34-45 DOI:10.1016/j.fsi.2006.09.002 | |
| Liu MM, Zhan PF, Huang SH, et al. Study on the immune response of silkworm cathepsin L and its specific inhibitor gene to microorganism induction. Science of Sericulture, 2015, 41(4): 650-657 [刘敏敏, 占鹏飞, 黄绍华, 等. 家蚕组织蛋白酶L及其特异性抑制剂基因参与微生物诱导蚕体的免疫响应研究. 蚕业科学, 2015, 41(4): 650-657] | |
| Liu YF, Yang JD, Zhao RL. Research progress of animal disease caused by Enterococcus faecalis. Journal of Domestic Animal Ecology, 2013, 34(11): 75-77 DOI:10.3969/j.issn.1673-1182.2013.11.019 [刘燕霏, 杨建德, 赵瑞利. 粪肠球菌动物致病的研究进展. 家畜生态学报, 2013, 34(11): 75-77] | |
| Luo Z, Zhang JQ, Li FH, et al. Cloning of a novel C-type lectin LvLec2 from the shrimp Litopenaeus vannamei and its immune response to different challenges. Marine Sciences, 2010, 34(11): 103-110 [罗展, 张继泉, 李富花, 等. 凡纳滨对虾C-型凝集素LvLec2对不同刺激的免疫应答. 海洋科学, 2010, 34(11): 103-110] | |
| Ma LY, Xu SZ, Ma JP. Research progress of pathogenic mechanism of Enterococcus. Chinese Journal of Nosocomiology, 2005, 15(3): 356-360 [马立艳, 徐淑珍, 马纪平. 肠球菌致病机制的研究进展. 中华医院感染学杂志, 2005, 15(3): 356-360] | |
| Pan LL, Huang GJ, Cheng SY, et al. cDNA cloning, characterization and challenge-based expression profiles of cathepsin D in winged pearl oyster Pteria penguin. South China Fisheries Science, 2012, 8(2): 22-29 [潘俐伶, 黄桂菊, 成书营, 等. 企鹅珍珠贝组织蛋白酶D的cDNA克隆、序列特征分析和应激表达研究. 南方水产科学, 2012, 8(2): 22-29] | |
| Piti A, Walaiporn C, Anchalee T. Two prophenoloxidases are important for the survival of Vibrio harveyi challenged shrimp Penaeus monodon. Developmental and Comparative Immunology, 2009, 33(2): 247-256 DOI:10.1016/j.dci.2008.09.003 | |
| Press OW, Desantes K, Anderson SK, et al. Inhibition of catabolism of radiolabeled antibodies by tumor cells using lysosomotropic amines and carboxylic ionophores. Cancer Research, 1990, 50(4): 1243-1250 | |
| Ricke SC. Perspectives on the use of organic acids and short chain fatty acids as antimicrobials. Poultry Science, 2003, 82(4): 632-639 DOI:10.1093/ps/82.4.632 | |
| Sun SM, Ge XP, Zhu J, et al. Effects of bioflocs on growth performance, digestive enzyme and immunity enzyme activities in juvenile blunt snout bream (Megalobrama amblycephala). Progress in Fishery Sciences, 2016, 37(2): 49-55 DOI:10.11758/yykxjz.20150412001 [孙盛明, 戈贤平, 朱健, 等. 生物絮团对团头鲂(Megalobrama amblycephala)生长、消化酶和免疫相关酶活性的影响. 渔业科学进展, 2016, 37(2): 49-55] | |
| Tian D, Jiang GL, Liu Y. Study on immune activity of sea cucumber (Apostichopus japonicus) with different weight. Marine Sciences, 2013, 37(10): 47-52 [田丹, 姜国良, 刘云. 不同体质量仿刺参免疫活性的研究. 海洋科学, 2013, 37(10): 47-52] | |
| Wang WF, Ma JM, Yang H, et al. cDNA cloning and characterisation of prophenoloxidase from Macrobrachium nipponense. Acta Anatomica Sinica, 2012, 43(6): 744-750 [王文锋, 马建敏, 杨洪, 等. 日本沼虾酚氧化酶原基因cDNA的全长克隆及表达分析. 解剖细胞, 2012, 43(6): 744-750] | |
| Wang XW, Zhang XW, Xu WT, et al. A novel C-type lectin (FcLec4) facilities the clearance of Vibrio anguillarum in vivo in Chinese white shrimp. Developmental and Comparative Immunology, 2009, 33(9): 1039-1047 DOI:10.1016/j.dci.2009.05.004 | |
| Xiao W, Li DY, Xu Y, et al. Effects of chronic external ammonia stress on growth, immunity and metabolism of juvenile GIFT tilapia (Oreochromis niloticus). South China Fisheries Science, 2015, 11(4): 81-87 [肖炜, 李大宇, 徐杨, 等. 慢性氨氮胁迫对吉富罗非鱼幼鱼生长、免疫及代谢的影响. 南方水产科学, 2015, 11(4): 81-87] | |
| Yeh MS, Lai CY, Liu CH, et al. A second proPO present in white shrimp Litopenaeus vannamei and expression of the proPOs during a Vibrio alginolyticus injection, molt stage, and oral sodium alginate ingestion. Fish and Shellfish Immunology, 2009, 26(1): 49-55 DOI:10.1016/j.fsi.2008.10.003 | |
| Yu TJ, Li J, Li JT, et al. The effects of pH changes on antioxidant enzyme activities of ridgetail white prawn (Palaemon carinicauda). Marine Sciences, 2015, 39(5): 47-53 [于天基, 李健, 李吉涛, 等. pH胁迫对脊尾白虾抗氧化酶活力的影响. 海洋科学, 2015, 39(5): 47-53] | |
| Zhao MM, Jiang JZ, He J, et al. The effect of Vibrio harveyi and abalone herpesvirus on immune factors of Haliotis diversicolor. Marine Sciences, 2015, 39(11): 39-48 DOI:10.11759/hykx20150812002 [赵曼曼, 姜敬哲, 何健, 等. 哈维弧菌和鲍类疱疹病毒刺激对杂色鲍免疫相关因子的影响. 海洋科学, 2015, 39(11): 39-48] |



