2. 中国海洋大学水产学院 青岛 266003;
3. 江苏中洋集团股份有限公司 南通 226600;
4. 海安县水产技术推广站 南通 226600
American Shad (Alosa sapidissima)
2. Fisheries College, Ocean University of China, Qingdao 266003;
3. Jiangsu Zhongyang Group, Nantong 226600;
4. Haian Aquatic Product Technology Promotion Department, Nantong 226600
胚胎发育是指鱼类雌、雄胚子发育成熟并排出体外,在水环境或者在鱼体内受精,形成受精卵,进入卵膜内发育到仔鱼脱膜初孵或卵胎生鱼类的初产仔鱼的过程,是鱼类早期生活史中的重要环节。目前,大部分鱼类胚胎发育主要集中在形态学方面,如鱇酿白鱼(Anabarilius grahami) (Ma et al, 2008)、驼背鲈(Chromileptes altivelis) (张梦淇等, 2014)、波纹唇鱼(Cheilinus undulatus) (陈猛猛等, 2015)、罗非鱼(Oreochromis niloticus) (Morrison et al, 2001)、长鳍吻(Rhinogobio ventralis) (管敏等, 2015)等,而鱼类胚胎发育组织学研究还较少(Hall et al, 2004; 佟雪红等, 2011; 何滔, 20111))。研究鱼类胚胎发育组织学不仅可以直观、清晰地了解胚胎期各个发育阶段的组织、器官及系统的发生发育特征,掌握早期发生发育规律,而且能解释鱼类早期生理机制,揭示其早期生活史,为提高和优化人工繁育和养殖技术提供重要的理论依据。
1) He T. Early development and related enzymatic activity in rock bream. Doctoral Dissertation of Chinese Academy of Sciences (Institute of Oceanology), 2011, 1–129 [何滔.条石鲷早期发育及相关酶活性的研究.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2011, 1–129]
美洲鲥(Alosa sapidissima)属于鲱形目(Clupeiformes)、鲱科(Clupeidae)、西鲱属(Alosa),是鲱形目中个体比较大的一种,以浮游生物、小型鱼类及虾类为食(Piper, 2003)1),主要生活在北美洲大西洋西岸、太平洋海岸及亚洲东南部等,为典型的溯河产卵鱼类,是北美地区重要的经济鱼类之一(Jones et al, 1978; Evermann et al, 1986; Limburg et al, 2003)。自21世纪引入我国,美洲鲥繁育及养殖技术逐渐成熟,养殖规模及产量不断扩大,已逐步成为我国濒临灭绝鲥(Tenualosa reevesii)的替代品,成为市场上备受欢迎的名贵淡水鱼类之一。目前,关于美洲鲥研究已有较多报道,如美洲鲥受精孵化(杜浩, 2005)2)、苗种培育技术(吴文化等, 2004)、早期器官发生(Gao et al, 2015; 高小强等, 2016)和摄食特性(高小强等, 2015)等,徐钢春等(2012)和洪孝友(2011)3)对美洲鲥早期胚胎发育形态进行了初步观察。而对其胚胎发育的组织学研究还未见报道。本研究在形态学观察的基础上,结合组织切片技术,对美洲鲥胚胎发育各个阶段的组织器官的发生发育进行观察和描述,旨在完善美洲鲥胚胎发育时序和丰富其早期发育生物学知识,为美洲鲥的繁育及养殖提供相应的理论知识。
1) Piper TD. Fecundity of American shad, Alosa sapidissima, in the Delaware and Hudson River, USA. Washington: University of Maryland, 2003, 1–107
2) Du H. Studies on key techniques in incubation, culture and transportation of American shad Alosasa pidissima. Master's Thesis of Huazhong Agricultural University. 2005, 15–22 [杜浩.美洲鲥(Alosa sapidissima)人工孵化、养殖及转运关键技术的研究.华中农业大学硕士研究生学位论文, 2005, 15–22]
1 材料与方法 1.1 亲鱼催产及孵化实验于2015年5月在江苏中洋集团繁育中心进行。挑选3–4龄以上体质健康、无伤病、发育较好的美洲鲥亲鱼放入到700 m3室内水泥池中暂养,水温控制在19–20℃。采用LHRH-A2(促黄体素释放激素)和多巴胺拮抗物进行药物催产,雌雄比例为1:2。取同一批次受精卵,转移到400 L锥形孵化缸中进行流水孵化,水流速为15–25 L/min,微量充气,以卵上下浮动为宜,孵化水温为20.5-21.5℃,溶解氧为6.8-8.2 mg/L,及时吸出缸内坏死长霉卵。
1.2 胚胎样品采集及观察根据洪孝友(2011)3)及徐钢春等(2012)的研究结果,划分美洲鲥胚胎发育时期。采用光学显微镜(NIKON YS100) 对受精卵进行连续观察拍照,以50%胚胎出现新特征作为该发育阶段的起始时间,记录胚胎发育时间及各个发育时期典型特征,并在各个发育时期分别取100-150粒受精卵,蒸馏水冲洗干净,用Bouin’s液在室温条件下固定24 h,70%酒精洗涤多次后保存。常规乙醇梯度脱水、二甲苯透明及石蜡包埋,运用LeiCa RM2265轮转式切片机进行连续切片,切片厚度为4-5 μm,H.E染色,中性树胶封片,NIKON YS100显微镜下观察并拍照,应用Photoshop CS 5.0软件对图片进行编辑。
3) Hong XY. Study on the morphogenesis and histology of the early American shad Alosa sapidissima. Master's Thesis of Shanghai Ocean University, 2011, 20–30 [洪孝友.美洲鲥早期发育的形态学及组织学观察.上海海洋大学硕士研究生学位论文, 2011, 20–30]
1.3 数据处理数据采用SPSS 18.0进行处理,实验结果以平均值±标准差(Mean±SD)表示。
2 实验结果 2.1 受精卵美洲鲥成熟卵呈卵圆形,透明,卵膜较薄,卵径为(3.09±0.08) mm,不具油球,为沉性卵。当卵受精后,卵膜吸水膨胀,膜质分离,受精膜出现(图 2-1)。1 h后,受精卵原生质开始由植物极向动物极流动、集中,最终在动物极形成盘状胚盘,此时,具胚盘的动物极向下,植物极向上。未受精的卵或者坏死卵为乳白色。

|
图 1 美洲鲥的胚胎发育
Figure 1 Embryonic development of American shad
1. 2细胞期;2. 4细胞期;3. 8细胞期;4. 16细胞期;5. 32细胞期;6. 64细胞期;7. 128细胞期;8.多细胞期;9.高囊胚期;10.低囊胚期;11.开始下包;12.下包30%;13.下包50%;14.下包75%;15.下包90%;16.完全下包(16a.体节; 16b.神经索);17.克氏囊出现;18.器官分化期;19.胚体扭动期;20.孵化期;21.初孵仔鱼 es.胚盾;hp.心脏原基;kv.克氏囊;np.神经板;nr.神经索;op.眼囊;so.体节;yp.卵黄栓 1: 2-cell stage; 2: 4-cell stage; 3: 8-cell stage; 4: 16-cell stage; 5: 32-cell stage; 6: 64-cell stage; 7: 128-cell stage; 8: Morula stage; 9: High blastula stage; 10: Low blastula stage; 11: Preliminary epiboly; 12: 30%-epiboly; 13: 50%-epiboly; 14: 75%-epiboly; 15: 90%-epiboly; 16: Complete epiboly (16a: somite; 16b: neural rod); 17: Kupffer's vesicle; 18: Segmentation period; 19: Twist stage of embryo; 20: Hatching period; 21: Newly-hatched larvae es: embrynic shield; hp: heart primordia; kv: Kupffer's vesicle; np: neural plate; nr: neural rod; op: optic vesicle; yp: yolk plug; so: somite |
|
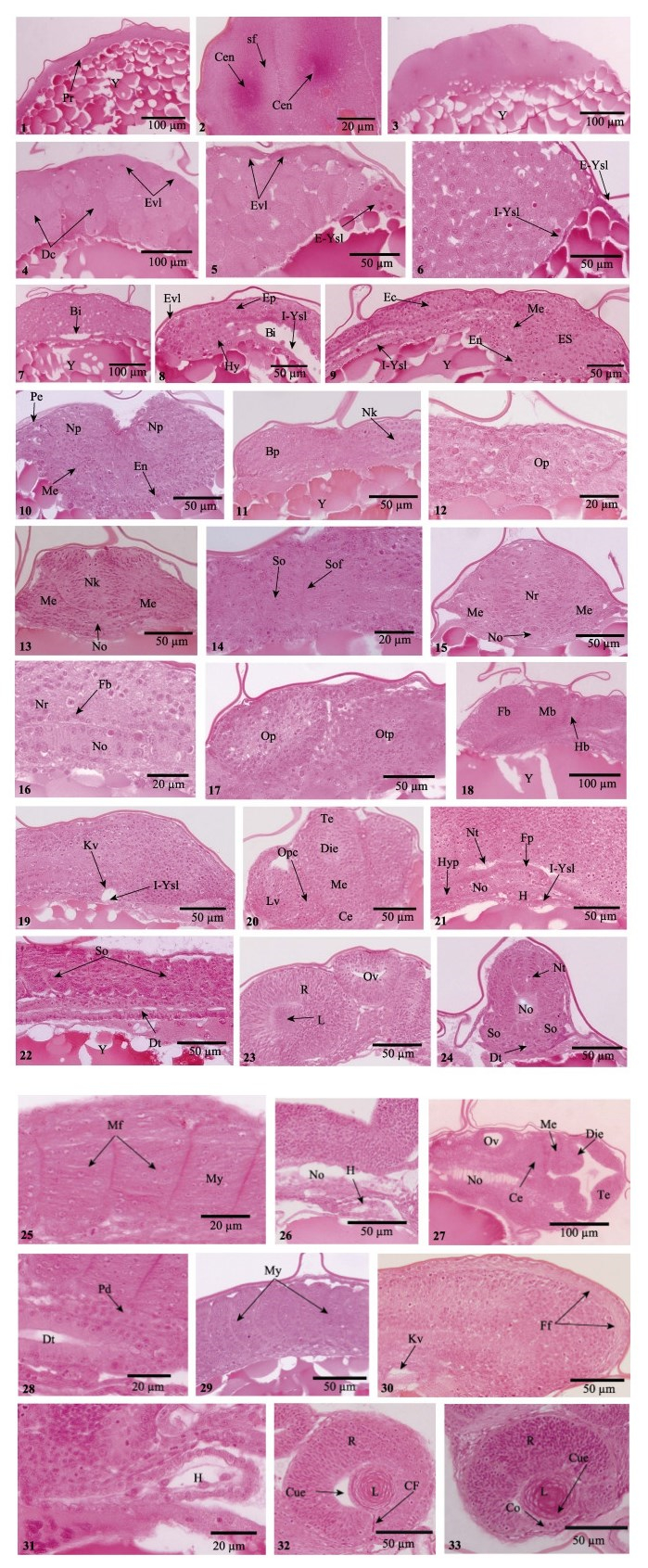
图 2 美洲鲥胚胎发育组织切片观察
Figure 2 Histological sections of the embryos of American shad
1.所示受精卵的细胞质;2. 2细胞期所示中心粒及纺锤丝;3. 8细胞期;4. 64细胞期所示胚体外层的包被层及内部的深埋细胞;5.多细胞期所示卵黄合胞体;6.高囊胚期所示内外卵黄合胞体;7.囊胚腔出现;8.原肠早期所示上、下胚层、包被层和内卵黄合胞体;9.原肠中期所示三胚层;10.周皮和神经板形成;11.脑原基出现;12.眼泡出现;13.可见明显的脊索和龙骨样;14.体节形成;15.神经索出现;16.神经基板出现;17.听囊出现;18.脑分化为三部分;19.克氏囊出现;20.所示端脑、间脑、中脑和后脑;21.神经索开始中空化,下脊索出现;22.消化管出现,体节进一步增多;23.原始视网膜形成,听囊开始中空化;24.神经管形成,脊索开始中空化,可见明显的消化管;25.肌节形成;26.围心腔形成;27.可见完全分化的脑及明显中空化的听囊;28.原肾管出现;29.肌节进一步增多,呈“V”型;30.克氏囊退化,鳍褶出现;31.围心腔进一步增大;32.可见晶状体立方上皮,脉络膜裂出现;33.巩膜形成,可见晶状体纤维 Bi:囊胚腔;Bp:脑原基;Ce:小脑;Cen:中心粒;CF:脉络膜裂;Cue:立方上皮;DC:深埋细胞;Die:间脑;Dt:消化管;Ec:外胚层;En:内胚层;Ep:上胚层;ES:胚盾;Evl:包被层;E-Ysl:内卵黄合胞体;Fb:前中脑;Ff:鳍褶;Fp:神经基板;H:心脏;Hb:后部脑;Hy:下胚层;Hyp:下脊索;I-Ysl:内卵黄合胞体;Kv:克氏囊;L:晶状体;LV:晶状体泡;Me:中胚层;Mb:中部脑;Mf:肌纤维;My:肌节;Nk:神经龙骨;No:脊索;Np:神经板;Nr:神经索;Nt:神经管;Op:眼泡;Opc:视杯;Otp:听板;Ov:听囊;Pe:周皮;Pd:原肾管;Pr:原生质;R:视网膜;sf:纺锤丝;So:体节;Sof:体节沟;Te:端脑;Y:卵黄囊 1. The fertilized ovum, showing the cytoplasmic streaming; 2. The centrioles and spindle fibre at 2-cell period; 3. 8-cell period; 4. Enveloping layer and deep cells at 64-cell period; 5. The multiple period showed the yolk syncytial layer; 6. The Internal syncytium and external syncytium were visible at high stage; 7. The blastocoel appeared; 8. Epiblast, hypoblast, enveloping layer and the Internal syncytium were obvious at early-gastrula; 9. The three germ layers differentiated at middle-gastrula; 10. The periderm and neural plate formed; 11. The brain primordium was visible; 12. The optic vesicle appeared; 13. The notochord and neural keel were obvious; 14. The somite formed; 15. The neural rod appeared; 16. The floor plate was present; 17. Otic placod formed; 18. The brain was differentiated into three parts; 19. Kupffer's vesicle appeared; 20. Telencephalon, diencephalon, mesencephalon and cerebellum were obvious; 21. The vacuolization of neural rod and hypochord were visible; 22. The digestive tube appeared and the somite increased; 23. The primitive retina and the vacuolization of otic placode were presented; 24. The neural tube formed, the vacuolization of notochord and digestive tube were obvious; 25. Myotome was visible; 26. Pericardial cavity formed; 27. The brain showed compelely development, the vacuolization of otic placode was obvious; 28. Pronephric duct appeared; 29. The increase of myotome; 30. The degeneration of Kupffer's vesicle and fin fold were visible; 31. Pericardial cavity further increased; 32. The cubical epithelium of lens was seen and choroid fissure developed; 33. The cornea was formed and lens fibers were obvious Bi: blastocoel; Bp: brain primordium; Ce: cerebellum; Cen: centrioles; CF: choroid fissure; Cue: cubical epithelium; DC: deep cells; Die: diencephalon; Dt: digestive tube; Ec: ectoderm; En: endoderm; Ep: Epiblast; ES: Embryonic shield; Evl: Enveloping layer; E-Ysl: External syncytium; Fb: forebrain; Ff: fin fold; Fp: floor plate; H: heart; Hb: hindbrain; Hy: hypoblast; Hyp: Hypochord; I-Ysl: internal syncytium; Kv: Kupffer's vesicle; L: lens; LV: lens vesicle; Me: Mesoderm; Mb: midbrain; Mf: muscle fibres; My: myotome; Nk: neural keel; No: notochord; Np: neural plate; Nr: neural rod; Nt: neural tube; Op: optic vesicle; Opc: optic cup; Otp: otic placode; Ov: otic vesicle; Pe: periderm; Pd: pronephric duct; Pr: protoplasm; R: retina; sf: spindle fibre; So: somite; Sof: somitic furrow; Te: telencephalon; Y: yolk sac |
2细胞期(1 h 26 min):像其他硬骨鱼类,美洲鲥的卵裂属于典型的盘状不完全卵裂。卵裂在胚盘上进行,第1次有丝分裂为径裂,形成的径裂沟将胚盘分成2个大小相同的分裂球,中心粒及纺锤丝清晰可见(图 1-1、图 2-1)。
4细胞期(1 h 57 min):第2个分裂沟形成,与第1个沟垂直径裂成大小相等的4个分裂球(图 1-2)。
8细胞期(2 h 25 min):第3次分裂垂直于第2次分裂沟形成2个分裂面,并与第1次分裂面平行,位于第1次分裂沟的左右两侧,分成前后排列的8个细胞(图 1-3),此时细胞大小出现差异(图 2-3)。
16细胞期(2 h 57 min):第4次分裂产生2个分裂面,与第1、第3分裂面垂直,与第2分裂面平行,位于其左右两侧,将胚盘分裂成16个细胞(图 1-4),其中,4个为中央细胞,12个为边缘细胞。
32细胞期(3 h 25 min):第5次卵裂形成4个分裂面,与第2、第4分裂面垂直,而与第1、第3分裂面平行,将胚盘分成32个细胞(图 1-5)。此时分裂的细胞在大小及形状上不规则。
64细胞期(3 h 56 min):自第6次分裂开始,径裂和纬裂2种分裂方式同时进行,可见明显的细胞边界(图 1-6)。此时,胚盘被分为2部分,胚盘最外层细胞部分称为包被层,将发育成胚胎表皮,起保护胚胎的作用;胚盘内层细胞称为包埋细胞,为胚胎主体细胞(图 2-4)。
128细胞期(4 h 26 min):此细胞分裂面在显微镜下已不能辨别,细胞体积小,分裂开始不同步(图 1-7)。
多细胞期(4 h 55 min):随着细胞分裂的进行,胚盘分裂面越来越多,细胞体积越来越小,细胞间的界限变得模糊(图 1-8)。胚盘外部的包被层细胞开始发育,逐渐扁平化;胚盘下方的边缘细胞与邻近的卵黄细胞开始融合,融合后的胚层细胞核不断在卵黄细胞质中分裂,且排列形成核环,此时,卵黄合胞体形成(图 2-5),该结构为硬骨鱼类所特有。
2.3 囊胚期高囊胚期(6 h 2 min):此时期,由于胚盘的高度分裂,细胞急剧增多,胚盘呈高帽状(图 1-9)。随着胚盘发育的进行,有些卵黄合胞体在胚盘底部向内迁移,形成内部卵黄合胞体层(I-YSL),其始终存在于胚胎发育的整个过程中;而另外一些向植物极移动,并停留在胚层前缘,形成外部卵黄合胞体层(E-YSL) (图 2-6)。
低囊胚期(7 h 40 min):此时期,囊胚边缘细胞沿着卵黄囊表面开始下包延伸,囊胚的高度逐渐降低,成为低囊胚(图 1-10)。在胚层和内部卵黄合胞体层之间,可见椭圆形的腔,即为囊胚腔(图 2-7)。
2.4 原肠期原肠早期(0-20%):8 h 8 min,通过外部合胞体的牵引作用,囊胚包被层细胞沿着卵黄囊的表面开始下包,标志着原肠运动的开始(图 1-11)。9 h 25 min,随着包被层细胞的不断下包,构成胚盘的细胞逐渐向胚盘边缘迁移、内卷,形成了一个环形加厚的结构,即为胚环,此时胚环分为两层:上面一层为上胚层,下面一层为下胚层(图 2-8)。
原肠中期(30%-50%):10 h 39 min,下包30%,在胚环向植物极运动的过程中,上、下胚层的细胞同时向将发育成胚胎背部一侧插入,形成一个加厚的区域,为胚盾(图 1-12)。此时胚环上胚层细胞进入胚盾,形成胚盾的上胚层,胚环下胚层细胞则形成胚盾下胚层。胚盾上胚层将发育成胚体外胚层,下胚层发育为胚体中胚层和内胚层。14 h 50 min,下包50%,随着细胞的继续下包,胚盾不断伸长(图 1-13),其下胚层细胞继续向前端集中和延伸,形成胚体中胚层,胚体原基出现,此时胚体三胚层形成(图 2-9)。
原肠末期(75%-100%):17 h 33 min,下包75%,细胞进一步向植物极下包,中线处的外胚层细胞增生呈板状,神经板形成(图 1-14、图 2-10),此时胚盘表面的包被层逐渐扁平化,胚胎周皮形成(图 2-10)。21 h 13 min,下包90%,胚体卵黄囊几乎被包裹,在植物极未被包围的卵黄部分称为卵黄栓或原口(图 1-15)。神经板前端膨大形成脑原基(图 2-11),在脑原基两侧区域形成一对对称的囊状突起即视泡(图 1-15、图 2-12)。脊索原基出现,由大且圆的细胞构成(图 2-13)。神经板细胞不断扩展、膨胀,在脊索原基上侧形成一个龙骨状结构(Neural keel)(图 2-11、图 2-13),为神经索前体。第1对体节出现(图 2-14)。24 h 15 min,胚盘下包完成,原口封闭,此时体节3对(图 1-16a)。龙骨状结构在邻近细胞的迅速挤压下,细胞粘贴在一起,之后合并形成实心的细胞索,原始的神经索形成(Neural rod) (图 1-16b、图 2-15)。脊索原基细胞分化为两层细胞,其背侧的细胞扁平化,形成神经基板原基(图 2-16)。在眼囊的后侧方,听囊形成(图 2-17)。此时,脑在形态上分化为三部分:前脑、中脑和后脑(图 2-18)。24 h 55 min,克氏囊在尾芽上部出现(图 1-17),由背部的立方形内胚层细胞与内卵黄合胞体组成(图 2-19)。
2.5 器官分化期受精26 h 23 min,胚体进入器官分化期,胚体体节继续增多,视囊增大。脑在形态上分化成了端脑、前脑、中脑和后脑,此时视泡外皮向内凹陷,形成双层杯状结构即视杯;贴近视杯的表皮外胚层逐渐增厚内陷入视杯,形成晶状体泡(图 2-20)。35 h 44 min,心脏原基出现,尾牙继续延伸、增长,逐渐偏离卵黄囊(图 1-18)。神经索中空化,此时神经管形成,脊索上部神经基板细胞继续扁平化,而在脊索下部,下脊索形成,由单层扁平细胞构成(图 2-21)。胚体体节进一步增多,在胚体腹部,原始的消化管出现,由两层扁平细胞组成的狭缝(图 2-22)。视杯内外两层细胞不断靠拢生长、增厚,最终两层腔缝消失,外细胞层发育成为视网膜色素上皮,内细胞层发育成为原始的视网膜。此时晶状体泡开始分化,晶状体内层细胞不断向内生长、延伸,在中心部位聚集,形成原始晶状体,听囊开始中空化(图 2-23)。
38 h 35 min,神经索中空化明显,此时脊索开始空泡化,消化管官腔增大(图 2-24)。40 h 22 min,体节细胞逐渐拉长、延伸,形成肌纤维细胞(图 2-25)。此时心脏开始跳动,围心腔出现(图 2-26)。42 h 50 min,可见明显分化的脑和中空化的听囊及脊索(图 2-27),消化管腔进一步增大,可见明显的立方上皮细胞,在脊索下部、消化管上方,肾管原基出现(图 2-28)。44 h 15 min,体节发育形成肌节,在胚体上呈V型结构,V型尖部方向朝向胚体的头部(图 2-29)。胚体尾芽继续延伸,在其外围尾鳍鳍褶出现,此时克氏囊腔退化(图 2-30)。47 h 35 min,心脏跳动频繁,围心腔逐渐增大(图 2-31)。克氏囊消失。晶状体被单层立方上皮所包裹,其内皮细胞增生、变长,继续向内延伸,形成初级晶状体纤维,在眼腹面可见明显的脉络膜裂(图 2-32)。胚体开始间歇性抽动,开始进入孵化期。
2.6 孵化期60 h 15 min,仔鱼出膜前期,胚胎转动明显,鳍原基全部出现(图 1-19)。角膜在视网膜前缘的瞳孔处形成,由单一的立方上皮构成。晶状体新生纤维继续向中央环绕(图 2-33)。70 h 15 min,仔鱼头尾剧烈摆动,卵膜破裂,仔鱼头部最先出膜,仔鱼大量出膜(图 1-20),此时仔鱼卵黄囊较大,附有轻微的色素,卵黄囊内不具油球(图 1-21)。
3 讨论卵裂是在母型调控下进行的极其复杂协调的细胞性活动,不同的生物种类,卵裂的模式不同。卵中卵黄的含量多少及分布决定了卵裂发生的位置和卵裂球的大小。对于大多数硬骨鱼类而言,卵均属于端黄卵,受精卵的分裂方式为不完全卵裂,而且由于种间存在的差异性,胚体细胞分裂的方式也具有一定的差别。本研究中,美洲鲥从第1次到第5次的卵裂方式均为经裂,自第6次开始出现纬裂。这与大菱鲆(Scophthalmus maximus) (佟雪红等, 2010)、大西洋鳕(Gadus morhua) (Hall et al, 2004)和鱇酿白鱼(Ma et al, 2008)类似。而条石鲷(Oplegnathus fasciatus)卵裂中直到第5次分裂(32细胞期)才出现纬裂(何滔, 2011)1);青鳉(Oryzias latipes)胚胎卵裂过程中第1次纬裂出现在第5次分裂(Iwamatsu, 2004);彼氏冰鰕虎鱼(Leucopsarion petersii)纬裂出现的时间更早,在第3次卵裂时出现(Nakatsuji et al, 2009)。由此可见,鱼类卵受精后的几次卵裂均为经裂,且在形态发生上较为相似,而纬裂的发生具有一定的时序性差异。
胚胎神经胚由预定的原肠腔外胚层细胞分化而成,其具有两种形成方式:初级神经胚形成即由脊索中胚层诱导外胚层细胞不断分裂、内陷,同时与其表皮脱离、包裹形成中空的神经管;而次级神经胚形成则是外胚层细胞向胚胎内部下陷形成实心的细胞索,之后细胞索中心发生中空化继而形成神经管。对于大多数鱼类而言,其神经胚形成均属于完全次级神经胚的形成方式。本研究中,美洲鲥原始的神经索在胚体完全下包时出现,此时为实心圆柱状;在受精35 h 44 min后,实心的神经索中空化,此时,胚体神经管形成,为典型的次级神经胚。这与条石鲷(何滔, 2011)1)、大菱鲆(佟雪红等, 2010)和大西洋鳕(Hall et al, 2004)的结果类似。
在胚胎发育过程中,体节是暂时性结构,其起源于胚体中胚层,沿体轴两侧从前到后,有顺序排列形成(刘东, 2012)。Hall等(2004)对大西洋鳕的研究表明,胚体在下包45%时,第1对体节出现。大菱鲆、条石鲷和夏鲆(Paralichthys dentatus)第1体节均在胚体下包90%时形成(Martinez et al, 2003; 佟雪红等, 2010; 何滔, 2011)1),而纹鳢(Channa striatus)、斑马鱼(Brachydanio rerio)和青鳉的第1体节在胚体完全下包时形成(Iwamatsu, 2004; Kimmel et al, 1995; Marimuthu et al, 2007)。本研究中,美洲鲥第1体节在胚体下包90%出现,这与大菱鲆、条石鲷和夏鲆的结果类似,由此可见,鱼类体节形成时间具有种的差异性。胚胎体节能够分化出肌节和生骨节等细胞,对早期仔稚鱼骨骼和肌肉的分化发育具有重要的影响(Hall et al, 2004)。而且Morin-Kensicki等(1997)也指出,在斑马鱼胚体发育过程中,一些体节细胞对血管的发育具有一定的作用。此外,在硬骨鱼类中,体节最终的数目也具有一定的差异,如大西洋鳕体节共52对(Hall et al, 2004),大西洋鲱(Clupea harengus)体节总数为62对(Hill et al, 1997),大西洋鲑(Salmo salar) (Gorodilov, 1996)和海鳟(Salmo trutta)体节总数均为60对(Killeen et al, 1999),斑马鱼则为32对(Kimmel et al, 1995)。本研究中,美洲鲥体节总数为55对。这可能与养殖温度或者盐度有关(Hempel et al, 1961)。
克氏囊是胚体发育阶段存在的一种暂时性的结构,位于胚胎后端腹面,靠近尾芽,为鱼类所特有,其随着胚胎的生长发育逐渐退化。本研究中,受精后24 h 55 min,克氏囊在胚体尾芽上方出现,为一个透明的球形,在47 h 35 min退化消失,历经大约22 h。有研究表明,克氏囊能够通过调节囊内液体的定向流动来保证胚体左右对称性发育(Essner et al, 2005; Okabe et al, 2008)。也有研究表明,构成克氏囊的细胞参与了胚体消化管的形成,因此,认为早期克氏囊的出现可能与营养物质的消化吸收有关(Rosenthal et al, 1973; Brummett et al, 1978)。然而,关于克氏囊在胚胎发育过程出现的机制及功能仍然不清楚。美洲鲥受精后35 h 44 min,心脏原基出现;40 h 22 min,围心腔出现,心脏开始跳动,在消化管上方一对肾管原基形成,此时可见微弱的体液循环。大多数硬骨鱼类胚胎心跳初期并没有功能性的鳃和血细胞,不能进行气体交换作用,因此,早期的循环系统可能与代谢废物的运输及卵黄营养物质的吸收有关(Isogai et al, 2001; Hall et al, 2004)。
大多数硬骨鱼类的眼囊原基出现在原肠晚期,在器官分化期开始分化形成原始的视网膜和晶状体。条石鲷受精10.5 h后胚胎发育至原肠晚期,眼囊原基出现,至15.5 h后胚胎器官开始分化,原始视网膜及晶状体形成,受精22 h后,胚胎发育至孵化期,角膜在脉络膜裂口处形成(何滔等, 2012)。大西洋鳕也具有类似的发育特点(Hall et al, 2004)。本研究中,美洲鲥受精21 h 13 min,胚盘下包90%,眼囊原基出现,受精35 h 44 min后,器官开始分化,原始的视网膜和晶状体形成,受精60 h 15 min,仔鱼出膜前期,角膜形成。由此可见,未分化的视网膜、晶状体及角膜构成了初孵仔鱼最原始的视觉系统。然而,在河川沙塘鳢(Odontobutis potamophila)的研究发现,受精后141 h,原始视网膜及晶状体出现;213 h,晶状体开始分化,角膜、巩膜明显,此时视网膜分化为6层;376 h,胚胎进入孵化前期,角膜分化为5层,视网膜分化为10层,虹膜、脉络膜明显。可见,河川沙塘鳢在孵化前,眼各个组织结构均开始分化发育,初孵仔鱼已经具备了较为完善的视觉系统(胡先成等, 2007)。这种发育模式可能与鱼类的生活环境及种质间的差异有关。
| Brummett AR, Dumont JN. Kupffer's vesicle in Fundulus heteroclitus: A scanning and transmission electron microscope study. Tissue & Cell, 1978, 10(1): 11-22 | |
| Chen MM, Luo J, Chen GH, et al. Embryonic development and morphologic observation of newly-hatched Cheilinus undulatus larvae. Progress in Fishery Sciences, 2015, 36(5): 38-44 DOI:10.11758/yykxjz.20150506 [陈猛猛, 骆剑, 陈国华, 等. 波纹唇鱼(Cheilinus undulatus)的胚胎发育及初孵仔鱼的形态观察. 渔业科学进展, 2015, 36(5): 38-44] | |
| Essner JJ, Amack JD, Nyholm MK, et al. Kupffer's vesicle is a ciliated organ of asymmetry in the zebrafish embryo that initiates left-right development of the brain, heart and gut. Development, 2005, 132(6): 1247-1260 DOI:10.1242/dev.01663 | |
| Evermann BW, Jordan DS. The fishes of north and middle America: A descriptive catalogue of the species of fish-like vertebrates found in the waters of North America, North of the Isthmus of Panama (Volume 1). Washington: Government Printing Office, 1986: 427-428 | |
| Gao XQ, Hong L, Liu ZF, et al. An integrative study of larval organogenesis of American shad Alosa sapidissima, in histological aspects. Chinese Journal of Oceanology & Limnology, 2015, 34(1): 1-17 | |
| Gao XQ, Hong L, Liu ZF, et al. The definition of point of no return of larvae and feeding characteristics of Alosa sapidissima larvae and juvenile. Journal of Fisheries of China, 2015, 39(3): 392-400 [高小强, 洪磊, 刘志峰, 等. 美洲西鲱仔鱼不可逆点及仔、稚鱼摄食特性研究. 水产学报, 2015, 39(3): 392-400] | |
| Gorodilov YN. Description of the early ontogeny of the Atlantic salmon, Salmo salar, with a novel system of interval (state) identification. Environmental Biology of Fishes, 1996, 47(47): 109-127 | |
| Guan M, Xiao K, Hu MH, et al. Study on the embryonic and early larval development of Rhinogobio ventralis. Progress in Fishery Sciences, 2015, 36(4): 57-64 DOI:10.11758/yykxjz.20150408 [管敏, 肖衎, 胡美宏, 等. 长鳍吻(Rhinogobio ventralis)胚胎发育和仔鱼发育. 渔业科学进展, 2015, 36(4): 57-64] | |
| Hall TE, Smith P, Johnston IA. Stages of embryonic development in the Atlantic cod Gadus morhua. Journal of Morphology, 2004, 259(3): 255-270 DOI:10.1002/(ISSN)1097-4687 | |
| He T, Xiao ZZ, Liu QH, et al. Histological observation of eye ontogeny in rock bream larvae (Oplegnathus fasciatus). Marine Sciences, 2012, 36(3): 49-53 [何滔, 肖志忠, 刘清华, 等. 条石鲷视觉器官早期发育的组织学观察. 海洋科学, 2012, 36(3): 49-53] | |
| Hempel G, Blaxter JHS. The experimental modification of meristic characters in herring (Clupea harengus L.). ICES Journal of Marine Science, 1961, 26(3): 336-346 DOI:10.1093/icesjms/26.3.336 | |
| Hill J, Johnston IA. Temperature and neural development of the Atlantic herring (Clupea harengus, L.). Comparative Biochemistry & Physiology Part A Physiology, 1997, 117(4): 457-462 | |
| Hu XC, Zhao YL. Visual organ development and its relationship with feeding of Odontobutis potamophila. Chinese Journal of Zoology, 2007, 42(5): 41-48 [胡先成, 赵云龙. 河川沙塘鳢视觉器官的发育及其与摄食的关系. 动物学杂志, 2007, 42(5): 41-48] | |
| Isogai S, Horiguchi M, Weinstein BM. The vascular anatomy of the developing zebrafish: An atlas of embryonic and early larval development. Developmental Biology, 2001, 230(2): 278-301 DOI:10.1006/dbio.2000.9995 | |
| Iwamatsu T. Stages of normal development in the medaka Oryzias latipes. Mechanisms of Development, 2004, 121(8): 605-618 | |
| Jones PW, Martin FD, Hardy JD. Development of fishes of the mid-Atlantic Bight. An atlas of egg, larval and juvenile stages. Volume 1. Acipenseridae through Ictaluridae. Fish and Wildlife Service/Office of Biological Services, Center for Environmental and Estuarine Studies of University of Maryland. Contribution, 1978, No. 783, 98-104 | |
| Killeen JR, McLay HA, Johnston IA. Temperature and neuromuscular development in embryos of the trout (Salmo trutta L.). Comparative Biochemistry and Physiology Part A Molecular & Integrative Physiology, 1999, 122(1): 53-64 | |
| Kimmel CB, Ballard WW, Kimmel SR, et al. Stages of embryonic development of the zebrafish. Developmental Dynamics an Official Publication of the American Association of Anatomists, 1995, 203(3): 253-310 DOI:10.1002/aja.1002030302 | |
| Limburg KE, Hattala KA, Kahnle A. American shad in its native range. In : Limburg KE, Waldman JR eds. Biodiversity, status, and conservation of the world's shads. American Fisheries Society Symposium, 35, Bethesda, Maryland, 2003, 125-140 | |
| Liu D. Blocking connexin43 expression caused abnormal zebrafish posterior somites development. Journal of Nantong University (Medical Sciences), 2012, 31(6): 425-427 [刘东. Connexin43基因表达下调导致斑马鱼胚胎后部体节发育异常. 南通大学学报(医学版), 2012, 31(6): 425-427] | |
| Ma L, Pan XF, Wei YH, et al. Embryonic stages and eye-specific gene expression of the local cyprinoid fish Anabarilius grahami in Fuxian Lake, China. Journal of Fish Biology, 2008, 73(8): 1946-1959 DOI:10.1111/jfb.2008.73.issue-8 | |
| Marimuthu K, Haniffa MA. Embryonic and larval development of the striped snakehead Channa striatus. Taiwania, 2007, 52(1): 84-92 | |
| Martinez GM, Bolker JA. Embryonic and larval staging of summer flounder (Paralichthys dentatus). Journal of Morphology, 2003, 255(2): 162-176 DOI:10.1002/(ISSN)1097-4687 | |
| Morin-Kensicki EM, Eisen JS. Sclerotome development and peripheral nervous system segmentation in embryonic zebrafish. Development, 1997, 124(1): 159-67 | |
| Morrison CM, Miyake T, Wright JR. Histological study of the development of the embryo and early larva of Oreochromis niloticus. Journal of Morphology, 2001, 247(2): 172-195 DOI:10.1002/(ISSN)1097-4687 | |
| Nakatsuji T, Kitano T, Akiyama N, et al. Ice goby (Shiro-uo), Leucopsarion petersii, may be a useful material for studying teleostean embryogenesis. Zoologicalence, 2009, 14(Jun 1997): 443-448 | |
| Okabe N, Burdine RD. Fluid dynamics in zebrafish Kupffer's vesicle. Developmental Dynamics an Official Publication of the American Association of Anatomists, 2008, 237(12): 3602-3612 DOI:10.1002/dvdy.v237:12 | |
| Rosenthal H, Fond M. Biological observations during rearing experiments with the garfish Belone belone. Marine Biology, 1973, 21(3): 203-218 DOI:10.1007/BF00355251 | |
| Tong XH, Ma DY, Xu SH, et al. Morphological and histological development of the embryo of turbot Scophthalmus maximus. Oceanologia Et Limnologia Sinica, 2011, 42(6): 844-849 DOI:10.11693/hyhz201106015015 [佟雪红, 马道远, 徐世宏, 等. 大菱鲆(Scophthalmus maximus)胚胎发育的形态学和组织学研究. 海洋与湖沼, 2011, 42(6): 844-849] | |
| Wu WH, Wang B, Shi W, et al. Study on culture technology of American shad (Alosa sapidissima) on a large scale Ⅰ.juveniles culturing. Chinese Journal of Fisheries, 2004, 17(2): 61-64 [吴文化, 王斌, 师伟, 等. 美洲鲥鱼苗种规模化养殖技术研究—稚鱼培育. 水产学杂志, 2004, 17(2): 61-64] | |
| Xu GC, Zhang CX, Zheng JL, et al. Artificial propagation and embryonic development of American shad, Alosa sapidissima. Marine Sciences, 2012, 36(7): 89-96 [徐钢春, 张呈祥, 郑金良, 等. 美洲鲥的人工繁殖及胚胎发育的研究. 海洋科学, 2012, 36(7): 89-96] | |
| Zhang MQ, Chen C, Li YL, et al. Developmental and morphological characteristics of embryo, larval, juvenile, and young fish, Chromileptes altivelis. Progress in Fishery Sciences, 2014, 35(5): 145-153 DOI:10.11758/yykxjz.20140521 [张梦淇, 陈超, 李炎璐, 等. 驼背鲈(Chromileptes altivelis)的胚胎发育及仔、稚、幼鱼形态观察. 渔业科学进展, 2014, 35(5): 145-153] |



