2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
紫菜(Pyropia)味道鲜美,营养丰富,具有较高的经济价值,我国主要栽培品种是条斑紫菜(P. yezoensis)和坛紫菜(P. haitanensis)。其中,条斑紫菜主要分布在中国的黄海、渤海、东海,日本列岛以及朝鲜半岛(何文君, 2009)1)。近年来,条斑紫菜养殖面积不断增大,成为我国长江以北主要经济海藻物种。大多数紫菜的生命周期包括两个阶段:丝状体时期和叶状体时期。紫菜叶状体多生长在潮间带的岩石上(钱飞箭, 2014)1)。随着潮汐作用,潮间带海藻生长于两种不同环境中:低潮时暴露于空气中,高潮时沉没于海水中。两种环境条件下,其光合能力和作用机理不同。沉没于海水时,海藻利用水体中的溶解性无机碳(主要为HCO3–)进行光合作用;在干出状态下,某些藻体主要利用空气中的CO2进行光合作用(邹定辉等, 2001)。不同紫菜物种对外界环境变化的适应能力不同。坛紫菜叶状体干露在空气中长达8 h,失水率达90%以上,复水后藻体仍健康生长(谢佳等, 2014);而生长在潮间带水沼中的半叶紫菜(Pyropia katadae var. hemiphylla)耐受失水胁迫的临界点为42%–46% (Lin et al, 2009; Wang et al, 2016)。
1) He WJ. Physiological effects of high temperature stress on and cloning and expression of Hsp70 gene from conchocelis of Porphyra yezoensis. Masters Thesis of Liaoning Normal University, 2009, 1–2 [何文君. 高温胁迫对条斑紫菜丝状体生理影响及 Hsp70 基因的克隆和表达. 辽宁师范大学硕士研究生学位论文, 2009, 1–2]
1) Qian JF. Study on the mechanism of Pyropia haitanensis induced by stressed and lipid metabolism related gene. Master's Thesis of Ningbo University, 2014, 1–2 [钱飞箭.坛紫菜受高温和干出胁迫的机理及脂代谢关键基因的研究.宁波大学硕士研究生学位论文, 2014, 1–2]
植物在经历逆境胁迫时,通常产生活性氧成分(ROS),致使膜脂过氧化。丙二醛(MDA)积累是膜脂过氧化的重要指标。如在Cu2+和盐胁迫初期,条斑紫菜体内MDA含量迅速增加,增幅可高达300% (冯琛等, 2004)。在逆境胁迫下,植物体内的抗氧化体系起着关键的调节作用。抗氧化体系包括还原物质和抗氧化酶类,在经历失水和复水的过程中,不同紫菜其体内氧化还原物质的含量与活性的变化也不尽相同。随着失水胁迫的增大,坛紫菜藻体活性氧成分呈上升趋势,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性呈现下降的趋势,谷胱甘肽还原酶(GR)、抗坏血酸(ASA)、还原型谷胱甘肽(GSH)呈现上升的趋势,表明坛紫菜细胞在发生高度失水胁迫时所产生的活性氧成分,主要由GR、ASA、GSH去除(谢佳等, 2014);Porphyra columbina藻体CAT活力、光系统Ⅱ(PSⅡ)原初光能转化效率(Fv/Fm)以及叶绿素a (Chl a)含量呈现下降趋势,藻红蛋白(R-PE)、藻蓝蛋白(R-PC)含量则呈现上升的趋势(Contreras-Porcia et al, 2010)。已有研究表明,条斑紫菜中某些多糖和黄酮类物质具有体外抗氧化活性(陈利梅, 2012;何芳等, 2015)。但在失水胁迫下,条斑紫菜体内重要的氧化还原物质的含量或活性的反应情况,尚知之甚少。本研究拟通过测定野生条斑紫菜叶状体在不同干出胁迫下,藻体内光合作用、光合色素、可溶性蛋白(SP)和MDA含量,以及重要抗氧化酶活力的变化情况,以探讨野生条斑紫菜对干出胁迫的生理响应特征,为揭示条斑紫菜叶状体对干出失水的适应机制奠定基础。
1 材料与方法 1.1 实验材料的处理实验材料于2016年3月采自山东青岛湛山潮间带岩石上。取回后立刻将紫菜叶状体擦干并置于光照培养箱中,光强为30 µmol·photons·m-2·s-1,温度为13℃,放置不同时间,计算失水率:
失水率=(鲜重–藻体失水后重量)/鲜重×100%
对失水率为10%、20%、30%、40%、50%、60%、70%、80%的样品,分别测量Fv/Fm、光合色素Chl a、Car、R-PE、R-PC、SP、MDA的含量,以及抗氧化酶SOD、POD、CAT的活性。每组样品设3个生物学重复。
1.2 叶绿素荧光参数的测定将新鲜紫菜叶状体擦干表面水分,置于光照培养箱中进行干出实验,将样品置于黑暗中10 min,测定Fv/Fm值。每个实验组设置3个重复。随后对处理样品进行复水处理。
1.3 叶绿素a和类胡萝卜素含量的测定称取干出后的藻体0.1 g,液氮充分研磨后,用5 ml 100%甲醇进行提取,然后放入4℃冰箱中(避光保存),静置24 h。4℃ 5000 g离心10 min,用紫外可见光分光光度计测定上清液的吸光度,对照液为100%甲醇。根据公式计算Chl a的含量(Robert, 1983):[Chl a]= 16.29×A665 nm-8.54×A652 nm。根据公式计算Car的含量:[Car]=7.6×(A480 nm-1.49×A510 nm)。
1.4 藻胆蛋白含量的测定R-PE和R-PC含量的测定参考高洪峰等(1993)。取干出后的藻体0.1 g,用0.1 mol/L的磷酸缓冲液进行提取,4℃ 5000×g离心10 min,取上清液,定容至25 ml,测其在455、564、592、595、618、645 nm处的吸光值,对照液为磷酸缓冲液。计算公式:
[R-PE]=0.123×A560 nm–0.07×A618 nm+0.015×A650 nm
[R-PC]=0.187×A618 nm–0.089×A650 nm
1.5 可溶性蛋白含量的测定考马斯亮蓝溶液(CBB)配制:考马斯亮蓝G-250 100 mg溶于50 ml 95%乙醇,加入100 ml 85% H3PO4,用蒸馏水稀释至1000 ml。
蛋白标准曲线:牛血清蛋白,根据其浓度用0.15 mol/L NaCl配制成100 μg/ml的蛋白溶液。标准曲线按表 1制作。以OD595 nm为纵坐标,标准蛋白含量为横坐标,在坐标轴上绘制标准曲线(张志良, 2001)。
|
|
表 1 蛋白标准曲线 Table 1 The standard protein curve |
蛋白质的提取:取0.1 g藻体,液氮充分研磨后,用蒸馏水定容至5 ml,涡旋20 min,4℃ 5000 g离心10 min得到提取液。0.1 ml提取液加0.9 ml蒸馏水加5 ml CBB混匀,2–5 min后测OD595 nm。对照液为1 ml蒸馏水加5 ml CBB。
1.6 MDA及POD、SOD、CAT含量的测定MDA及POD、SOD、CAT含量的测定均采用南京建成试剂盒依次测定,记录结果。
1.7 数据处理因材料进行了失水处理,计算色素、SP、MDA的含量时,需进行调整:以上公式测定含量×(1-失水率),再进行不同失水率组间的对比。采用Excel 2007、Origin 8以及SPSS数据处理系统进行数据的统计分析并做图,设显著水平为P < 0.05。
2 结果 2.1 干出胁迫对野生条斑紫菜Fv/Fm的影响如图 1所示,随着失水率的增加,Fv/Fm显著下降(P < 0.05),当失水率达到60%时,Fv/Fm达到最小值。当藻体失水66%时,对藻体进行1 h复水处理,藻体的Fv/Fm可恢复正常值(0.5–0.6);失水率80%的藻体复水1 h后,Fv/Fm可恢复至0.48。

|
图 1 干出胁迫对野生条斑紫菜Fv/Fm的影响 Figure 1 Effect of water loss on the optimal chlorophyll fluorescence quantum yields (Fv/Fm) of wild P. yezoensis |
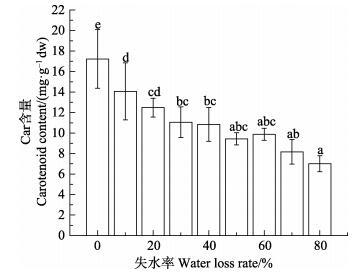
从图 2和图 3可以看出,随着失水率的增大,紫菜叶状体Chl a和Car的含量呈现逐渐下降的趋势。对照组(失水率为0) Chl a和Car的含量显著高于实验组(P < 0.05)。在失水率为10%–20%时,Chl a和Car含量与对照组相比显著下降(P < 0.05);失水率为30%– 70%,Chl a和Car的含量比失水率20%时显著下降;在失水率为80%时,Chl a和Car的含量降到最低值,与失水率≤40%组差异显著(P < 0.05)。

|
图 2 干出胁迫对野生条斑紫菜Chl a含量的影响 Figure 2 Effects of water loss on the Chlorophyll a content of wild P. yezoensis 标有不同字母者表示差异显著(P < 0.05)。下同 Different letters indicated significant differences (P < 0.05). The same as below |
|
图 3 干出胁迫对野生条斑紫菜Car含量的影响 Figure 3 Effects of water loss on the carotenoid content of wild P. yezoensis |
如图 4、5所示,R-PE和R-PC的变化趋势一致,对照组含量最高,在失水胁迫初期(失水率10%–20%),R-PE和R-PC含量显著下降(P < 0.05);随着藻体失水率从20%增加到60%,R-PE和R-PC含量呈上升趋势;随着藻体继续失水直至失水率达80%,R-PE和R-PC含量没有显著变化。总体来说,与对照组相比,藻胆蛋白(R-PE和R-PC)含量在失水藻体中是降低的。

|
图 4 干出胁迫对野生条斑紫菜R-PE含量的影响 Figure 4 Effects of water loss on the R-phycoerythrin content of wild P. yezoensis |

|
图 5 干出胁迫对野生条斑紫菜R-PC含量的影响 Figure 5 Effects of water loss on the R-phycocyanin content of wild P. yezoensis |
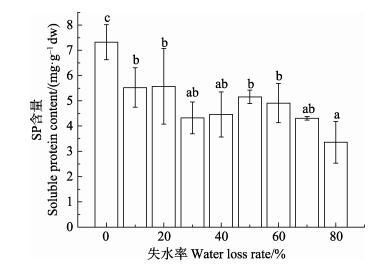
从图 6可以看出,随着失水胁迫的增大,SP含量呈现逐渐下降的趋势。对照组SP含量显著高于实验组(P < 0.05),失水率为10%–70%时,组间差异不显著;失水率达到80%时,即高失水胁迫下,SP含量显著下降(P < 0.05)。总体来说,与对照组相比,SP含量在失水藻体中是降低的。
|
图 6 干出胁迫对野生条斑紫菜SP含量的影响 Figure 6 Effects of water loss on the soluble protein content of wild P. yezoensis |
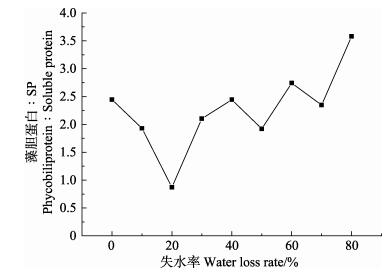
在失水胁迫初期(失水率为10%–20%),藻胆蛋白(R-PE+R-PC)与SP的比值呈急剧下降趋势;随着藻体失水率从20%增加到40%,该比值上升至对照水平(失水率=0);随着藻体继续失水直至失水率达80%,该比值显著高于对照值。总之,与对照组相比,藻胆蛋白(R-PE+R-PC)与SP的比值呈现先下降后升高的趋势(图 7)。
|
图 7 干出胁迫下野生条斑紫菜藻胆蛋白与SP比值 Figure 7 The ratio of phycobiliproteins to soluble proteins of wild P. yezoensis during water loss |
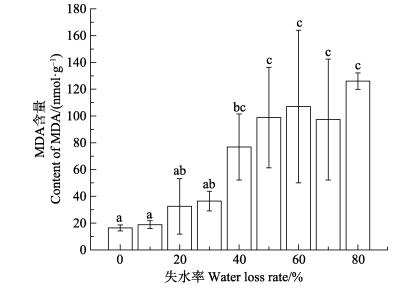
失水率为10%–30%时,藻体MDA含量与对照组相比差异不显著(P﹥0.05);失水率为40%时,MDA含量与对照组相比显著升高(P < 0.05),但直至失水率由40%增加到80%,MDA含量没有显著变化(图 8)。
|
图 8 干出胁迫对野生条斑紫菜MDA含量的影响 Figure 8 Effects of water loss on the malondialdehyde content of wild P. yezoensis |
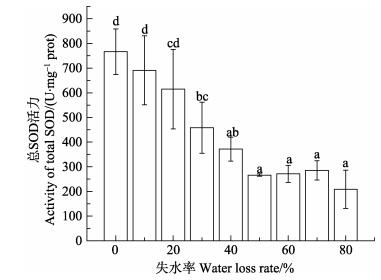
失水率达到10%、20%时,总SOD活力与对照组没有显著差异(P﹥0.05) (图 9);当失水率达到30%时,总SOD活力显著降低(P < 0.05);失水率从50%至80%,其间差异不显著,但与失水率 < 40%组相比,总SOD活力显著降低(P < 0.05)。
|
图 9 干出胁迫对野生条斑紫菜总SOD活力的影响 Figure 9 Effects of water loss rate on the total superoxide dismutase activity of wild P. yezoensis |
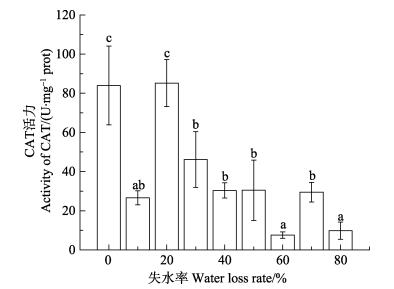
如图 10所示,失水率≤20%时,CAT活力维持在对照水平;失水率30%时,CAT活力下降,显著低于对照组(P < 0.05);失水率增加到70%,CAT酶活力变化不大;失水率80%组的CAT活力又显著下降。
|
图 10 干出胁迫对野生条斑紫菜CAT活力的影响 Figure 10 Effects of water loss on the catalase activity of wild P. yezoensis |
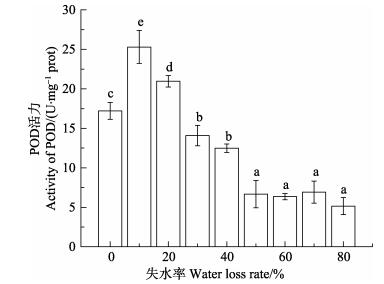
在干出过程中,POD活力的变化趋势与SOD和CAT明显不同。失水率10%的处理相比对照组,POD活力显著上升(P < 0.05);随着失水率增加,POD活力逐渐下降(P < 0.05),但失水率20%时其活力仍然显著高于对照组;当失水率≥30%时,处理组的POD活力降低至对照以下(P < 0.05);失水率50%–80%处理组,其POD活力水平与失水率30%–40%组相比,又有显著下降,但彼此间没有显著差异(P﹥0.05) (图 11)。
|
图 11 干出胁迫对野生条斑紫菜POD活力的影响 Figure 11 Effects of water loss on the POD activity of wild P. yezoensis |
紫菜的光合色素主要是藻胆蛋白和叶绿素,而藻胆蛋白包括R-PE、R-PC和别藻蓝蛋白。藻胆蛋白是红藻的主要捕光色素,能高效捕获光能,并传递至PSⅡ。光合色素的含量极易受外界环境的影响(Shen, 1995)。对刚采集的新鲜野生紫菜进行不同程度的干出胁迫发现,随着失水率的增大,紫菜叶状体的Chl a和Car含量不断下降,藻胆蛋白的含量呈现先下降后上升的趋势,失水处理组与对照组相比,藻胆蛋白含量降低。本研究发现,随着失水程度加大,Fv/Fm显著降低,推测是由于失水抑制了光合色素的合成、光合链的电子传递和一些酶的活性。Hader等(2002) 指出,藻体在氧化应激状态下,PSⅡ呈现下调状态,其间的能量以热能形式耗散,以保护光合膜不受损伤。Oh等(2013) 研究发现,Car不仅参与吸收传递光能的过程,而且还会接受过剩的叶绿体激发态的能量,避免单线态氧的产生,进而起到保护作用(白志英等, 2009)。在逆境条件下,Car还会被ROS氧化,以减少ROS的产生。因此,推测Car含量的降低与参与抗氧化反应有关。藻胆蛋白不仅是主要的捕光色素,还是紫菜体内重要的抗氧化物质。Contreras-Porciaet等(2010) 研究发现,在Porphyra columbina干出过程中,R-PE和R-PC以热能的形式耗散藻体产生的过多热量,抑制活性氧的暴发。Romay等(2003) 研究指出,R-PC可以直接清除不同类型的活性氧,降低脂质过氧化的水平。藻胆蛋白是SP的重要组成部分,虽然失水胁迫导致藻体的藻胆蛋白(R-PE和R-PC)和SP含量降低(相比对照组),但对比不同程度失水胁迫藻体的藻胆蛋白(R-PE和R-PC):SP比值,发现该比值呈现先下降后上升的趋势,在失水率40%时达到对照水平,失水80%时显著超出对照水平。表明随着失水胁迫加剧,条斑紫菜藻胆蛋白的抗逆作用逐渐显现,一方面作为类囊体膜的重要组成部分,对维持光合膜的完整性起着积极作用,为保证复水后快速恢复光合作用(Fv/Fm)做准备;另一方面,作为抗氧化物质,抑制细胞内活性氧的过度累积,减轻膜脂的过氧化作用(MDA的产生)。
Davison等(1996) 研究表明,植物体在干出胁迫的过程中,最先受到伤害的是细胞膜,即发生膜脂过氧化,产生MDA。随着失水程度加剧,植物细胞中活性氧不断积累,MDA的含量也逐渐增加。本研究发现,随着失水胁迫处理,藻体MDA水平分为两个阶段:对照水平和胁迫水平。MDA含量在失水率≤30%时没有显著变化,失水率≥40%时显著上升,但失水率为40%–80%时,藻体间没有显著差异。表明失水率达40%时,细胞膜脂发生明显过氧化;但失水程度进一步加剧,条斑紫菜膜脂过氧化程度没有随之加剧,藻胆蛋白在可溶性蛋白中比重的增加可能对抑制MDA的产生具有重要贡献。失水胁迫初期,MDA水平没有明显积累,应该与抗氧化酶的作用相关。
为了避免过量活性氧对植物细胞的损伤,植物细胞通常会通过提高相关抗氧化酶的活性与抗氧化物质含量来清除过多的活性氧以应对胁迫(曾超西等, 1997; Lee et al, 1982)。野生条斑紫菜叶状体在失水胁迫初期(10%–20%),SOD和CAT活性与对照组无显著性差异;随着失水胁迫的增大,其活力显著下降,但失水率40%–80%组无显著性差异。说明野生条斑紫菜细胞中的SOD和CAT在低失水胁迫下参与过量活性氧的清除,但随着细胞含水量的减少,SOD和CAT活力逐渐降低。在植物经历胁迫的过程中,由于物种、生长环境以及地区分布的差异,细胞内相应的抗氧化应激途径也会有所差异。陆生植物SOD活性随干旱脱水可呈现一直下降、先上升后下降、保持不变等多种模式(李明等, 2002;赵天宏等, 2008)。生活在中高潮区的脐形紫菜(Porphyra umbilicalis)在失水胁迫后藻体SOD活力轻微下降,而生活在中低潮区的条斑紫菜没有发现此现象(Liu, 2009)1)。而本研究中SOD活力随着失水胁迫增加显著降低,可能由于本研究所采集的条斑紫菜品系和生长环境与Liu(2009)1)不同导致。CAT活力受外界条件影响较为明显,它是一类光敏感性酶类,强光下易发生光失活(赵天宏等, 2008);另外,超氧阴离子和过氧化氢共同或分别与CAT形成复合物,也可降低CAT的活力(Asada, 1999)。在干出过程中,POD活力的变化趋势与SOD和CAT明显不同。在失水初期(10%–20%),其活力显著上升,随后其活力随着胁迫程度的加大逐渐降低,这与邵世光等(2009) 在对条斑紫菜进行盐度胁迫处理时测定的POD活力变化一致,表明在失水胁迫初期藻体通过提高POD酶活性以减少胁迫产生的超氧化物自由基的伤害。结果表明,野生条斑紫菜在干出胁迫的过程中,POD、SOD与CAT在胁迫初期清除超氧化物自由基的过程中发挥了一定的作用,随着胁迫程度的增大,藻体细胞内水量减少,不能够为抗氧化酶系的抗氧化反应提供足够的水环境,进而导致相关酶活力降低。
1) Liu YC. Mechanism for differential desiccation tolerance in porphyra specie. Boston: Doctoral Dissertation of Northeastern University, 2009, 47–60
综上所述,随着条斑紫菜失水胁迫的增大,藻体光合作用降低,复水后可恢复到正常状态;Chl a、Car和SP含量减少;藻胆蛋白含量呈现先下降后上升的趋势;藻胆蛋白与SP比值的变化趋势与藻胆蛋白变化趋势类似,但在高失水胁迫下,该值显著高于对照组;细胞在失水率达40%以上(含)产生过量MDA;SOD、CAT、POD的活力均在低失水胁迫(≤20%)时活力较高,随着胁迫的增大,活力逐渐下降。由结果推测,在失水胁迫初期,主要由POD、SOD以及CAT等抗氧化酶抑制活性氧的暴发;在失水胁迫后期,抗氧化酶活力降低,藻胆蛋白可能起着清除活性氧的作用。
| Asada K. The water-water cycle in chloroplasts: Scavenging of active oxygens and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 601-639 DOI:10.1146/annurev.arplant.50.1.601 | |
| Bai ZY, Li CD, Sun HC, et al. The effect and chromosomal control on chlorophyll content and corticoid content under drought stress in wheat (Triticum aestivum L).. Acta Agriculturae Boreali-Sinic, 2009, 24(1): 1-6 DOI:10.7668/hbnxb.2009.01.001 [白志英, 李存东, 孙红春, 等. 干旱胁迫对小麦叶片叶绿素和类胡萝卜素含量的影响及染色体调控. 华北农学报, 2009, 24(1): 1-6] | |
| Chen LM. Ultrasonic-assisted aqueous two-phase extraction and antioxidant activity of total flavonoids from Porphyra yezoensis. Food Science, 2012, 33(4): 41-46 DOI:10.3969/j.issn.2095-6002.2012.04.009 [陈利梅. 超声波辅助双水相提取条斑紫菜黄酮类物质及其抗氧化活性研究. 食品科学, 2012, 33(4): 41-46] | |
| Contreras-Porcia L, Thomas D, Flores V, et al. Tolerance to oxidative stress induced by desiccation in Porphyra columbina (Bangiales, Rhodophyta). Journal of Experimental Botany, 2010, 62(6): 1815-1829 | |
| Davison IR, Pearson GA. Stress tolerance in intertidal seaweeds. Journal of Phycology, 1996, 32(2): 197-211 DOI:10.1111/j.0022-3646.1996.00197.x | |
| Feng C, Lu X, Yu W. Biochemical and physiological effects of adversity stress on Porphyra yezoensis. Transactions of Oceanology and Limnology, 2004, 11061106(3): 22-26 [冯琛, 路新枝, 于文功. 逆境胁迫对条斑紫菜生理生化指标的影响. 海洋湖沼通报, 2004, 11061106(3): 22-26] | |
| Gao HF. The variation in the contents of phycobiliproteins from Porphyra haitanensis collected in different growing stages. Oceanologia Et Limnologia Sinica, 1993, 24(6): 645-648 [高洪峰. 不同生长期坛紫菜中藻胆蛋白的含量变化. 海洋与湖沼, 1993, 24(6): 645-648] | |
| Hader D, Lebert M, Sinha RP, et al. Role of protective and repair mechanisms in the inhibition of photosynthesis in marine macroalgae. Photochemical and Photobiological Sciences, 2002, 1(10): 809-814 DOI:10.1039/B206152J | |
| He F, Wang ZH, Ma WW, et al. Study on antioxidant activity of polysaccharides with different molecular weights from Pyropia yeoensis in vitro. Journal of Shanghai Ocean University, 2015, 25(5): 783-788 [何芳, 汪之和, 马婉婉, 等. 不同分子量条斑紫菜多糖体外抗氧化活性研究. 上海海洋大学学报, 2015, 25(5): 783-788] | |
| Lee EH, Bennett JH. Superoxide dismutases. Plant Physiology, 1982, 69(12): 352-354 | |
| Li M, Wang GX. Effect of drought stress on activities of cell defense enzymes and lipid peroxidation in Glycyrrhiza uralensis seedlings. Acta Ecologica Sinica, 2002, 22(4): 503-507 [李明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响. 生态学报, 2002, 22(4): 503-507] | |
| Lin AP, Wang GC, Yang F, et al. Photosynthetic parameters of sexually different parts of Porphyra katadai var. hemiphylla (Bangiales, Rhodophyta) during dehydration and rehydration. Planta, 2009, 229: 803-810 | |
| Oh S, Shin M, Lee K, et al. Effects of water activity on pigments in dried laver (Porphyra) during storage. Food Science & Biotechnology, 2013, 22(6): 1523-1529 | |
| Robert J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b. Photosynthesis Research, 1983, 88(C7): 4505-4523 | |
| Romay Ch, González R, Ledón N, et al. C-phycocyanin: A biliprotein with antioxidant, anti-inflammatory and neuroprotective effects. Current Protein and Peptide Science, 2003, 4(3): 207-216 DOI:10.2174/1389203033487216 | |
| Shao SG, Yan BL, Li TY, et al. Effects of the stress of Cr6+, Pb2+, Cd2+on protective enzyme system in Porphyra yezoensis. Journal of Hydroecology, 2009, 2(4): 94-97 [邵世光, 阎斌伦, 李廷友, 等. Cr6+、Pb2+、Cd2+胁迫下条斑紫菜保护酶系统的响应. 水生态学杂志, 2009, 2(4): 94-97] | |
| Shen DL. Chromosomal and mutagenic study of the marine macroalgae, Gracilaria enuistipitata. Journal of Applied Phycology, 1995, 7(1): 26-30 | |
| Wang WJ, Sun XT, Liu FL, et al. Effect of abiotic stress on the gameophyte of Pyropia katadae var. hemiphylla (Bangiales, Rhodophyta). Journal of Applied Phycology, 2016, 28(1): 469-479 DOI:10.1007/s10811-015-0579-4 | |
| Pyropia katadae var. hemiphylla (Bangiales, Rhodophyta). Journal of Applied Phycology, 2016, 28(1): 469-479 DOI:10.1007/s10811-015-0579-4 | |
| Xie J, Xu Y, Ji DH, et al. Physiological response of the antioxidant system in Pyropia haitanensis to desiccation stress. Journal of Fishery Sciences of China, 2014, 21(2): 405-412 [谢佳, 徐燕, 纪德华, 等. 坛紫菜叶状体对失水胁迫的抗氧化生理响应. 中国水产科学, 2014, 21(2): 405-412] | |
| Zeng CX, Wang YR. Low temperature injury and peroxidation of membranes lipids in rice seedlings. Acta Botanica Sinica, 1997, 29(5): 506-512 [曾超西, 王以柔. 水稻幼苗的低温伤害与膜脂过氧化. 植物学报, 1997, 29(5): 506-512] | |
| Zhang ZL. Plant Physiology experiment instruction. Beijing: Higher Education Press, 2000: 125-126. [张志良. 植物生理学实验指导. 北京: 高等教育出版社, 2000: 125-126.] | |
| Zhao TH, Sun JW, Fu Y. Advances of research on metabolism of plant reactive oxygen species and exogenous regulation under abiotic stresses. Crops, 2008, 11061106(3): 10-13 [赵天宏, 孙加伟, 付宇. 逆境胁迫下植物活性氧代谢及外源调控机理的研究进展. 作物杂志, 2008, 11061106(3): 10-13] | |
| Zou DH, Gao KS. Progress in studies on photosynthetic in organic carbon utilization in marine macroalgae. Marine Science Bulletin, 2001, 20(5): 83-90 [邹定辉, 高坤山. 大型海藻类光合无机碳利用研究进展. 海洋通报, 2001, 20(5): 83-90] |



