2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
药物是水产病害防治的重要手段。氟苯尼考是新一代酰胺醇类(氯霉素类)广谱抗菌药物,以其良好的抗菌活性、较低的毒性和不易产生耐药性等优点,在国内外畜牧和水产养殖方面得到广泛应用(黄凯等, 2015;陈晋旭等, 2012)。抗菌药物在水产养殖中起着重要作用,但其过量使用对养殖生物和环境会造成不利影响。已有研究报道水产常用药物,如土霉素、恶喹酸和氟苯尼考,影响水产动物的免疫调节和引起氧化应激(Guardiola et al, 2012; Caipang et al, 2009)。Park等(1995) 研究发现,磺胺间二甲氧嘧啶会降低凡纳滨对虾(Litopenaeus vannamei)血细胞对微生物的吞噬能力。王永胜等(2008) 研究表明,氯霉素对凡纳滨对虾非特异性免疫系统具有一定的抑制作用。王海潮等(2011) 研究发现,水产中17种常见抗菌药物的高浓度组(500 μg/ml)均对锯缘青蟹(Scylla serrata)酚氧化酶(PO)活性有明显抑制作用;低剂量组(5–10 μg/ml)(推荐使用剂量),有的抗菌药物对PO有明显抑制作用,有的抗菌药物对PO无抑制作用,而阿维菌素和氟苯尼考对PO则有免疫促进作用。张喆等(2011) 研究了不同剂量诺氟沙星药饵投喂中国对虾(Fenneropenaeus chinensis)7 d后,发现其各剂量组鳃和肌肉中的抗氧化酶的变化趋势不同。Ren等(2014) 研究发现,氟苯尼考对凡纳滨对虾血淋巴抗氧化能力产生显著影响。
目前,有关氟苯尼考对甲壳动物影响的研究大多集中在药代和残留检测方面(岳刚毅等, 2011;赵青松等, 2014;杨倩等, 2010;邵会等, 2015),而氟苯尼考对甲壳动物免疫和抗氧化功能影响的研究较少。本研究向脊尾白虾(Exopalaemon carinicauda)配合饲料中添加低(10 mg/kg·BW)、中(20 mg/kg·BW)、高(40 mg/kg·BW) 3个剂量的氟苯尼考药粉,通过测定脊尾白虾血浆血蓝蛋白(HEM)含量、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和总抗氧化能力(T-AOC)的变化情况,探讨氟苯尼考对脊尾白虾免疫和抗氧化功能的影响,以期为甲壳动物健康养殖提供技术支持。
1 材料与方法 1.1 实验动物外观健康的脊尾白虾购于山东日照海辰水产有限公司。实验于昌邑市海丰水产养殖有限责任公司开展。实验用虾体长为(46.0±4.8) mm,体重为(1.5±0.4) g。实验前,在10 cm3室内水泥池暂养10 d,水温为(24.0±0.5)℃,盐度为27±1,pH为6.5±0.3。连续充气,每天换水1次,换水量为1/3,并投喂对虾配合饲料。
1.2 药物与试剂氟苯尼考由湖北中牧安达药业有限公司提供(批号150208-1),含量为98%;其他试剂为国产分析纯。
1.3 基础饲料基础饲料配方:鱼粉(45%)、花生粉(25%)、豆粕(10%)、面粉(7%)、鱼油(5%)、玉米粉(5%)、鱼膏(2%)。
1.4 实验设计实验分为对照组、氟苯尼考低剂量组(10 mg/kg·BW)、中剂量组(20 mg/kg·BW)和高剂量组(mg/kg·BW),每组90尾、3个平行,每个平行30尾。鸡蛋为粘合剂,每次投喂量为虾体重的2%(张喆等, 2011),对照组投喂不含药物的基础饲料。每天于07:00和17:00投喂2次,连续投喂5 d,之后各组均投喂基础饲料。于最后一次给药后的3、6、12、24、48、96、168和240 h分别随机挑选9尾虾,用1 ml一次性无菌注射器(先抽取0.3 ml抗凝剂-EDTA盐)于围心腔取0.3 ml血淋巴,置于1.5 ml无RNA酶离心管中,液氮保存。
1.5 样品处理取血淋巴冰上解冻,4℃、4000 r/min离心10 min,取血浆待用。
1.6 免疫和抗氧化酶活性测定血蓝蛋白含量:取100 μl血浆样品,加入900 μl双蒸水混匀,335 nm下测吸光值。每个样品3个重复。计算公式(Song et al, 2003):
E335 nm(mmol/L)=17.26×OD335 nm
ACP、AKP、T-SOD、CAT和T-AOC采用南京建成试剂盒测定。
1.7 统计分析数据以平均值±标准差(Mean±SD)表示,用SPSS 17.0软件进行单因素方差分析(One-way ANOVA)并进行Duncan氏多重比较(P < 0.05为差异显著)。
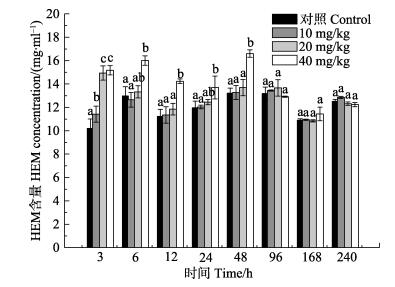
2 结果 2.1 氟苯尼考对脊尾白虾血浆中HEM含量的影响由图 1可知,与对照组相比,3个剂量组HEM含量均呈上升趋势。低、中剂量组在3 h与对照组均为显著差异(P < 0.05);高剂量组在3–48 h与对照组呈现显著差异(P < 0.05),96 h后恢复至对照组水平(P > 0.05)。比较不同组、同时间的HEM含量,3 h时中剂量组显著高于低剂量组(P < 0.05);6–48 h时高剂量组显著高于低、中剂量组(P < 0.05)。
|
图 1 氟苯尼考对脊尾白虾血浆中HEM含量的影响 Figure 1 Effects of florfenicol on the HEM concentration in the hemolymph serum of E. carinicauda 标有不同字母者表示在同一时间点组间差异显著(P < 0.05)。下同 Different letters indicated significant differences between the groups at the same time point (P < 0.05). The same as below |
由图 2可知,低、中剂量组血浆ACP活性均呈先升高后下降的趋势,在3 h均达到最高值,中剂量组显著高于低剂量组(P < 0.05),且3–6 h时间点与对照组表现出显著差异(P < 0.05),12 h时间点后恢复至对照组水平(P > 0.05);高剂量组的血浆ACP活性呈现下降趋势,在3–168 h显著低于其他3组(P < 0.05),240 h后恢复至对照组水平(P > 0.05)。

|
图 2 氟苯尼考对脊尾白虾血浆中ACP活性的影响 Figure 2 Effects of florfenicol on the activities of ACP |
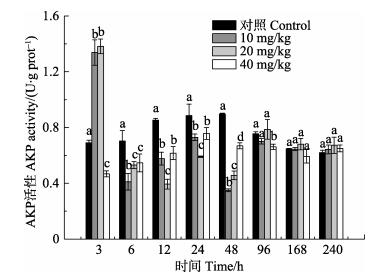
由图 3可知,低、中剂量组血浆AKP活性均呈先升高后下降的趋势,在3 h达到最高值(P < 0.05),之后逐渐下降,6–48 h显著低于对照组(P < 0.05),96 h后恢复至对照组水平(P > 0.05);高剂量组血浆ACP活性呈现下降趋势,在3–48 h与对照组表现出显著差异(P < 0.05),96 h后恢复至对照组水平(P > 0.05)。
|
图 3 氟苯尼考对脊尾白虾血浆中AKP活性的影响 Figure 3 Effects of florfenicol on the activities of AKP in the hemolymph serum of E. carinicauda |
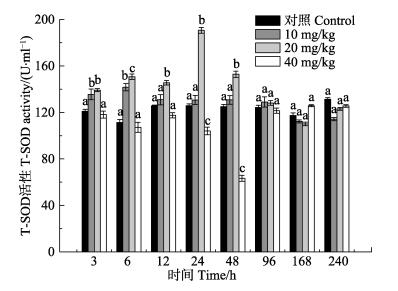
由图 4可知,低剂量组血浆T-SOD活性呈升高趋势,在3–6 h显著高于对照组(P < 0.05),在6 h达最高值,12 h后恢复至对照组水平(P > 0.05);中剂量组血浆T-SOD活性呈先升高后下降的趋势,在3–48 h显著高于对照组(P < 0.05),在24 h达最高值,96 h后恢复至对照组水平(P > 0.05);高剂量组则前期呈现下降趋势,在48 h达最低值(P < 0.05),后逐渐恢复至对照组水平(P > 0.05)。比较不同实验组、同一时刻T-SOD活性,6–48 h时中剂量组显著高于低剂量组(P < 0.05);在24–48 h高剂量组显著低于低、中剂量组(P < 0.05)。
|
图 4 氟苯尼考对脊尾白虾血浆中T-SOD活性的影响 Figure 4 Effects of florfenicol on the activities of T-SOD in the hemolymph serum of E. carinicauda |
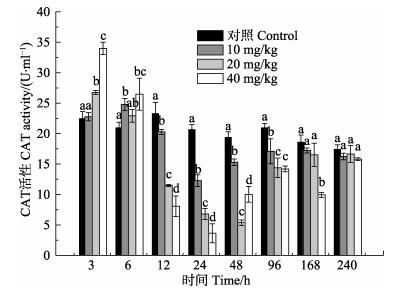
由图 5可知,低、中、高各剂量组血浆CAT活性呈先上升后下降再上升的趋势,均在24 h达到最低值(P < 0.05),且出现剂量效应。低、中剂量组在12–96 h显著低于对照组(P < 0.05),168 h后恢复至对照组水平(P > 0.05);高剂量组在12–168 h显著低于其他3组(P < 0.05),240 h后恢复至对照组水平(P > 0.05)。
|
图 5 氟苯尼考对脊尾白虾血浆中CAT活性的影响 Figure 5 Effects of florfenicol on the activities of CAT in the hemolymph serum of E. carinicauda |
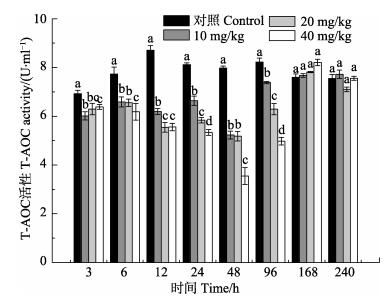
由图 6可知,低、中、高各剂量组血浆T-AOC活性呈先下降后上升的趋势,且出现剂量效应。各剂量组在3–96 h显著低于对照组(P < 0.05),且高剂量组显著低于低剂量组(P < 0.05),3个剂量组在48 h均达到最低值(P < 0.05),168 h后恢复至对照组水平(P > 0.05)。
|
图 6 氟苯尼考对脊尾白虾血浆中T-AOC活性的影响 Figure 6 Effects of florfenicol on the activities of T-AOC in the hemolymph serum of E. carinicauda |
甲壳动物缺乏抗体和特异性免疫细胞,长期进化过程中形成了自身独特的非特异性免疫防御机制,从而保证其在生物界中的生存和繁衍(Hoffmann et al, 1999)。血淋巴因同时含有体液免疫因子和细胞免疫因子,是目前研究甲壳动物免疫机能的主要组织。存在于软体动物和节肢动物血淋巴中的血蓝蛋白(HEM)是一种呼吸蛋白(孙杰等, 2010)。除载氧外,HEM还具有酚氧化酶活性(Burmester, 2002)、抗菌功能(Terwilliger, 1998)和适应环境等作用(Zhang et al, 2004)。近年来,越来越多的研究证实HEM参与虾类机体的免疫防御。Fan等(2013) 研究发现,凡纳滨对虾在受到病原菌刺激后,其血淋巴中的HEM会通过转变为酚氧化物酶的形式或降解为抗菌片段等方式参与机体抵御病原菌侵染。HEM含量受到各种因素的影响,如个体发育情况或环境因子(如温度、pH值)等。Song等(2003) 报道,凡纳滨对虾在感染病原后其体内HEM浓度下降幅度达33.3%。本研究发现,低、中、高各剂量组HEM含量在实验前期整体高于对照组水平,这可能是虾体处于应激状态,诱导增强其免疫功能导致。
ACP和AKP是甲壳动物先天免疫反应的重要参与者,ACP是吞噬溶酶体的重要组成部分,在血细胞进行吞噬和包囊反应中会随着ACP的释放起到杀菌的作用(Liu et al, 2011);AKP存在于虾蟹血细胞的小颗粒细胞和中透明细胞(刘晓云等, 2002),有清除、水解、消化外源异物的功能,同时还是生物体内重要的解毒体系(何海琪等, 1992)。研究表明,ACP和AKP是衡量机体免疫能力的重要指标(杨志彪等, 2006, 陈昌福等, 2004)。目前,关于抗菌药物对甲壳动物ACP和AKP的影响已有一些研究。刘立鹤等(2006) 研究发现,不同浓度黄霉素添加到基础饲料中饲喂凡纳滨对虾8周,4 mg/kg组凡纳滨对虾血浆ACP活性显著升高,12、24和48 mg/kg组凡纳滨对虾血浆ACP活性呈现下降趋势。温俊等(2008) 研究发现,4 mg/kg黄霉素饲喂凡纳滨对虾30 d,其AKP活性显著升高。本研究结果显示,饲喂氟苯尼考5 d后,低、中剂量对脊尾白虾血浆中ACP和AKP活性有明显促进作用,高剂量则表现出抑制作用。这与郭明凯等(2012) 在中华绒螯蟹(Eriocheir sinensis)和刘立鹤等(2006) 在凡纳滨对虾中的研究结果一致。
当水产动物受到外界环境因子(水温、盐度、溶氧、氨氮以及化学污染物质等)胁迫时会产生氧化应激,导致自由基在体内产生和积累,如果机体抗氧化防御系统未能及时清除体内增加的自由基,过多的活性氧自由基对机体本身会产生毒害作用(Rånby et al, 1978)。虾类用来清除体内过多的活性氧自由基以维持正常的氧化状态的抗氧化防御系统是其非特异性免疫反应中的核心免疫机制(Castex et al, 2010),抗氧化能力是评价机体健康的重要指标(Xu et al, 2013;洪美玲等, 2007; Bebianno et al, 2005)。像其他甲壳动物一样,虾类抗氧化防御系统包括抗氧化酶(SOD、CAT等)和非酶小分子(VA、VC、VE、还原型谷胱甘肽和类胡萝卜素等)(Liu et al, 2004)。T-SOD和CAT等构成的抗氧化酶系统发挥了重要的抗氧化功能,其活性的高低直接或间接反映了机体抗氧化功能的强弱(任海等, 2014)。
抗氧化酶本质上是相互依赖的,因其固有的生物周期、外界理化环境因子和人为污染的影响而产生各种变化(Sheehan et al, 1999)。SOD作为活性氧自由基的天然消除剂,是唯一以超氧阴离子(O2–)为底物的酶,是机体防御氧化损伤的一种重要酶类(Winterbourn, 1993)。其活性高低可间接反映甲壳动物活性氧的水平和细胞受氧化损伤的程度,且SOD与生物的免疫水平密切相关。本实验发现,低、中剂量组氟苯尼考对脊尾白虾血浆T-SOD具有诱导作用,呈先升高后降低的趋势;高剂量氟苯尼考对脊尾白虾血浆T-SOD具有抑制作用。有研究发现,当生物体受到轻度逆境胁迫时,其T-SOD活性往往升高;而当受到重度逆境胁迫时,其T-SOD活性通常降低,机体内积累过量的活性氧,从而导致生物体受到伤害(Cabell et al, 1999)。也有学者认为这种现象是生物体的“应激适应”和“应激损伤”(李毅平等, 1998)。本实验中,低、中剂量作用下T-SOD活性显著上升可能是氟苯尼考代谢过程中产生过多氧自由基,为了清除过多的氧自由基,T-SOD表现为活性增强;当氟苯尼考剂量增加,机体产生的氧自由基超出其所能清除的范围,氧自由基进攻抗氧化系统,从而T-SOD表现为活性被抑制。
一般条件下,机体为克服不良环境对其的损害,会通过T-SOD、CAT等抗氧化酶的联合作用来清除氧自由基(Lopes et al, 2001)。CAT是机体抗氧化防御体系中重要的酶之一,可以把T-SOD歧化O2–产生的过氧化氢(H2O2)转变为水(H2O)和氧气(O2),从而防止机体氧化损伤(Mohankumar et al, 2006)。钟君伟等(2014) 将不同质量浓度的敌百虫药浴克氏原螯虾(Procambarus clarkii) 12 d,在第2天,0.132 mg/L和0.264 mg/L组的肝胰腺CAT活性明显上升,之后,各剂量组CAT活性逐渐下降,在12 d时各剂量组CAT活性显著低于对照组水平。在本实验前期,各剂量组血浆CAT活性表现出明显的诱导作用;当实验进行到第12 h时,各剂量组血浆CAT活性表现出明显的抑制作用,并呈现剂量–效应关系。这可能是由于氟
苯尼考致使机体产生氧自由基,使得SOD分解O2–生成过多的H2O2,机体为清除过多的H2O2,CAT的合成量升高,降低了氟苯尼考对机体的氧化损伤作用;随着实验的进行,机体活性氧中间体增多,超出了机体的清除能力,大量活性氧中间体改变了CAT酶结构,降低了CAT活性(游学军等, 2001)。
T-AOC是反映机体总抗氧化水平的综合性指标,通过分解机体产生的过氧化物,阻断过氧化链,清除自由基和活性氧(翟少伟等, 2016)。T-AOC大小可以反映机体对外来刺激的代偿能力和机体自由基代谢的状态(Fuller, 1989)。Ren等(2015) 研究发现,将凡纳滨对虾暴露于不同剂量(0.3、2.1、14.7 μg/L)多环芳烃化合物CHR中21 d,结果表明CHR对其鳃和肝胰腺中T-AOC活性有显著抑制作用,且呈剂量–效应,指出T-AOC活性可作为评估凡纳滨对虾养殖环境CHR污染的敏感指标。郭明凯(2012)1)按50、100和200 mg/kg的剂量将恩诺沙星添加于饲料中投喂中华绒螯蟹7 d,各实验组血浆中T-AOC活性在实验期间显著高于对照组水平。而Ren等(2014) 研究氟苯尼考对凡纳滨对虾T-AOC活性影响的结果发现,T-AOC在投喂氟苯尼考(0–6 d)呈下降趋势,且变化具有明显的时间规律性和显著的剂量效应。这可能是因为药物、物种不同而有所不同。本研究中,3个氟苯尼考处理组的血浆T-AOC活性均被抑制。有学者认为机体的抗氧化能力在一定程度上反映其健康状况(Xu et al, 2013)。本研究T-AOC活性降低推测是氟苯尼考在一定程度上损害了脊尾白虾的健康。
1) Guo MK. Effects of enrofloxacin and cortisol on the immune function and intestinal microflora of Chinese mitten crab (Eriocheir sinensis). Masterxs Thesis of Soochow University, 2012, 26–27 [郭明凯. 恩诺沙星和皮质醇对中华绒螯蟹(Eriocheir sinensis)免疫功能及肠道菌群的影响. 苏州大学硕士研究生学位论文, 2012, 26–27]
4 结论本实验所用氟苯尼考的低(10 mg/kg·BW)、中(20 mg/kg·BW)、高(40 mg/kg·BW) 3种剂量均能够影响脊尾白虾血浆中免疫指标和抗氧化酶活性。低、中剂量氟苯尼考对HEM含量、ACP、AKP、T-SOD和CAT活性具有诱导作用,而高剂量氟苯尼考对HEM含量、ACP、AKP、T-SOD、CAT和T-AOC活性具有抑制作用。本实验结果可为制定抗菌药物在实际生产中的使用剂量和作用时间提供参考。
| Bebianno M, Company R, Serafim A, et al. Antioxidant systems and lipid peroxidation in Bathymodiolus azoricus from Mid-Atlantic Ridge hydrothermal vent fields. Aquatic Toxicology, 2005, 75(4): 354-373 DOI:10.1016/j.aquatox.2005.08.013 | |
| Burmester T. Origin and evolution of arthropod hemocyanins and related proteins. Journal of Comparative Physiology B, 2002, 172(2): 95-107 DOI:10.1007/s00360-001-0247-7 | |
| Cabell LA, Monahan MK, Anslyn EV. A competition assay for determining glucose-6-phosphate concentration with a tris-boronic acid receptor. Tetrahedron Letters, 1999, 40(44): 7753-7756 DOI:10.1016/S0040-4039(99)01651-2 | |
| Caipang CMA, Lazado CC, Brinchmann MF, et al. In vivo modulation of immune response and antioxidant defense in Atlantic cod, Gadus morhua following oral administration of oxolinic acid and florfenicol. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 150(4): 459-464 | |
| Chen CF, Yao J, Chen CR, et al. Prevention of epidemic diseases of shrimp and crab with immunologic stimulant. Freshwater Fisheries, 2004, 34(2): 56-58 [陈昌福, 姚娟, 陈超然, 等. 利用免疫刺激剂预防虾、蟹的传染性疾病. 淡水渔业, 2004, 34(2): 56-58] | |
| Chen JX, Ji H, Peng L, et al. Residues and elimination of florfenicol and its metabolite florfenicol amine in the freshwater crayfish. Journal of Nanjing Agricultural University, 2012, 35(2): 110-114 [陈晋旭, 季辉, 彭麟, 等. 氟苯尼考及其代谢物在淡水小龙虾中残留消除规律的研究. 南京农业大学学报, 2012, 35(2): 110-114] | |
| Fan L, Wang A, Wu Y. Comparative proteomic identification of the hemocyte response to cold stress in white shrimp, Litopenaeus vannamei. Journal of Proteomics, 2013, 80(6): 196-206 | |
| Fuller R. A review: Probiotics in man and animals. Journal of Applied Bacteriology, 1989, 66(5): 365-378 DOI:10.1111/jam.1989.66.issue-5 | |
| Guardiola F, Cerezuela R, Meseguer J, et al. Modulation of the immune parameters and expression of genes of gilthead seabream (Sparus aurata) by dietary administration of oxytetracycline. Aquaculture, 2012: 334-337-51-57 | |
| Guo MK, Li Y, Wang YF, et al. Effects of enrofloxacin on the non-specific immune response of Eriocheir sinensis. Feed Research, 2012, 11061106(2): 66-68 [郭明凯, 李义, 王玉芬, 等. 恩诺沙星对中华绒螯蟹非特异性免疫的影响. 饲料研究, 2012, 11061106(2): 66-68] | |
| He HQ, Sun F. Studies on the characteristics of acid and alkaline posphatases in Chinese shrimp. Oceanologia et Limnologia Sinica, 1992, 23(5): 555-560 [何海琪, 孙凤. 中国对虾酸性和碱性磷酸酶的特性研究. 海洋与湖沼, 1992, 23(5): 555-560] | |
| Hoffmann JA, Kafatos FC, Janeway CA, et al. Phylogenetic perspectives in innate immunity. Science, 1999, 284(5418): 1313-1318 DOI:10.1126/science.284.5418.1313 | |
| Hong ML, Chen LQ, Gu SZ, et al. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (Eriocheir sinensis). Journal of Fishery Sciences of China, 2007, 14(3): 412-418 [洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412-418] | |
| Huang K, Chen SJ, Huang J, et al. Analysis of antibiotic resistance of Salmonella isolated from animals and identification of its florfenicol resistant gene. China Animal Husbandry & Veteinary Medicine, 2015, 42(2): 459-466 [黄凯, 陈素娟, 黄骏, 等. 动物源性沙门氏菌的耐药性分析及氟苯尼考类耐药基因的鉴定. 中国畜牧兽医, 2015, 42(2): 459-466] | |
| Li YP, Gong H. The research progress of the system of antioxidant responses in insect. Chinese Bulletin of Life Sciences, 1998, 10(5): 240-244 [李毅平, 龚和. 昆虫体内抗氧化系统研究进展. 生命科学, 1998, 10(5): 240-244] | |
| Liu CH, Chen JC. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus. Fish & Shellfish Immunology, 2004, 16(3): 321-334 | |
| Liu LH, Liu HY, Dong AH, et al. Effects of flavomycin on the growth and non-specific immune response of Litopenaeus vannamei. Freshwater Fisheries, 2006, 36(6): 25-28 [刘立鹤, 刘辉宇, 董爱华, 等. 饲料中添加黄霉素对凡纳滨对虾生长和非特异性免疫力的影响. 淡水渔业, 2006, 36(6): 25-28] | |
| Liu XL, Xi QY, Yang L, et al. The effect of dietary Panax ginseng polysaccharide extract on the immune responses in white shrimp, Litopenaeus vannamei. Fish & Shellfish Immunology, 2011, 30(2): 495-500 | |
| Liu XY, Zhang ZF, Ma HM. Study on enzyme cyto-chemistry of bleed cells in Penaeus chinensis. Journal of Ocean University of Qingdao, 2002, 32(2): 259-265 [刘晓云, 张志峰, 马洪明. 中国对虾血细胞酶细胞化学的初步研究. 青岛海洋大学学报(自然科学版), 2002, 32(2): 259-265] | |
| Lopes PA, Pinheiro T, Santos MC, et al. Response of antioxidant enzymes in freshwater fish populations (Leuciscus alburnoides complex) to inorganic pollutants exposure. Science of the Total Environment, 2001, 280(1-3): 153-163 DOI:10.1016/S0048-9697(01)00822-1 | |
| Mohankumar K, Ramasamy P. White spot syndrome virus infection decreases the activity of antioxidant enzymes in Fenneropenaeus indicus. Virus Research, 2006, 115(1): 69-75 DOI:10.1016/j.virusres.2005.07.006 | |
| Park ED, Lightner DV, Milner N, et al. Exploratory bioavailability and pharmacokinetic studies of sulphadimethoxine and ormetoprim in the penaeid shrimp, Penaeus vannamei. Aquaculture, 1995, 130(2-3): 113-128 DOI:10.1016/0044-8486(94)00217-C | |
| Rånby BG, Rabek JF.Singlet oxygen reactions with organic compounds and polymers.John Wiley & Sons, 1978 | |
| Ren H, Li J, Li JT, et al. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in Exopalaemon carinicauda. Journal of Agro-Environment Science, 2014, 33(4): 647-655 DOI:10.11654/jaes.2014.04.005 [任海, 李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾(Exopalaemon carinicauda)抗氧化系统酶活性及GPx基因表达的影响. 农业环境科学学报, 2014, 33(4): 647-655] | |
| Ren X, Pan L, Wang L. Effect of florfenicol on selected parameters of immune and antioxidant systems, and damage indexes of juvenile Litopenaeus vannamei following oral administration. Aquaculture, 2014, 432(34): 106-113 | |
| Ren X, Pan L, Wang L. The detoxification process, bioaccumulation and damage effect in juvenile white shrimp Litopenaeus vannamei exposed to chrysene. Ecotoxicology and Environmental Safety, 2015, 114: 44-51 DOI:10.1016/j.ecoenv.2015.01.004 | |
| Shao H, Leng KL, Zhou MY, et al. Simultaneous determination of chloramphenicol, thiamphenicol, florfenicol and florfenicol amine residues in aquatic products with gas chromatography/mass spectrometry. Progress in Fishery Sciences, 2015, 36(3): 137-141 DOI:10.11758/yykxjz.20150321 [邵会, 冷凯良, 周明莹, 等. 水产品中氯霉素、甲砜霉素、氟苯尼考、氟苯尼考胺多残留的同时测定—GC/MS法. 渔业科学进展, 2015, 36(3): 137-141] | |
| Sheehan D, Power A. Effects of seasonality on xenobiotic and antioxidant defence mechanisms of bivalve molluscs. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1999, 123(3): 193-199 DOI:10.1016/S0742-8413(99)00033-X | |
| Song YL, Yu CI, Lien TW, et al. Haemolymph parameters of Pacific white shrimp (Litopenaeus vannamei) infected with Taura syndrome virus. Fish & Shellfish Immunology, 2003, 14(4): 317-331 | |
| Sun J, Wang BJ, Zhu SJ, et al. Purification, cDNA cloning and relationship study on three kind of immune-related factors in shrimp Fenneropenaeus chinensis. Progress in Fishery Sciences, 2010, 31(1): 80-88 [孙杰, 王宝杰, 孙姝娟, 等. 中国明对虾血蓝蛋白基因cDNA的克隆与序列分析. 渔业科学进展, 2010, 31(1): 80-88] | |
| Terwilliger NB. Functional adaptations of oxygen-transport proteins. Journal of Experimental Biology, 1998, 201: 1085-1098 | |
| Wang HC, Zhao HQ, Qian D, et al. Effect of common antibiotics in aquaculture on phenoloxidase activity in mud crab. Fisheries Science, 2011, 30(1): 38-41 [王海潮, 赵海泉, 钱冬, 等. 水产常用抗菌药物对锯缘青蟹酚氧化酶的影响. 水产科学, 2011, 30(1): 38-41] | |
| Wang YS, Qian LM, Chen CQ, et al. Effect of antibiotic and probiotics on nonspecific immune system of pacific white shrimp, Litopenaeus vannarnei. Journal of Oceanography in Taiwan Strait, 2008, 27(2): 161-167 [王永胜, 钱鲁闽, 陈昌生, 等. 抗生素和有益微生物对凡纳滨对虾非特异性免疫效应的研究. 台湾海峡, 2008, 27(2): 161-167] | |
| Wen J, Sun M, Sun DY. Effects of synbiotic on growth and intestine of Litopenaeus vannarnei. Feed Research, 2008, 11061106(10): 53-55 [温俊, 孙鸣, 孙冬岩. 合生素对南美白对虾肠道菌群和免疫机能的影响. 饲料研究, 2008, 11061106(10): 53-55] | |
| Winterbourn CC. Superoxide as an intracellular radical sink. Free Radical Biology and Medicine, 1993, 14(1): 85-90 DOI:10.1016/0891-5849(93)90512-S | |
| Xu WJ, Pan LQ. Enhancement of immune response and antioxidant status of Litopenaeus vannamei juvenile in biofloc-based culture tanks manipulating high C/N ratio of feed input. Aquaculture, 2013, s412-413(6): 117-124 | |
| Yang Q, Wu ZX, Chen XX, et al. Research advances of pharmacodynamics and pharmacokinetics of florfenicol in aquaculture animals. Journal of Hydroecology, 2010, 3(5): 116-121 [杨倩, 吴志新, 陈孝煊, 等. 氟苯尼考的药效学及其在水产动物中的代谢动力学研究进展. 水生态学杂志, 2010, 3(5): 116-121] | |
| Yang ZB, Zhao YL, Zhou ZL, et al. Effects of water-borne copper on activities of metabolism enzymes in Eriocheir sinensis. Oceanologia et Limnologia Sinica, 2006, 37(2): 118-124 [杨志彪, 赵云龙, 周忠良, 等. 水体铜对中华绒螯蟹(Eriocheir sinensis)代谢酶活性的影响. 海洋与湖沼, 2006, 37(2): 118-124] | |
| You XJ, Zheng YH. Effects of P-NCB on liver catalase activity of grasscarp (Ctenophoryngodon idellus). Southwest China Journal of Agricultural Sciences, 2001, 14(4): 79-82 [游学军, 郑永华. 对氯硝基苯对草鱼种肝胰脏过氧化氢酶活性的影响. 西南农业学报, 2001, 14(4): 79-82] | |
| Yue GY, Wu ZX, Yang Q, et al. Pharmacokinetics of florenicol and its metabolite, florenicolamine, in red swamp crayfish, Procambarus clarkii. Acta Hydrobiologica Sinica, 2011, 35(2): 307-312 DOI:10.3724/SP.J.1035.2011.00307 [岳刚毅, 吴志新, 杨倩, 等. 氟苯尼考及氟苯尼考胺在克氏原螯虾体内药物代谢动力学. 水生生物学报, 2011, 35(2): 307-312] | |
| Zhai SW, Shi QC, Chen XH. Effect of dietary animicrobial peptides-surfactin supplementation on parameters of intestinal health genetically improved farmed tilapia (GIFT, oreochromis niloticus). Acta Hydrobiologica Sinica, 2016, 40(4): 1-7 [翟少伟, 史庆超, 陈学豪. 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响. 水生生物学报, 2016, 40(4): 1-7] | |
| Zhang X, Huang C, Qin Q. Antiviral properties of hemocyanin isolated from shrimp Penaeus monodon. Antiviral Research, 2004, 61(2): 93-99 DOI:10.1016/j.antiviral.2003.08.019 | |
| Zhang Z, Li J, Feng W, et al. Effects of norfloxacin on the non-specific immune response of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2011, 32(2): 53-59 [张喆, 李健, 冯伟, 等. 不同浓度诺氟沙星对中国对虾非特异性免疫酶活的影响. 渔业科学进展, 2011, 32(2): 53-59] | |
| Zhao QS, Jin S, Chen YE, et al. Pharmacokinetics of florfenicol in disease model of Portunus trituberculatus. Oceanologia et Limnologia Sinica, 2014, 45(3): 130-135 [赵青松, 金珊, 陈寅儿, 等. 氟苯尼考在三疣梭子蟹(Portunus trituberculatus)疾病模型内的代谢动力学. 海洋与湖沼, 2014, 45(3): 130-135] | |
| Zhong JW, Zhu YA, Meng QL, et al. Effects of the stress of Trichlophon on some immune parameters of Procambarus clarkii. Journal of Hydroecology, 2014, 35(2): 96-100 [钟君伟, 朱永安, 孟庆磊, 等. 敌百虫胁迫对克氏原螯虾免疫学相关指标的影响. 水生态学杂志, 2014, 35(2): 96-100] |



