2. 农业部东海与远洋渔业资源开发利用重点实验室 中国水产科学研究院东海水产研究所 上海 200090;
3. Norwegian University of Science and Technology, Department of Biology, Trondheim 7491, Norway;
4. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
5. 中国科学院大学中丹学院 北京 100049
2. Key Laboratory of East China Sea & Oceanic Fishery Resources Exploitation and Utilization, Ministry of Agriculture, East Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090;
3. Norwegian University of Science and Technology, Department of Biology, Trondheim 7491, Norway;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
5. University of Chinese Academy of Sciences, Sino-Danish College, Beijing 100049
双齿围沙蚕(Perinereis aibuhitensis Grube)广泛分布在我国沿海滩涂和河口区域(张柏东等, 2013),主要摄取沉积物和其中的动植物碎片,在近岸水域生态系统食物链的能量流动和物质循环中占有重要地位。其营养丰富,是目前公认的鱼、虾、蟹等生物的最佳鲜活饵料(Fish et al, 1989; 顾晓英等, 2002),也是游钓业的“万能饵料”,国内和国际市场需求量大,是我国重要的出口创汇产品(冯善聪等, 2014)。近年来,因其较高的经济价值,双齿围沙蚕的养殖业发展很快,在其自然栖息地滥采滥捕的现象也随之加重。
目前,关于双齿围沙蚕的研究已有较多报道,其中涉及生物学特性、养殖技术、生理学、生态学等方面(冷忠业等, 2001; 邓锦松等, 2006; 张青田等, 2008; 洪秀云等, 1982; 周一兵等, 2007; 赖祖鹏等, 2014; 雷艳等, 2013; 赵欢等, 2016)。同时,双齿围沙蚕也具有重要的环境修复功能,其对沉积环境的生物地球化学循环具有积极作用,可以有效降低生源要素和硫化物在底质环境中的累积(邓锦松等, 2006; 江小桃等, 2012),通过生物扰动作用可以有效降低鱼类网箱养殖产生的残饵和粪便对底质环境的影响(房景辉等, 2014)。作者前期研究发现,双齿围沙蚕对H2S毒性的耐受能力很强,这是否与其自然栖息环境特点有关?以往研究中关于双齿围沙蚕自然栖息地沉积环境特点的研究很少,缺少其栖息生物学数据。本研究通过对双齿围沙蚕自然栖息地沉积物中重要环境因子的调查研究,分析不同因素的变化特征,为其人工养殖、资源保护及科学研究提供参考资料。
1 材料与方法 1.1 样品采集2015年9月,在山东海阳市丁字湾白沙河河口(36°38' 27.72"N, 120°53' 51.75"E)的双齿围沙蚕自然栖息地,使用滩涂柱状泥样采集和保存装置(房景辉等, 2016)分别在潮间带的高潮区、中潮区、低潮区3个区域采集4根直径为5 cm、深度为50 cm的沉积物柱状样品。及时将保存装置用PE保鲜膜密封并放入保温箱,带回实验室后立即进行分析测定。
1.2 样品分析与测定在厌氧手套箱(YQX-1,长沙天创粉末技术有限公司)进行H2S相关样品的测定操作。将柱状沉积物样品按深度分为5 cm、15 cm、25 cm和50 cm,使用微电极(Unisense, 丹麦)测定对应深度位于样品柱中部的H2S含量。采集不同深度沉积物于10 ml离心管中,封口后在离心机(L-550, 长沙湘仪离心机有限公司) 4000 r/min离心10 min,使用微电极测定间隙水中的H2S含量。在不同深度取5 g左右沉积物样品,使用电热恒温鼓风干燥箱(DHG-9240A, 上海精宏实验设备有限公司)在70℃下烘72 h至恒重,测定沉积物含水率。烘干样品用研钵磨碎后取1.5 g左右于坩埚中,450℃条件下在马弗炉(SX3-4-10X, 龙口市电炉制造厂)里煅烧6 h后称重,测定有机物含量。采用元素分析仪(Vario Elementar, 德国)测定烘干样品的碳、氮含量。不同深度样品的粒径采用马尔文激光粒度仪(maz3000, Malvern, 英国)进行测定。
1.3 数据处理与分析采用SPSS 13.0统计分析软件分析数据,采用双因素方差分析(Two-way ANOVA)检验不同潮区和深度对各参数的影响,采用Bonferroni修正法修正显著水平,以P < 0.05作为差异显著水平。
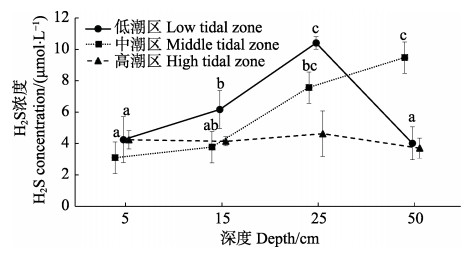
2 结果 2.1 H2S 2.1.1 沉积物中的H2S双因素方差分析显示,沉积物中H2S浓度受潮区和深度影响显著(潮区: F=12.476, P < 0.01;深度: F=7.791, P < 0.01),潮区和深度的交互作用显著(F=6.716, P < 0.01)。低潮区和中潮区H2S浓度没有显著性差异(P > 0.05),高潮区H2S浓度显著低于其他2个潮区(P < 0.05)。沉积物中深度在25 cm处的H2S浓度显著高于其他深度(P < 0.05)。
在低潮区,随着深度的增加,沉积物中的H2S浓度呈先升高后降低的变化趋势,25 cm的H2S浓度显著高于其他深度(P < 0.01, 图 1)。在中潮区,H2S浓度随着沉积物深度的增加而逐渐升高,到50 cm处达到最大值并显著高于5 cm和15 cm处的H2S浓度(P < 0.01)。高潮区的H2S浓度随着深度的增加没有显著变化(P > 0.05)。
|
图 1 不同潮区的不同深度沉积物中的H2S浓度 Figure 1 The concentration of hydrogen sulphide in the sediment at different depths of different tidal zones 图中不同字母表示相同潮区不同深度沉积物中的数据差异显著(P < 0.05)。下同 Data with different letters were significantly different among different depths in the same tidal zone (P < 0.05). The same as below |
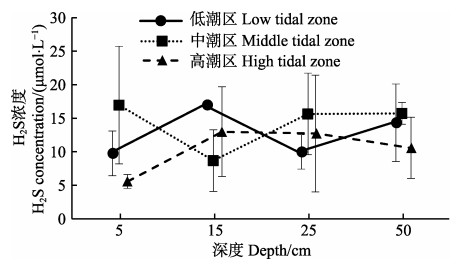
双因素方差分析显示,不同潮区和深度对间隙水中H2S浓度无显著影响(潮区: F=0.735, P=0.493;深度: F=0.335, P=0.786),并且两者无交互作用(F=0.915, P=0.507)。3个不同潮区间隙水中H2S浓度无显著性差异(P > 0.05)。不同深度沉积物的间隙水中H2S浓度无显著性差异(P > 0.05);相同潮区不同深度的间隙水中,H2S浓度也无显著性差异(P > 0.05, 图 2)。
|
图 2 不同潮区的不同深度间隙水中的H2S浓度 Figure 2 The concentration of hydrogen sulphide in the pore water at different depths of different tidal zones |
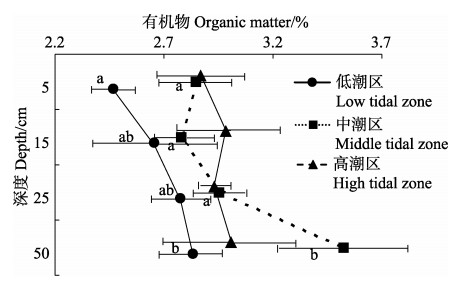
双因素方差分析显示,沉积物中有机物含量受潮区和深度影响显著(潮区: F=7.208, P < 0.01;深度: F=5.026, P < 0.01), 而潮区和深度之间无交互作用(F=1.673, P=0.158)。低潮区的有机物含量显著低于中潮区和高潮区(P < 0.05),深度在50 cm处的有机物含量显著高于其他深度的有机物含量(P < 0.05)。
对于相同潮区、不同深度下沉积物的有机物含量来说,每个潮区基本上都随着深度的增加有机物含量升高。低潮区50 cm深处沉积物的有机物含量显著高于5 cm处(P < 0.01, 图 3);中潮区50 cm深处的沉积物中的有机物含量高于其他深度;但高潮区不同深度的有机物含量无显著差异(P > 0.05)。
|
图 3 不同潮区的不同深度沉积物中的有机物含量 Figure 3 The content of organic matter in the sediment at different depths of different tidal zones |
双因素方差分析显示,潮区对沉积物中的碳含量影响不显著(F=0.799, P=0.458),而深度对沉积物中的碳含量影响显著(F=3.760, P=0.019),潮区和深度之间无交互作用(F=2.329, P=0.053)。不同潮区之间的碳含量无显著差异(P > 0.05),不同深度的沉积物中碳含量随深度的增加而升高,50 cm深处的碳含量显著高于5 cm深处的碳含量(P < 0.05)。
|
|
表 1 不同潮区的不同深度沉积物中的碳含量(%) Table 1 The carbon content in the sediment at different depths of different tidal zones (Mean±SD) (%) |
在低潮区,5 cm深处的沉积物中的碳含量显著低于其他3个碳含量无显著性差异的区域。在中潮区,50 cm深处的沉积物中碳含量显著高于5 cm深处的碳含量(P < 0.01)。而在高潮区,不同深度的沉积物中碳含量之间无显著性差异(P > 0.05)。
2.3.2 氮含量双因素方差分析显示,沉积物中的氮含量受潮区和深度影响显著(潮区: F=6.938, P < 0.01;深度: F=8.718, P < 0.01),而潮区和深度之间无交互作用(F=2.322, P=0.054)。高潮区沉积物中的氮含量显著低于低潮区和中潮区(P < 0.05),低潮区和中潮区沉积物的氮含量无显著性差异(P > 0.05)。不同深度的沉积物中氮含量随深度的增加而逐渐升高,50 cm深处的氮含量显著高于5 cm深处的氮含量(P < 0.05)。
|
|
表 2 不同潮区的不同深度沉积物中的氮含量(%) Table 2 The nitrogen content in the sediment at different depths of different tidal zones (Mean±SD) (%) |
在低潮区,5 cm深处沉积物中的氮含量显著低于其他3个深度的氮含量(P < 0.05);而在中潮区,50 cm深处沉积物中的氮含量显著高于其他3个区域(P < 0.05);在高潮区,各个深度的沉积物中氮含量无显著性差异(P > 0.05)。
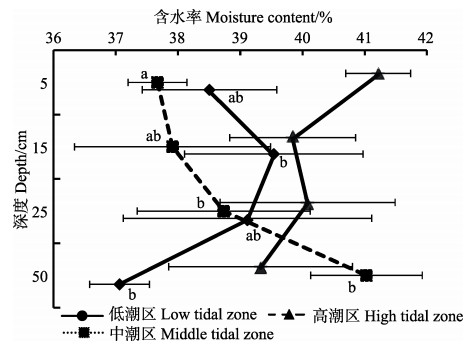
2.4 沉积物的含水率双因素方差分析显示,潮区和深度对沉积物含水率无显著影响(潮区: F=2.528, P=0.095;深度: F=0.025, P=0.995),潮区和深度之间无交互作用(F=1.812, P= 0.126)。对于相同潮区、不同深度沉积物的含水率,在低潮区深度为15 cm处的沉积物含水率显著高于50 cm处(P < 0.05,图 4);中潮区深度为50 cm处的沉积物含水率显著高于深度为5 cm处(P < 0.05);高潮区不同深度的含水率无显著性差异(P > 0.05)。
|
图 4 不同潮区的不同深度沉积物的含水率 Figure 4 The moisture content of the sediment at different depths of different tidal zones |
双因素方差分析显示,潮区对沉积物的中值粒径影响显著(F=6.630, P < 0.01),而深度对沉积物的中值粒径无显著影响(F=0.786, P=0.512),潮区和深度之间无交互作用(F=0.796, P=0.581)。沉积物中值粒径随着潮区的由低到高呈现逐渐减小的趋势,低潮区沉积物的中值粒径显著高于其他两个潮区(P < 0.05)。不同深度下沉积物的中值粒径无显著差异(P > 0.05, 表 3)。
|
|
表 3 不同潮区的不同深度沉积物的中值粒径(μm) Table 3 The median diameter of sediment at different depths of different tidal zones (μm) |
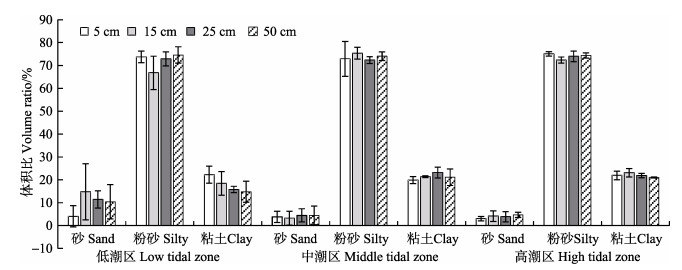
从沉积物粒度分布来看(图 5),粉砂在不同潮区和不同深度的沉积物中所占的比重均为最大(66.77%– 75.37%),而砂含量最低,均低于20%。在相同潮区,不同深度的同一沉积物类型的含量间均无显著差异(P > 0.05)。根据我国海洋调查规范(GB/T 12763.8-2007),此沉积物粒度分类均属粘土质粉砂。
|
图 5 不同潮区的不同深度沉积物的粒度 Figure 5 The grain size of sediment at different depths of different tidal zones |
硫化物以不同形式广泛存在于海洋底栖环境中,在一些网箱自然栖息地的沉积物中硫化物含量可达949 mg/kg干重,部分非网箱自然栖息地的硫化物含量也在142 mg/kg干重以上(甘居利等, 2003)。Abele-Oeschger(1996)发现,一些潮间带底质间隙水中的硫化物含量达到665 μmol/L。Miron等(1993)在对3种沙蚕栖息环境中的硫化物水平进行研究时发现,Nereis succinea和N. diversicolor生存环境间隙水中含有的可溶性硫化物最高可达2000 μmol/L,而N.virens生境中的硫化物水平低于50 μmol/L。沙躅栖息地间隙水中硫化物的浓度为1.7–340 μmol/L(Oeschger et al, 1992)。这些研究仅关注了可溶性硫化物的浓度,忽略了毒性最强的H2S浓度,而H2S浓度又与pH值等环境条件密切相关,因此,这就使以上研究难以比较相关物种生活环境中H2S的浓度。例如,在Wang等(1999)有关硫化物毒性作用的综述中涉及23个种类对硫化物的毒性作用反应,均没有给出H2S的具体浓度。但是,可以根据实验所调整的pH值,通过H2S的电离公式求出体系中H2S的浓度(Knezovich et al, 1996)。通过计算,Polychaete nereis在H2S浓度为16.2 μmol/L时的半致死时间为24 d (Vismann, 1990);Rhepoxynius abronius在H2S溶液中暴露48 h的半致死浓度和安全浓度分别为50和45 μmol/L,而Eohaustorius estuarius的H2S半致死浓度和安全浓度分别为103.75和60 μmol/L (Knezovich et al, 1996)。相关研究较少直接测定沉积物中的H2S浓度,而本研究中,双齿围沙蚕自然栖息地沉积物H2S的最高浓度为11.64 μmol/L,间隙水的H2S浓度最高为25.074 μmol/L,因此,双齿围沙蚕自然栖息地沉积物中的H2S含量较高,甚至达到或接近某些多毛类的半致死浓度,水生底栖多毛类的生存环境中H2S含量通常较高,它们在长期进化过程中对H2S产生了较高的耐受能力(Wang et al, 1999)。
但本研究发现,在同一栖息地的不同潮区和深度,H2S的浓度是不同的。在低潮区和中潮区,沉积物H2S的浓度随深度的增加而逐渐增加,但在低潮区的50 cm深处,H2S浓度显著下降。这是因为随深度增加,环境还原性增强(马洪波等, 2002),H2S在还原性环境中更稳定,低潮区50 cm深处已经超出了自然淤积的沉积物深度,因此,其H2S含量显著降低,并且与高潮区沉积物的H2S含量相当。不考虑低潮区50 cm深处的H2S含量影响,沉积物的H2S含量随潮区的降低而逐渐升高,沉积物在空气中暴露的时间与潮区高低关系密切,较高潮区的沉积物在空气中暴露时间要长于低潮区,硫化物的氧化也更充分。
本研究中,沉积物的有机物含量为2.47%–3.53%,这与桑沟湾贝类(3.25%±0.51%)和藻类(2.87%±0.54%)养殖区表层沉积物的有机物含量相当(姚永锋, 2014)1),说明双齿围沙蚕自然栖息地的有机物含量比较丰富,保证了其摄食需要。对于受人类活动影响较强的大鹏湾,其1998–2007年间的总碳含量为2.0%–2.6%,显著高于本研究沉积物的碳含量。而本研究沉积物的氮含量又显著高于山东南部近海,包括胶州湾内浅海(吕桂才等, 2010),而两者均低于胶州湾潮间带的沉积物氮含量(吕欣欣等, 2008),所以,沉积物的有机质组分含量存在较大的随机性,随不同区域环境特点而变化。沉积物中的有机物、碳和氮含量间往往存在较高的相关性(吕桂才等, 2010; 李绪录等, 2012),本研究中的有机物和碳含量极显著相关(P < 0.01),碳氮含量显著相关(P < 0.05),而有机物与氮含量相关性不显著(P=0.092)。
1) Yao YF. Feeding and sea ranching equipment of sea cucumber Apostichopas japonicus in Sungo Bay. Master´s Thesis of East China University of Science and Technology, 2014, 13–21 [姚永锋.桑沟湾海区刺参摄食与笼养的初步研究.华东理工大学硕士研究生学位论文, 2014, 13–21]
对于吞食沉积物的多毛类,每天处理沉积物的量至少相当于其本身的体重(干重) (张青田等, 2008),双齿围沙蚕的颗粒分选行为可能发生在吞食沉积物之前,并且双齿围沙蚕倾向于摄食粒径较小的沉积物颗粒(Lopez et al, 1987)。张青田等(2008)实验证明,双齿围沙蚕摄食沉积物的平均粒径为5.9-10.4 μm,此粒度范围正好处在粉砂的粒度范围内,而本研究的沉积物绝大部分是粉砂和粘土,其中又以粉砂为主,属于粘土质粉砂底质类型(GBT12763.8-2007)。其中,高潮区沉积物中粉砂和粘土所占比重高于低潮区;砂占了很少的一部分,由低潮区到高潮区砂的含量逐渐减少。由于沉积颗粒物越细小,对有机物的富集能力越大,因此,沉积物中有机物的含量和沉积物的组分分布有关(高建华等, 2007),高潮区沉积物的中值粒径显著小于低潮区,这可能是造成高潮区沉积物的有机物含量和含水率显著高于低潮区的原因之一。
4 结论本研究通过对双齿围沙蚕典型自然栖息地沉积环境特点研究,进一步明确了双齿围沙蚕的栖息环境中的H2S含量较高的环境特点,有助于证明其较强的环境耐受性。H2S含量随沉积物深度的增加而逐渐升高,在双齿围沙蚕的栖息深度范围内,H2S含量在中潮区和低潮区随深度的增加显著增加。沉积物中的有机物和碳含量极显著相关,碳氮含量显著相关,并且三者含量随着沉积物深度的增加呈现逐渐升高的趋势。沉积物粒度分类属粘土质粉砂,高潮区沉积物的中值粒径显著小于低潮区,可能是造成高潮区沉积物的有机物含量和含水率显著高于低潮区的原因之一。
| Abele-Oeschger D. A comparative study of superoxide dismutase activity in marine benthic invertebrates with respect to environmental sulphide exposure. Journal of Experimental Marine Biology and Ecology, 1996, 197(1): 39-49 DOI:10.1016/0022-0981(95)00143-3 | |
| Deng JS, Ma S, Niu HX, et al. Effects of introduction of Perinereis aibuhitensis Grube on the sediment quality of shrimp ponds. Periodical of Ocean University of China, 2006, 36(增刊Ⅱ): 99-104 DOI:10.3969/j.issn.1672-335X.2006.01.019 [邓锦松, 马甡, 牛化欣, 等. 投放双齿围沙蚕对虾池底质的修复作用. 中国海洋大学学报, 2006, 36(增刊Ⅱ): 99-104] | |
| Fang JH, Fang JG, Wang HQ, et al. A device for collecting and preserving mud sample in tidal flat. 2016.05.11, ZL201521041111.3 [房景辉, 方建光, 王海青, 等. 一种滩涂柱状泥样采集和保存装置. 2016. 05. 11, ZL201521041111. 3] | |
| Fang JH, Zhang JH, Wu WG, et al. Carbon and nitrogen budget and environmental optimization in an integrated cage culture model of Japanese flounder with Perinereis aibuhitensis. Journal of Fishery Science of China, 2014, 21(2): 390-397 [房景辉, 张继红, 吴文广, 等. 双齿围沙蚕-牙鲆网箱综合养殖模型碳氮收支的实验研究. 中国水产科学, 2014, 21(2): 390-397] | |
| Feng SC, Huang GQ, Lai ZP, et al. Tolerance studies on the temperature, salinity and desiccation in Perinereis aibuhitensis. Transactions of Oceanology and Limnology, 2014, 11061106(1): 109-114 [冯善聪, 黄国强, 赖祖鹏, 等. 双齿围沙蚕对温度、盐度和干露的耐受性研究. 海洋湖沼通报, 2014, 11061106(1): 109-114] | |
| Fish JD, Fish SA. Studentsx guide to the seashore. London: Unwin Hyman Ltd, 1989 | |
| Gan JL, Lin Q, Huang HH, et al. Distribution, variation and pollution of the sulfide in surfacial sediment at cage culture area in Dapengao Bay. Journal of Fisheries of China, 2003, 27(6): 570-574 [甘居利, 林钦, 黄洪辉, 等. 大鹏澳网箱自然栖息地底质硫化物分布、变化和污染分析. 水产学报, 2003, 27(6): 570-574] | |
| Gao JH, Wang YP, Pan SM, et al. Source and distribution of organic matter in seabed sediments of the Changjiang River estuary and its adjacent sea area. Acta Geographica Sinica, 2007, 62(9): 981-991 DOI:10.11821/xb200709009 [高建华, 汪亚平, 潘少明, 等. 长江口外海域沉积物中有机物的来源及分布. 地理学报, 2007, 62(9): 981-991] | |
| General Administration of Quality Supervision, Inspection and Quarantine of PRC and Standard Administration of PRC. GB/T12763. 8-2007, Specifications for oceanographic survey-Part 8: Marine geology and geophysics survey. Beijing: Standard Press of China, 2007, 1-85 [中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763. 8-2007, 海洋调查规范第8部分: 海洋地质地球物理调查. 北京: 中国标准出版社, 2007, 1-85] | |
| Gu XY, Jiang XM, Zheng ZM. Biological characteristics of Perinereis aibuhitensis Grube and status of its utilization. Modern Fisheries Information, 2002, 17(8): 33-34 [顾晓英, 蒋霞敏, 郑忠明. 双齿围沙蚕(Perinereis aibuhitensis Grube)的生物学特征和开发利用现状. 现代渔业信息, 2002, 17(8): 33-34] | |
| Hong XY, Tan KF. A study on the life history of Pernereis aibuhitensis Grube and the morphology of the mature maternal body. Journal of Fisheries of China, 1982, 6(2): 165-171 [洪秀云, 谭克非. 双齿围沙蚕的研究—生活史及异沙蚕体形态研究. 水产学报, 1982, 6(2): 165-171] | |
| Jiang XT, Tan YH, Ke ZX, et al. Effects of introduction of Perinereis aibuhitensis and Sargassum hemiphyllum on nitrogen and phosphorus in overlying water. Journal of Tropical Oceanography, 2012, 31(4): 129-134 [江小桃, 谭烨辉, 柯志新, 等. 投放双齿围沙蚕和马尾藻对养殖底泥上覆水氮、磷含量的影响. 热带海洋学报, 2012, 31(4): 129-134] | |
| Knezovich JP, Steichen DJ, Jelinski JA, et al. Sulfide tolerance of four marine species used to evaluate sediment and pore-water toxicity. Bulletin of Environmental Contamination and Toxicology, 1996, 57(3): 450-457 DOI:10.1007/s001289900211 | |
| Lai ZP, Feng SC, Liang WQ, et al. Acute toxicity of several conventional disinfectants to sand worm Perinereis aibuhitensis. Fisheries Science, 2014, 33(3): 147-151 [赖祖鹏, 冯善聪, 梁伍气, 等. 几种常用消毒剂对双齿围沙蚕的急性毒性试验. 水产科学, 2014, 33(3): 147-151] | |
| Lei Y, Song YY, Wang LL, et al. Preliminary study on effects of cadmium on metallothionein like protein content in Perinereis aibuhitensis. Modern Agricultural Sciences and Technology, 2013, 11061106(11): 287-289 DOI:10.3969/j.issn.1007-5739.2013.11.183 [雷艳, 宋莹莹, 王丽丽, 等. 镉对双齿围沙蚕类金属硫蛋白诱导的初步研究. 现代农业科技, 2013, 11061106(11): 287-289] | |
| Leng ZY, Yu TF. Artificial breeding of Perinereis aibunitensis and culture test. Fisheries Science, 2001, 20(1): 30 [冷忠业, 于天飞. 双齿围沙蚕人工育苗及养殖试验. 水产科学, 2001, 20(1): 30] | |
| Li XL, Zhou YP, Xia HY. Multi-year measurements of carbon, nitrogen and phosphorus and sources of organic matter in the surface sediments of the Mirs Bay. Acta Scientiae Circumstantiae, 2012, 32(5): 1113-1119 [李绪录, 周毅频, 夏华永. 大鹏湾表层沉积物中碳、氮、磷的多年调查结果和有机质来源分析. 环境科学学报, 2012, 32(5): 1113-1119] | |
| Lopez GR, Levinton JS. Ecology of deposit-feeding animals in marine sediments. Quarterly Review of Biology, 1987: 235-260 | |
| Lü GC, Zhang Z, Wang JT, et al. Distribution characteristics of carbon, nitrogen and phosphor in the sediments of southern Shandong adjacent seas. Marine Science, 2010, 34(9): 1-4 [吕桂才, 张哲, 王江涛, 等. 山东南部近海沉积物中碳、氮、磷的分布特征. 海洋科学, 2010, 34(9): 1-4] | |
| Lü XX, Zou L, Liu SM, et al. Preservation of organic carbon and chlorophylls in the intertidal sediments of Jiaozhou Bay. Marine Science, 2008, 32(5): 40-45 [吕欣欣, 邹立, 刘素美, 等. 胶州湾潮间带沉积物有机碳和叶绿素的埋藏特征. 海洋科学, 2008, 32(5): 40-45] | |
| Ma H, Song J, Lu X. Nitrogen forms and decomposition of organic carbon in the southern Bohai Sea core sediments. Acta Oceanologica Sinica, 2002, 24(5): 64-70 [马红波, 宋金明, 吕晓霞. 渤海南部海域柱状沉积物中氮的形态与有机碳的分解. 海洋学报, 2002, 24(5): 64-70] | |
| Miron G, Kristensen E. Factors influencing the distribution of nereid polychaetes: The sulfide aspect. Marine Ecology Progress Series, 1993, 93(7): 143-153 | |
| Oeschger R, Vetter RD. Sulfide detoxification and tolerance in Halicryptus spinulosus(Priapulida): A multiple strategy. Marine Ecology Progress Series, 1992, 87(2): 167-179 | |
| Vismann B. Sulfide detoxification and tolerance in Nereis (Hediste) diversicolor and Nereis (Neanthes) virens (Annelida: Polychaeta). Marine Ecology Progress Series, 1990, 59: 229-238 DOI:10.3354/meps059229 | |
| Wang F, Chapman PM. Biological implications of sulfide in sediment: A review focusing on sediment toxicity. Environmental Toxicology and Chemistry, 1999, 18(11): 2526-2532 | |
| Zhang BD, Lian B, Wang B, et al. PCR-DGGE analysis of immobilized microbial diversity in digestive tract of sand worm Perinereis aibuhitensis. Journal of Dalian Ocean University, 2013, 28(5): 413-417 [张柏东, 连彬, 王斌, 等. 双齿围沙蚕消化道共栖微生物菌群多样性的PCR-DGGE分析. 大连海洋大学学报, 2013, 28(5): 413-417] | |
| Zhang QT, Hu GK. Study on feeding natural sediment of Perinereis aibuhitensis. Journal of Tianjin University of Science & Technology, 2008, 23(3): 26-29 [张青田, 胡桂坤. 双齿围沙蚕摄食自然沉积物的研究. 天津科技大学学报, 2008, 23(3): 26-29] | |
| Zhao H, Li WJ, Wan L, et al. Single and synergetic effects of heavy metal Cd(Ⅱ) and Cu(Ⅱ) stress on heat shock protein 70 (HSP70) gene expression in lugworm Perinereis aibuhitensis. Journal of Dalian Ocean University, 2016, 31(2): 156-161 [赵欢, 李婉娟, 万良, 等. Cd(Ⅱ)、Cu(Ⅱ)胁迫对双齿围沙蚕热休克蛋白70(HSP70) 基因表达的影响. 大连海洋大学学报, 2016, 31(2): 156-161] | |
| Zhou YB, Yang DZ, Guan ZC, et al. Technique for artificial breeding and culture of Perinereis aibnhitensis Grube in ponds. Fisheries Science, 2007, 26(3): 150-153 [周一兵, 杨大佐, 管兆成, 等. 双齿围沙蚕人工育苗和虾池养殖技术研究. 水产科学, 2007, 26(3): 150-153] |



