舌状蜈蚣藻Grateloupia livida (Harv)Yamad属于红藻门(Rhodophyta)、隐丝藻目(Cryptonemiales)、海膜科(Halymeniaceae)、蜈蚣藻属(Grateloupia C. Agardh),生长在高潮带附近的岩礁上或低潮带石沼中,广泛分布于中国沿海、日本、韩国、越南和印度洋(夏邦美, 2004)。舌状蜈蚣藻在广东俗称“面条菜”,可食用(Tseng, 1983),具有同属其他藻类或海带(Laminaria japonica)、裙带菜(Undaria pinnatifida)、紫菜(Porphyra)等海藻所无法媲美的脆韧口感,是制作凉拌菜的绝佳食材。舌状蜈蚣藻也与同属其他藻类一样,具有抗肿瘤、抗凝血、抗菌抗病毒、增强免疫力等作用,还可以作为染料和提取藻胶的工业原料(李卫东等, 2012; Jiang et al, 2013; Ye et al, 2015)。随着对舌状蜈蚣藻经济价值的深入认识,人们对其养殖开发也越来越重视。为舌状蜈蚣藻苗种生产奠定基础,李伟新等(1989)进行了舌状蜈蚣藻生殖器官的研究,张丽娟(2000)进行舌状蜈蚣藻切段离体再生的研究,宋志民等(2013)和陈伟洲等(2013)进行温度和光照强度对舌状蜈蚣藻果孢子放散与附着以及早期发育的影响研究。关于水流和光周期对舌状蜈蚣藻果孢子萌发生长的影响则未见报道。
水流直接或间接地影响大型海藻的生理、群落结构,是海藻产量的主要影响因素(Hurd, 2000)。研究表明,海藻的光合速度和无机盐吸收速度等受水流速度的影响(Wheeler, 1980; Gerard, 1982; Gao, 1991; Hurd, 1996; 孟伟杰等, 2014),水流对江蓠(Gracilaria parvispora)藻体的生长和孢子的萌发有显著影响(Ryder et al, 2004)。自然海区中,舌状蜈蚣藻多生长在海浪冲击度较强的区域,水流对其孢子萌发生长的影响更是值得探究。
光照周期对很多种大型藻类生命周期的不同阶段和代谢过程产生影响(McKamey et al, 2006; Sánchez-Romero et al, 2012; Mansilla, 2014),不同藻类在不同阶段对光照周期的要求不同,短日照诱导巨藻(Macrocystis pyrifera)产生新叶,长日照则促进叶片生长(王伟等,1998);较长时间的光照对褐藻(Padina boergesenii) (Vasuky et al, 2001)、雨生红球藻(Haematococcus pluvialis)(韦韬等, 2013)和蜈蚣藻(Grateloupia filicina)丝状体的生长有促进作用(杨晋等, 2015)。光照周期对舌状蜈蚣藻孢子萌发会产生怎样的影响仍有待探索。
本文研究了不同水流条件、不同光照周期与光照强度交叉对舌状蜈蚣藻孢子萌发生长的影响,为舌状蜈蚣藻苗种繁育提供参考。
1 材料与方法 1.1 实验装置及材料成熟舌状蜈蚣藻果孢子体采自广东深圳杨梅坑海域。采集的果孢子体清洗干净后放在白色水桶充气培养,待水中果孢子达到1000 ind./ml以上时,取果孢子水,按照附着密度约6 ind./mm2的比例泼洒果孢子水到装有海水的方形水槽里(底部铺满载玻片作为附着器),轻轻搅拌均匀。附着有果孢子的载玻片将用于实验。实验用水为经黑暗处理5 d以上的砂滤海水,盐度为32。
实验于2015年3月在中国水产科学研究院南海水产研究所深圳试验基地进行。用LED植物生长灯作为实验光源,采用自行研制的流水装置(陈素文等, 2015b)和海藻光周期实验装置(陈素文等, 2015a)分别作为水流和光周期培养装置,用空调控制室温为18℃。用南京圣荣仪器设备有限公司生产的LGY-Ⅱ型便携式流速测算仪测量水流速度。
1.2 实验设计 1.2.1 不同水流条件对果孢子萌发生长的影响取采苗1 d后,果孢子附着密度没有显著性差异的51张载玻片(平均附着密度为5.35 ind./mm2)中的45张置于流水装置(图 1-A),另外6张则分别置于6个500 ml烧杯中。流水装置设置5个水流速度(1、4、7、10、14 cm/s),每一水流速度各设3个平行组,每个平行组内有3张载玻片;3个烧杯进行微充气,使底部水流速度均为1.5 cm/s,另外3个烧杯不充气(水流速度为0)作为对照。

|
图 1 流水实验装置(A)和光周期实验装置(B) Figure 1 The equipment for water velocity control (A) and photo period control (B) |
采苗后的载玻片培养15 d后(不充气、不流水),取盘状体密度无显著性差异(盘状体平均密度为2.62 ind./mm2)的45张载玻片放于流水装置中,其余6张置于烧杯中,水流速度的设置同前所述。
所有采苗载玻片的培养过程均采用光照强度为65 μmol photons/m2·s,光周期为L: D=12: 12;每隔2 d全换水1次。两组实验均进行20 d后测各组盘状体大小、萌发出直立体及存活数量并结束实验。
1.2.2 不同光照周期对果孢子萌发生长的影响实验设置6个光照周期(6L: 18D、8L: 16D、10L: 14D、12L: 12D、14L: 10D、16L: 8D),每个光照周期设置3个光照强度(35、85、135 μmol photons/m2·s)。采苗24 h后的载玻片(孢子平均附着密度为5.02 ind./mm2)放入500 ml烧杯中并置于不同光照周期和光照强度下(图 1-B)。每个光照条件下放4个烧杯作为平行组。培养期间,控制水温为18℃,每3 d换水1次,换水时清洗掉杂藻。实验进行30 d时,测各组盘状体大小;60 d时,测各组盘状体萌发出直立体的比例及存活盘状体数;70 d时,测孢苗高度。
1.2.3 测定方法在10×10倍显微镜下,测盘状体大小和盘状体数,每张载玻片随机测量10个盘状体的大小,并随机统计10个视野中盘状体数和萌发出直立体的盘状体数。孢苗高度采用游标卡尺测量,每张载玻片随机测量10株藻体的高度。
盘状体存活率Rt=P0/Pt×100%;
直立体萌发率St=Ut/Dt×100%
式中,P0和Pt分别为实验开始时盘状体密度和实验进行t天时盘状体的密度;Dt和Ut分别为实验进行t天所测10个视野中的盘状体总数和萌发出直立体的盘状体数。
1.3 数据处理流水实验的数据采用软件SPSS 21.0中的单因素方差分析(One-way ANOVA),用Duncan进行组间差异显著性(P < 0.05)的多重比较。光周期实验的数据则采用软件SPSS 21.0中的一般线性模型单变量进行双因素分析,用Student-Newman-Keuls进行组间差异显著性(P < 0.05)多重比较。光周期实验的数据进行分析时,一定光照周期下的3个不同光照强度实验组是视作该光照周期条件下的同一个组来进行比较,一定光照强度下的6个不同光照周期实验组是视作该光照强度条件下的一个组来进行比较,故光周期实验分析结果的组间差异显著性是这种含义的组间比较结果,并非指各实验组之间的比较结果(这也是结果图中不标示各实验组之间差异显著性的原因)。所得数据均以平均值±标准差(Mean±SD)表示。
2 结果 2.1 不同水流条件对附着果孢子的影响附着1 d后的果孢子在不同水流条件下培养20 d,对照组(水流速度为0)的盘状体规格显著高于其他水流速度下的处理组;充气培养水流速度为1.5 cm/s的处理组中,盘状体的存活率最高;流水装置中水流速度最大的组,盘状体大小及存活率显著低于其他组(图 2)。

|
图 2 附着1 d的果孢子培养于不同流速下所形成盘状体的大小及存活率 Figure 2 The sizes and the survival rates of G. livida discs of which the carpospores were incubated under different water velocity after attaching for 1 d 不同字母表示差异显著(P < 0.05),下同 Different letters indicated significant differences (P < 0.05), the same as below |
孢子附着15 d后发育成的盘状体在不同水流条件下培养20 d,充气培养(水流速度为1.5 cm/s)组中,盘状体大小和直立体萌发率明显最大;对照组和其他水流速度组之间,盘状体大小没有显著性差异,对照组的直立体萌发率明显最小;各组之间盘状体的存活率没有显著性差异(图 3)。
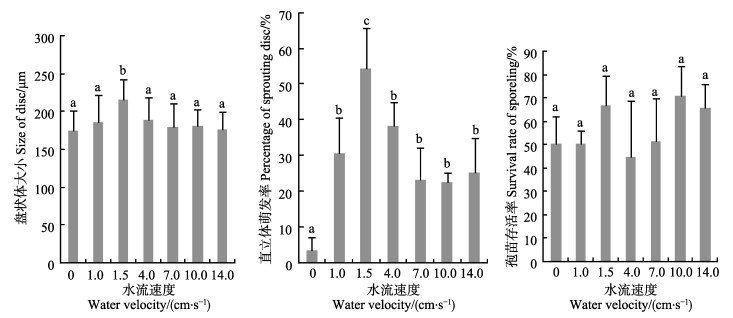
|
图 3 孢子附着15 d形成的盘状体培养于不同流速下的大小、直立体萌发率及存活率 Figure 3 The sizes and percentage of sprouting disc and the survival rates of G. livida discs of which the carpospores were incubated under different water velocity after attaching for 15 d |
舌状蜈蚣藻附着果孢子在不同光照周期和光照强度下培养30 d。结果显示,光照周期和光照强度对盘状体的生长都具有显著性影响(P < 0.05),且二者具有交互作用(P < 0.05)。在每天6–10 h的光照时长范围内,随着光照时间的增加,各光照强度下盘状体的生长都呈上升趋势,光照时间超过10 h时,各光照强度下盘状体的生长都呈平稳下降趋势(图 4-a)。多重比较的分析结果显示,光照时间为10 h的(10L: 14D),盘状体明显最大;光照时间为6 h的处理组,盘状体明显最小,其他光照时间处理组,盘状体的大小没有显著差异;光照强度为135 μmol photons/m2·s时,盘状体规格显著小于光照强度为35、85 μmol photons/m2·s时,后二者之间无显著性差异。
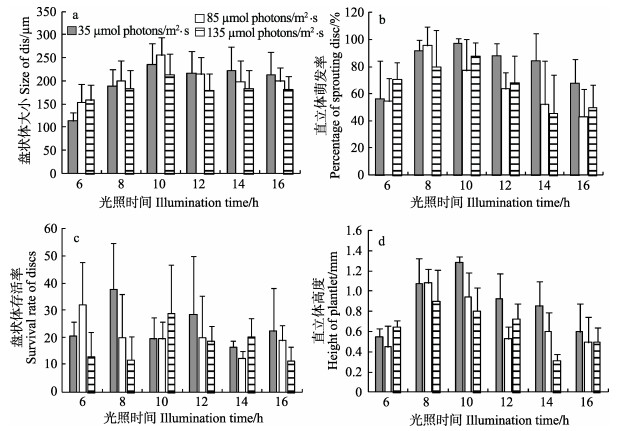
|
图 4 不同光照周期和光照强度下舌状蜈蚣藻盘状体的大小、直立体萌发率、盘状体存活率和直立体高度 Figure 4 The sizes of disc, the percentage of sprouting disc, the survival rates of disc and the heights of plantlet of G. livida carpospores incubated under different photo periods and light intensities |
舌状蜈蚣藻附着果孢子在不同光照周期和光照强度下培养60 d。结果显示,光照周期和光照强度对盘状体萌发出直立体的影响都具有显著性(P < 0.05),但二者没有交互作用(P > 0.05)。光照时间为8–10 h,直立体萌发率没有显著性差异,这2个光照时间下直立体的萌发率明显比光照时间为6、14和16 h的高;光照强度为35 μmol photons/m2 s时,直立体萌发率明显比光照强度为85、135 μmol photons/m2 s的组高(图 4-b)。
舌状蜈蚣藻附着孢子在不同光照周期和光照强度下培养60 d。结果显示,光照周期和光照强度对盘状体存活率的都没有显著性影响(P > 0.05),且二者没有交互作用(P > 0.05)(图 4-c)。
舌状蜈蚣藻附着果孢子在不同光照周期和光照强度下培养70 d。结果显示,光照周期和光照强度对直立体生长都具有显著性影响(P < 0.05),且二者具有交互作用(P < 0.05)。在光照强度为35 μmol photons/m2·s时,直立体高度最高值出现在光照时间为10 h的处理组;在光照强度为85、135 μmol photons/m2·s时,直立体高度最高值出现在光照时间为8 h的处理组(图 4-d)。多重比较的分析表明,光照时间为8、10 h,直立体高度明显最高,而这2个光照时间之间的直立体高度差异不显著,其他光照时间之间的直立体高度差异不显著。在光照强度为35 μmol photons/m2·s时,直立体高度明显比光照强度为85、135 μmol photons/m2·s条件下的高,后二者之间没有显著性差异。
3 讨论海带配子体克隆育苗生产中,流水速度和洗刷压力是幼苗培育技术中的关键因素,采取附苗后静水24 h后微流水(表层流速5 cm/s以下)、72 h后正常流水(张培玉等, 2005)。实验表明,附着1 d的舌状蜈蚣藻果孢子在不同水流速度下培养20 d,水流速度为0的生长最快;而对于果孢子附着15 d后萌发形成的盘状体来说,水流速度为0条件下,直立体的萌发率最低,此结果与海带配子体幼苗培育技术略有不同。舌状蜈蚣藻育苗生产中,可采取附苗后静水培养,附苗后15 d再进行充气流水培养。
实验采用的流水装置所形成的流水方式类似于海带夏苗培育过程中的流水方式(水在阶梯式培苗池中循环),实验表明,这种方式的流水与充气方式的流水对舌状蜈蚣藻孢子萌发的影响不同,虽然没有设置完全相同的流速来证明这二者是因形成水流的方式不同而影响不同,但在流速接近时(流水装置的流速为1 cm/s和充气的为1.5 cm/s),二者对孢子萌发生长的影响差异也很明显,说明形成水流的方式不同所造成的影响也不同。充气能促进藻类利用水体中主要无机碳源HCO3-,提高藻类光合作用能力(Zou, 2005; 韩婷婷等, 2013),这可能是舌状蜈蚣藻孢苗培养过程中,采用充气培养比单纯的流水培养更有利于孢子萌发生长的原因。
江蓠孢子培养于不同水流速度下(充气形成0–6.5 cm/s流速),水流速度为6.5 cm/s,孢子的萌发最好(Ryder, 2004)。实验表明,舌状蜈蚣藻在充气水流速度为1.5 cm/s条件下的萌发状况最佳。因实验所设置的充气水流单一,故是否有更合适的充气水流速度有待于进一步研究。
大部分关于光照对海藻萌发生长影响的研究都侧重于光照强度的影响,往往把光照周期设为12L: 12D (Chen et al, 2011; 陈伟洲等, 2013、2014; 陈佩等, 2015)。而在对海萝(Gloiopeltis)的深入研究中发现,光周期对海萝孢子萌发的影响程度不亚于光照强度的影响(未发表)。因此,在对舌状蜈蚣藻进行研究时,也将关注点落到光周期上。实验表明,光照周期明显影响了舌状蜈蚣藻孢子的萌发和生长,最合适的光照周期为8L: 16D和10L: 14D。在进行蜈蚣藻孢子育苗生产中,可通过遮光来控制光照时间。
陈伟洲等(2013)的研究表明,在舌状蜈蚣藻盘状体发育过程中,较高光强(5000–10000 lx)可以促进盘状体的生长发育;低光强(500 lx)培养条件显著抑制了盘状体的生长发育;光照强度为2500 lx时,盘状体的生长次于5000 lx和10000 lx。本研究则表明,舌状蜈蚣藻在光照强度为35 μmol photons/m2·s(约3000 lx)比在光照强度为85 μmol photons/m2·s(约7000 lx)和135 μmol photons/m2·s时更有利于盘状体的萌发生长。这可能是由于在本研究结果的处理中,将一定光照强度下的6个不同光照周期实验组当成该光照强度条件下的1个组,来进行不同光照强度组之间的比较,而陈伟洲等的实验则是单一进行光照周期12L: 12D下不同光照强度之间的比较。即将光照周期的作用考虑进去,所得出的结果就会不同。
实验结果显示,舌状蜈蚣藻附着果孢子在不同光照周期和光照强度下培养30 d,盘状体的生长在光照强度为35 μmol photons/m2·s时与在光照强度为85 μmol photons/m2·s时的差异不显著,而培养到60、70 d,则在光照强度为35 μmol photons/m2·s时比在光照强度为85 μmol photons/m2·s时直立体的萌发率较高,孢苗的生长更快。说明舌状蜈蚣藻盘状体后期的萌发生长更需要相对较弱的光,在育苗生产中可据此进行光照强度的调节。
| Chen P, Huang ZJ, Zhu JY, et al. Effect of environmental factor on conchospore releasing, attachment and germination in Pyropia dentata. South China Fisheries Science, 2015, 11(1): 55-61 [陈佩, 黄中坚, 朱建一, 等. 环境条件对长紫菜壳孢子放散、附着和萌发的影响. 南方水产科学, 2015, 11(1): 55-61] | |
| Chen SW, Chen LX, Zhang WW, et al. Device for be used for experiment of marine alga photoperiod: China. ZL2015202-16205.3, 2015a [陈素文, 陈利雄, 张文文, 等. 一种用于海藻光周期实验的装置. 专利号: ZL201520216205.3, 2015a] | |
| Chen SW, Guo YJ, Chen LX, et al. Experimental facility and experimental method for researching influences of water flow to attachment, germination and growth of alga spores: China. ZL201520228848.X, 2015b [陈素文, 郭永坚, 陈利雄, 等. 用于研究水流对海藻孢子附着、萌发生长影响的实验装置. 专利号: ZL201520228848.X, 2015b] | |
| Chen SW, Wu JF, Chen LX, et al. Effects of light and temperature on the attachment and development of Gloiopeltis tenax and Gloiopeltis furcata tetraspores. Journal of Applied Phycology, 2011, 23(6): 1045-1051 DOI:10.1007/s10811-010-9638-z | |
| Chen WZ, Song ZM, Huang ZJ. Effects of temperature and irradiance on early development of Grateloupia livida. South China Fisheries Science, 2013, 9(6): 14-19 [陈伟洲, 宋志民, 黄中坚. 温度、光照强度对舌状蜈蚣藻早期发育的影响. 南方水产科学, 2013, 9(6): 14-19] | |
| Chen WZ, Zhong ZH, Jin YL, et al. Effects of light intensity, temperature and salinity on growth and biochemical constituents of Hypnea cervicornis. South China Fisheries Science, 2014, 10(2): 48-53 [陈伟洲, 钟志海, 金玉林, 等. 光照强度、温度和盐度对鹿角沙菜生长及生化组分的影响. 南方水产科学, 2014, 10(2): 48-53] | |
| Gao K. Effects of seawater current speed on the photosynthetic oxygen evolution of Sargassum thunbergii (Phaeophyta). Japanese Journal of Phycology, 1991, 39: 291-293 | |
| Gerard VA. In situ water motion and nutrient uptake by the giant kelp Macrocystis pyrifera. Marine Biology, 1982, 69(1): 51-54 DOI:10.1007/BF00396960 | |
| Han TT, Fang JG, Zhang JH, et al. Effect of light intensity on the photosynthetical responses of Gracilaria lemaneiformis in non-aerated and aerated cultures. Journal of Fisheries of China, 2013, 37(12): 1801-1806 [韩婷婷, 方建光, 张继红, 等. 静止和充气培养条件下光强对龙须菜光合生理效应的影响. 水产学报, 2013, 37(12): 1801-1806] | |
| Hurd CL, Harrison PJ, Druehl LD. Effect of seawater velocity on inorganic nitrogen uptake by morphologically distinct forms of Macrocystis integrifolia from wave-sheltered and exposed sites. Marine Biology, 1996, 126(2): 205-214 DOI:10.1007/BF00347445 | |
| Hurd CL. Water motion, marine macroalgal physiology, and production. Journal of Phycology, 2000, 36(3): 453-472 DOI:10.1046/j.1529-8817.2000.99139.x | |
| Jiang Z, Chen Y, Yao F, et al. Antioxidant, antibacterial and antischistosomal activities of extracts from Grateloupia livida (Harv). Yamada. PLoS One, 2013, 8(11) | |
| Li WD, Wu X, Jiang D, et al. Prospect of application and artificial culture of Grateloupia. Hebei Fisheries, 2012, 11061106(11): 48-54 DOI:10.3969/j.issn.1004-6755.2012.11.019 [李卫东, 吴茜, 蒋丹, 等. 蜈蚣藻属海藻的应用及人工养殖前景展望. 河北渔业, 2012, 11061106(11): 48-54] | |
| Li WX, Ding ZF, Chen SF, et al. A study on the reproductive organs of Grateloupia livida. Journal of Zhanjiang Fisheries College, 1989, 9(1-2): 110-115 [李伟新, 丁镇芬, 陈少凡, 等. 舌状蜈蚣藻Grateloupia livida (Harv.) Yamada生殖器官的研究. 湛江水产学院学报, 1989, 9(1-2): 110-115] | |
| Mansilla A, Rosenfeld S, Rendoll J, et al. Tolerance response of Lessonia flavicans from the sub-Antarctic ecoregion of Magallanes under controlled environmental conditions. Journal of Applied Phycology, 2014, 26(5): 1971-1977 DOI:10.1007/s10811-014-0294-6 | |
| McKamey KA, Amsler CD. Effects of temperature and light on growth of the Antarctic algae Geminocarpus geminatus (Ectocarpales: Phaeophyceae) and Cladophora repens (Cladophorales: Cladophorophyceae) in culture. Phycologia, 2006, 45(2): 225-232 DOI:10.2216/04-75.1 | |
| Meng WJ, Wang P, Gui FK, et al. Nutrient uptakes by Ishige foliaceaokamurai and Sargassum fusiforme differ in algal section and mass, carbon concentration, and water flow. Oceanologia et Limnologia Sinica, 2014, 45(3): 663-668 DOI:10.11693/hyhz20130311001 [孟伟杰, 王萍, 桂福坤, 等. 藻体部位、藻质量、碳源、水流对铁钉菜和羊栖菜营养盐吸收的影响. 海洋与湖沼, 2014, 45(3): 663-668] | |
| Ryder E, Nelson SG, McKeon C, et al. Effect of water motion on the cultivation of the economic seaweed Gracilaria parvispora (Rhodophyta) on Molokai, Hawaii. Aquaculture, 2004, 238(1-4): 207-219 DOI:10.1016/j.aquaculture.2004.05.019 | |
| Sánchez-Romero A, Miranda-Baeza A, López-Elías JA, et al. Effect of light regime on the N-ammonium removal by the red algae Gracilaria vermiculophylla. Current Research Journal of Biological Sciences, 2012, 4(5): 613-618 | |
| Song ZM, Chen WZ, Liu T. Effect of temperature, irradiance and salinity on the release and attachment of carpospore of Grateloupia livida. Transactions of Oceanology and Limnology, 2013, 11061106(1): 90-96 [宋志民, 陈伟洲, 刘涛. 温度、光强和盐度对舌状蜈蚣藻果孢子放散与附着的影响. 海洋湖沼通报, 2013, 11061106(1): 90-96] | |
| Tseng CK. Common seaweeds of China. Beijing: Science Press, 1983. | |
| Vasuky S, Ganesan M, Rao PVS. Effect of light intensity, photoperiod, ESP medium and nitrogen sources on growth of marine brown alga Padina boergesenii (Dictyotales, Phaeophyta). Indian Journal of Geo-Marine Sciences, 2001, 30(4): 228-231 | |
| Wang W, Lin JM, Jin DX. Photocontrol of development in algae. Chinese Bulletin of Botany, 1998, 15(5): 31-39 [王伟, 林均民, 金德祥. 藻类的光控发育. 植物学通报, 1998, 15(5): 31-39] | |
| Wei T, Gu WH, Li J, et al. Effect of photoperiod on microalgae Haematococcus pluvialis. Chinese Bulletin of Botany, 2013, 48(2): 168-173 [韦韬, 顾文辉, 李健, 等. 雨生红球藻的光周期效应. 植物学报, 2013, 48(2): 168-173] | |
| Wheeler WN. Effect of boundary layer transport on the fixation of carbon by the giant kelp Macrocystis pyrifera. Marine Biology, 1980, 56(2): 103-110 | |
| Xia BM. Flora algarum marinarum sinicarum, TomusⅡ Rhodophyta, No.Ⅲ. Beijing: Science Press, 2004: 118-122. [夏邦美. 中国海藻志·第二卷·红藻门·第三册. 北京: 科学出版社, 2004: 118-122.] | |
| Yang J, Luo QJ, Qiu CG, et al. Effects of temperature, salinity and light on growth of Grateloupia filicina filament. Journal of Biology, 2015, 32(2): 65-69 [杨晋, 骆其君, 邱成功, 等. 温度、盐度、光照对蜈蚣藻丝状体生长的影响. 生物学杂志, 2015, 32(2): 65-69] | |
| Ye DY, Jiang ZB, Zheng FC, et al. Optimized extraction of polysaccharides from Grateloupia livida (Harv.) Yamada and biological activities. Molecules, 2015, 20(9): 16817-16832 DOI:10.3390/molecules200916817 | |
| Zhang LJ. Initial study on the isolated regeneration of the fragments of Grateloupia livida (Harv.)Yamada. Journal of Jimei University (Natural Science), 2000, 5(3): 35-39 [张丽娟. 舌状蜈蚣藻切段离体再生的初步研究. 集美大学学报(自然科学版), 2000, 5(3): 35-39] | |
| Zhang PY, Zhang QS, Tang XX, et al. Seedling culture techniques for producing kelp gametophyte clone. Chinese Journal of Applied and Environmental Biology, 2005, 11(5): 545-548 [张培玉, 张全胜, 唐学玺, 等. 海带配子体克隆育苗生产中幼苗培育技术的研究. 应用与环境生物学报, 2005, 11(5): 545-548] | |
| Zou DH. Effects of elevated atmospheric CO2 on growth, photosynthesis and nitrogen metabolism in the economic brown seaweed, Hizikia fusiforme (Sargassaceae, Phaeophyta). Aquaculture, 2005, 250(3-4): 726-735 DOI:10.1016/j.aquaculture.2005.05.014 |



