2. 福建省海洋生物资源开发利用协同创新中心 厦门 361013
2. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361013
溴氰菊酯(Deltamethrin,DM)又名敌杀死,是一种含有α-氰基的Ⅱ型拟除虫菊酯类仿生杀虫剂,以触杀、胃毒为主,杀虫谱广,对机体的神经系统功能具有损害作用。迄今已商品化的菊酯类农药有50多种,广泛应用于农作物病虫害防治和水产养殖清塘、毒杀滩涂贝类养殖埕地的敌害生物以及杀灭水产养殖生物寄生虫等方面。菊酯类农药残留通过地下水、陆源径流和清塘废水输入近岸海域,造成海洋与渔业环境污染,严重地危害海洋生物的生存,海洋与渔业污染事故时有发生,也带来水产品质量的安全问题(梅立永等, 2007; 赵李娜等, 2014; Thomas et al, 2008)。大部分的菊酯类农药属于环境激素类物质,通过食物链传递,可对人类生理生殖系统产生危害,有些类型还有致畸、致癌、致突变的作用(郑伟华等, 2004)。
国内外关于拟除虫菊酯类农药对水生生物的急性毒性、亚急性毒性及其作用机理进行了较多的研究,但主要集中于淡水鱼类、甲壳类等方面(王瑞龙等, 2007; 魏华等, 2010; Haverinen et al, 2016; 丁正峰等, 2013),而拟除虫菊酯类农药对于海水养殖贝类和虾、蟹类的毒性效应研究较少。迄今为止,仅有拟除虫菊酯类农药对几种海水养殖虾类、贝类的毒性及其体内ATPase、AChE、GST、SOD、CAT等酶类活性变化和组织损伤的研究报道(陈碧鹃等, 1997; 谭晓珍等, 2005; 许贻斌等, 2015; 陈宇锋, 2016),但拟除虫菊酯类农药对主要海水养殖甲壳类和双壳类动物的毒性比较及其积累研究尚未见报道。
作者通过室内实验,分别研究了溴氰菊酯对甲壳类动物远海梭子蟹(Portunus pelagicus)、日本囊对虾(Marsupenaeus japonicus)和双壳类动物文蛤(Meretrix meretrix)、菲律宾蛤仔(Ruditapes philippinarum)的毒性及其积累效应,这对于掌握溴氰菊酯对海水养殖生物的毒性机理,确定其在水产养殖中安全用量;客观地评估溴氰菊酯对海水养殖环境和水产品质量安全的风险,为准确地鉴定和处理溴氰菊酯造成的海洋与渔业污染事故提供科学依据,均具有重要的应用价值和现实意义。
1 材料与方法 1.1 实验药品、仪器溴氰菊酯标准品(99.7%),购自国家标准物质研究中心;2.5%溴氰菊酯乳油,拜耳杭州作物科学有限公司生产,使用前配成1 g/L的母液。丙酮、石油醚、乙酸乙酯、正己烷、环己烷均为色谱纯。安捷伦6890N型气相色谱仪(美国Agilent公司),配有电子捕获检测器,HP-5毛细管柱(30 m×0.32 mm×0.25 μm);电子分析天平(梅特勒-托利多仪器上海有限公司),超声波清洗器(昆山市超声仪器有限公司),R205旋转蒸发仪(上海申生科学仪器有限公司),YGC-36氮吹仪(成都雅源科技有限公司),80-2B低速离心机(上海安亭科学仪器厂),固相萃取装置(上海安谱科学仪器有限公司)、YSI-6920多参数水质分析仪(美国YSI公司)。
1.2 实验动物远海梭子蟹购自福建漳浦县沙西海水水产养殖场,壳长为(11.90±0.60) cm,体重为(150.5±21.0) g。实验前在体积为25 m3的室内圆形水泥池内暂养3-5 d,暂养密度为0.6-0.8 kg/m3,采用流水式换水。少量多次投喂新鲜的牡蛎肉,投喂量约为其体重的8%。每天早上将暂养池中水排干,清除残饵和排泄物。
日本囊对虾购自漳浦县前亭对虾养殖场,体长为(12.00±0.90) cm,体重为(11.7±2.7) g。实验前在体积为10 m3 (20 m2×0.5 m)的水泥池内暂养3-5 d,暂养密度为10-20只/m2。并在暂养池池面遮盖一块双层黑色遮阳网,避免惊扰和阳光直射。每天换水1次。早、晚适量投喂1次海马牌2#对虾配合饲料。
文蛤和菲律宾蛤仔均购自漳浦县佛昙海水养殖场,文蛤仔壳长为(4.89±0.30) cm, 体重为(29.4±4.8) g,菲律宾蛤仔壳长为(3.75±0.20) cm, 体重为(10.8±1.6) g。实验前在室外土池(面积为1.5 hm2)挂笼暂养1周,水体中丰富的浮游植物供贝类摄食。实验前一天移至室内水泥池(面积为10 m2)中无饵料暂养,暂养密度为50-60粒/m2。
1.3 实验用水实验用水为砂滤、袋滤海水。海水温度范围为24.20-26.58℃;盐度范围为31.15-33.80;pH值范围为7.95-8.12,溶解氧含量范围为5.96-6.55 mg/L。
1.4 实验方法 1.4.1 急性毒性实验溴氰菊酯对4种海水养殖生物急性毒性实验按GB/T16310.1-1996《船舶散装运输液体化学品危害性评价规范水生生物急性毒性试验方法》进行。远海梭子蟹和日本囊对虾的实验容器分别为体积1.00 m3的室内水泥池和体积0.08 m3的玻璃水族箱;文蛤和菲律宾蛤仔的实验容器均为体积0.06 m3玻璃水族箱。根据溴氰菊酯对4种实验动物毒性预实验得出的24 h全部死亡和96 h全部存活的浓度范围,在正式实验时,在此范围内按等对数间距设置7个浓度组,其浓度梯度见图 1、图 2。每组设2个平行。挑选规格均匀、健康的4种海水养殖生物作为实验对象,每组放入实验动物10只/粒。实验期间不投饵,24 h不间断微量充气。采用半静水式换水补药方法,每隔24 h换水1次,重新投药。实验开始后,前8 h内连续观察,以后定时或不定时地进行观察,并于24 h、48 h、72 h和96 h分别记录实验动物的死亡数。贝类死亡检查:将贝类与地面轻轻碰撞,活的贝类发出沉闷的声音,死亡的贝类则为空谷的声音。并用指甲轻抠其两壳缝隙,死亡贝类的双壳会有所松动,活的贝类双壳则依然紧闭。将死亡个体清除并记录死亡数。
|
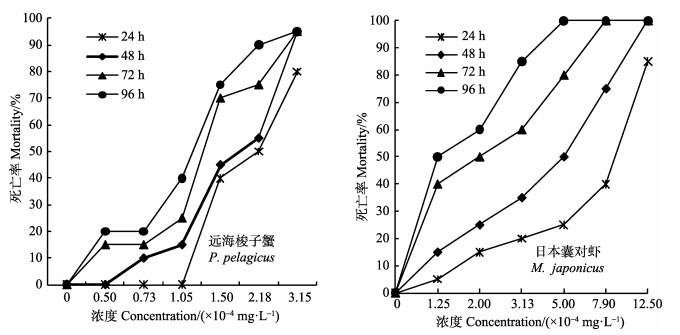
图 1 不同溴氰菊酯浓度下甲壳类动物的死亡率 Figure 1 Mortalities of the crustacean exposed to different concentrations of deltamethrin |
|
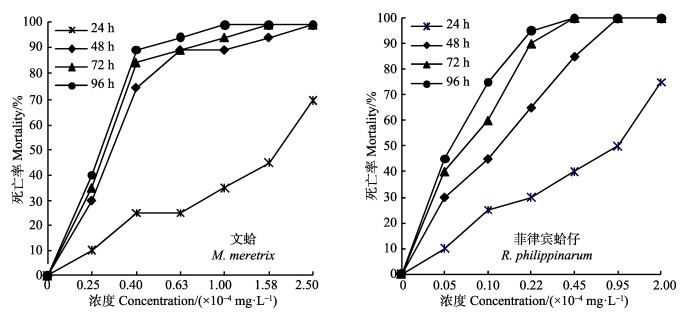
图 2 不同溴氰菊酯浓度下双壳类动物的死亡率 Figure 2 Mortalities of the bivalve exposed to different concentrations of deltamethrin |
实验期间,用YSI-6920多参数水质分析仪每天测定1次水温、盐度、pH、DO等理化因子,4种受试动物水体中水温范围为24.41-27.66℃;盐度范围为31.30-33.78;pH值范围为7.48-8.04,溶解氧含量范围为4.71-6.42 mg/L。
1.4.2 实验动物溴氰菊酯的积累实验甲壳类的实验容器为1.0 m3的室内水泥池,双壳类的实验容器为0.08 m3的玻璃水族箱,分别放入20只远海梭子蟹和40尾日本囊对虾、30粒文蛤和50粒菲律宾蛤仔。所有实验水体中分别设置4个溴氰菊酯浓度梯度,实验条件与正式实验相同。在实验水体中加入溴氰菊酯使用液混匀后和实验经24 h换水时,分别采集1次水样,放入冰箱4-5℃冷藏。采集经暴露24 h、48 h、72 h和96 h后存活的4种实验动物样品,放于-10~-20℃冷冻保存。水样中溴氰菊酯含量分析采用《生活饮用水标准检验方法农药指标》(GB/T5750.9-2006)中的方法(中华人民共和国质量监督检验检疫总局等, 2006);受试动物样品取肌肉组织,匀浆。肌肉中溴氰菊酯含量分析采用《动物性食品中有机氯农药和拟虫菊酯农药多组分残留量的测定》(GB/T5009.162-2008)中的方法(全国农药标准化技术委员会, 2009)。
1.5 计算方法 1.5.1 半致死浓度及安全浓度计算采用SPSS 18.0软件,计算得出受试动物死亡百分率的概率单位与实验浓度对数的回归方程,求出半致死浓度(LC50)。安全浓度(SC)采用特伦堡(Turubell)的安全浓度计算公式(陈宇锋, 2016):
| $ {\rm{SC}} = 48\;{\rm{h}}\;{\rm{L}}{{\rm{C}}_{50}} \times 0.3/{\left({24\;{\rm{h}}\;{\rm{L}}{{\rm{C}}_{50}}/48\;{\rm{h}}\;{\rm{L}}{{\rm{C}}_{50}}} \right)^2} $ | (1) |
由于溴氰菊酯在水体中较易挥发和降解,实验过程中浓度处于持续衰减状态。故采用实验水体中溴氰菊酯的初始浓度与实验经24 h换水时的浓度的平均值作受试动物吸收积累过程中水体中的浓度,其积累系数公式:
| $ \overline {{C_W}} = \left({{C_{w0}} + {C_{W1}}} \right)/2 $ | (2) |
| $ {\rm{SCF}} = {C_A}/\overline {{C_W}} $ | (3) |
式(2)、式(3)中,CA为经过某实验时间受试动物体内溴氰菊酯的浓度;Cw0为实验水体中溴氰菊酯的初始浓度;Cw1为实验经24 h换水时水体中溴氰菊酯的浓度;
如图 1所示,在远海梭子蟹和日本囊对虾的实验水体中,溴氰菊酯浓度分别在5.00×10-5-3.15× 10-4 mg/L和1.25×10-4-1.25×10-3 mg/L范围内,随着浓度的提高,各实验组远海梭子蟹和日本囊对虾的死亡率随之上升,二者呈显著正相关。在溴氰菊酯浓度分别为1.50×10-4-3.15×10-4 mg/L和7.90×10-4-1.25×10-3mg/L的高浓度组,短时间内(24 h)远海梭子蟹和日本囊对虾的死亡率分别达40%-80%和40%-85%;在溴氰菊酯浓度分别为5.00×10-5-1.05× 10-4 mg/L和1.25×10-4-2.00×10-4 mg/L的低浓度组,远海梭子蟹和日本囊对虾陆续发生死亡,96 h内死亡率分别达20%-40%和50%-60%,且远海梭子蟹和日本囊对虾的暴露时间越长,死亡率越高,二者呈显著正相关。
表 1为不同时间下,溴氰菊酯浓度对数-甲壳类死亡率概率单位的回归方程,并进行了回归方程的相关系数R和回归系数的显著性检验,据此计算出溴氰菊酯对远海梭子蟹和日本囊对虾的24 h LC50、48 h LC50、72 h LC50、96 h LC50分别为2.07×10-4、1.70×10-4、1.27×10-4、1.10×10-4 mg/L和7.32×10-4、3.90×10-4、1.93×10-4和1.43×10-4 mg/L,并根据Turubell的安全浓度计算公式,计算出溴氰菊酯对远海梭子蟹和日本囊对虾的安全浓度分别为3.44×10-5和3.32×10-5 mg/L。
|
|
表 1 不同时间下溴氰菊酯对甲壳类动物的LC50值 Table 1 LC50 values of deltamethrin to the crustacean at different exposure time |
甲壳类动物的溴氰菊酯中毒反应症状具有一定的共性。实验开始时,在低浓度溴氰菊酯实验组中,远海梭子蟹均在池底爬行,日本囊对虾在玻璃水族箱底部水层聚集、游动、活动正常,与对照组无明显差异。随着暴露时间的延长,4 h后小部分的远海梭子蟹的螯足、步足间歇性抽搐,48 h后出现少量死亡,死亡个体的断足率很低,一般为趴在池底、步足松开。日本囊对虾则活力逐渐减弱,对外界刺激反应迟钝,躯体弓形侧倒,步足抽搐、微微颤抖,24 h后出现少量死亡。在高浓度溴氰菊酯实验组中,经1-2 h后,远海梭子蟹便出现行为异常,主要表现为急躁不安,间歇性上游,同时伴有呼吸困难,附肢间歇性抽搐,螯足、步足部分断开,断足率随着溴氰菊酯浓度的升高而增加。日本囊对虾则出现急躁不安,间歇性的急促游动,偶有跳跃撞壁,随之活力逐渐减弱,体色发红,躯体肌肉僵直,附肢抽搐、张开,短时间内(24 h)出现大量死亡。
2.2 溴氰菊酯对双壳类动物的毒性如图 2所示,在文蛤和菲律宾蛤仔养殖水体中,溴氰菊酯浓度分别为0.25-2.50 mg/L和0.05-2.00 mg/L,随着浓度的提高,各实验组文蛤和菲律宾蛤仔的死亡率随之增加,二者呈显著正相关。在溴氰菊酯浓度分别为1.00-2.50 mg/L和0.95-2.00 mg/L的高浓度组,24 h内便发生文蛤和菲律宾蛤仔的大量死亡,死亡率分别达45%-70%和50%-75%,48 h后,文蛤和菲律宾蛤仔几乎全部死亡;在溴氰菊酯浓度分别为0.25-0.40 mg/L和0.05-0.10 mg/L的低浓度组,文蛤和菲律宾蛤仔陆续发生死亡,96 h内死亡率分别达40%-90%和45%-75%,且文蛤和菲律宾蛤仔的曝露时间越长,死亡率越高,二者呈显著正相关。
表 2为不同时间下,溴氰菊酯浓度对数-双壳类死亡率概率单位的回归方程,并进行了回归方程的相关系数R和回归系数的显著性检验,据此计算出溴氰菊酯对文蛤和菲律宾蛤仔的24 h LC50、48 h LC50、72 h LC50、96 h LC50分别为1.52、0.30、0.28、0.27 mg/L和0.67、0.11、0.07、0.06 mg/L,并依据Turubell的安全浓度计算公式,计算出溴氰菊酯对文蛤和菲律宾蛤仔的安全浓度分别为3.51×10-3 mg/L和9.50×10-4 mg/L。
|
|
表 2 不同时间下溴氰菊酯对双壳类动物的LC50值 Table 2 LC50values of deltamethrin to the bivalves at different exposure time |
双壳类动物的溴氰菊酯中毒反应症状基本相似。在低浓度溴氰菊酯实验组中,实验开始时,水体透明,文蛤微微张开双壳,斧足自然伸出。菲律宾蛤仔的斧足和水管均能自然伸出,处于正常活动状态,与对照组无明显差异。随着暴露时间的延长,2种贝类逐渐呈现迷昏麻痹状态,表现为对外物触及时不敏感,反应迟钝,受刺激后贝壳不能快速关闭,经24 h后出现少量死亡。在高浓度溴氰菊酯实验组中,水体呈现乳白色浑浊,2种贝类贝壳紧闭,斧足和水管无伸缩能力,过滤活动基本停止,呈现麻痹中毒状态。在中毒后期,双壳类闭壳肌萎缩、松弛,水管萎缩、下垂,外套膜极度收缩,贝壳微微张开不能闭合,受刺激后无闭壳反应,短时间内(24 h)出现大量死亡。
2.3 溴氰菊酯在甲壳类和双壳类动物体内的积累如表 3所示,由于远海梭子蟹、日本囊对虾实验水体中溴氰菊酯的初始浓度和实验经24 h换水时的浓度均低于检出限(为未检出),故无法计算其生物积累系数(SCF)来评估其对实验水体中不同浓度溴氰菊酯的积累率。在24-96 h后,文蛤暴露在平均浓度为0.86-0.05 mg/L溴氰菊酯水体中,其对溴氰菊酯的SCF为2.57-12.40;菲律宾蛤仔暴露在溴氰菊酯平均浓度为0.37-0.03 mg/L水体中,其对溴氰菊酯的SCF为3.03-27.85。文蛤和菲律宾蛤仔暴露48 h、72 h、96 h时与暴露24 h时相比,水体中溴氰菊酯平均浓度前者分别为后者的63.20%、13.20%、6.08%和17.80%、9.73%、7.30%,其对溴氰菊酯的SCF前者比后者则分别高0.52、2.61、3.82倍和1.93、7.84、8.27倍。由此表明,在一定的溴氰菊酯浓度范围内,双壳类动物对水体中溴氰菊酯的积累率随暴露时间的延长而增大,二者成正相关;随暴露浓度的升高而减少,二者成负相关。
|
|
表 3 溴氰菊酯在甲壳类和双壳类动物体内的积累 Table 3 The bioaccumulation of deltamethrin in the crustacean and bivalve |
本研究中,甲壳类动物暴露于较高浓度的溴氰菊酯水体中,日本囊对虾表现出急躁不安,间歇性的急促游动并跳跃撞壁,随后躯体弓形侧躺,步足抽搐,僵硬张开等症状。这与多种鱼类如唐鱼(Tanichthys albonubes)、孔雀鱼(Poecilia reticulata)、剑尾鱼(Xiphophorus helleri)和泥鳅(Misgurnus anguillicaudatus)等暴露在一定浓度的菊酯类农药水体中表现出急躁、狂游、撞壁、抽搐等典型的神经性中毒症状极为相似(王瑞龙等, 2007; Rukiye et al,2003; Khalili et al, 2012; 夏晓华等, 2013)。远海梭子蟹表现出现呼吸困难,侧翻于池底,步足间歇性抽搐,部分或全部的螯足和步足断开脱落等症状。这与锯缘青蟹(Scylla serrata)在杀灭菊酯中毒后,出现自断步足的现象(吴琴瑟等, 1993),以及河蟹(Chinese mitten crabe)在溴氰菊酯中毒后,四肢无力或有微微颤抖,个别出现附肢脱落的症状(耿雪冰等, 2009)一致。双壳类动物文蛤和菲律宾蛤仔的溴氰菊酯中毒症状,表现为贝壳紧闭、外套膜明显收缩,水管和斧足伸缩无力,最后闭壳肌萎缩、松弛,双壳无法闭合等症状。这与栉孔扇贝(Chlamys farreri)暴露在高浓度氰戊菊酯(0.13 mg/L)水体中时,呈现出外套膜极度收缩,鳃呈暗褐色,受刺激后仅在外套膜边缘有轻微的收缩反应,但无闭壳反应的症状(谭晓珍等, 2005)基本相似。
由于菊酯类农药属于神经毒剂,目前普遍认为,其作用机制主要是通过对受试生物体内钠泵的干扰使神经膜动作电位的去极化期延长,周围神经也出现重复电位而造成肌肉的持续收缩,抑制脑突触体膜上的ATPase,使突触后膜上的乙酰胆碱酯酶(AchE)等神经递质大量聚集,从而引起脑AchE被抑制。造成机体内在的代谢和神经传导功能紊乱、蛋白失活、自由基大量爆发等一系列的机体损伤(Burredge et al, 2000; 王朝晖等, 2000),从而导致受试生物大量死亡。溴氰菊酯对受试生物的毒性机理除主要表现为神经性中毒外,溴氰菊酯可以造成克氏原螯虾(Procambarus clarkii)肌细胞超微结构损伤,激活细胞的厌氧呼吸,在组织中产生大量的乳酸,乳酸的蓄积会造成细胞酸化而加重对细胞的毒性,造成克氏原螯虾的死亡(吴楠等, 2015)。溴氰菊酯通过对菲律宾蛤仔淋巴液中AchE、Na+-K+-ATPase和肝脏、鳃中GST活性的抑制,导致其机体正常功能受到了严重干扰,肝脏和鳃的组织细胞受损、甚至坏死,并通过损伤菲律宾蛤仔的鳃组织和消化盲囊细胞影响菲律宾蛤仔的新陈代谢,包括细胞免疫酶的反应,进而导致菲律宾蛤仔的死亡(许贻斌等, 2015)。
3.2 溴氰菊酯对甲壳类和双壳类动物的毒性效应溴氰菊酯对同类不同种实验动物的毒性存在明显的种间差异。从表 1、表 2中溴氰菊酯对远海梭子蟹、日本囊对虾和文蛤、菲律宾蛤的24 h、48 h、72 h、96 h半致死浓度及其安全浓度可看出,同为甲壳类动物,溴氰菊酯对远海梭子蟹的毒性稍高于日本囊对虾;同为双壳类动物,溴氰菊酯对菲律宾蛤仔的毒性显著高于文蛤。总体上,溴氰菊酯对甲壳类动物远海梭子蟹、日本囊对虾的毒性明显高于双壳类动物文蛤、菲律宾蛤仔。这可能是甲壳类和双壳类动物的内部生理结构和生活习性存在较大差异,导致其自身防御系统对溴氰菊酯毒害的抵御能力各不相同。在急性毒性实验水体中,双壳类动物较长时间内双壳紧闭,尽量减少呼吸与摄食以抵御溴氰菊酯的毒害,而甲壳类动物则一直保持呼吸与摄食,对于水体中溴氰菊酯的毒害基本无力回避。
目前,菊酯类农药对甲壳类动物的毒性效应研究较多,据报道,在海水甲壳类动物中,氯氰菊酯对成体龙虾(Panulirus stimpsoni holthuis)的96 h LC50为0.104 μg/L;溴氰菊酯对平均体重为4.6 g的凡纳滨对虾(Litopenaeus vannamei)的96 h LC50为0.0714 μg/L;氰戊菊酯对日本囊对虾的96 h LC50为0.310 μg/L (Burredge et al, 2000; 冷春梅等, 2009; 陈宇锋, 2016)。氯氰菊酯对成体龙虾的毒性与本研究中溴氰菊酯对日本囊对虾的毒性(96 h LC50为0.143 μg/L)相近。在淡水甲壳类动物中,溴氰菊酯对日本沼虾(Macrobrachium nipponensis)的24 h LC50为0.14 µg/L;对克氏原螯虾的24 h LC50和96 h LC50分别为0.156 μg/L和0.0562 μg/L;对河蟹成体的96 h LC50为0.65 μg/L;氯氰菊酯对中华米虾(Caridina denticulata sinensis) 96 h LC50为0.077 μg/L (龚瑞忠等, 1996, 魏华等, 2010; 王宏伟等, 2009; 耿雪冰等, 2009)。由此表明,生活在海水或淡水环境中不同种甲壳类动物对菊酯类农药的敏感性存在较大的差异,总体上,淡水虾类对菊酯类农药比海水虾类更为敏感。菊酯类农药对双壳类动物的毒性效应研究较少,据报道,氯氰菊酯和氰戊菊酯对栉孔扇贝的96 h LC50分别为0.124 mg/L和1.17 mg/L;氰戊菊酯对紫贻贝(Mytilus edulis)和栉孔扇贝的96 h LC50分别为1.28 mg/L和0.30 mg/L (谭晓珍等, 2005; 陈碧鹃等, 1997)。本研究得出的溴氰菊酯对文蛤的毒性(96 h LC50为0.27 mg/L)与陈碧鹃等(1997)报道的氰戊菊酯对栉孔扇贝的毒性相近,而菲律宾蛤仔对菊酯类农药与栉孔扇贝、紫贻贝和文蛤相比更敏感。上述研究结果显示,氰戊菊酯对栉孔扇贝的毒性差异较大,可能与实验生物的规格、暂养时间及实验水温、pH、DO等理化因子的影响有关。农药对鱼类的96 h LC50 < 1.0 mg/L,毒性级别为极高毒(周凤霞, 2006),故溴氰菊酯对文蛤和菲律宾蛤仔的毒性总体为鱼类的极高毒级别,对日本囊对虾和远海梭子蟹的毒性远高于鱼类的极高毒级别。
3.3 甲壳类和双壳类动物对溴氰菊酯的积累效应海洋生物对有机农药的积累是一个缓慢的过程。由于溴氰菊酯在水体中较易挥发和降解,实验过程中其浓度处于持续衰减状态。用实验水体中溴氰菊酯的初始浓度与24 h后换水时浓度的平均值作受试动物吸收积累过程中实验水体中的浓度计算积累系数,较能真实地反映受试动物对溴氰菊酯的积累能力。本研究中,由于远海梭子蟹、日本囊对虾对溴氰菊酯极为敏感,加入其实验水体中的溴氰菊酯浓度均低于方法检出限(1.0 μg/L),实验水体中溴氰菊酯均未检出,故未能计算其对溴氰菊酯的积累系数,须侍水体中溴氰菊酯检测方法改进后,方能进行远海梭子蟹、日本囊对虾对溴氰菊酯的积累研究。文蛤、菲律宾蛤仔在溴氰菊酯平均浓度分别为0.86-0.05 mg/L和0.37-0.03 mg/L的水体中暴露24-96 h时,其对溴氰菊酯的积累率与暴露时间成正相关,与暴露浓度成负相关。这可能是在高浓度溴氰菊酯水体中双壳类动物急性中毒后活力骤降,双壳紧闭,基本停止呼吸和摄食,短时间内发生大量死亡,不利于其对水体中溴氰菊酯的吸收与积累,从而造成其体内溴氰菊酯的积累率较低;而在低浓度溴氰菊酯水体中双壳类动物逐渐适应,尚能进行呼吸和摄食活动,将水体中溴氰菊酯不断吸收、富集于体内,从而导致其体内溴氰菊酯的积累率较高,且受试动物在实验水体中暴露存活时间越长,对水体中溴氰菊酯的吸收和积累越多,其体内溴氰菊酯的积累率就越高。
水生生物对水体中菊酯类农药的积累研究较少,李娟英等(2015)研究表明,菲律宾蛤仔对沉积物间隙水中浓度为0.023-0.255 μg/L的4种菊酯类农药积累28 d后的积累系数为27.8-301。奥利亚罗非鱼(Oreochromis aurea)对水体中浓度为2.0-10.0 μg/L的溴氰菊酯的积累15 d后,在其肌肉和肝脏中积累含量分别为3.70- 6.57 μg/kg和3.70-7.12 μg/kg,最大积累系数分别为1.85和2.20,15-20 d达到累积-释放的动态平衡(吴伟等, 2006)。将白鲢(Hypophthal-michthys molitrix)暴露在3 μg/L的甲氰菊酯溶液中2 h后,鱼体肌肉内甲氰菊酯含量达0.020 μg/kg,随后含量直线上升,在暴露8 h后达最高值0.0412 μg/kg,生物积累系数为411.3(王朝晖等, 2000)。由此表明,不同种类的水生生物对水体中菊酯类农药的积累能力存在明显的种间差异。
已有研究表明,含有α-氰基的拟除虫菊酯类农药毒性较大,有卤原子取代则毒性更高,且毒性随卤原子分子量的增加而增加(张征等, 2006; Ensibi et al, 2014),对甲壳类和双壳类动物的毒性为极高毒或高毒。建议在养殖区附近应慎用含有α-氰基的溴氰菊酯、氯氰菊酯等拟除虫菊酯类农药,尽量使用甲醚菊酯、胺菊酯、二氯戊菊酯等不含α-氰基等对水生动物毒性较低的拟除虫菊酯类农药。
| Burredge LE, Haya K, Waddy SL, et al. The lethality of anti-sea lice formulations Salmosan (Azamethiphos) and Escis (Cypermethrin) to stage Ⅳ and adult lobsters (Homarus americanus) during repeated short-term exposures. Aquaculture, 2000, 182(1-2): 27-35 DOI:10.1016/S0044-8486(99)00251-3 | |
| Chen BJ, Chen MS, Wu ZK. Study on the toxicity of fenvalerate and tetramethrin to ocean algae and shellfish. Journal of Fishery Sciences of China, 1997, 4(2): 51-55 [陈碧鹃, 陈民山, 吴彰宽. 氰戊菊酯、胺菊酯对海洋藻类、贝类的毒性研究. 中国水产科学, 1997, 4(2): 51-55] | |
| Chen YF. Acute toxicity of fenvalerate and ethofenprox on Penaeus japonicus. Journal of Fisheries Research, 2016, 38(2): 126-131 [陈宇锋. 氰戊菊酯、醚菊酯对日本囊对虾的急性毒性. 渔业研究, 2016, 38(2): 126-131] | |
| Ding ZF, Shi YB, Li XX, et al. Toxic effects of fenvalerate on Odontobutis potamophila juveniles. Journal of Ecology and Rural Environment, 2013, 29(3): 357-363 [丁正峰, 史阳白, 李潇轩, 等. 氰戊菊酯对河川沙塘鳢幼鱼的毒性效应. 生态与农村环境学报, 2013, 29(3): 357-363] | |
| Ensibi C, Hernández-Moreno D, Santiyán MPM, et al. Effects of carbofuran and deltamethrin on acetylcholinesterase activity in brain and muscle of the common carp. Environmental Toxicology, 2014, 29(4): 386-393 DOI:10.1002/tox.v29.4 | |
| General Administration Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T5750.9-2006 Standard examination methods for drinking water—Pesticides parameters. Beijing: China Standard Press, 2006. [中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 生活饮用水标准检验方法农药指标(GB/T5750-2006). 北京: 中国标准出版社, 2006.] | |
| Geng XB, Shen MF, Wu GH, et al. Acute toxicity effects of Chinese mitten crabs on deltamethrin. Journal of Aquaculture, 2009, 30(10): 48-50 DOI:10.3969/j.issn.1004-2091.2009.10.012 [耿雪冰, 沈美芳, 吴光红, 等. 溴氰菊酯对河蟹的急性毒性研究. 水产养殖, 2009, 30(10): 48-50] | |
| Gong RZ, Cai DJ, Zhong QY. Study on toxicity and safety evaluation of deltamethrin on fish and shrimp. Rural Eco-Environment, 1996, 12(1): 29-32, 50 [龚瑞忠, 蔡道基, 钟巧云. 溴氰菊酯对鱼虾的毒性与安全评价研究. 农村生态环境, 1996, 12(1): 29-32, 50] | |
| Haverinen J, Vornanen M. Deltamethrin is toxic to the fish (crucian carp, Carassius carassius) heart. Pesticide Biochemistry and Physiology, 2016, 129: 36-42 DOI:10.1016/j.pestbp.2015.10.014 | |
| Khalili M, Khaleghi SR, Hedayati A. Acute toxicity test of two pesticides diazinon and deltamethrin, on swordtail fish (Xiphophorus helleri). Global Veterinaria, 2012, 8(5): 541-545 | |
| Leng CM, Chen JZ, Gong JX, et al. Deltamethrin degradation in water environment and its toxicity to three aquatic animals. Environmental Protection Science, 2009, 35(4): 43-45, 53 [冷春梅, 陈家长, 巩俊霞, 等. 溴氰菊酯在水环境中的降解及对三种水生动物的毒性. 环境保护科学, 2009, 35(4): 43-45, 53] | |
| Li JY, Li ZH, Cui Y, et al. Biomimetic research on bio-availability and bioaccumulation of sediment-associated pyrethroids using solid-phase microextraction. Asian Journal of Ecotoxicology, 2015, 10(3): 144-152 [李娟英, 李振华, 崔昱, 等. 固相微萃取在评价沉积物中菊酯类农药生物有效性及生物累积中的仿生研究. 生态毒理学报, 2015, 10(3): 144-152] | |
| Mei LY, Zhao ZJ, Yin X, et al. Simulating the environment behavior and fate of synthetic Pyrethroids. Journal of Agro-Environment Science, 2007, 26(6): 2316-2322 [梅立永, 赵智杰, 尹璇, 等. 拟除虫菊酯类农药环境行为与归趋模拟. 农业环境科学学报, 2007, 26(6): 2316-2322] | |
| National Pesticide Standardization Technical Committees. Pesticide standard assembly. Beijing: China Standard Press, 2009. [全国农药标准化技术委员会. 农药标准汇编. 北京: 中国标准出版社, 2009.] | |
| Rukiye V, Figen UE, Hilal P, et al. Investigation of acute toxicity of deltamethrin on guppies (Poecilia reticulata). Ecotoxi-cology and Environmental Safety, 2003, 55(1): 82-85 DOI:10.1016/S0147-6513(02)00096-9 | |
| Tan XZ, Wu Y, Li T, et al. Acute toxicity of cypermethrin and fenvalerate to scallop (Chlamys farreri). Journal of Dalian Fisheries University, 2005, 20(3): 203-207 [谭晓珍, 吴垠, 李韬, 等. 氯氰菊酯和氰戊菊酯对栉孔扇贝的急性毒性试验研究. 大连水产学院学报, 2005, 20(3): 203-207] | |
| Thomas CR, Hose GC, Warne MS, et al. Effects of river water and salinity on the toxicity of deltamethrin to freshwater shrimp, cladoceran, and fish. Archives of Environmental Contamination and Toxicology, 2008, 55(4): 610-618 DOI:10.1007/s00244-008-9147-0 | |
| Wang HW, Cai DB, Liang AM, et al. Effects of dietary Mn supplementation on superoxide dismutase (SOD) activity in prawn Caridina denticulata sinensis exposed to cypermethrin. Fisheries Sciences, 2009, 28(3): 139-141 [王宏伟, 蔡端波, 梁爱民, 等. 氯氰菊酯胁迫下锰对中华米虾SOD活性的影响. 水产科学, 2009, 28(3): 139-141] | |
| Wang RL, Chen YM, Xu J, et al. Effects of cypermethrin on superoxide dismutase (SOD) activities in liver and gill tissues of Tanichthys albonubes. Ecology and Environment, 2007, 16(3): 790-793 [王瑞龙, 陈玉明, 徐军, 等. 氯氰菊酯对唐鱼肝和鳃组织超氧化物歧化酶(SOD)活性的影响. 生态环境, 2007, 16(3): 790-793] | |
| Wang ZH, Yin YW, Lin XT, et al. A review of the research on the ecological toxicology of the pesticides in water ecosystem. Journal of Jinan University (Natural Science), 2000, 21(3): 123-127 [王朝晖, 尹伊伟, 林小涛, 等. 拟除虫菊酷农药对水生态系统的生态毒理学研究综述. 暨南大学大学学报(自然科学版), 2000, 21(3): 123-127] | |
| Wei H, Wu N, Shen H, et al. Oxidative stress of deltamethrin to the liver of crayfish (Procambarus clarkii). Journal of Fisheries of China, 2010, 34(5): 733-739 [魏华, 吴楠, 沈竑, 等. 溴氰菊酯对克氏原螯虾的氧化胁迫效应. 水产学报, 2010, 34(5): 733-739] | |
| Wu N, Wei H, Shen H, et al. The toxic research of deltamethrin on the muscle tissue of the red swamp crayfish (Procambarus clarkia). Journal of Fisheries of China, 2015, 39(9): 1412-1421 [吴楠, 魏华, 沈竑, 等. 溴氰菊酯对克氏原螯虾肌肉组织的毒性研究. 水产学报, 2015, 39(9): 1412-1421] | |
| Wu QS, Lu WP. Experiment on using fenvalierate to clean prawn culture ponds. Marine Sciences, 1993, 11061106(1): 66-68 [吴琴瑟, 卢伟波. 杀灭菊酯在对虾养殖清池中的使用. 海洋科学, 1993, 11061106(1): 66-68] | |
| Wu W, Chen JZ, Ma XY, et al. Accumulation of deltamethrin in the tissue of tilapia and the influence on activity of glutathione-S-transferase. Journal of Agro-Environmental Science, 2006, 25(5): 1176-1181 [吴伟, 陈家长, 马晓燕, 等. 溴氰菊酯在罗非鱼组织中的累积及对谷胱甘肽-S-转移酶的影响. 农业环境科学学报, 2006, 25(5): 1176-1181] | |
| Xia XH, Zhang LX, Shi KP, et al. Acute toxicity and physiological toxicity of lambda-cyhalothrin on Oriental weatherfish. Journal of Agricultural Sciences of Jiangsu, 2013, 41(6): 270-272 [夏晓华, 张林霞, 司松波, 等. 高效氯氟氰菊酯对泥鳅的急性毒性及生理毒性. 江苏农业科学, 2013, 41(6): 270-272] | |
| Xu YB, Zheng HD, Chen YF, et al. Preliminary exploration on the effects of deltamethrin on enzyme activity and organs injury in Ruditapes philippinarum. Asian Journal of Ecotoxicology, 2015, 10(6): 206-212 [许贻斌, 郑惠东, 陈宇锋, 等. 溴氰菊酯对菲律宾蛤仔体内酶活性和组织损伤的初步探索. 生态毒理学报, 2015, 10(6): 206-212] | |
| Zhang Z, Li J, Liang W, et al. Toxic effects of pyrethroid pesticide on water ecosystem. Resources and Environment in the Yangtze Basin, 2006, 15(1): 125-129 [张征, 李今, 梁威, 等. 拟除虫菊酯杀虫剂对水生态系统的毒性作用. 长江流域资源与环境, 2006, 15(1): 125-129] | |
| Zhao LN, Lai ZN, Zhang WZ, et al. Residual levels and health risk assessment of pyrethroid pesticides in aquatic products of the Pearl River delta. Asian Journal of Ecotoxicology, 2014, 9(3): 437-444 [赵李娜, 赖子尼, 张威振, 等. 珠江河网水产品中菊酯类农药残留调查及健康风险评价. 生态毒理学报, 2014, 9(3): 437-444] | |
| Zheng WH, Zhao JZ, Ma DY, et al. Development of deltamethrin toxicity and mutagenicity. Journal of Beijing Agricultural College, 2004, 19(1): 77-80 [郑伟华, 赵建庄, 马德英, 等. 溴氰菊酯的毒性和致突变性的研究进展. 北京农学院学报, 2004, 19(1): 77-80] | |
| Zhou FX. Biological monitoring. Beijing: Chemical Industry Press, 2006: 99-112. [周凤霞. 生物监测. 北京: 化学工业出版社, 2006: 99-112.] |



