2. 中国海洋大学 海水养殖教育部重点实验室 青岛 266003;
3. 山东省华春渔业有限公司 东营 257200
2. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003;
3. Shandong Huachun Fisheries Co., LTD, Dongying 257200
蛸类幼体捕捉猎物行为是一种可辨识的行为(Boletzky, 1987; Villanueva et al, 1997; Hernandez-Garcia et al, 2000)。蛸类幼体摄食行为的发生会受到环境条件影响,因此,本研究通过观察不同条件下的蛸类幼体摄食行为发生频率,以期获得适宜的摄食环境条件。蛸类幼体在孵化之后,初期能够利用卵黄储备度过初始的数小时或数天,之后依靠捕食外源饵料进行生长(Boletzky, 1975、1989)。外卵黄囊体积的减少或者消失被认为是一种幼体健康和活力的象征,表明这些储备被正常吸收。相反,一个大的外卵黄囊表明过早孵化(Boletzky et al, 1983、1987),而且缺失或遗弃外卵黄囊会降低幼体的成活率(Okubo, 1979)。蛸类幼体对蛋白质和不饱和脂肪酸有很高需求(Giménez et al, 2002; Iglesias et al, 2004; Aguila et al, 2007; Domingues et al, 2007; Cerezo-Valverde et al, 2008),同时依赖具有丰富营养组成的活体饵料(Navarro et al, 2000、2003; Iglesias et al, 2007; Seixas et al, 2010; Farías et al, 2011)。蛸类幼体在第1个月表现出了很高的死亡率,其原因可能是缺乏一种合适的饵料来满足其营养需求,因此,关于蛸类幼体的饵料研究引起国际上广泛关注。
目前,关于短蛸(Amphioctopus fangsiao, d’Orbigny, 1839–1841)幼体饵料方面的研究少有报道,本研究采用不同饵料进行生长实验,以期为短蛸幼体养殖过程中的饵料选取提供参考和数据支持。
1 材料与方法 1.1 材料于2012年在山东省海洋资源与环境研究院东营养殖实验基地进行短蛸摄食观察实验,于2016年在华春渔业有限公司进行短蛸生长存活实验。实验用短蛸幼体孵化于6月初,选取体质强、健康的同一批个体。摄食行为观察实验容器为普通白色塑料桶,生长实验容器为75 cm×40 cm×25 cm白色塑料箱,实验用水为经砂滤池过滤的天然海水,自然水温在25–26℃之间,盐度在26–28之间。饵料准备包括卤虫(Artemia)无节幼体、中国毛虾(Acetes chinensis)虾苗、桡足类、四角蛤蜊(Mactra veneriformis)贝肉。卤虫无节幼体由卤虫卵孵化,并经过营养强化。桡足类(哲水蚤目)和虾苗(约1 cm)由天然池塘通过不同孔径的滤网分离获得。贝肉为四角蛤蜊的足和闭壳肌,去除内脏团。
1.2 幼体摄食行为观察在桶内放入约30 cm高的水体,将15只初孵幼体放入其中后,1 min为幼体适应期,之后的9 min记录活跃幼体和摄食行为发生次数。活跃幼体的判定为在水体中游动而非贴于桶壁之上的个体。摄食行为发生的判定为幼体突然猛的向前游动1次,作为发生1次摄食行为。实验由2人观察计数,1人计时。
个体平均摄食次数=总摄食行为发生次数/活跃幼体数
1.2.1 不同密度卤虫无节幼体对初孵幼体摄食行为的影响将15只饥饿的1–2 d龄幼体,放入3组密度分别为0.1、0.5、1个/ml的卤虫无节幼体饵料中,观察记录10 min中内其活跃个体和摄食行为。观察时间默认晚上,实验光线为室内光(30 Lux)。
1.2.2 饵料对初孵幼体的摄食行为的影响根据饵料种类将实验分为3组:卤虫无节幼体0.1个/ml、桡足类0.1个/ml、虾苗10只/L,每组分别放入15只饥饿的1–2 d龄幼体,观察记录10 min中内其活跃个体和摄食行为。观察时间默认晚上,实验光线为室内光(30 Lux)。
1.2.3 不同时间段初孵幼体的摄食行为分别在08:00、12:00、20:00,将15只饥饿的1–2 d龄幼体放入0.1个/ml的卤虫无节幼体饵料中,观察记录10 min中内其活跃个体和摄食行为。
1.2.4 不同光线条件下初孵幼体的摄食行为分别在自然光直射(600 Lux)、室内光(30 Lux)和黑暗(0.02 Lux)条件下,将15只饥饿的2–3 d龄幼体,放入0.1个/ml的卤虫无节幼体饵料中,观察记录10 min中内幼体活跃个体和摄食行为。
1.2.5 不同日龄幼体的摄食行为根据日龄将饥饿的幼体分为5组(0–1、1–2、2–3、3–4、4–5 d),每组15只,将其放入密度为0.1个/ml的卤虫无节幼体饵料中,观察记录10 min内幼体活跃个体和摄食行为。观察时间默认晚上,实验光线为室内光(30 Lux)。
1.3 不同饵料下初孵和附底幼体的生长、存活根据幼体的生长过程,将幼体分为初孵幼体(0.03 g)和附底幼体(0.1 g) 2个阶段。在初孵幼体阶段中,根据饵料使用不同分为4组:卤虫无节幼体组、桡足类组、虾苗组、混合组(卤虫无节幼体+桡足类+虾苗),养殖9 d,观察其成活率和生长情况。在附底幼体阶段中,单一饵料已经不能够满足,根据饵料的大小区别,采取4种饵料组合:卤虫无节幼体+桡足类组、桡足类+虾苗组、虾苗+贝肉组、混合组,养殖10 d,观察其成活率和生长情况,计算反映短蛸幼体生长情况的2个指标:增长率(Growth rate, GR)和瞬时增长率(Instantaneous growth rate, IGR)(姜作发等; 2007),公式如下:
| $ {\rm{GR}} = \left({{W_2} - {W_1}} \right)/{W_1} \times 100\% ; $ |
| $ {\rm{IGR}} = \left({\ln {W_2} - \ln {W_1}} \right)/t \times 100\% ; $ |
W1、W2分别代表初始体重和结束体重,t代表实验天数。
2 结果 2.1 幼体摄食行为 2.1.1 不同密度卤虫无节幼体对初孵幼体摄食行为的影响从0.1个/ml上升至1个/ml卤虫无节幼体密度过程中,短蛸幼体平均活跃个数、摄食行为发生次数、个体平均摄食次数均表现减少(图 1)。
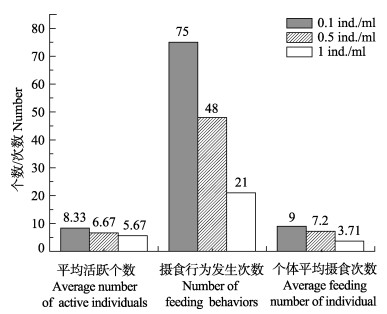
|
图 1 不同密度卤虫无节幼体下初孵幼体的摄食行为 Figure 1 The feeding behavior of A. fangsiao new hatchlings fed on Artemia nauplii at different densities |
虾苗能够极大地引起幼体的摄食兴趣,幼体表现出明显的攻击性,摄食行为发生次数达到131次,个体平均摄食次数达到20.68次(图 2)。幼体对桡足类没有很强的摄食欲望,各项指标均为最低。卤虫无节幼体摄食行为发生次数适中,活跃幼体个数最多。
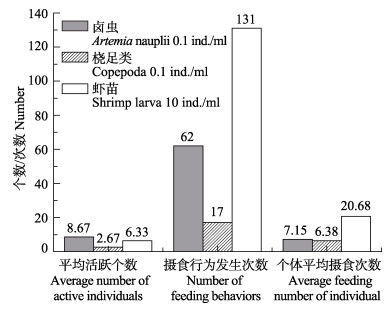
|
图 2 初孵幼体对不同饵料的摄食行为 Figure 2 The feeding behavior of A. fangsiao new hatchlings fed on different diets |
如图 3所示,晚上是初孵幼体的摄食活跃时间段,表现为高平均活跃个数(8.67)和高摄食行为发生次数(75)。而上午和下午,初孵幼体摄食并不活跃,摄食行为较少。
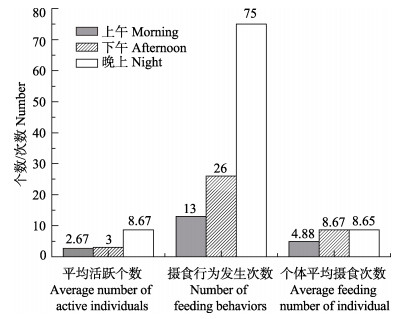
|
图 3 不同时间段初孵幼体的摄食行为 Figure 3 The feeding behavior of A. fangsiao new hatchlings at different time points |
室内光条件下,摄食行为发生次数出现最多,为76次;而黑暗条件下,幼体更加活跃,8.33只平均活跃幼体数;自然光直射条件下,幼体不活跃,摄食行为发生也较少(图 4)。
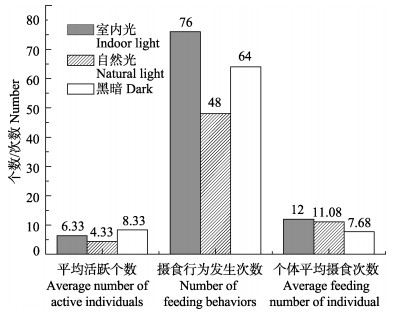
|
图 4 不同光线条件下初孵幼体的摄食行为 Figure 4 The feeding behavior of A. fangsiao new hatchlings under different light conditions |
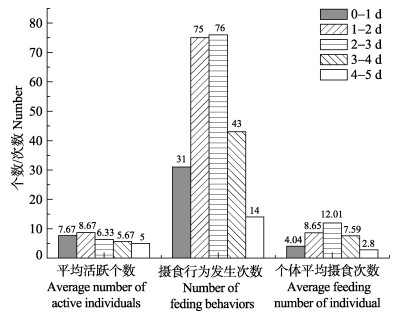
1–2 d龄幼体和2–3 d龄幼体的摄食行为较为强烈,表现为高的摄食行为发生次数(75和76)和个体平均摄食次数(8.65和12.01);0–1 d龄幼体,尽管活跃个数较高,但摄食行为较少;3–4 d龄和4–5 d龄摄食行为逐渐衰退,尤其4–5 d的个体平均摄食次数仅为2.8次(图 5)。
|
图 5 不同日龄初孵幼体的摄食行为 Figure 5 The feeding behavior of A. fangsiao new hatchlings at different ages |
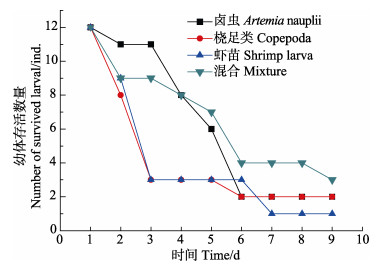
总体上短蛸初孵幼体的成活率低,其中,采用混合饵料的存活率相对最高,为25%;其次,卤虫无节幼体、桡足类作为饵料,存活率均为16.67%;虾苗条件下存活率最低,仅为8.33%(图 6)。
|
图 6 短蛸初孵幼体(0.03 g)摄食不同饵料的存活情况 Figure 6 The survival rate of A. fangsiao new hatchlings (0.03 g) fed on different diets |
利用卤虫无节幼体、虾苗和混合饵料均能够获得较高的增长率和瞬时增长率,分别为433%以上和20%左右;而桡足类的生长效果不佳(表 1)。
|
|
表 1 不同饵料下短蛸初孵幼体(0.03 g)的生长情况 Table 1 The growth of A. fangsiao new hatchlings (0.03 g) fed on different diets |
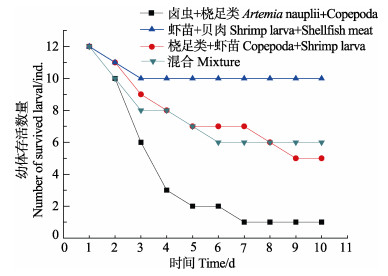
虾苗+贝肉饵料组合的存活率最高,为83.3%;混合饵料组的成活率达到50%;桡足类+虾苗组的成活率约40%;卤虫无节幼体和桡足类已不适于附底幼体,仅存活1只,存活率为8.3%(图 7)。
|
图 7 短蛸附底幼体(0.1 g)摄食不同饵料的存活情况 Figure 7 The survival rate of A. fangsiao benthic hatchlings (0.1 g) fed on different diets |
桡足类+虾苗、虾苗+贝肉、混合饵料均能够达到约13%的瞬时增长率,而卤虫无节幼体+桡足类的增长率仅为8%(表 2)。
|
|
表 2 不同饵料下短蛸附底幼体(0.1 g)的生长情况 Table 2 The growth of A. fangsiao benthic hatchlings (0.1 g) fed on different diets |
蛸类的摄食行为包括三个阶段,第一阶段为“注意阶段”:幼体减慢速度靠近猎物,采取一系列不同的迂回移动包括前进、后退和侧游。第二阶段为“定位阶段”:胴部末端径直朝向猎物,将腕聚集起来指向前端呈瞄准姿势,体轴与猎物直接对齐。此时,幼体几乎保持静止,有时在猎物旁利用活动漏斗喷出的水流旋转调整自己的位置,从而获得最佳攻击位置。第三阶段为“攻击阶段”:幼体通过漏斗一次(或者两次)强力喷出的水流急速前游,将猎物用腕全部包裹。相较于0.5个/ml和1个/ml卤虫无节幼体密度,短蛸摄食行为在0.1个/ml发生次数较多,这与真蛸(Octopus vulgaris)相似(Iglesias et al, 2006),其原因可能是较低密度能够使幼体更好地锁定目标,实施更加有效的捕食行为。关于饵料密度,不同研究采用不同密度,没有明确标准,Iglesias等(2004)使用卤虫成体(1–4 mm)的密度为0.05–0.1个/ml;Moxica等(2002)使用0.1个/ml;Villanueva等(2002)采用密度为0.2、2、4、10个/ml卤虫无节幼体进行研究,发现最高生长率出现在高密度;Carrasco等(2003)使用卤虫密度为0.2–0.8个/ml;Okumura等(2005)使用卤虫密度为2.0个/ml,关于饵料的密度高低对生长和存活的影响仍需研究。饵料高密度并不一定能引起较多的摄食行为,在实际养殖过程中,为减少时间和经济成本,可以适当减少饵料投喂密度,保证其被幼体有效摄食。短蛸0–1 d幼体可能仍然依靠卵黄营养,对外源饵料在生理上未做好准备。Yamauchi等(1964)记录短蛸孵化幼体的卵黄10 h内全部吸收,24 h前后主动捕食并不积极,此时用镊子夹取2 mm饵料碎片,幼体用腕抱持,此举说明短蛸已经开始摄食外源营养。1–2 d和2–3 d由于卵黄已基本吸收完成,机体处于饥饿状态,所以表现出强烈的摄食需求,其他实验同样观察到发育良好、非早产的真蛸幼体在孵化24 h之后便开始摄食(Villanueva et al, 2002; Morote et al, 2005; Iglesias et al, 2006)。3–4 d之后,可能由于饥饿时间过长,身体虚弱,达到不可逆点,摄食行为发生消极。因此,在实际养殖过程中,从孵化第2天开始要对短蛸幼体的饵料条件加以重视。
夜间是短蛸初孵幼体摄食行为发生的主要时间段,这可能与其喜安静和阴暗的特点相关。因此,在养殖过程中,在傍晚要投喂足够量的饵料,防止由于夜间摄食量多而导致饵料缺乏,同时,白天可适量减少饵料投喂量,以节省饵料。短蛸初孵幼体在黑暗条件下活跃,而在室内微光条件下,摄食行为发生较多。黑暗条件下活跃可能与其自身习性相关,短蛸喜在阴暗环境下生存,另一方面,摄食行为发生可能有一个视觉阈,超过一定光线照度后,幼体才进行大量摄食。上午、下午摄食行为少,说明强光照对短蛸的摄食有直接抑制作用。真蛸初孵幼体相关实验显示,微光条件下的摄食率比黑暗下提高3倍(Villenueva et al, 2008)。Márquez等(2007)在研究真蛸幼体摄食与光照关系时同样发现,黑暗条件下的摄食个体较少,表明光照(视觉)在捕食行为中的重要性。然而,这些作者同时认为,光照对摄食并非必要因素,因为黑暗条件下幼体的摄食率与饵料密度呈正相关。因此,在养殖过程中,应保持较低的光照条件,避免阳光直射,傍晚可能是幼体一天中摄食的高峰期,需保证饵料充足。虾苗能够极大地引起短蛸的摄食兴趣。口的直径限制摄食饵料的大小,初孵蛸类相较于大部分肉食性幼鱼,能够利用发育良好的腕和吸盘捕获与其相同大小的猎物。短蛸在幼体阶段有极强的攻击性,喜欢攻击身体大小相似的物体,甚至水体中的相似悬浮物都会成为它进攻的目标(张学舒, 2002)。虾苗体长1 cm,与短蛸幼体初孵幼体大小类似,符合其捕食选择。但作者在实验中同样发现,虾苗游泳速度快于短蛸幼体,短蛸幼体不易捕捉成功,造成摄食效率低。因此,初孵幼体期间,应尽可能寻找一种体型与短蛸相似,而游泳能力却低于短蛸的活体饵料。
3.2 初孵幼体和附底幼体的饵料选择采用混合饵料投喂初孵幼体,成活率相对较高(25%),生长率也能达到20%。剩余3种单一饵料作比较,卤虫无节幼体成活率和增长率均为最高,接近混合饵料,可以确定其在短蛸初孵幼体生长过程中的重要性。虾苗成活率较低原因可能是其短蛸幼体难以捕食所导致的饥饿造成。使用桡足类,幼体生长率较低,可能桡足类在营养上不能满足初孵幼体。因此,初孵幼体培育过程中,尽可能混合投喂,卤虫无节幼体是关键饵料。目前,卤虫是水产养殖最广泛应用的开口饵料之一,在蛸类养殖过程中也能够表现出较好结果,但在低温和对n-3不饱和脂肪酸需求较高时,不宜使用(Uriarte et al, 2011)。
幼体附底以后,随着饵料体积的增大,幼体成活率增加。凡是有虾苗的饵料组合,均获得较高的存活率和生长率,没有虾苗的“卤虫无节幼体+桡足类”的组合在存活率和生长率上都不理想,表明短蛸饵料结构开始转变,虾苗是此时附底幼体的一种优良饵料。在虾苗+贝肉的饵料中,成活率超过80%,表明贝肉有助于附底幼体的成活。短蛸的饵料大小应随着幼体的生长进行调整(Kitajima et al, 1985),因此,当幼体开始附底时,要及时进行饵料转换,虾苗和贝肉是附底幼体的重要饵料。
| Aguila J, Cuzon G, Pascual C, et al. The effects of fish hydrolysate (CPSP) level on Octopus maya (Voss and Solis) diet: Digestive enzyme activity, blood metabolites, and energy balance. Aquaculture, 2007, 273(4): 641-655 DOI:10.1016/j.aquaculture.2007.07.010 | |
| Boletzky SV, Boyle PR. Embryonic phase. Cephalopod life cycles, Vol Ⅱ, London: Academic Press, 1987: 5-31. | |
| Boletzky SV, Hanlon RT. A review of the laboratory maintenance, rearing and culture of cephalopod molluscs. Memoirs of the National Museum Victoria, 1983, 44: 147-187 DOI:10.24199/j.mmv.1983.44.11 | |
| Boletzky SV. A contribution to the study of yolk absorption in the Cephalopoda. Zeitschrift für Morphologie der Tiere, 1975, 80(3): 229-246 | |
| Boletzky SV. Juvenile behaviour. In Cephalopod life cycles. Volume Ⅱ. Comparative Reviews, Boyle PR (ed.). London: Academic Press, 1987. | |
| Boletzky SV. Recent studies on spawning, embryonic development, and hatching in the Cephalopoda. Advanced Marine Biology, 1989, 25(6): 85-115 | |
| Carrasco JF, Rodríguez C, Rodríguez M. Cultivo intensivo de paralarvas de pulpo (Octopus vulgaris, Cuvier 1797) utilizando como base de la alimentación zoeas vivas de crustáceos. Libro de Resúmenes del Ⅸ Congreso National de Acuicultura, Cádiz. Consejería de Agricultura y Pesca. Junta de Andalucía, Cádiz, Spain, 2003, 255 | |
| Cerezo-Valverde J, Hernández MD, Aguado-Giménez F, et al. Growth, feed efficiency and condition of common octopus (Octopus vulgaris) fed on two formulated moist diets. Aquaculture, 2008, 275(1-4): 266-273 DOI:10.1016/j.aquaculture.2008.01.012 | |
| Domingues PM, López N, Mu oz JA, et al. Effects of a dry pelleted diet on growth and survival of the Yucatan octopus, Octopus maya. Aquaculture Nutrition, 2007, 13(13): 273-280 | |
| Farías A, Navarro JC, Cerna V, et al. Effect of broodstock diet on the fecundity and biochemical composition of eggs of the Patagonian red octopus (Enteroctopus megalocvathus Gould 1852). Ciencias Marinas, 2001, 37(1): 11-21 | |
| Giménez FA, García BG. Growth and food intake models in Octopus vulgaris Cuvier (1797): Influence of body weight, temperature, sex and diet. Aquaculture International, 2002, 10(5): 361-377 DOI:10.1023/A:1023335024053 | |
| Hernández-García V, Martín AY, Castro JJ. Evidence of external digestion of crustaceans in Octopus vulgaris paralarvae. Journal of the Marine Biological Association of the UK, 2000, 80(3): 559-560 DOI:10.1017/S0025315400002320 | |
| Iglesias J, Fuentes L, Sánchez J, et al. First feeding of Octopus vulgaris Cuvier, 1797 paralarvae using Artemia: Effect of prey size, prey density and feeding frequency. Aquaculture, 2006, 261(2): 817-822 DOI:10.1016/j.aquaculture.2006.08.002 | |
| Iglesias J, Otero JJ, Moxica C, et al. The completed life cycle of the octopus (Octopus vulgaris, Cuvier) under culture conditions: Paralarval rearing using Artemia and zoeae, and first data on juvenile growth up to 8 months of age. Aquaculture International, 2004, 12(12): 481-487 | |
| Iglesias J, Sánchez FJ, Bersano J, et al. Rearing of Octopus vulgaris paralarvae: Present status, bottlenecks and trends. Aquaculture, 2007, 266(1-4): 1-15 DOI:10.1016/j.aquaculture.2007.02.019 | |
| Jiang ZF, Jia ZH, Bai QL, et al. Growth characters of cultured juvenile Oncorhynchus masou masou. Journal of Fishery Sciences of China, 2007, 14(1): 160-164 [姜作发, 贾锺贺, 白庆利, 等. 人工养殖山女鳟幼鱼的生长特性. 中国水产科学, 2007, 14(1): 160-164] | |
| Kitajima C, Hayashida G. On the laboratory culture of Amphioctopus fangsiao. Aquaculture, 1985, 32 | |
| Márquez L, Quintana D, Almansa E, et al. Effects of visual conditions and prey density on feeding kinetics of paralarvae of Octopus vulgaris from a laboratory spawning. Journal of Molluscan Studies, 2007, 73(2): 117-121 DOI:10.1093/mollus/eym003 | |
| Morote E, Rodríguez M, Mancera JM, et al. Las enzimas digestivas como indicadores del estado nutricional en paralarvas de pulpo Octopus vulgaris Cuvier, 1797. Boletin-Instituto Espanol de Oceanografia, 2005, 21(1-4): 177-186 | |
| Moxica C, Linares F, Otero JJ, et al. Cultivo intensivo de paralarvas de pulpo, Octopus vulgaris Cuvier, 1797, en tanques de 9 m. Boletin-Instituto Espanol de Oceanografia, 2002, 18: 31-36 | |
| Navarro JC, Villanueva R. Lipid and fatty acid composition of early stages of cephalopods: An approach to their lipid requirements. Aquaculture, 2000, 183(1-2): 161-177 DOI:10.1016/S0044-8486(99)00290-2 | |
| Navarro JC, Villanueva R. The fatty acid composition of Octopus vulgaris paralarvae reared with live and inert food: Deviation from their natural fatty acid profile. Aquaculture, 2003, 219(1-4): 613-631 DOI:10.1016/S0044-8486(02)00311-3 | |
| Okubo S. Spawning and rearing of hatchlings of the giant pacific octopus. Animals and Nature, 1979, 9: 2-6 | |
| Okumura S, Kurihara A, Iwamoto A, et al. Improved survival and growth in Octopus vulgaris paralarvae by feeding large type Artemia and Pacific sandeel, Ammodytes personatus: Improved survival and growth of common octopus paralarvae. Aquaculture, 2005, 244(1-4): 147-157 DOI:10.1016/j.aquaculture.2004.11.044 | |
| Seixas P, Rey-Méndez M, Valente LM, et al. High DHA content in Artemia is ineffective to improve Octopus vulgaris paralarvae rearing. Aquaculture, 2010, 300(1-4): 156-162 DOI:10.1016/j.aquaculture.2009.12.021 | |
| Uriarte I, Iglesias J, Domingues P, et al. Current status and bottle neck of octopod aquaculture: The case of American species. Journal of World Aquaculture Society, 2011, 42(6): 735-752 DOI:10.1111/jwas.2011.42.issue-6 | |
| Villanueva R, Koueta N, Riba J, et al. Growth and proteolytic activity of Octopus vulgaris paralarvae with different food rations during first feeding, using Artemia nauplii and compound diets. Aquaculture, 2002, 205(3-4): 269-286 DOI:10.1016/S0044-8486(01)00678-0 | |
| Villanueva R, Norman MD. Biology of the planktonic stages of benthic octopuses. Oceanography and Marine Biology: An Annual Review, 2008, 46: 105-202 | |
| Villanueva R, Nozais C, Boletzky SV. Swimming behaviour and food searching in planktonic Octopus vulgaris Cuvier from hatching to settlement. Journal of Experimental Marine Biology and Ecology, 1997, 208(1-2): 169-184 DOI:10.1016/S0022-0981(96)02670-6 | |
| Yamauchi K, Takeda F. Laboratory experiment on hatching of Amphioctopus fangsiao. Aquaculture, 1964, 12: 1-9 | |
| Zhang XS. The breeding action and embryogensis of Octopus ocellatus in the man-made environment. Journal of Zhejiang Ocean University (Natural Science), 2002, 21(3): 220-224 [张学舒. 人工环境中短蛸的繁殖行为和胚胎发生. 浙江海洋学院学报(自然科学版), 2002, 21(3): 220-224] |



