2. 上海海洋大学食品学院 上海 201306
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306
喹诺酮类(Quinolones, QNs)药物为广谱抑菌药,因其具有抗菌谱广、高效、低毒、价格低廉等特点,在畜牧、水产等养殖生产中使用广泛(杨守国等, 2010)。喹诺酮类抗菌药大量用于人类和动物医疗,还添加于饲料中以提高饲料利用率和促进动物生长(顾海东等, 2013)。喹诺酮类药物作为人工合成的抗菌药在水产养殖业中发挥着巨大的作用。抗生素的使用一方面极大地促进了水产养殖业的发展,另一方面也造成了渔业养殖水环境污染和水产品中药物残留问题(张瑞杰等, 2012)。研究表明,水产用抗生素少部分进入食物链、大部分进入环境中,仅有少量抗生素被鱼体吸收(聂湘平等, 2007; 徐英江等, 2010)。尽管很多抗生素的半衰期不长,但由于其被频繁地使用并进入环境,导致其形成“假持续”现象,进而对人体健康以及整个生态系统构成长期潜在危害(周启星等, 2007)。进入环境中的抗生素可能导致养殖环境中病菌产生耐药性,破坏水产养殖动物的微生态平衡,因此,水产养殖动物的病害防治工作愈发艰巨(胡文佳等, 2007)。目前,抗生素已经在各种环境中检出,包括废(污)水、地表水、地下水等(Watkinson et al, 2009)。针对环境中特别是水产养殖环境,抗生素的环境分析方法、生态效应的报道也逐渐增多。汪昆平等(2012)研究表明,固相萃取-高效/超高效液相色谱法是当今检测环境抗生素的有效手段,高效液相色谱法(HPLC)具有分离速度快、效率高、应用广泛的特点。抗生素残留在色谱分析时最常用的检测方式有紫外-可见检测器(UV-VIS)、荧光检测器(FLD)等(Ho et al, 2004; Göbel et al, 2004; Toussaint et al, 2005)。结合固相萃取(SPE)样品前处理的色谱、质谱分析技术最为普遍(杜鹃等, 2015)。目前的检测方法仍存在待测物种类别少、回收率低、检出限高等问题(Reverté et al, 2003; 孙广大等, 2009; 李佩佩等, 2015; 尹艳敏等, 2015)。关于养殖海水中喹诺酮类药物的检测方法并没有相应的标准规范,因此,对于水产养殖环境中抗菌药残留检测方法的研究具有重大意义。本研究结合固相萃取的液相色谱–质谱联用技术,建立了养殖海水中17种喹诺酮类药物的检测方法。针对前处理以及检测条件进行了不同条件的优化,结果显示,该方法操作简单、选择性强、灵敏度高、重现性好,可满足养殖海水中17种喹诺酮类药物的检测。
1 材料与方法 1.1 仪器和试剂TSQ QuantumTM Access液相色谱-质谱仪(Thermo Fisher Scientific, 美国);NEVAPTMll2型氮气吹扫仪(Organomation, 美国);Milli-Q型超纯水仪(Millipore, 美国);12管固相萃取装置(Supelco Co, 美国);6 ml/500 mg Oasis HLB固相萃取柱(Waters, 美国);棕色采集瓶。
依诺沙星(Enoxacin, ENX)、麻保沙星(Marbofloxacin, MAR)、氧氟沙星(Ofloxacin, OFL)、培氟沙星(Pefloxacin, PEF)、氟罗沙星(Fleroxacin, FLE)、诺氟沙星(Norfloxacin, NOF)、氘代诺氟沙星(D5-Norfloxacin, D5-NOF)、环丙沙星(Ciprofloxacin, CIP)、奥比沙星(Orbifloxacin, ORB)、氘代环丙沙星(D8-Ciprofloxacin, D8-CIP)、萘啶酸(Nalidixic Acid, NA)、氘代恩诺沙星(D5-Enrofloxacin, D5-ENR),以上标准品纯度均为99.0%;丹诺沙星(Danofloxacin, DAN, 纯度为99.9%)、恩诺沙星(Enrofloxacin, ENR, 纯度为99.8%)、沙拉沙星(Sarafloxacin, SAR, 纯度为93.5%)、司帕沙星(Sparfloxacin, SPX, 纯度为99.6%)、氟甲喹(Flumequine, FLU, 纯度为98.5%)、双氟沙星(Difloxacin, DIF, 纯度为98.0%)、噁喹酸(Oxolinic Acid, OA, 纯度为98.0%)、洛美沙星(Lomefloxacin, LOM, 纯度为97.6%),均购自德国Dr.Ehrenstorfer公司。
甲醇、乙腈(HPLC级, Merck公司);甲酸、乙酸铵(HPLC级,Fluka公司);超纯水(18.2 MΩ·cm);盐酸;氢氧化钠。
标准溶液配制:分别称取10.0 mg上述标准品,用甲醇溶解并定容至10 ml,个别不易溶解的标准品(如洛美沙星、依诺沙星等)需加入少量甲酸溶解后,甲醇稀释并定容至10 ml,配制成1.0 g/L的标准储备液,–20℃保存6个月。实验时,用甲醇稀释上述标准储备液,配制成不同浓度的混合标准使用液。
1.2 海水样品海水样品采自黄海灵山湾海区近岸的4个工厂化养殖场(A、B、C和D)。用棕色采集瓶分别从每个养殖场的进水口、出水口和不同的养殖池内进行海水采集。空白海水样品采自青岛黄海近岸海域,经质谱检测不含待测药物。样品当天带回实验室处理。
1.3 样品检测条件 1.3.1 色谱条件色谱柱为MGⅡ(2.1 mm×150 mm, 5 μm),柱温为35℃,流速为0.20 ml/min,进样量为10 μl,流动相A为甲酸水溶液(含0.1%甲酸)、B为乙腈,梯度洗脱程序见表 1。
|
|
表 1 流动相梯度洗脱程序 Table 1 Mobile phase gradient elution program |
电喷雾离子源(ESI),正离子模式,多反应监测(MRM),喷雾电压为4500 V,雾化气流量为12 L/min,辅助气流量为2 L/min,离子传输管温度为350℃,源内碰撞诱导解离电压为10 V,其他参数见表 2。
|
|
表 2 喹诺酮的质谱检测参数 Table 2 MS detection parameters of quinolones |
水样经0.45 mm水系滤膜过滤,去除水中悬浮颗粒物。加入适量的稀盐酸调节水样pH为3.00±0.05,准确量取500 ml调节pH之后的水样,准确加入1 mg/ml混合内标标准工作液50 ml,以约5 ml/min流速通过Oasis HLB固相萃取柱进行富集和净化。SPE小柱上样前,依次用6 ml甲醇和6 ml 5 mmol/L乙酸铵缓冲液(pH=3.00±0.05)进行活化平衡。水样过柱后用10 ml乙酸铵缓冲液淋洗,减压抽干后用6 ml甲醇分2次进行洗脱。在40℃下,将洗脱液用氮气吹至近干,用流动相(0.1%甲酸水溶液:乙腈=9: 1)定容至1 ml,过0.22 mm微孔滤膜,待测。
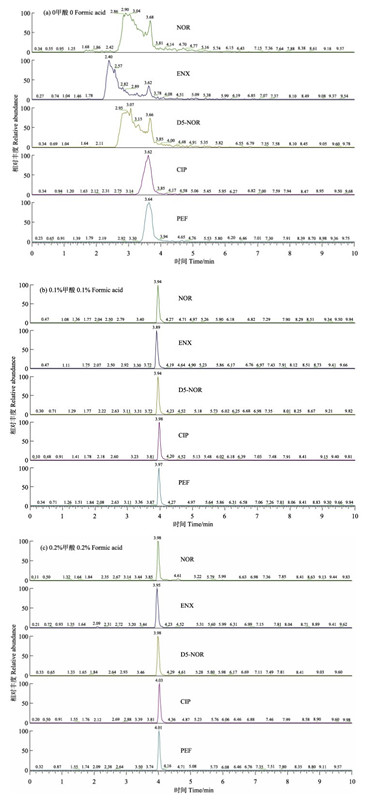
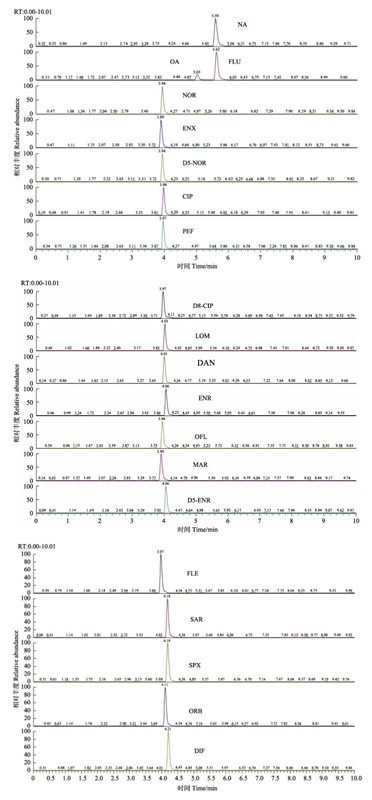
2 结果与讨论 2.1 色谱条件的优化利用液相色谱法或液相色谱-质谱法测定喹诺酮类药物时,常用的液相色谱流动相有水-乙腈、水-甲醇和水-甲醇-乙腈等(王金秋等, 2014)。在流动相的水相中加入醋酸铵和甲酸等挥发性电解质,可以提高离子化效率,在保持较好分离度的前提下获得理想色谱峰形(高立红等, 2010)。为了考察加入甲酸对喹诺酮类药物峰形的调节作用,比较了当流动相中甲酸浓度分别为0、0.1%和0.2%时,对喹诺酮类药物峰形的影响。发现纯水(甲酸浓度为0)和乙腈为流动相时,有多种药物不出峰(图 1-a);0.1%的甲酸水溶液和乙腈为流动相时,峰形好且灵敏度高(图 1-b);0.2%的甲酸水溶液和乙腈为流动相时,质谱峰灵敏度降低(图 1-c)。因此,选择0.1%甲酸水溶液和乙腈为流动相,17种喹诺酮类药物以及3种内标物标准溶液(20 ng/ml)的色谱图见图 2。
|
图 1 不同流动相分离的5种喹诺酮的色谱图 Figure 1 Chromatogram of 5 quinolones in different mobile phases |
|
图 2 17种喹诺酮以及3种内标物标准溶液的色谱图 Figure 2 Chromatogram of a mix solution of 17 quinolones and 3 internal standards (20 ng/ml) |
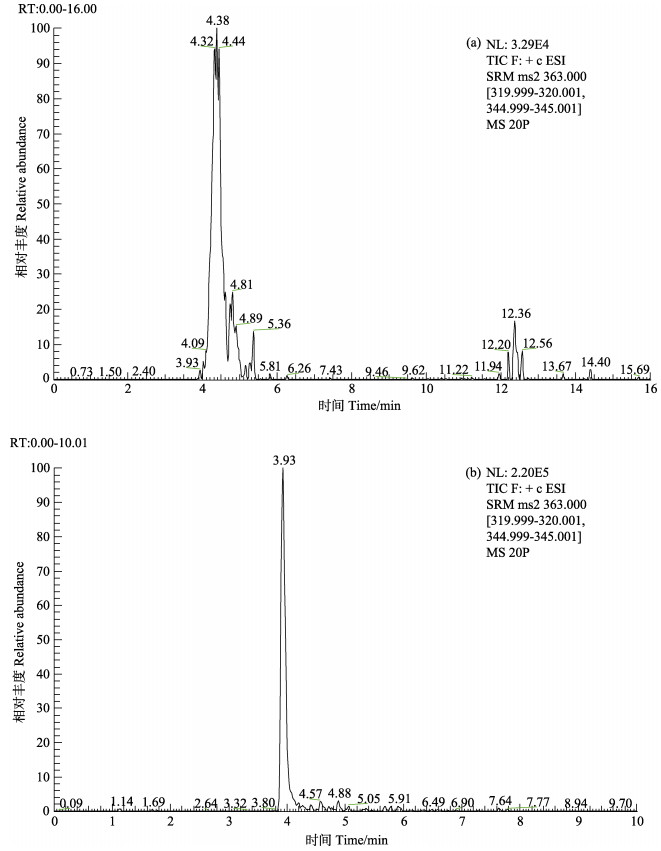
采用0.1%甲酸水溶液(A)、甲醇(B)和乙腈(C)的三元流动相,出峰时间长(16 min)且灵敏度降低。麻保沙星出峰有小分叉,响应强度低(图 3-a)。而采用0.1%甲酸水和乙腈两相为流动相时,麻保沙星出峰正常(图 3-b);所有喹诺酮类分析时间短(10 min),分离度好且响应强度高。
|
图 3 麻保沙星标准溶液在不同流动相下的色谱图 Figure 3 Chromatogram of standard marbofloxacin in different mobile phase (20 ng/ml) |
喹诺酮类药物的基本结构中既含有羧基官能团,又含有叔胺基,属于两性、极性化合物(Ho et al, 2004)。固相萃取技术使得高倍浓缩萃取水环境中的抗生素成为可能。Oasis HLB是亲水亲脂平衡型固相萃取柱,对极性和非极性物质都有很好的富集效果。本研究选择Oasis HLB(6 ml/500 mg)对养殖海水中喹诺酮进行富集。
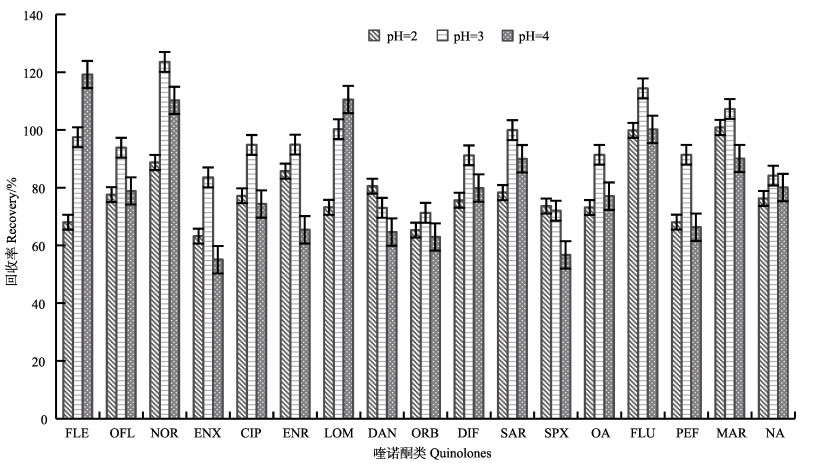
天然海水的pH范围为7.8–8.3,海水的pH可以影响抗生素与SPE柱的结合效率,影响到最终的萃取效果。研究证明,抗生素在酸性条件下比中性(不调节pH)、碱性条件下与SPE的结合更显著(高会等, 2011; 孙广大等, 2009)。因此,本研究将过柱海水的pH分别调成2.0、3.0、4.0三种水平。按照前处理的方法通过加标回收可知,当海水用盐酸调节pH至3.0时,水样加标的回收率结果更稳定,重现性好(图 4),所以本研究在过柱前统一将海水pH调为3.0,这与徐维海等(2006)和张瑞杰等(2012)的研究结果一致。
|
图 4 采用不同pH上样溶液时的17种喹诺酮的回收率比较 Figure 4 Comparison of 17 quinolones recoveries with loading buffers at different pH |
经过Oasis HLB小柱的富集之后,需对SPE柱进行淋洗除去杂质,本研究选择乙酸铵水溶液作为淋洗液,分别选择6、8、10、12 ml不同体积进行实验,可知当淋洗液的体积为10 ml时,能够得到满意的除杂效果和回收率。
SPE柱淋洗后,对洗脱液的种类以及使用量进行考察。首先,选用乙腈和甲醇进行洗脱,经过回收数据统计可知,用甲醇洗脱后的样品回收率较稳定,经过乙腈处理的回收率偏高,且乙腈的毒性比甲醇大,所以选择甲醇为洗脱液。对甲醇的使用量进行对比,结果显示,6 ml的甲醇分2次进行洗脱即可达到较高的回收率,继续增加使用量之后,效果不明显,且增加了甲醇使用量,延长了氮吹时间。
2.4 线性范围和方法检出限在优化的色谱和质谱条件下,用流动相稀释喹诺酮的混合标准品,每个浓度梯度都准确加入1 mg/ml混合内标标准工作液50 ml,使混合标准工作液终浓度为1、2、5、10、20、50、100和200 mg/L。标准曲线结果显示,17种喹诺酮的线性关系均良好,R2 > 0.999,仪器测定线性范围为1–200 mg/L,空白海水(500 ml)加标的方法得到17种喹诺酮的方法(S/N=3)检出限的范围为2–10 ng/L,定量限(S/N=10)的范围为5–20 ng/L(表 3)。
|
|
表 3 目标物的线性方程、线性范围、相关系数、方法检出限以及方法定量限 Table 3 Calibration equations, linear range, correlation coefficients (R2), detection limits and quantitation limits |
本研究采用内标法进行定量分析,在样品中加入回收率指示物,以此来保证整个样品前处理过程的回收率。诺氟沙星、依诺沙星、麻保沙星、氧氟沙星、培氟沙星、氟罗沙星、洛美沙星以氘代诺氟沙星为内标,环丙沙星、奥比沙星以氘代环丙沙星为内标,恩诺沙星、丹诺沙星、沙拉沙星、司帕沙星、双氟沙星、恶喹酸、氟甲喹、萘啶酸以氘代恩诺沙星为内标。采用标准添加法,选择空白海水为空白样品,海水样分别在20、100、200 ng/L三个添加水平下进行加标回收率和精密度(n=5)的考察。结果显示,回收率范围71.3%–125.0%,方法的相对标准偏差≤12.27%(表 4)。由此说明,该方法灵敏度、准确性与重现性都较高,可用于水产养殖环境中海水的喹诺酮类残留检测。
|
|
表 4 目标化合物加标回收率以及相对标准偏差 Table 4 Spiked recoveries and RSDs of the target compounds (n=5) |
采用所建立的养殖海水中17种喹诺酮类药物的检测方法对黄海灵山湾近岸的4个养殖场的海水进行取样。共检测出4种喹诺酮类药物,分别是恩诺沙星、氧氟沙星、诺氟沙星和环丙沙星,浓度范围是ND–6880.05 ng/L (表 5)。其中,恩诺沙星的检出率最高,在4家养殖场中都有检出,其他3种喹诺酮的检出率较低。养殖场C的检测结果显示,该场用药种类多且含量较高,需引起重视。在水产养殖过程中,恩诺沙星属于允许按规范使用的抗菌药,氧氟沙星、诺氟沙星和环丙沙星是禁止使用的抗菌药。目前,虽然没有水体中喹诺酮类药物残留限量标准,但检测结果显示,水产养殖过程中喹诺酮类药物存在不同程度的滥用现象,需要进一步加强监管。
|
|
表 5 养殖海水中喹诺酮类药物检测结果 Table 5 Results of quinolones detected in aquaculture seawater samples (ng/L) |
本研究采用SPE与LC-MS/MS联用技术,建立了养殖海水中17种喹诺酮类药物残留的分析方法。该方法可检测到的喹诺酮类药物较全面,具有较高的灵敏度和选择性,准确可靠,回收率为71.3%–125.0%。该方法适用于养殖海水中的喹诺酮类药物残留的检测。将此方法初步应用于黄海灵山湾近岸养殖区喹诺酮类药物残留的调查,结果显示,养殖区水体中检出喹诺酮类药物,且浓度较高,表明该养殖区存在较严重的超浓度使用喹诺酮类药物的现象。
| Du J, Zhao HX, Chen JW. Simultaneous determination of 23 antibiotics in mariculture water using solid-phase extraction and high performance liquid chromatography-tandem mass spectrometry. Chinese Journal of Chromatography, 2015, 33(4): 348-353 [杜鹃, 赵洪霞, 陈景文. 固相萃取-高效液相色谱-串联质谱法同时测定养殖海水中23种抗生素. 色谱, 2015, 33(4): 348-353] | |
| Gao LH, Shi YL, Liu JM, et al. Determination of fluroquinolone antibiotics in wastewater samples. Environmental Chemistry, 2010, 29(5): 948-953 [高立红, 史亚利, 刘杰民, 等. 污水中氟喹诺酮类抗生素的分析方法. 环境化学, 2010, 29(5): 948-953] | |
| Gao H, Zu GR, Gu J, et al. Simultaneous determination of quinolone antibiotics and estrogens in environmental water samples using high performance liquid chromatography tandem mass spectrometry. Chinese Journal of Analysis Laboratory, 2011, 30(12): 8-12 DOI:10.3969/j.issn.1000-0720.2011.12.003 [高会, 祖国仁, 顾佳, 等. HPLC-MS/MS法联合分析环境水体中喹诺酮类抗生素和雌激素. 分析试验室, 2011, 30(12): 8-12] | |
| Göbel A, McArdell CS, Suter MJF, et al. Trace determination of macrolide and sulfonamide antimicrobials, a human sulfonamide metabolite, and trimethoprim in wastewater using liquid chromatography coupled to electrospray tandem mass spectrometry. Analytical Chemistry, 2004, 76(16): 4756-4764 DOI:10.1021/ac0496603 | |
| Gu HD, Yin YM, Qin HB. Determination of quinolones in water samples by solid phase extraction-ultra performance liquid chromatography electrospray tandem mass spectrometry. Administration and Technique of Environmental Monitoring, 2013, 25(3): 34-37 [顾海东, 尹燕敏, 秦宏兵. 超高效液相色谱三重四级杆质谱联用法测定水中喹诺酮类抗生素. 环境监测管理与技术, 2013, 25(3): 34-37] | |
| Ho C, Sin DW, Tang HP, et al. Determination and on-line clean-up of (fluoro) quinolones in bovine milk using column-switching liquid chromatography fluorescence detection. Journal of Chromatography A, 2004, 1061(2): 123-131 DOI:10.1016/j.chroma.2004.11.003 | |
| Hu WJ, Yang SY, Zhu XM. The impact of mariculture on marine ecosystem and studies on bioremediation. Journal of Xiamen University (Natural Science), 2007, 46(S1): 197-202 [胡文佳, 杨圣云, 朱小明. 海水养殖对海域生态系统的影响及其生物修复. 厦门大学学报(自然科学版), 2007, 46(S1): 197-202] | |
| Li PP, Zhang XJ, Mei GM, et al. Determination of quinolones in aquaculture waters by ultra performance liquid chromatography-tandem mass spectrometry. Journal of Zhejiang University (Science Edition), 2015, 42(3): 334-338 [李佩佩, 张小军, 梅光明, 等. 超高效液相色谱-串联质谱检测养殖水体中喹诺酮类抗生素. 浙江大学学报(理学版), 2015, 42(3): 334-338] | |
| Nie XP, Wang X, Chen JF. Aquaculture and the residues of environmental xenobiotics and its impacts upon aquatic environment. Environmental Science and Technology, 2007, 30(4): 106-110 [聂湘平, 王翔, 陈菊芳. 水产养殖与有毒有害污染物残留及其环境影响. 环境科学与技术, 2007, 30(4): 106-110] | |
| Reverté S, Borrull F, Pocurull E, et al. Determination of antibiotic compounds in water by solid-phase extraction-high-performance liquid chromatography-(electrospray) mass spectrometry. Journal of Chromatography A, 2003, 1010(2): 225-232 | |
| Sun GD, Su ZY, Chen M, et al. Simultaneous determination of tetracycline and quinolone antibiotics in environmental water samples using solid phase extraction-ultra pressure liquid chromatography coupled with tandem mass spectrometry. Chinese Journal of Chromatography, 2009, 27(1): 54-58 [孙广大, 苏仲毅, 陈猛, 等. 固相萃取-超高压液相色谱-串联质谱同时分析环境水样中四环素类和喹诺酮类抗生素. 色谱, 2009, 27(1): 54-58] | |
| Toussaint B, Chedin M, Bordin G, et al. Determination of (fluoro) quinolone antibiotic residues in pig kidney using liquid chromatography-tandem mass spectrometry: I. Laboratory-validated method. Journal of Chromatography A, 2005, 1088(1-2): 32-39 DOI:10.1016/j.chroma.2005.02.057 | |
| Wang JQ, Ma JM, Xia X, et al. Determination of 13 quinolone antibiotic residues in swine muscle by UPLC-MS/MS. Journal of Chinese Mass Spectrometry Society, 2014, 35(2): 185-192 DOI:10.7538/zpxb.youxian.2014.0003 [王金秋, 马建民, 夏曦, 等. 超高效液相色谱-串联质谱法同时测定猪肌肉中13种喹诺酮药物残留. 质谱学报, 2014, 35(2): 185-192] | |
| Wang KP, Zhang QQ, Guo JS, et al. Review of the determination of fluoroquinolones in the environment and its removal from the sewage. Journal of Safety and Environment, 2012, 12(2): 104-110 [汪昆平, 章琴琴, 郭劲松, 等. 环境中氟喹诺酮类抗生素残留检测和去除研究进展. 安全与环境学报, 2012, 12(2): 104-110] | |
| Watkinson AJ, Murby EJ, Kolpin DW, et al. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water. Science of the Total Environment, 2009, 407(8): 2711-2723 DOI:10.1016/j.scitotenv.2008.11.059 | |
| Xu YJ, Gong XH, Zhang XZ, et al. Simultaneous determination of 21 sulfonamide residues in seawater by UPLC-MS/MS. Marine Environmental Science, 2010, 29(4): 579-581 [徐英江, 宫向红, 张秀珍, 等. UPLC MS/MS测定海水中21种磺胺类药物残留的研究. 海洋环境科学, 2010, 29(4): 579-581] | |
| Xu WH, Zhang G, Zou SC, et al. Occurrence and seasonal changes of antibiotics in the Victoria Harbour and the Pearl River, South China. Environmental Science, 2006, 27(12): 2458-2462 DOI:10.3321/j.issn:0250-3301.2006.12.016 [徐维海, 张干, 邹世春, 等. 香港维多利亚港和珠江广州河段水体中抗生素的含量特征及其季节变化. 环境科学, 2006, 27(12): 2458-2462] | |
| Yang SG, Li ZX, Wang QY, et al. Determination of quinolones drug residues in aquacultural seawater using HPLC method. Progress in Fishery Sciences, 2010, 31(2): 95-101 [杨守国, 李兆新, 王清印, 等. 高效液相色谱法检测海水养殖环境中喹诺酮类药物残留. 渔业科学进展, 2010, 31(2): 95-101] | |
| Yin YM, Shen YQ, Zhu YF, et al. Simultaneous determination of sulfonamides, quinolones and chloramphenicols in water and sediment samples by ultra performance liquid chromatography-tandem mass spectrometry. Journal of Analytical Science, 2015, 31(2): 228-232 [尹燕敏, 沈颖青, 朱月芳, 等. 超高效液相色谱-串联质谱法同时测定水和沉积物中磺胺类、喹诺酮类和氯霉素类抗生素残留. 分析科学学报, 2015, 31(2): 228-232] | |
| Zhang RJ, Zhang G, Zheng Q, et al. Concentrations and spatial distributions of selected quinolones antibiotics in Laizhou Bay and main rivers flowing into the bay. Marine Environmental Science, 2012, 31(1): 53-57 [张瑞杰, 张干, 郑芊, 等. 喹诺酮类抗生素在莱州湾及主要入海河流中的含量和分布特征. 海洋环境科学, 2012, 31(1): 53-57] | |
| Zhou QX, Luo Y, Wang ME. Environmental residues and ecotoxicity of antibiotics and their resistance gene pollution: A review. Asian Journal of Ecotoxicology, 2007, 2(3): 243-251 [周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染. 生态毒理学报, 2007, 2(3): 243-251] |



