2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
对虾产业是我国海洋渔业的重要组成部分,而病害问题一直是制约其可持续发展的一个重要因素。白斑综合征(White spot syndrome, WSS)是造成养殖对虾死亡的主要病症,其发病速度快,具有极强的破坏性(衣启麟等, 2015),一旦在养殖池内暴发,在3–10 d内对虾死亡率会达到100%,致使全球对虾养殖业遭受巨大的经济损失(薛晖等, 2010; Cavalli et al, 2008; Verbruggen et al, 2016)。对虾患WSS后,会出现摄食减少、空胃;游泳无力,反应迟钝;甲壳上,尤其是头胸甲处出现2–3 mm大小的白色斑点,甲壳易剥离;体色暗,直至最后体内细胞解体、器官坏死,导致病虾死亡(魏克强等, 2005; Dutta et al, 2013)。而白斑综合征病毒(White spot syndrome virus, WSSV)为水产动物中已知基因组最大的病毒,2009年被农业部《一、二、三类动物疫病病种名录》列为水生生物一类动物疫病病毒(马晓燕等, 2012)。为了了解和控制疾病的发生,减少经济损失,诸多学者探究WSSV的防治措施(闫冬春, 2006)。然而,这些方法都不能有效控制WSS的大规模暴发(Verbruggen et al, 2016)。
研究发现,当对虾种类、感染方式和感染剂量不同时,对虾的死亡时间存在差别(江世贵等, 2000; 何建国等, 1999)。孙成波等(2006)研究发现,凡纳滨对虾(Litopenaeus vannamei)和斑节对虾(Penaeus monodon)在人工注射感染WSSV后,其病毒复制的时间和抵抗力存在明显的差异。Jiang等(2006)研究发现,中国对虾(Fenneropenaeus chinensis)和日本囊对虾(Marsupenaeus japonicus)在WSSV人工感染下,日本囊对虾的存活时间长于中国对虾。张天时等(2010)研究发现,中国对虾自然感染与人工感染WSSV,其部分家系对WSSV的抵抗力较强。研究中国对虾与凡纳滨对虾,以及中国对虾选育群体和野生群体感染WSSV后存活时间及其体内WSSV病毒载量变化;阐明不同对虾种类对WSSV抗病力的差异及影响因素,可为实践中进一步优化选育策略、合理地选择养殖品种、减少和控制对虾疾病的暴发提供参考。
1 材料与方法 1.1 实验条件实验在中国水产科学研究院黄海水产研究所对虾性状测试车间进行,实验所用玻璃钢圆池容积为10 m3,实际加水量约为6 m3,保证24 h充气。实验用水为经砂滤的自然海水,海水盐度为30±1,实验期间水温维持在(24±2)℃,实验前,圆池用次氯酸钠浸泡消毒12 h后清洗干净。
1.2 健康对虾来源实验所用中国对虾野生群体是从韩国引进的朝鲜半岛西海岸野生群体(W-Fc);中国对虾选育群体来自山东青岛海水养殖引种育种中心,为经过连续10代人工选育的抗病新品种‘黄海2号’(S-Fc);凡纳滨对虾群体为购自广州某育苗场的商业一代苗种(C-Lv)。3组对虾体长为5–7 cm,体重为1.6–2.1 g,各600尾。实验前暂养3 d,每日投喂3次(06:00、14:00、22:00)配合饲料(日投饵量占对虾总体重的3%–5%),吸污1次,换水1次(约为50%)。实验前,3组对虾各随机抽取10尾对虾,经实时荧光定量RT-PCR检测其体内WSSV病毒载量,结果均为阴性。
1.3 WSSV毒饵的制备取甲壳有明显白斑、濒死发病的对虾,经实时荧光定量PCR检测肌肉中WSSV拷贝数,最后制成病毒载量为107copies/mg的毒饵。在充分预冷的组织匀浆机中搅匀,加入可食用红色素,制成混合均匀、颜色醒目的毒饵,毒饵制备过程必须在低温环境中快速进行,–80℃冰箱保存。
1.4 人工饲喂感染对虾各设置2个平行组和1个对照组(各200尾)。饲喂毒饵前,对虾饥饿处理6 h,保证其胃肠排空。分别将不同实验组的对虾捞出,放入单独容器中,将制备的新鲜WSSV毒饵置于冰上,用镊子夹取毒饵(约10 mg)轻轻送至对虾口器处,待抱食后的对虾胃部出现明显的红色,将其放回圆池。对照组饲喂经检验不含病毒的对虾肌肉。饲喂完毕后,正常投饵、换水,观察对虾死亡情况,清除24 h内死亡的对虾。
1.5 样品采集及处理实验开始后,分别选取3、6、12、24、36、48、72、144 h共8个时间点活体取样,用于检测体内肌肉组织的病毒载量。每组对虾每个时间点取3个样品的肌肉组织并置于–80℃冰箱保存,实验共进行13 d。
1.6 WSSV载量检测方法取8个时间点的各组对虾肌肉组织按照王伟继(2008)1)方法进行DNA的提取。DNA经1%琼脂糖凝胶电泳,利用凝胶成像系统(BioImaging Systems)检测其完整性,使用超微量紫外分光光度计(Biodropsis Bo-2000)测定DNA质量及浓度,并将其稀释至40 ng/μl。WSSV载量测定采用TaqMan实时荧光定量PCR法(Durand et al, 2002),目标片段长度为69 bp,引物及探针由生工生物工程(上海)股份有限公司合成。荧光定量PCR反应体系(20 μl):1×Premix Ex TaqTM (Probe qPCR)、正反向引物各0.25 μmol/L(表 1)、ROX Reference DyeⅡ 0.25 μmol/L、探针0.125 μmol/L、病毒DNA模板2 μl,灭菌双蒸水补足体积。PCR反应程序:95℃预变性10 s;95℃变性5 s,60℃退火及延伸34 s,共40个循环。以本实验室自行制备含有目的片段的重组质粒PUCm-T/WSSV69为标准品,将WSSV标准品进行10倍系列梯度稀释,共7个梯度,分别为(1.02×102)–(1.02×108) copies/μl,无菌双蒸水作为阴性对照,每个稀释度设置3个平行,用作阳性对照及标准曲线的构建。每个DNA样品平行检测3次,取其平均值作为该样品的WSSV载量。
1) Wang WJ. Genetic mapping of the Chinese shrimp Fenneropenaeus chinensis using AFLP markers and commercial traits QTL mapping. Doctoral Dissertation of Ocean University of China, 2008, 66–73 [王伟继.中国对虾(Fenneropenaeus chinensis) AFLP分子标记遗传连锁图谱的构建以及相关性状的QTL定位.中国海洋大学博士研究生学位论文, 2008, 66-73]
|
|
表 1 实验所用引物序列 Table 1 Sequences of PCR primers in this study |
从出现第1尾对虾死亡开始,每隔1 h进行观察,捞出死亡对虾,记录其死亡时间,装入取样管并放置于–20℃冰箱中,直至对虾全部死亡。统计感染WSSV后每组对虾的平均存活时间,结果表示为平均值±标准差(Mean±SD)。采用SPSS 19.0软件和Origin 9.0进行数据统计分析,并用单因素方差分析(One-way ANOVA)进行对虾平均存活时间和体内肌肉组织病毒载量的差异分析。
2 结果 2.1 WSSV感染后对虾存活时间差异的比较3组对虾均在40 h后开始出现死亡个体。S-Fc最大存活时间比C-Lv长9 h,比W-Fc长62 h;S-Fc最小存活时间比C-Lv长6 h,比S-Fc长7 h。对照组无死亡,而WSSV感染组的死亡率为100%。用单因素方差分析比较同种含量病毒感染下3组对虾的平均存活时间的差异,结果显示,S-Fc、W-Fc和C-Lv两两之间平均存活时间均存在显著性差异(表 2)。
|
|
表 2 WSSV感染后3组对虾存活时间 Table 2 Survival time of the three groups of shrimps after WSSV infection |
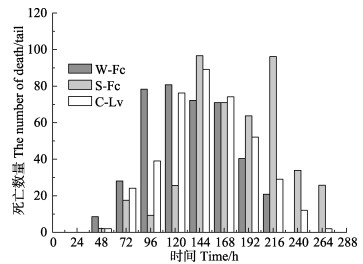
WSSV感染后3组对虾各时间段的死亡情况:40 h前,3组对虾无死亡;40–48 h,W-Fc、S-Fc和C-Lv组死亡尾数分别为8、2和2尾;72–96 h,3组对虾的死亡尾数分别为78、39和9尾,W-Fc死亡数量迅速上升,S-Fc上升较慢;96–120 h,W-Fc最先达到单位时间死亡尾数最大值,为80尾;120–144 h,S-Fc和C-Lv同时达到单位时间段死亡尾数最大值,分别为96尾和89尾。W-Fc在72–168 h持续保持相对较高的死亡数量,在126 h死亡率最先达到100%。S-Fc在192–216 h达到死亡尾数的第二高峰。
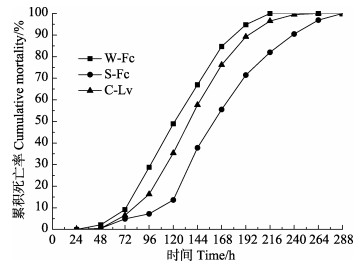
2.3 WSSV感染后3组对虾累积死亡率的比较实验开始40 h内,3组对虾累积死亡率均为0。随着实验的进行,对虾开始逐渐死亡,其累积死亡率不断增长。W-Fc、S-Fc和C-Lv对虾累积死亡率在120 h时分别达到48.93%、13.62%和35.34%;168 h时,分别达到84.71%、55.53%和76.19%;分别在216、288、264 h达到100%。
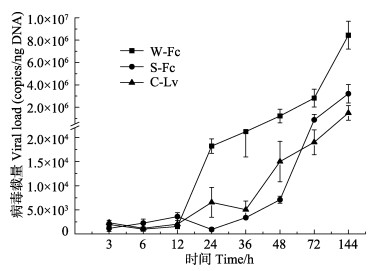
2.4 WSSV感染后3组对虾肌肉病毒载量的变化W-Fc、S-Fc和C-Lv其体内肌肉组织病毒载量在3–12 h均保持较低水平(1.01×103–3.60×103 copies/ng DNA),随后出现病毒增殖高峰期,并伴随死亡高峰期;24–36 h, W-Fc达到(2.12×104±5.24×103) copies/ng DNA,S-Fc和C-Lv保持较低水平;至48 h,3组分别达到(1.22×106±6.14×105)、(7.10×103±7.26×102)和(1.50×104±4.19×103) copies/ng DNA,3组均有显著性差异(P<0.05),S-Fc和C-Lv两组之间差异不显著(P>0.05);至72 h,S-Fc达到(8.71×105±4.80×105) copies/ng DNA,C-Lv保持在(1.90×104±2.57×103)copies/ng DNA,两组差异显著(P<0.05);当3组对虾体内肌肉组织病毒载量均达106copies/ng DNA时,其所用时间分别为48、144和144 h (表 3)。
|
|
表 3 3组对虾不同时间病毒载量(copies/ng DNA) Table 3 The viral loads in the three groups of shrimps at different time points (copies/ng DNA) |
|
图 1 3组对虾不同时间点的死亡数量 Figure 1 The number of death of three groups of shrimps at different time points |
|
图 2 WSSV感染后对虾的累积死亡率 Figure 2 The cumulative mortality of shrimps after the WSSV infection |
48 h之前,3组对虾整体增殖趋势为W-Fc增长最快,C-Lv次之,S-Fc最慢。48–144 h时,其增殖趋势是W-Fc增长速度最快,S-Fc增殖速度开始迅速上升,C-Lv缓慢上升。
3 讨论在感染对虾的众多病原中,WSSV的危害最严重(Bonilla et al, 2007)。研究同种对虾不同品种以及不同种类对虾对WSSV的敏感性关系,对于虾的遗传选育有重要意义(刘庆慧等, 2005)。现已有中国对虾和日本囊对虾(盖春蕾等, 2013)、凡纳滨对虾和斑节对虾(Wongtavatchai et al, 2007)、日本沼虾(Macrobrachium nipponensis)和凡纳滨对虾(戚兰等, 2003)以及不同家系的中国对虾(董世瑞等, 2015)对疾病的敏感性差异研究。
3.1 对虾自身特点宿主对WSSV的敏感性和抵抗力因种而异,如WSSV引起印度对虾(Penaeus indicus)、斑节对虾、巨掌沼虾(Macrobrachium superbum)100%死亡率的时间分别为感染后的72 h、48 h、5 d和8 d,而罗氏沼虾(Macrobrachium rosenbergii)在注射感染WSSV 15 d后没有死亡(Sahul et al, 2000)。李素红等(2007)研究表明,即使同一种属不同家系之间的中国对虾,对WSSV的敏感性也存在较大差异。黄永春等(2013)对凡纳滨对虾进行WSSV感染实验发现,不同家系的对虾对WSSV的抗性不同。本研究比较了中国对虾和凡纳滨对虾以及中国对虾人工选育群体与野生群体之间对WSSV的敏感性,其在平均存活时间、累积死亡率和对虾体内病毒载量方面均存在显著差异。
|
图 3 WSSV感染后对虾肌肉病毒载量变化 Figure 3 Changes in the viral loads in the muscle of the three groups of shrimps after WSSV infection |
20世纪90年代前,我国北方对虾养殖主要品种是中国对虾。2001年后,由于凡纳滨对虾性状优良,在我国沿海养殖规模迅速扩大,成为我国对虾养殖的绝对优势种(黄永春等, 2013)。本研究中,中国对虾野生群体与凡纳滨对虾商业苗种相比较,平均存活时间短(表 2)、各时间点累积死亡率高(图 2),并且随着实验时间的延长其体内病毒载量增殖的速度加快(图 3),从抗WSSV性能角度揭示了凡纳滨对虾之所以能够替代中国对虾成为绝对优势种的原因。但本研究中,凡纳滨对虾商业苗种与中国对虾‘黄海2号’相比,其对WSSV的耐受力较差,可能是由于种源受控:一代苗种泰国正大对虾、美国迈阿密SIS对虾等质量参差不齐,土苗冒充一代苗种等原因导致。而中国对虾‘黄海2号’是采用群体、家系与多性状复合育种技术,经10代连续培育出的中国对虾养殖新品种(品种登记号:GS01-002-2008),其表现出明显的抗病性,能有效阻止WSSV的感染规模以及感染进程,应用于实际生产中,能够在一定程度上缓解和控制WSSV疾病的发生,减少养殖户的经济损失(逄锦菲等, 2013)。中国对虾‘黄海2号’已在我国山东、天津、河北、江苏等沿海省市推广应用,为我国对虾养殖业带来了良好的社会效益和经济效益(孔杰等, 2012)。在等量WSSV感染下,中国对虾选育群体‘黄海2号’比中国对虾野生群体平均存活时间长,并且随着实验的进行对虾体内病毒增殖相对缓慢,在一定程度上说明中国对虾的选育工作取得了一定的进步和成果,也符合了其具有明显抗病性的结论。通过抗病良种选育,可提高对虾的免疫机能和抗病能力,是有效预防对虾白斑病的重要措施之一(纪荣兴等, 2008)。
3.3 免疫机制对虾属于无脊椎动物,没有后天的获得性免疫反应(Adaptive immune response),它对病原体的免疫力依赖于其先天免疫系统(Innate immune system),这个免疫系统包括一系列的体液和细胞免疫因子(Li et al, 2013)。戚兰等(2003)对日本沼虾和凡纳滨对虾体液防御系统中重要免疫因子比较研究,发现凡纳滨对虾肌肉溶菌酶活性、血液中的酸性磷酸酶(ACP)和碱性磷酸酶(ALP)活性均高于日本沼虾,说明凡纳滨对虾的溶菌酶和溶酶体酶的免疫功能比日本沼虾强;日本沼虾的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性高于凡纳滨对虾,说明日本沼虾的抗氧化酶活力比凡纳滨对虾强。Jiang(2010)通过对中国对虾和日本囊对虾在感染等量WSSV的情况下分析其免疫因子变化,得出日本囊对虾抗WSSV的免疫系统强于中国对虾。这些研究表明,不同种类的对虾在免疫机制上存在差异,但关于中国对虾和凡纳滨对虾在WSSV感染下免疫因子变化的差异,还需要进一步研究。
本研究中国对虾选育群体‘黄海2号’在人工感染WSSV条件下表现出良好的抗病性能。表明通过抗病选育获得对虾新品种是防治WSS的一个有效途径,新品种的推广和应用大大缓解了WSS疾病的危害。
| Bonilla CME, Sanz VA, Wille M, et al. A review on the morphology, molecular characterization, morphogenesis and pathogenesis of white spot syndrome virus. Journal of Fish Diseases, 2007, 31(1): 1-18 DOI:10.1111/jfd.2008.31.issue-1 | |
| Cavalli LS, Netto SA, Abreu PC, et al. Evaluation of white spot syndrome virus (WSSV) in wild shrimp after a major outbreak in shrimp farms at Laguna, southern Brazil. Atlantica (Rio Grande), 2008, 11061106 | |
| Dong SR, Lu YF. Path analysis of effects of morphometric traits on resistance to WSSV among different families in Fenneropenaeus chinensis. Chinese Fishery Quality and Standards, 2015, 5(2): 15-21 [董世瑞, 吕瑜峰. 不同家系中国对虾形态性状与抗病力的关系. 中国渔业质量与标准, 2015, 5(2): 15-21] | |
| Durand SV, Lightner DV. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp. Journal of Fish Diseases, 2002, 25(7): 381-389 DOI:10.1046/j.1365-2761.2002.00367.x | |
| Dutta S, Chakrabarty U, Mallik A, et al. White spot syndrome virus (WSSV) prevalence associated with disease resistance among wild populations of black tiger shrimp, Penaeus monodon (Fabricius). Aquaculture Research, 2013, 46(2): 453-461 | |
| Gai CL, Xu L, Ye HB, et al. The difference of sensitivity to the white spot syndrome virus between Fenneropenaeus chinensis and Penaeus japonicas. Fisheries Science & Technology Information, 2013, 40(4): 207-209 [盖春蕾, 许拉, 叶海斌, 等. 中国对虾和日本对虾对白斑综合征病毒(WSSV)敏感性的比较. 水产科技情报, 2013, 40(4): 207-209] | |
| He JG, Zhou HM, Yao B, et al. White spot syndrome baculovirus (WSBV) host range and transmission route. Journal of Sun Yatsen University (Natural Science Edition), 1999, 38(2): 65-69 [何建国, 周化民, 姚伯, 等. 白斑综合征杆状病毒的感染途径和宿主种类. 中山大学学报(自然科学版), 1999, 38(2): 65-69] | |
| Huang YC, Ai HS, Pan ZC, et al. Establishment and WSSV resistant characteristics of selective breeding families for resistance to the white spot syndrome virus of Litopenaeus vannamei. Journal of Fisheries of China, 2013, 37(3): 359-366 [黄永春, 艾华水, 潘忠诚, 等. 凡纳滨对虾抗WSSV选育家系的建立及其抗病特性. 水产学报, 2013, 37(3): 359-366] | |
| Ji RX, Zou WZ, Yan QP, et al. Immunogenicity and WSSV resistance of anti-WSSV Penaeus japonicus F3. Journal of Fisheries of China, 2008, 32(1): 98-104 [纪荣兴, 邹文政, 鄢庆枇, 等. 日本对虾抗白斑病子三代的抗白斑综合征病毒感染能力及免疫特性. 水产学报, 2008, 32(1): 98-104] | |
| Jiang G, Yu R, Zhou M. Studies on nitric oxide synthase activity in haemocytes of shrimps Fenneropenaeus chinensis and Marsupenaeus japonicus after white spot syndrome virus infection. Nitric Oxide, 2006, 14(3): 219-277 DOI:10.1016/j.niox.2005.11.005 | |
| Jiang GJ. Comparison of defence ability against the white spot syndrome virus between Fenneropenaeus chinensis and Marsupenaeus japonicas. Aquaculture Research, 2010, 41(9): 1322-1330 DOI:10.1111/are.2010.41.issue-9 | |
| Jiang SG, He JG, Ma ZM, et al. The pathogenicity of the white spot syndrome virus to Penaeus monodon larva. Journal of Sun Yatsen University (Natural Science Edition), 2000, 39(S1): 172-176 [江世贵, 何建国, 马之明, 等. 白斑综合征病毒对斑节对虾幼体和仔虾的致病性. 中山大学学报(自然科学版), 2000, 39(S1): 172-176] | |
| Kong J, Luo K, Luan S, et al. The new variety of Fenneropenaeus chinensis "Huanghai No. 2". Journal of Fisheries of China, 2012, 36(12): 1855-1862 [孔杰, 罗坤, 栾生, 等. 中国对虾新品种"黄海2号"的培育. 水产学报, 2012, 36(12): 1855-1862] | |
| Li FH, Xiang JH. Recent advances in researches on the innate immunity of shrimp in China. Developmental and Comparative Immunology, 2013, 39(1): 11-26 | |
| Li SH, Zhang TS, Meng XH, et al. Analysis of the resistance of heterosis in Fenneropenaeus chinensis to natural infection with white spot syndrome virus. Journal of Fisheries of China, 2007, 31(1): 68-75 [李素红, 张天时, 孟宪红, 等. 中国对虾杂交优势对自然感染白斑综合征病毒的抗病力分析. 水产学报, 2007, 31(1): 68-75] | |
| Liu QH, Huang J, Yang B, et al. Changes of immune and biochemical factors in two selected populations of prawn (Fenneropenaeus chinensis) infected by white spot syndrome virus. Marine Fisheries Research, 2005, 26(6): 22-27 [刘庆慧, 黄倢, 杨冰, 等. 人工选育中国对虾两个群体WSSV感染相关免疫与生化因子的变化. 海洋水产研究, 2005, 26(6): 22-27] | |
| Ma XY, Li P, Yan J, et al. A review on shrimp white spot syndrome virus. Journal of Nanjing Normal University., 2012, 35(4): 90-100 [马晓燕, 李鹏, 严洁, 等. 对虾白斑综合征病毒的概述. 南京师大学报(自然科学版), 2012, 35(4): 90-100] | |
| Pang JF, Kong J, Meng XH, et al. Real-time assay for quantifying WSSV load in Fenneropenaeus chinensis " Huang hai No. 2". Oceanologia et Limnologia Sinica, 2013, 44(3): 782-787 DOI:10.11693/hyhz201303037037 [逄锦菲, 孔杰, 孟宪红, 等. 中国对虾(Fenneropenaeus chinensis) "黄海2号"人工感染WSSV的荧光定量分析. 海洋与湖沼, 2013, 44(3): 782-787] | |
| Qi L, Ke HF, Zheng CY, et al. Studies on immunological factors of Macrobrnahium nipponese and Penaeus vannmei. Journal of Shaoxing University, 2003, 23(10): 65-67 DOI:10.3969/j.issn.1008-293X.2003.10.017 [戚兰, 柯慧芬, 郑春燕, 等. 日本沼虾和南美白对虾免疫因子的比较研究. 绍兴文理学院学报, 2003, 23(10): 65-67] | |
| Sahul Hameed AS, Xavier CM, Anilkumar M. Tolerance of Macrobrachium rosenbergii to white spot syndrome virus. Aquaculture, 2000, 183(3-4): 207-213 DOI:10.1016/S0044-8486(99)00305-1 | |
| Sun CB, He JG, Li ZL, et al. Sensitivity difference to WSSV of Penaeus monodon and Litopenaeus vannamei. Journal of Guangdong Ocean University, 2006, 26(3): 17-20 [孙成波, 何建国, 黎子兰, 等. 凡纳滨对虾和斑节对虾对WSSV敏感性的比较. 广东海洋大学学报, 2006, 26(3): 17-20] | |
| Verbruggen B, Bickley L, van Aerle R, et al. Molecular mechanisms of white spot syndrome virus infection and perspectives on treatments. Viruses, 2016, 8(1): 23 DOI:10.3390/v8010023 | |
| Wei KQ, Xu ZR. Advances in research of white spot syndrome virus of penaeid shrimp. Chinese Journal of Preventive Veterinary Medicine, 2005, 41(5): 39-41 [魏克强, 许梓荣. 对虾白斑综合征病毒研究进展. 中国兽医杂志, 2005, 41(5): 39-41] | |
| Wongtavatchai J, Lópezdóriga MV, Francis MJ. Effect of AquaVac™ Vibromax™ on size and health of post larva stage of Pacific white shrimp Litopenaeus vannamei and black tiger shrimp Penaeus monodon. Aquaculture, 2010, 308(3-4): 75-81 DOI:10.1016/j.aquaculture.2010.08.017 | |
| Xue H, Ding ZF, Zhou G, et al. Survey and research of the white spot syndrome virus (WSSV) infection in several kinds of economic types of freshwater crustaceans. Jiangsu Agricultural Sciences, 2010, 11061106(3): 294-297 [薛晖, 丁正峰, 周刚, 等. 白斑综合征病毒(WSSV)在几种经济类淡水甲壳动物中的感染与流行调查研究. 江苏农业科学, 2010, 11061106(3): 294-297] | |
| Yan DC. Prevention and cure of shrimp white spot syndrome virus. Journal of Fishery Sciences of China, 2006, 25(4): 202-204 [闫冬春. 防治对虾白斑综合征病毒(WSSV)的主要措施. 水产科学, 2006, 25(4): 202-204] | |
| Zhang TS, Kong J, Li SH, et al. Comparison of WSSV-resistance in artificial and natural infection experiments in Fenneropenaeus chinensis. Chinese Journal of Oceanology and Limnology, 2010, 41(5): 763-768 DOI:10.11693/hyhz201005015015 [张天时, 孔杰, 李素红, 等. 中国对虾(Fenneropenaeus chinensis)自然感染与人工感染WSSV抗病力的比较. 海洋与湖沼, 2010, 41(5): 763-768] | |
| Yi QL, Liu R, Sun R, et al. Oral administration of CpG ODNs and Yarrowia lipolytica harboring VP28 in farm ponds to protect shrimp from white spot syndrome virus infection. Progress in Fishery Sciences, 2015, 36(2): 77-86 DOI:10.11758/yykxjz.20150210 [衣启麟, 刘瑞, 孙瑞, 等. 自然养殖水体投喂CpG ODN和表面展示VP28的解脂耶罗维亚酵母对凡纳滨对虾(Litopenaeus vannamei)抗WSSV的免疫保护作用. 渔业科学进展, 2015, 36(2): 77-86] |



