2. 上海海洋大学水产与生命学院 上海 201306;
3. 中国海洋大学海洋生命学院 青岛 266003
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. College of Marine Life Sciences, Ocean University of China, Qingdao 266003
随着我国海水鱼类养殖规模和产量逐年增加,各种疾病日益增多,给养殖业造成了巨大的经济损失。在我国,抗生素等化学药物依然是控制水产动物疾病的首要手段,但长期频繁使用会引起水环境污染恶化、病原菌耐药性增加、水产动物抗病力降低、食品安全隐患等问题。在国际上,通过疫苗接种预防动物疾病被认为是一种安全有效的手段,目前,已有100多种商品化鱼用疫苗在北美、欧洲、日本等国家的市场上销售,有效地预防了鲑鳟鱼、鳕鱼(Gadus morhua)、鲈鱼(Perca fluviatilis)、鲷(Chrysophrys major)、黄条鰤(Seriola aureovittata)等重要经济品种的疾病。
鳗弧菌(Vibrio anguillarum)是水产养殖动物的一种主要致病菌,可引起多种养殖鱼类发生弧菌病,严重危害牙鲆(Paralichthys olivaceus)、大菱鲆(Scophthalmus maximus)、大西洋鲑(Salmo salar)、鲈鱼、日本鳗鲡(Anguilla japonica)等我国的重要经济鱼类。该病原可引起鱼类出血性败血症,导致鳍部严重出血、眼球突出、体表溃烂直至死亡(边慧慧, 2009; 陈吉祥等, 2005)。鳗弧菌至少有23种血清型,其中O1、O2和部分O3血清型是主要的致病菌(Wang et al, 2009; Colwell, 1984),而O2血清型又有O2a、O2b和O2c三种血清亚型,O3血清型有O3a和O3b两种血清亚型(Buch et al, 2003; Mikkelsen et al, 2011),不同血清亚型的菌株在生理生化特征、血清学反应、遗传特征等方面有所差别(Mikkelsen et al, 2007)。O1和O2血清型分布在世界各地,是感染鲑鱼、鳕鱼和大菱鲆等海水养殖鱼类最主要的病原菌,O3血清型在丹麦、意大利和日本等国家偶有发现,曾在患病的欧洲鳗鲡(Anguilla anguilla)中分离得到(Pedersen et al, 1999)。国际上已经商品化的鳗弧菌疫苗有灭活三价疫苗(含O1、O2a、O2b血清型)(Mikkelsen et al, 2011; Schr der et al, 2006),主要用于挪威的养殖鳕鱼;其他为多联疫苗,如杀鲑气单胞菌(Aeromonas salmonicida)-鳗弧菌二联灭活疫苗、杀鲑气单胞菌-鳗弧菌-耶尔森氏菌(Yersinia ruckeri)三联灭活疫苗、杀鲑气单胞菌-鳗弧菌-海水病弧菌-冷水病弧菌(Vibrio salmonicida)四联灭活疫苗等,主要用于欧洲、美洲的鲑鱼、鳗鱼养殖。我国学者研发了多种鳗弧菌疫苗,如用于鲈鱼的灭活疫苗(肖慧等, 2003),用于鲆鲽类的灭活疫苗(莫照兰等, 2002; 朱开玲等, 2004)、口服疫苗(肖鹏等, 2007)和减毒疫苗(潘燕华等, 2009),但上述疫苗制剂的免疫效果评价均停留在实验室条件阶段,很少进入中试阶段,更没有获得生产批文且正式用于生产的鳗弧菌疫苗。造成我国鱼用疫苗产业化缓慢的一个重要原因是缺乏系统深入的流行病学调查工作,对流行于疫区的病原种类和抗原的变化缺乏明确的了解,对现有疫苗株的血清型或基因型的背景不清晰,因而不能预估疫苗对流行疾病提供的免疫保护,影响了疫苗中试阶段的进展。
本实验室对危害我国海水鱼类养殖的鳗弧菌开展了血清学分型研究,发现流行于我国鲆鲽类养殖的鳗弧菌主要有O1、O2、O3血清型,以O1血清型为主,其次为O2和O3血清型,其中O3血清型来源于发病大菱鲆(赵鲁宁, 2014)。本研究在确定鳗弧菌O3血清型菌株致病性的基础上,制备了灭活疫苗,进一步研究了灭活疫苗对牙鲆的免疫保护效果,为鳗弧菌O3血清型及多价疫苗的研发提供前期基础。
1 材料与方法 1.1 实验菌株和培养基鳗弧菌O3血清型菌株SMP1、SMP3和SMP4由中国水产科学院黄海水产研究所养殖生物疾病控制与分子病理学研究室提供(赵鲁宁, 2014),保存于–80℃冰箱。用胰蛋白胨大豆肉汤(TSB)液体或胰蛋白胨大豆琼脂平板(TSA)培养,培养温度为28℃。
1.2 实验用鱼蓝蔓龙(Trichogaster trichopterus Pallas)(Hao et al, 2013)购自山东青岛南山花鸟虫鱼市场,用于鳗弧菌菌株的毒力分析。其平均体长为7 cm,暂养于60 L水箱进行海水养殖驯化,养殖水温为25~28℃,连续充气,每天在养殖淡水中加适量海水直至盐度为10 (窦海鸽等, 2006)。牙鲆购自山东日照某养殖场,用于疫苗免疫实验。其平均体重为4.8 g,平均体长为8.5 cm,于500 L水箱暂养,水温为13~16℃,连续通气。实验前,暂养鱼随机取3~5尾进行细菌学分析,取鱼的肝、脾、肾组织,于TSA平板划线,在28℃培养24~48 h,确定未有细菌生长时,暂养鱼方可用于后续实验。
1.3 菌株复壮取保存于–80℃冰箱的鳗弧菌菌种,于TSA平板划线,挑取单菌落,接种于TSB液体培养基中,28℃、140 r/min培养过夜,得到浓度为108 CFU/ml的菌液。取2尾健康牙鲆,以0.1 ml/尾的剂量进行背部肌肉注射。取濒死牙鲆的肝、脾、肾组织于TSA平板划线分菌,挑取形态特征一致的优势菌进行分离纯化,经血清学反应鉴定后,同上方法进行第2次复壮,菌液浓度为107 CFU/ml,注射剂量为0.1 ml/尾。复壮2次的菌株保种进行后续实验。
1.4 鳗弧菌菌株毒力检测取上述复壮菌株于TSA平板划线,挑取单菌落,接种于TSB过夜培养,取培养液按1%接种量转接新鲜TSB,继续摇床培养3 h,菌液于4℃、6000 r/min离心10 min,用无菌PBS重悬,调节OD540 nm=0.5,进行10倍梯度稀释,制备稀释度为103~106 CFU/ml的菌液。取健康蓝蔓龙分组,采用背部肌肉注射方式,每组注射一个稀释度的菌液0.1 ml,对照组注射同等体积的PBS。定时观察蓝蔓龙的发病症状和死亡情况,对死亡鱼进行细菌分离,并进行形态学和血清学鉴定。统计14 d的累计死亡率,采用改良寇氏法(杨茂成, 1990)计算LD50。
1.5 鳗弧菌灭活疫苗制备和安全性检验取上述复壮菌株于TSA平板划线,挑取单菌落接种于TSB过夜培养,取培养液按1%接种量转接新鲜TSB培养24 h,测定OD540 nm后,加入终浓度为0.2%的甲醛,在28℃、140 r/min摇床条件下进行灭活。进行灭活检验时,取灭活12 h和24 h的菌液各0.1 ml涂布TSA平板,同时取灭活菌液按1%比例接种TSB培养基,培养后观察是否有细菌生长。灭活后的菌液以6000 r/min离心10 min,沉淀菌体用灭菌PBS离心洗涤2次,重悬菌体至OD540 nm=0.5,制成疫苗,置于4℃保存。进行安全性检验时,将灭活疫苗以0.1 ml/尾的剂量腹腔注射牙鲆,每种疫苗注射5尾,对照组注射同等体积的PBS,实验鱼观察2周,记录鱼的症状及存活情况。
1.6 疫苗免疫与攻毒实验健康牙鲆随机分组,每组50尾,取浓度为108 CFU/ml的疫苗,以0.1 ml/尾的接种量从腹腔注射牙鲆,则每尾鱼的接种剂量为107 CFU;对照组注射等量的无菌PBS。在免疫后的7、14、21、28 d,从每个实验组随机取3尾鱼,从尾柄静脉采血制备血清,采用微量凝集法(沈萍, 1999)检测血清特异性抗体效价。
在免疫后第28天进行攻毒实验,取浓度为107 CFU/ml的活菌从背部肌肉注射免疫组鱼和对照组鱼,每组鱼20尾,每尾0.1 ml。攻毒后,观察鱼临床症状,统计14 d内的死亡数,按照如下公式计算:
疫苗免疫保护率(Relative percent survival rate, RPS)=(1–免疫组死亡率/对照组死亡率)×100%
1.7 统计分析血清抗体水平测定数据采用SPSS 18.0统计软件进行单因素方差分析(One-way ANOVA),以P < 0.05为差异有统计学意义。
2 结果 2.1 鳗弧菌菌株复壮在进行菌株复壮时,将–80℃保存的鳗弧菌菌种SMP1、SMP3和SMP4在TSA平板上活化,用TSB培养得到菌悬液,以108 CFU/ml的剂量分别注射感染牙鲆,感染的牙鲆在注射后24~48 h内全部死亡,注射部位红肿、内脏充血、全身性肌肉出血等典型症状,从濒死鱼的肝、脾、肾组织分离得到形态一致的菌落。得到的菌落经血清学鉴定为原发菌株后,以此菌落为菌种,以107 CFU/ml的剂量再次注射感染牙鲆,感染的牙鲆在注射后24~48 h内全部死亡,从濒死鱼的内脏分离得到的菌落经过血清学鉴定后,用于毒力实验和疫苗制备。
2.2 鳗弧菌菌株毒力分析以103~106 CFU/ml系列浓度的鳗弧菌SMP1、SMP3和SMP4感染蓝蔓龙,在感染后的第1天,SMP3组开始出现死亡,在感染后的第2天SMP1和SMP4开始出现死亡,死亡高峰出现在第2~3天,第7天后不再出现死亡情况。濒死鱼的症状为全身性肌肉出血,肝充血,脾脏肿大。计算得到SMP1、SMP3和SMP4的LD50依次为105.1、104.7和105.4 CFU/ml (表 1)。
|
|
表 1 O3血清型鳗弧菌的毒力检测 Table 1 Virulence of V. anguillarum serotype O3 strains |
在扩大培养24 h的3株鳗弧菌(SMP1、SMP3和SMP4)的菌悬液中加入终浓度为0.2%的甲醛进行细菌灭活,定时取菌液在TSA和TSB培养,检测灭活情况。结果显示,加入甲醛后12 h,在3种菌悬液中未检测到细菌的生长。灭活后的菌液注射牙鲆,在14 d观察期间,牙鲆生长、进食正常,未有死亡,说明灭活的疫苗对动物安全。
2.4 免疫鱼的血清抗体效价3种鳗弧菌灭活疫苗以107 CFU/尾的剂量注射免疫牙鲆,在免疫后的第7、14、21、28天取血,测定抗体效价。结果如图 1所示,在免疫后第7天,各免疫组牙鲆的血清均可检测到明显的抗体效价,并随着时间的延长呈上升趋势,其中,SMP1组和SMP3组在第1~3周呈显著性上升(P < 0.05);在第28天时,SMP1、SMP3和SMP4组的血清抗体效价分别为1:1280、1:640和1:905(图 1)。在相同采样时间点,各免疫组之间的血清效价没有显著性差异(P > 0.05)。未免疫的对照组鱼血清未检测到抗体效价。
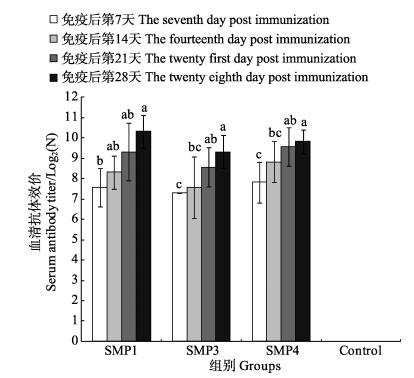
|
图 1 免疫血清效价测定 Figure 1 Determination of serum antibody titer 不同字母表示显著差异(P < 0.05) Different letters denoted significant differences (P < 0.05) |
在免疫后的第28天,用浓度为107 CFU/ml的SMP1、SMP3和SMP4活菌分别攻毒对应的免疫组和对照组,检测疫苗的免疫保护力。结果显示,攻毒后,未免疫组出现大量死亡,死亡高峰出现在攻毒后第2~ 5天;而免疫组中,仅SMP1和SMP4组出现少量死亡。根据累积死亡率计算SMP1、SMP3、SMP4组的相对免疫保护率分别为94.4%、100%和73.7% (表 2)。
|
|
表 2 鳗弧菌灭活疫苗的免疫保护力 Table 2 Relative percent survival rate (RPS) of immunized P. olivaceus challenged by 107 CFU/ml V. anguillarum bacteria |
我国学者研制了针对不同养殖品种的鳗弧菌灭活疫苗,但未明确疫苗株的血清型或基因型,在一定程度上限制了疫苗的田间应用示范。本研究开展了3株鳗弧菌O3血清型菌株(SMP1、SMP3和SMP4)的免疫原性和免疫保护效果的初步研究,在确定3株鳗弧菌菌株致病力的基础上,用福尔马林作为灭活剂制备了3种安全的灭活菌剂,比较了3种灭活菌剂免疫牙鲆后的血清抗体效价和免疫保护,结果证明,3种疫苗制剂具有较强的免疫原性,对牙鲆起到了有效的免疫保护。
用于制备疫苗的菌种由于传代次数多、保存时间长,其生长、繁殖以及毒力等会减弱,为了恢复疫苗株的原始毒力和免疫原性,本研究将冷冻保存的鳗弧菌菌株注射感染牙鲆进行2次复壮,从病鱼的内脏组织均分离到与原始菌株表型特征一致的细菌,感染病菌的牙鲆出现典型的出血性败血病症状,结果显示,鳗弧菌菌株的毒力得到了恢复。本研究在致病性实验中选取了蓝蔓龙作为实验动物,蓝蔓龙也称丝足鱼,是一种繁殖快、饲养简单、便宜的淡水观赏鱼,作为实验动物用于多种水产致病菌的免疫和致病性研究(Ling et al, 2001; Fang et al, 2000; Srinivasa et al, 2003)。本实验室对蓝蔓龙的耐盐性和盐度驯化进行了研究(窦海鸽等, 2006),并将盐度驯化的鱼应用于海水病原菌的致病性研究和海水疫苗评价(窦海鸽, 2006; 李杰等, 2010; 潘海建等, 2013; Hao et al, 2013),证明了蓝蔓龙作为海水鱼实验动物用于病原毒力分析和疫苗评价的可行性。本研究将海水驯化的蓝蔓龙用于检测复壮的鳗弧菌的毒力,结果显示,3株菌表现出较强的致病力,LD50在104.7~105.4 CFU/ml,其中,SMP4最低剂量组(103 CFU/ml)出现12.5%的死亡率,而104 CFU/ml组没有死亡,可能由于实验动物个体差异所导致。鳗弧菌的致病性与外膜蛋白、脂多糖、胞外产物等多种因子有关(Frans et al, 2011),这些致病因子是宿主免疫系统识别的抗原分子,毒力越强的鳗弧菌被认为具有越强的免疫原性。根据上述结果,3株菌株可作为候选疫苗株进行免疫原性和免疫保护效果的评价。
采用甲醛灭活的方法可以得到安全和有效的鳗弧菌疫苗(肖慧等, 2003; 莫照兰等, 2002)。本研究采用终浓度为0.2%(v/v)的甲醛作为灭活剂,在28℃、140 r/min的条件下处理12 h,可以完全灭活细菌,用此方法灭活的3种菌剂对牙鲆没有致病性。制备的3种疫苗免疫牙鲆,免疫后第7天便可检测到明显的血清抗体产生,且在一个月内抗体效价呈上升趋势,到第28天时,各免疫组血清效价高于1:640。一般认为较低的温度不适合刺激鱼体的免疫反应,牙鲆的适合生长温度为12~23℃,本研究期间,养殖牙鲆的水温为13~16℃,表明在较低的养殖温度鳗弧菌疫苗可以刺激牙鲆产生较强的体液免疫反应。攻毒实验显示,各免疫组牙鲆均能够抵抗剂量为107 CFU/ml的鳗弧菌感染,RPS在73.7%~100%范围内,因此,可以认为牙鲆血清中针对鳗弧菌疫苗的特异抗体水平与该疫苗提供的免疫保护力相关。从数据来看,免疫牙鲆后,每种疫苗在各个检测点的血清抗体效价没有明显区别,但RPS有所不同,即毒力强的菌株提供的RPS更高。因此,可以选择毒力强的鳗弧菌菌株作为疫苗候选株。其中,SMP3菌株毒力最强,免疫牙鲆后产生的血清效价相对较低,但保护率最高。推测可能由于SMP3存在不同于其他菌株的某些毒力因子,这些毒力因子在体外表达水平不高(但可能在宿主内有较高水平表达),因而不能诱导高水平的体液免疫应答;另外,某些毒力因子可能参与细胞免疫应答而检测不到抗体水平。上述机制需要进一步的研究进行确证。
本研究利用3株O3血清型鳗弧菌菌株制备灭活疫苗,对牙鲆均起到了良好的免疫保护效果,具有作为疫苗株的开发应用价值。我们将进一步比较不同血清型鳗弧菌菌株的毒力强弱、分布特征等数据,为鳗弧菌疫苗的开发应用提供基础。
| Bian HH. Primary study on a new method of oral Vibrio anguillarum vaccine for flounder. Masterxs Thesis of Hebei University, 2009, 3 [边慧慧. 牙鲆鳗弧菌口服疫苗免疫新途径的初步研究. 河北大学硕士研究生学位论文, 2009, 3] http://www.cnki.com.cn/Article/CJFDTotal-LNRZ201302072.htm | |
| Buch C, Sigh J, Nielsen J, et al. Production of acylated homoserine lactones by different serotypes of Vibrio anguillarum both in culture and during infection of rainbow trout. Systematic and Applied Microbiology, 2003, 26(3): 338-349 DOI:10.1078/072320203322497365 | |
| Chen JX, Li CF, Yan XH, et al. Studies on biological characteristics of five pathogenic Vibrio anguillarum strains isolated from diseased turbot (Scophthalmus maximus) in Shandong Province of China. High Technology Letters, 2005, 15(6): 92-96 [陈吉祥, 李彩风, 颜显辉, 等. 大菱鲆病原鳗弧菌生物学及分子特征研究. 高技术通讯, 2005, 15(6): 92-96] | |
| Colwell RR, Grimes DJ. Vibrio diseases of marine fish populations. Helgol nder Meeresuntersuchungen, 1984, 37(1-4): 265-287 DOI:10.1007/BF01989311 | |
| Dou HG, Huang J, Wang XH, et al. Salinity tolerance and salt water acclimation of gourami Trichogaster trichopterus. Journal of Fishery Sciences of China, 2006, 13(5): 775-780 [窦海鸽, 黄倢, 王秀华, 等. 丝足鱼(Trichogaster trichopterus)耐盐性及盐度驯化. 中国水产科学, 2006, 13(5): 775-780] | |
| Dou HG. Tentative application of freshwater gourami Trichogaster trichopterus on virulence analysis and vaccine evaluation for bacteria isolates from seawater fish. Masterxs Thesis of Shanghai Fisheries University, 2006, 31–37 [窦海鸽. 淡水丝足鱼用于海水鱼细菌分离物毒力分析和疫苗评价的初步研究. 上海水产大学硕士研究生学位论文, 2006, 31–37] | |
| Fang HM, Ling KC, Ge R, et al. Enhancement of protective immunity in blue gourami, Trichogaster trichopterus (Pallas) against Aeromonas hydrophila and Vibrio anguillarum by A. hydrophila major adhesion. Journal of Fish Diseases, 2000, 23: 137-145 DOI:10.1046/j.1365-2761.2000.00229.x | |
| Frans I, Michiels CW, Bossier P, et al. Vibrio anguillarum as a fish pathogen: Virulence factors, diagnosis and prevention. Journal of Fish Diseases, 2011, 34(9): 643-661 DOI:10.1111/jfd.2011.34.issue-9 | |
| Hao B, Mo ZL, Xiao P, et al. Role of alternative sigma factor 54 (RpoN) from Vibrio anguillarum M3 in protease secretion, exopolysaccharide production, biofilm formation and virulence. Applied Microbiology and Biotechnology, 2013, 97(6): 2575-2585 DOI:10.1007/s00253-012-4372-x | |
| Li J, Mo ZL, Mao YX, et al. Effect of esaC gene on Edwardsiella tarda's virulence and secretion of T3SS proteins. High Technology Letters, 2010, 20(2): 199-203 [李杰, 莫照兰, 茅云翔, 等. esaC基因对迟缓爱德华氏菌的毒力和T3SS蛋白分泌的影响. 高技术通讯, 2010, 20(2): 199-203] | |
| Ling SHM, Wang XH, Lim TM, et al. Green fluorescent protein-tagged Edwardsiella tarda reveals portal of entry in fish. FEMS Microbiology Letters, 2001, 194(2): 239-243 DOI:10.1111/fml.2001.194.issue-2 | |
| Mikkelsen H, Lund V, Larsen R, et al. Vibriosis vaccines based on various sero-subgroups of Vibrio anguillarum O2 induce specific protection in Atlantic cod (Gadus morhua L.) juveniles. Fish and Shellfish Immunology, 2011, 30(1): 330-339 DOI:10.1016/j.fsi.2010.11.007 | |
| Mikkelsen H, Lund V, Martinsen LC, et al. Variability among Vibrio anguillarum O2 isolates from Atlantic cod (Gadus morhua L.): Characterisation and vaccination studies. Aquaculture, 2007, 266(1-4): 16-25 DOI:10.1016/j.aquaculture.2007.02.041 | |
| Mo ZL, Xu YL, Zhang PJ. Vaccination against Vibrio anguillarum on cultured flounder, Paralichthys olivaceus. Marine Sciences, 2002, 26(4): 63-66 [莫照兰, 徐永立, 张培军. 养殖牙鲆鳗弧菌疫苗的研究. 海洋科学, 2002, 26(4): 63-66] | |
| Pan HJ, Hao B, Li J, et al. Impact of Cpx on the virulence of Edwardsiella tarda. Marine Sciences, 2013, 37(2): 17-21 [潘海建, 郝斌, 李杰, 等. Cpx对迟缓爱德华氏菌毒力的影响. 海洋科学, 2013, 37(2): 17-21] | |
| Pan YH, Ma Y, Zhao DL, et al. Study on immune response of Paralichthys olivaceus induced by live attenuated V. anguillarum vaccine. Food and Drug, 2009, 11(5): 12-15 [潘燕华, 马悦, 赵东玲, 等. 鳗弧菌减毒活疫苗对牙鲆免疫效果的研究. 食品与药品, 2009, 11(5): 12-15] | |
| Pedersen K, Grisez L, Houdt R, et al. Extended serotyping scheme for Vibrio anguillarum with the definition and characterization of seven provisional O-serogroups. Current Microbiology, 1999, 38(3): 183-189 DOI:10.1007/PL00006784 | |
| Schr der MB, Mikkelsen H, B rdal S, et al. Early vaccination and protection of Atlantic cod (Gadusmorhua L.) juveniles against classical vibriosis. Aquaculture, 2006, 254(1-4): 46-53 DOI:10.1016/j.aquaculture.2005.10.015 | |
| Shen P, Fan XR, Li GW. Microbiology experiment (3rd ed). Higher Education Press, 1999: 154-165. [沈萍, 范秀容, 李广武. 微生物学实验 (第三版). 高等教育出版社, 1999: 154-165.] | |
| Srinivasa Rao PS, Lim TM, Leung KY. Functional genomics approach to the identification of virulence genes involved in Edwardsiella tarda pathogenesis. Infection and Immunity, 2003, 71(3): 1343-1351 DOI:10.1128/IAI.71.3.1343-1351.2003 | |
| Wang Z, Vinogradov E, Li J, et al. Structural characterization of the lipopolysaccharide O-antigen from atypical isolate of Vibrio anguillarum strain 1282. Carbohydrate Research, 2009, 344(11): 1371-1375 DOI:10.1016/j.carres.2009.04.027 | |
| Xiao H, Li J, Wang XH, et al. Preparation of vaccine against vibriosis of sea perch (Lateolabrax japonicus) and its immune efficiency evaluation. Journal of Ocean University of Qingdao, 2003, 33(2): 226-232 [肖慧, 李军, 王祥红, 等. 鲈鱼鳗弧菌病疫苗的制备及免疫防治效果. 青岛海洋大学学报, 2003, 33(2): 226-232] | |
| Xiao P, Mo ZL, Zou YX, et al. Immune responses and efficacy of an oral-emulsified bivalent vaccine against Vibrio anguillarum in turbot (Scophthalmus maximus). High Technology Letters, 2007, 17(9): 979-985 [肖鹏, 莫照兰, 邹玉霞, 等. 鳗弧菌油乳化二价口服疫苗免疫养殖大菱鲆的免疫应答及免疫效果的研究. 高技术通讯, 2007, 17(9): 979-985] | |
| Yang MC. Veterinary statistics. Beijing: China Prospect Publishing House, 1990: 232-234. [杨茂成. 兽医统计学. 北京: 中国展望出版社, 1990: 232-234.] | |
| Zhao LN. Characterziation of serotype and genotype of Vibrio anguillarum strains isolated from marine fish. Masterxs Thesis of Qingdao Agricultural University, 2014, 25–30 [赵鲁宁. 海水养殖鱼类鳗弧菌分离株的血清型和基因型鉴定. 青岛农业大学硕士研究生学位论文, 2014, 25–30] | |
| Zhu KL, Chen JX, Li Y, et al. Study on the vaccination against V. anguillarum in farmed marine turbot. High Technology Letters, 2004, 14(2): 76-80 [朱开玲, 陈吉祥, 李筠, 等. 鳗弧菌灭活疫苗对海水养殖大菱鲆的免疫预防研究. 高技术通讯, 2004, 14(2): 76-80] |



