2. 国家海洋局第二海洋研究所 卫星海洋环境动力学国家重点实验室 杭州 310012;
3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071
2. State Key Laboratory of Satellite Ocean Environment Dynamics, Second Institute of Oceanography, State Oceanic Administration, Hangzhou 310012;
3. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071
海洋浮游纤毛虫是一类个体微小(粒径为5~200 μm)、营浮游生活的单细胞原生动物,在海洋中广泛分布,主要包括无壳寡毛类纤毛虫及砂壳纤毛虫两大类。目前,已经报道过的无壳寡毛类纤毛虫约有140种(Agatha, 2011),砂壳纤毛虫有900多种(张武昌等, 2012),无壳纤毛虫占纤毛虫丰度中的比例较高(Verity et al, 2010; Dolan et al, 2007)。浮游纤毛虫是微型浮游动物的重要类群,是微食物环的顶级摄食者,其主要摄食桡足类,不能摄食微小的浮游植物、细菌、鞭毛虫等,同时被浮游动物和鱼类幼体等所摄食,进一步转化为鱼虾等资源,是连接微食物环和经典食物链的重要媒介,在海洋浮游生态系统的物质循环和能量流动中发挥重要的作用(Pierce et al, 1992; Sherr et al, 1988)。
渤海湾位于渤海西部,是一个典型的半封闭性海湾,是许多经济鱼虾类的产卵场和索饵场,对黄渤海的渔业经济意义重大。浮游纤毛虫是仔稚鱼的重要饵料,目前,只对渤海湾2011年春季和夏季2个航次大型砂壳纤毛虫(> 76 μm)的丰度、生物量及种类组成进行了研究(于莹等, 2016)。本研究报道了2015年春、夏、秋季渤海湾近岸浮游纤毛虫丰度和生物量(由于冬季渤海湾结冰,无法进行海上作业,故本文暂缺冬季数据),增加小型砂壳纤毛虫的研究,为该海区浮游纤毛虫分布的长期变化、浮游生态系统的研究及渔业资源的发展提供基础数据。
1 材料与方法2015年春季(5月12、14日)、夏季(7月23、24日)和秋季(9月8、9日)在渤海湾近岸海区15个站位进行浮游纤毛虫的调查(图 1),水深为5~15 m。在各站位表层取1 L水样,用Lugol’s液固定,终浓度为1%。样品分析按照Utermöhl(1958)的方法进行,自然沉淀至少48 h,用虹吸管将水样上层清液小心吸出,剩余约150 ml,于阴凉处保存。取12 ml放于沉降杯内,在Olympus IX71倒置显微镜下100倍或400倍镜检。记录无壳纤毛虫、砂壳纤毛虫的丰度,砂壳纤毛虫根据张武昌等(2012)、尹光德(1952)方法鉴定到种。测量纤毛虫的体长、体宽,按最接近的几何形状(如柱体、球体和锥体)计算体积。生物量由体积乘转换系数(0.19 pg·C/μm3) (Putt et al, 1989)得来,砂壳纤毛虫的体积直接按照肉体体积计算。

|
图 1 渤海湾调查站位 Figure 1 Locations of the sampling stations in the Bohai Bay |
根据徐兆礼等(1989)的公式计算优势度(Y),公式如下:
| $ Y = \frac{{{n_i}}}{N}{f_i} $ |
式中,ni为第i种的个体数;N为总个体数;fi为第i种在各个站位出现的频率;Y > 0.02时,该种为优势种。
砂壳纤毛虫群落的多样性采用Shannon指数(H’) (Shannon et al, 1949),均匀度采用Pielou指数(J) (Pielou, 1966),其公式分别如下:
| $ H' = - \sum\limits_{i = 1}^S {{P_i}{\rm{lo}}{{\rm{g}}_2}{P_i}} $ |
| $ J = \frac{{H'}}{{{\rm{lo}}{{\rm{g}}_2}S}} $ |
式中,S为物种种类数;Pi为第i种的个体数与总个体数的比值。
2 结果与分析 2.1 丰度和生物量春、夏、秋季纤毛虫丰度和生物量的变化特点见表 1。从表 1可以看出,无壳纤毛虫丰度秋季最高,为(2178±1661) ind./L;春季最低,为(752±748) ind./L。无壳纤毛虫生物量夏季最高,为(4.19±4.43) μg·C/L;春季最低,为(1.52±2.35) μg·C/L。砂壳纤毛虫丰度和生物量均在夏季最高[(725±657) ind./L,(1.59±1.41) μg·C/L,春季最低[(264±317) ind./L, (0.39±0.41) μg·C/L;纤毛虫丰度秋季最高[(2456±1776) ind./L],春季最低[(1016± 868) ind./L],纤毛虫生物量夏季最高[(5.78±4.45) μg×C/L],春季最低[(1.91±2.53) μg·C/L]。
|
|
表 1 3个季节纤毛虫丰度(ind./L)和生物量(μg·C/L)的变化特点 Table 1 Variation in the abundance (ind./L) and biomass (μg·C/L) of the ciliates during three seasons |
3个季节砂壳纤毛虫占纤毛虫丰度的比例平均为(26.7±23.3)%,夏季最高,为(43.4±25.1)%;秋季最低,为(12.3±8.1)%,春季为(24.4±22.0)%。
2.2 水平分布 2.2.1 春季春季无壳纤毛虫丰度的高值区主要分布在调查海区的北部和中部近岸海区,无壳纤毛虫生物量的高值区主要分布在中部近岸海区;砂壳纤毛虫丰度和生物量的高值区主要分布在北部近岸和南部海区;纤毛虫丰度和生物量的分布特点与无壳纤毛虫类似(图 2)。

|
图 2 春季无壳纤毛虫、砂壳纤毛虫及纤毛虫丰度(ind./L)和生物量(μg·C/L)的水平分布 Figure 2 The horizontal distribution of the abundance (ind./L) and biomass (μg·C/L) of aloricate ciliates, tintinnids and total ciliates in the spring |
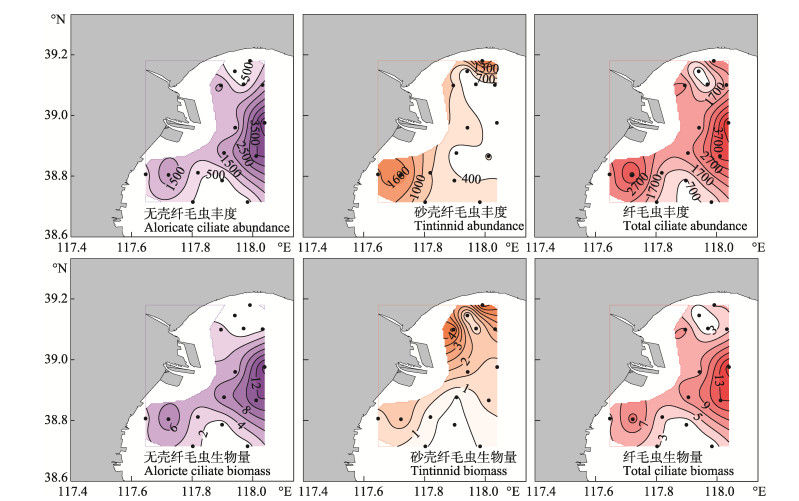
夏季无壳纤毛虫丰度和生物量的高值区主要分布在调查海区中部离岸和南部近岸海区;砂壳纤毛虫丰度的高值区主要分布在调查海域的北部和南部近岸海区,砂壳纤毛虫生物量的高值区主要分布在调查海域的北部近岸海区;纤毛虫丰度和生物量的分布特点与无壳纤毛虫类似(图 3)。
|
图 3 夏季无壳纤毛虫、砂壳纤毛虫及纤毛虫丰度(ind./L)和生物量(μg·C/L)的水平分布 Figure 3 The horizontal distribution of the abundance (ind./L) and biomass (μg·C/L) of aloricate ciliates, tintinnids and total ciliates in the summer |
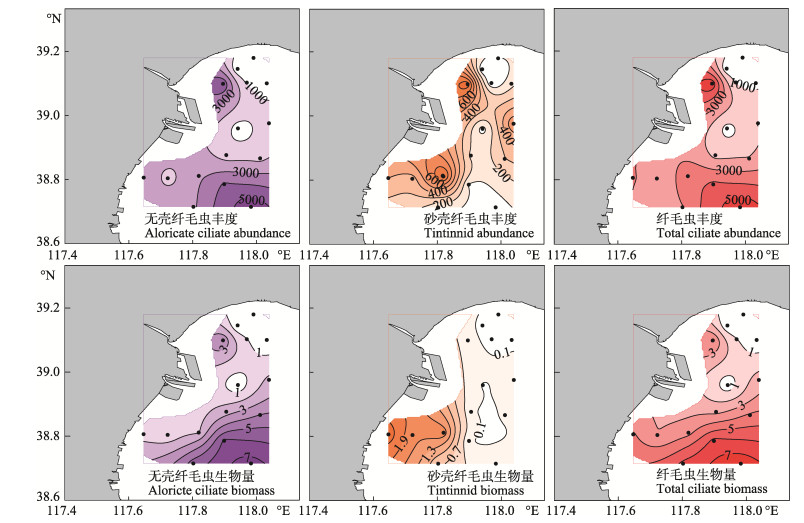
秋季无壳纤毛虫丰度和生物量的高值区主要分布在调查海区的北部近岸和南部离岸海区;砂壳纤毛虫丰度的高值区主要分布在调查海域的北部和南部近岸海区,砂壳纤毛虫生物量的高值区主要分布在调查海域的南部近岸海区;纤毛虫丰度和生物量的分布特点与无壳纤毛虫类似(图 4)。
|
图 4 秋季无壳纤毛虫、砂壳纤毛虫及纤毛虫丰度(ind./L)和生物量(μg·C/L)的水平分布 Figure 4 Horizontal distribution in terms of abundance (ind./L) and biomass (μg·C/L) of aloricate ciliates, tintinnids and total ciliates in autumn |
春、夏、秋季共鉴定出砂壳纤毛虫8属25种,其中,拟铃虫属(Tintinnopsis)种类最多,为15种(表 2)。夏季鉴定出砂壳纤毛虫种类最多(20种),且透明壳种类,如管状真铃虫(Eutintinnus tubulosus)、钟状网纹虫(Favella campanula)、巴拿马网纹虫(Favella panamensis)及兆氏类杯虫(Metacylis jorgensenii)主要在夏季出现。
|
|
表 2 3个季节鉴定的砂壳纤毛虫种类 Table 2 The species list of tintinnids in the spring, summer and autumn |
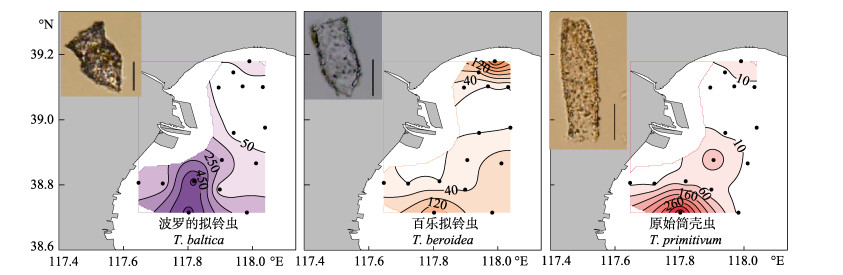
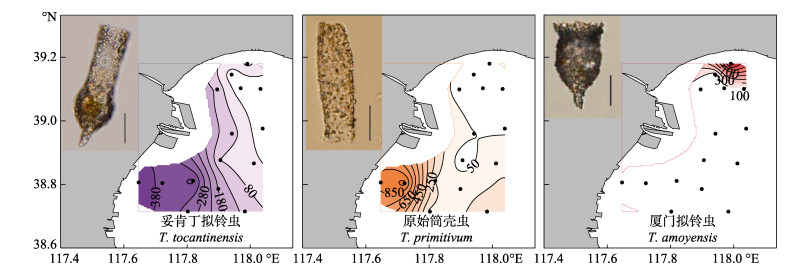
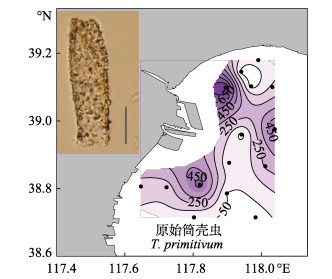
春季优势种为波罗的拟铃虫(Tintinnopsis baltica, Y=0.44)、百乐拟铃虫(Tintinnopsis beroidea, Y=0.11)和原始筒壳虫(Tintinnidium primitivum, Y=0.05)。波罗的拟铃虫和原始筒壳虫均主要分布在调查海域的南部,百乐拟铃虫主要分布在调查海域的北部和南部(图 5)。夏季优势种为妥肯丁拟铃虫(Tintinnopsis tocantinensis, Y=0.15)、原始筒壳虫(Y=0.15)和厦门拟铃虫(Tintinnopsis amoyensis, Y=0.13)。妥肯丁拟铃虫和原始筒壳虫均主要分布在调查海域的南部近岸,厦门拟铃虫则主要分布在调查海域北部近岸(图 6)。秋季优势种为原始筒壳虫(Y=0.72),其高值区在调查海域的近岸和远岸都有分布(图 7)。
|
图 5 春季渤海湾砂壳纤毛虫优势种丰度(ind./L)的水平分布(比例尺:25 μm) Figure 5 The horizontal distribution of the abundance dominant tintinnid (ind./L) in the spring (Scale bar: 25 μm) |
|
图 6 夏季砂壳纤毛虫优势种丰度(ind./L)的水平分布(比例尺:25 μm) Figure 6 The horizontal distribution of the abundance dominant tintinnid (ind./L) in the summer (Scale bar: 25 μm) |
|
图 7 秋季渤海湾砂壳纤毛虫优势种丰度(ind./L)的水平分布(比例尺:25 μm) Figure 7 The horizontal distribution of the abundance of the dominant tintinnid (ind./L) in the autumn (Scale bar: 25 μm) |
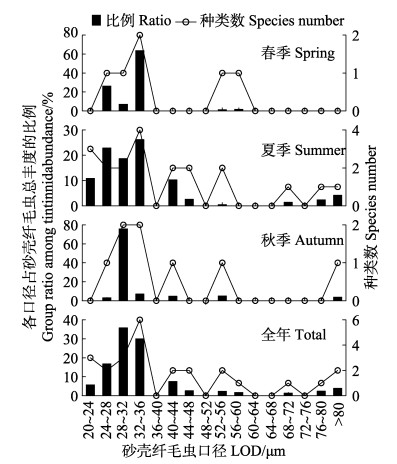
按砂壳纤毛虫口径(Lorica oral diameter, LOD)划分,春季砂壳纤毛虫群落分为5个粒径组,24~28 (百乐拟铃虫)及32~36 μm [波罗的拟铃虫和寇氏拟铃虫(Tintinnopsis kofoidi)]的粒径组在砂壳纤毛虫群落中占优,其丰度占砂壳纤毛虫总丰度的比例分别为26.4%和63.5%。夏季分为10个粒径组,包括3个较大粒径组,24~28 (百乐拟铃虫和妥肯丁拟铃虫)、28~32 [原始筒壳虫和管状拟铃虫(Tintinnopsis tubulosa)]及32~36 μm [厦门拟铃虫、清兰拟铃虫(Tintinnopsis chinglanensis)、最小拟铃虫(Tintinnopsis minima)和筒状拟铃虫(Tintinnopsis tubulosoides)]的粒径组丰度占砂壳纤毛虫总丰度的比例分别为22.9%、18.7%和26.2%。秋季分为6个粒径组,包括1个较大粒径组,28~32 μm的粒径组[尖底类瓮虫(Amphorellopsis acuta)和原始筒壳虫]丰度占砂壳纤毛虫总丰度的比例为75.8% (图 8)。
|
图 8 3个季节各口径砂壳纤毛虫占砂壳纤毛虫总丰度的比例 Figure 8 The percentages of tintinnids with different lorica oral diameters in the total tintinnid abundance in the three seasons |
春季砂壳纤毛虫群落口径较小,为(31.5±2.5) μm,夏季和秋季较大,分别为(35.9±8.2)和(34.8±5.2) μm。从全年来看,口径范围在24~36 μm的砂壳纤毛虫(尖底类瓮虫、原始筒壳虫、厦门拟铃虫、百乐拟铃虫、波罗的拟铃虫、清兰拟铃虫、寇氏拟铃虫、最小拟铃虫、妥肯丁拟铃虫、管状拟铃虫和筒状拟铃虫)是渤海湾砂壳纤毛虫群落的优势类群,其种类数占砂壳纤毛虫总种数的44.0%,其丰度占砂壳纤毛虫总丰度的82.6%,口径大于60 μm的砂壳纤毛虫种类较少且丰度较低(图 8)。
2.3.3 群落特征春季砂壳纤毛虫群落Shannon指数的平均值为(0.93±0.55),最大值为1.70,出现在1号站;Pielou指数的平均值为(0.62±0.34),最大值为0.92,出现在3号站。夏季砂壳纤毛虫群落Shannon指数的平均值为(2.13±0.43),最大值为3.24,出现在3号站;Pielou指数的平均值为(0.81±0.13),最大值为0.98,出现在3号站。秋季砂壳纤毛虫群落Shannon指数的平均值为(0.85±0.75),最大值为1.82,出现在11号站;Pielou指数的平均值为(0.50±0.43),最大值为1.00,出现在13号站。
3 讨论渤海湾纤毛虫生态学资料很少,只有于莹等(2016)研究了2011年春季和夏季大型砂壳纤毛虫的种类和丰度。本研究是首次记录渤海湾无壳纤毛虫的丰度,其在春、夏、秋3个季节均占纤毛虫总丰度的50%以上,无壳纤毛虫是渤海湾浮游纤毛虫的优势类群,在渤海湾微食物网中占据重要地位。
对比于莹等(2016)网采的样品,本研究第1次通过直接采集水样的方法研究渤海湾砂壳纤毛虫群落,鉴定出的砂壳纤毛虫种类比网采样品更多。本研究夏季比2011年夏季(于莹等, 2016)多鉴定出9种砂壳纤毛虫[鲁西塔尼亚类铃虫(Codonellopsis lusitanica)、管状真铃虫、简单薄铃虫(Leprotintinnus simplex)、兆氏类杯虫、百乐拟铃虫、直颈拟铃虫(Tintinnopsis directa)、矮小拟铃虫(Tintinnopsis nana)、管状拟铃虫和筒状拟铃虫],其多为小型砂壳纤毛虫,在砂壳纤毛虫总丰度中约占6%。结果表明,虽然网采样品可以采集大部分优势类群,但往往遗漏一些丰度不高的小型砂壳纤毛虫,很难全面了解全部砂壳纤毛虫,在今后调查中应尽量用采水的方法研究砂壳纤毛虫群落组成,更全面地了解所有粒径的砂壳纤毛虫。
3.1 水平分布本研究中,无壳纤毛虫和砂壳纤毛虫丰度和生物量的水平分布特点不同,无壳纤毛虫在3个季节中没有表现出明显的分布规律,在近岸和远岸都有丰度和生物量的高值出现;砂壳纤毛虫丰度和生物量则一般在近岸较高。砂壳纤毛虫的分布特点与多数温带近岸海区,如Ise Bay (Uye et al, 2000)及2011年渤海湾(于莹等, 2016)砂壳纤毛虫的分布规律一致。这可能与其饵料的可利用性有关,近岸海域由陆源输入带来丰富营养盐,刺激浮游植物大量生长,从而为砂壳纤毛虫提供较高水平的饵料(于莹等, 2011)。由于缺乏环境因子数据,无法分析无壳纤毛虫分布特点形成的原因。在今后研究中,需加强温度、盐度数据的调查,分析影响纤毛虫时空变化的原因;并结合饵料水平(如分粒级Chl-a数据及鞭毛虫、蓝细菌丰度等)及桡足类的摄食水平(需进行稀释培养实验)进一步探究纤毛虫丰度和生物量分布格局的成因。
3.2 砂壳纤毛虫与莱州湾(陈雪等, 2014、2015)及桑沟湾(于莹等, 2013)同期相比,本研究中鉴定出的砂壳纤毛虫种类数相当,且夏季鉴定出的砂壳纤毛虫种类数最多,这与世界其他海区的报道一致,如Narragansett Bay (Verity, 1987)及Hiroshima Bay (Kamiyama et al, 1996),砂壳纤毛虫种类数一般在夏季较多。
渤海湾砂壳纤毛虫占纤毛虫丰度的比例比桑沟湾(于莹等, 2013)及胶州湾(于莹等, 2011)高,这可能与海区的富营养状况有关。砂壳纤毛虫在富营养化的海区,一般有较高的生长能力(Kamiyama et al, 1994),由于渤海湾自身的水交换能力较差,加上近年来环渤海经济圈的快速发展,渤海湾一直处于富营养化的状态(Wang et al, 2009),这可能是渤海湾砂壳纤毛虫占纤毛虫丰度比例较高的原因之一。
与体长相比,口径是表征砂壳纤毛虫壳大小的更稳定的指标,其大小决定其摄食颗粒的大小,往往随浮游植物群落的结构组成而改变,呈现一定的季节变化(Middlebrook et al, 1987; Verity et al, 1987)。渤海湾春季砂壳纤毛虫群落口径较小,夏季和秋季较大,这可能反映了其主要饵料——浮游植物群落粒级的季节变化,在今后的调查中应增加观测分粒级Chl-a浓度,从砂壳纤毛虫饵料的角度分析砂壳纤毛虫口径大小呈现明显季节变化的成因。
原始筒壳虫在渤海湾3个季节中占优势,这在我国黄海(Yu et al, 2014)、东海(Yu et al, 2016)及南海北部湾(于莹等, 2014)等都已有过报道。这表明原始筒壳虫在我国海区分布较广,从温带到热带海区都有分布,且优势度较高,是我国海区重要的广温性种类。
| Agatha S. Global diversity of aloricate oligotrichea (Protista, Ciliophora, Spirotricha) in marine and Brackish Sea water. PLoS One, 2011, 6(8): e22466 DOI:10.1371/journal.pone.0022466 | |
| Chen X, Zhang WC, Wu Q, et al. Seasonal change of the community of large-sized tintinnids (Ciliophora, Tintinnida) in Laizhou Bay. Biodiversity Science, 2014, 22(5): 649-657 [陈雪, 张武昌, 吴强, 等. 莱州湾大型砂壳纤毛虫群落季节变化. 生物多样性, 2014, 22(5): 649-657] | |
| Chen X, Wu Q, Luan QS, et al. The horizontal distribution of dominant large tintinnid (Ciliophora, Tintinnida) in Laizhou Bay. Progress in Fishery Sciences, 2015, 36(2): 11-22 DOI:10.11758/yykxjz.20150202 [陈雪, 吴强, 栾青杉, 等. 莱州湾大型砂壳纤毛虫丰度的水平分布. 渔业科学进展, 2015, 36(2): 11-22] | |
| Dolan JR, Ritchie ME, Ras J. The "neutral" community structure of planktonic herbivores, tintinnid ciliates of the microzooplankton, across the SE Tropical Pacific Ocean. Biogeosciences Discussions, 2007, 4(3): 297-310 | |
| Kamiyama T. The impact of grazing by microzooplankton in northern Hiroshima Bay, the Seto Inland Seam, Japan. Marine Biology, 1994, 119(1): 77-88 DOI:10.1007/BF00350109 | |
| Kamiyama T, Tsujino M. Seasonal variation in the species composition of tintinnid ciliates in Hiroshima Bay, the Seto Inland Sea of Japan. Journal of Plankton Research, 1996, 18(12): 2313-2327 | |
| Middlebrook K, Emerson CW, Roff JC, et al. Distribution and abundance of tintinnids in the Quoddy Region of the Bay of Fundy. Canadian Journal of Zoology, 1987, 65(3): 594-601 | |
| Pielou EC. The measurement of diversity in different types of biological collections. Journal of Theoretical Biology, 1966, 13(1): 131-144 | |
| Pierce RW, Turner JT. Ecology of planktonic ciliates in marine food webs. Reviews in Aquatic Sciences, 1992, 6(2): 139-181 | |
| Putt M, Stoecker DK. An experimentally determined carbon: Volume ratio for marine "oligotrichous" ciliates from estuarine and coastal waters. Limnology and Oceanography, 1989, 34(6): 1097-1103 DOI:10.4319/lo.1989.34.6.1097 | |
| Shannon CE, Weaver W. The mathematical theory of communication. Urbana: University of Illinois Press, 1949: 1-114. | |
| Sherr EB, Sherr BF. Role of microbes in pelagic food webs: A revised concept. Limnology and Oceanography, 1988, 33(5): 1225-1227 DOI:10.4319/lo.1988.33.5.1225 | |
| Utermöhl H. Zur vervollkommnung der quantitativen phytoplankton methodik. Mitteilingen der Internationalen Vereinigung fur Theoretische und Angewandte Limnologie, 1958, 9: 1-38 | |
| Uye SI, Nagano N, Shimazu T. Abundance, biomass, production and trophic roles of micro-and net-zooplankton in Ise Bay, central Japan, in winter. Journal of Oceanography, 2000, 56(4): 389-398 DOI:10.1023/A:1011172221257 | |
| Verity PG. Abundance, community composition, size distribution, and production rates of tintinnids in Narragansett Bay, Rhode Island. Estuarine Coastal and Shelf Science, 1987, 24(5): 671-690 DOI:10.1016/0272-7714(87)90106-5 | |
| Verity PG, Borkman DG. A decade of change in the Skidaway River Estuary. Ⅲ: Plankton. Estuaries and Coasts, 2010, 33(2): 513-540 DOI:10.1007/s12237-009-9208-2 | |
| Wang XL, Cui ZG, Guo Q, et al. Distribution of nutrients and eutrophication assessment in the Bohai Sea of China. Chinese Journal of Oceanology and Limnology, 2009, 27(1): 177-183 DOI:10.1007/s00343-009-0177-x | |
| Xu ZL, Chen YQ. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea. Chinese Journal of Ecology, 1989, 8(4): 13-15 [徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 1989, 8(4): 13-15] | |
| Yin GD. Preliminary investigation of tintinnopsis in Jiaozhou Bay. Journal of Shandong University, 1952, 2(1): 36-56 [尹光德. 胶州湾砂壳纤毛虫之初步调查. 山东大学学报, 1952, 2(1): 36-56] | |
| Yu Y, Ma YY, Chen W, et al. Community structure of large tintinnids (Ciliophora, Tintinnida) in Bohai Bay during spring and summer. Marine Science, 2016, 40(11): 57-64 DOI:10.11759/hykx20150422002 [于莹, 马玉艳, 陈卫, 等. 春季和夏季渤海湾近岸海域大型砂壳纤毛虫的群落结构. 海洋科学, 2016, 40(11): 57-64] | |
| Yu Y, Zhang WC, Cai YM, et al. Abundance and biomass of planktonic ciliates in the Beibu Gulf during summer 2009. Journal of Tropical Oceanography, 2014, 33(2): 60-65 DOI:10.11978/j.issn.1009-5470.2014.02.008 [于莹, 张武昌, 蔡昱明, 等. 2009年夏季北部湾浮游纤毛虫的丰度和生物量. 热带海洋学报, 2014, 33(2): 60-65] | |
| Yu Y, Zhang WC, Feng MP, et al. Differences in the vertical distribution and response to freshwater discharge between aloricate ciliates and tintinnids in the East China Sea. Journal of Marine Systems, 2016, 154(A): 103-109 | |
| Yu Y, Zhang WC, Jiang ZJ, et al. Seasonal variation of planktonic ciliates in Sanggou Bay, Huanghai Sea. Acta Oceanologica Sinica, 2013, 35(3): 215-224 [于莹, 张武昌, 蒋增杰, 等. 桑沟湾浮游纤毛虫丰度和生物量分布的季节变化. 海洋学报, 2013, 35(3): 215-224] | |
| Yu Y, Zhang WC, Zhao N, et al. Annual variations in the abundance and biomass of planktonic ciliate in the Jiaozhou Bay. Oceanologia et Limnologia Sinica, 2011, 42(5): 690-701 DOI:10.11693/hyhz201105010010 [于莹, 张武昌, 赵楠, 等. 胶州湾浮游纤毛虫丰度和生物量的周年变化. 海洋与湖沼, 2011, 42(5): 690-701] | |
| Yu Y, Zhang WC, Zhang CX, et al. Basin-scale variation in planktonic ciliate distribution: A detailed temporal and spatial study of the Yellow Sea. Marine Biology Research, 2014, 10(7): 641-654 DOI:10.1080/17451000.2013.852683 | |
| Zhang WC, Feng MP, Yu Y, et al. An illustrated guide to contemporary tintinnids in the world. Beijing: Science Press, 2012: 1-499. [张武昌, 丰美萍, 于莹, 等. 砂壳纤毛虫图谱. 北京: 科学出版社, 2012: 1-499.] |



