2. 上海海洋大学水产与生命学院 上海 201306;
3. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006
2. College of Fisheries and Science, Shanghai Ocean University, Shanghai 201306;
3. Key Laboratory of Marine Ecological restoration, Shandong Marine Resource and Environment Research Institute, Yantai 264006
细胞粘附因子(Cell adhesion molecules)介导细胞与细胞之间以及细胞与细胞外基质之间的相互作用,参与信号传导、细胞间识别、细胞增殖和分化、炎症和伤口愈合等过程(Zhuang et al, 2008)。根据结构和功能的不同,细胞粘附因子分为整合素(Integrin)、钙粘素(Cadherin)、选择素(Selectin)、免疫球蛋白超家族(Ig-superfamily)和透明质酸粘素(Hyaladherin)五类。其中,整合素是一种由一个α亚单位和一个β亚单位通过非共价键连接而成的异二聚体跨膜糖蛋白。目前,已经确认的有18种α亚单位和8种β亚单位,共组成20余种整合素(Jia et al, 2015)。大部分α亚基只结合一种β亚基,少数的如αV亚基可以与不同的β亚基结合。由于不同的α亚基和β亚基的氨基酸序列存在不同程度上的同源性,使得它们在结构上有共同的特点。整合素在体内表达广泛,大多数细胞表面都可表达一种以上的整合素,在多种生命活动中发挥关键作用。脊椎动物的Integrin作为一种重要的粘附受体,首先在淋巴细胞表面发现,目前,对于Integrin发挥的免疫功能的研究已经比较深入。Integrin细胞外的“头部”结构域可以结合配体,“颈部”是激活单位,而长度可变的细胞质内结构域形成细胞骨架起到链接信号分子的作用。此外,Integrin蛋白是双向信号转导分子(Hynes, 2002; Schwartz et al, 1995),在调控免疫反应过程中也发挥必不可少的作用(Rose et al, 2002; von Andrian et al, 2003)。近些年的研究表明,Integrin还参与肿瘤细胞粘附,比如,Integrin在口腔癌癌前病变时,起串联受体的作用(Shahidul et al, 2010);Integrin还被证明是人肠道弧菌病毒(Nelsen-Salz et al, 1999)、腺病毒(Wickham et al, 1993)、手足口病毒(Jackson et al, 2000)、乳头瘤病毒(Coulson et al, 1997)等多种病毒的受体。
在无脊椎动物中,果蝇(Drosophila melanogaster) Integrin被研究得较为透彻,现已发现3个不同的α亚基(αPS1、αPS2和αPS3)和2个β亚基,3个位置特殊的Integrin异构体(PS1、PS2和PS3)与已被发现脊椎动物的β1-Integrin最为相似(Relja et al, 2011; Stark et al, 1997; Yee et al, 1993),有研究表明,果蝇β-Integrin参与调控其血细胞吞噬细菌(Mamali et al, 2009)。在其他无脊椎动物中也相继发现了Integrin,例如,在冈比亚按蚊(Anopheles gambiae)中克隆得到的β-Integrin基因,推测其参与血细胞介导的对大肠杆菌的包囊作用,相应的结构特征可能使其具有吞噬革兰氏阴性菌的能力(Moita et al, 2006);在海洋无脊椎动物中,凡纳滨对虾(Litopenaeus vannamei) β-Integrin被认为是细胞膜上的对虾白斑综合征病毒(WSSV)受体(Li et al, 2007);中华绒螯蟹(Eriocheir sinensis) β-Integrin作为细胞受体参与抗菌免疫(Huang et al, 2015);仿刺参(Apostichopus japonicus) β-Integrin起到细胞凋亡抑制剂的作用(Wang et al, 2016)。与高等动物和模式动物相比,目前海洋无脊椎动物Integrin的研究尚处在起步阶段,有关贝类Integrin的报道十分有限。
本研究从前期已构建的大竹蛏(Solen grandis) cDNA文库中克隆获得大竹蛏β-Integrin (SgβInt)基因的cDNA全长,分析了SgβInt编码氨基酸的序列特征,通过荧光定量PCR法检测了SgβInt基因的mRNA在健康大竹蛏不同组织中的表达谱,以及在大竹蛏受到脂多糖(LPS)、肽聚糖(PGN)和葡聚糖(Glucan) 3种不同病原相关分子(PAMPs)刺激后,血细胞中SgβInt基因的响应规律,旨在了解SgβInt基因在大竹蛏防御外源微生物的免疫应答中发挥的功能,为进一步阐释无脊椎动物Integrin的结构和功能、丰富无脊椎动物先天性免疫学研究提供支持。
1 材料与方法 1.1 实验动物野生大竹蛏捕取自山东省烟台周边海区,体长为90 mm左右,共210只,实验前在20~22℃海水中暂养7 d。取其中10只大竹蛏用于解剖获得组织,剩余的200只随机均分为5组,用于PAMPs刺激实验,LPS、PGN和Glucan等3种PAMPs分别用PBS(0.14 mol/L NaCl, 3 mmol/L KCl, 8 mmol/L Na2HPO4, 1.5 mmol/L KH2PO4, pH=7.4)溶解,终浓度分别为0.5、0.8和1.0 mg/ml;以50 μl/只的剂量注射大竹蛏肌肉(Yang et al, 2011)。第1~3组分别注射LPS、PGN、Glucan,第4组注射PBS作为阴性对照,第5组未作任何处理作为空白对照。
1.2 RNA的提取和cDNA模板的合成解剖大竹蛏,取肌肉、外套膜、血细胞、性腺、肝胰腺和鳃等,加入TRIzol (Invitrogen),存于–80℃。
PAMPs注射后3、6、12、24和48 h分别从实验组和对照组中随机取5只大竹蛏,注射器吸取预冷的抗凝剂(0.1 mol/L葡萄糖,13 mmol/L柠檬酸,15 mmol/L柠檬酸钠,0.45 mol/L NaCl,10 mmol/L EDTA,pH=7.0),抽取血淋巴,4℃ 800 g条件下离心5 min,收集血细胞,以1 ml TRIzol重悬,存于–80℃。
所有保存于TRIzol中的样品,按照TRIzol试剂盒说明书提取RNA,经DNase I (Promega)降解DNA,反应体系:RNA 8 μl, RQ1 RNase-Free DNase 5× Reaction Buffer 2.5 μl,RQ1 RNase-Free DNase 1 μl,RNase抑制剂0.6 μl,于37℃反应30 min;加入1 μl Stop solution,65℃ 10 min灭活DNase;加入2× Oligo dT 2.5 μ1,70℃反应5 min,冰浴2 min。反应体系:5×M-MLV反应缓冲液6.5 μl,RNase-Free dNTP 12.5 μl,RNase抑制剂1.25 μl,M-MLV反转录酶2.5 μl,RNase-Free水1 μl,42℃反转录1 h,95℃ 5 min灭活反转录酶。模板存入–80℃,用于荧光定量PCR分析。
1.3 SgβInt基因cDNA全长的克隆在本研究前期工作构建的大竹蛏cDNA文库中,用BLAST分析获得SgβInt基因的EST序列,将对应质粒转入Trans5α感受态细胞(全式金)中,挑取单菌落,以pBluescript II SK*载体的通用引物M13F和M13R对其进行重新测序。
1.4 SgβInt基因的序列分析在http://www.expasy.org/进行蛋白等电点和分子量预测;用BLAST软件进行序列同源性比较和相似性搜索;使用SingalP查找信号肽;使用MEGA 4.1软件,将SgβInt基因和家蚕(Bombyx mori)、通讯鳌虾(Pacifastacus leniusculus)、紫海胆(Strongylocentrotus purpuratus)、双脐螺(Biomphalaria glabrata)、凡纳滨对虾、中华绒螯蟹、果蝇、冈比亚按蚊、仿刺参、鸭嘴海豆芽(Lingula anatina)、小菜蛾(Plutella xylostella)、豌豆蚜(Acyrthosiphon pisum)、长牡蛎(Crassostrea gigas)、瓜实蝇(Bactrocera cucurbitae)、地中海实蝇(Ceratitis capitata)、意大利蜂(Apis mellifer)、华支睾吸虫(Clonorchis sinensis)、粘虫(Mythimna separata)和大乳头水螅(Hydra magnipapillata)等20个物种的β-Integrin基因编码的氨基酸序列以邻接法(Neighbor-joining)构建系统进化树;使用SWISS-MODEL预测SgβInt基因编码氨基酸序列的三级结构,利用pyMOL软件展示。
1.5 荧光定量PCR检测将cDNA模板稀释100倍,使用Mastercycler ep realplex(Eppendorf)荧光定量PCR仪进行PCR扩增。反应体系20 μl:2×SYBR Green Master Mix (Applied Biosystems)10 μl、稀释100倍后的cDNA模板2 μl、正反引物各1 μl和6 μl水。SgβInt的正向引物为5'-AAGCGTGTCCGAGCAAATGTC-3',反向引物为5'-TGTGGGGAGGGGTAGGATAAT-3';内参基因β-actin的正反向引物分别为5'-TGTACGCCAACAC TGTCCTGTC-3'和5'-CATCGTATTCCTGCTTGCT GATC-3'。反应程序:50℃ 2 min,95℃ 10 min;94℃ 30 s,60℃ 60 s,40个循环。采用2-ΔΔCt法分析实验数据,以t检验分析显著性,P < 0.05为差异显著,P < 0.01为差异极显著。
1.6 SgβInt基因重组载体的构建PCR反应扩增SgβInt成熟肽DNA序列,反应体系:菌液模板1 μl,10×Buffer 2.5 μl,2.5 mmol/L dNTP 2 μl,正反引物各1 μl,Taq酶1 μl,DEPC水补足至25 μl。重组正反引物分别为5'-AACATGAGGTCCAT-GATAAACGG-3 和5 -TCATGTTGTAGTGTATGTC-TCACTGGTC-3'。反应条件:94℃ 5 min;94℃ 30 s,62℃ 30 s,72℃ 80 s,35个循环;72℃ 10 min;4℃保存。PCR产物0.5~4.0 μl;PEASY E1 Expression Vector(全式金) 1 μl,混合后室温反应5 min,将连接产物加入Trans-T1(全式金)感受态细胞中,42℃水浴热激60 s;加入LB液体培养基,涂布平板,培养过夜。挑选单菌落由北京诺赛基因组研究有限公司测序。
1.7 SgβInt基因重组蛋白的诱导表达将测序结果正确的菌株使用EZNA mini plasmid (Omega)试剂盒按照步骤提取质粒转入Transetta(全式金)感受态细胞中,涂布平板,37℃培养过夜。挑取单菌落,加入含氨苄青霉素(AMP)的LB培养基中,200 r/min、37℃震荡培养至OD600 nm约为0.6;加入终浓度为1 mmol/L的IPTG诱导表达目的蛋白,37℃ 200 r/min诱导培养4 h;4℃、5000 r/min离心10 min,收集菌体沉淀。以12%的SDS-PAGE电泳分析诱导表达结果。
2 结果 2.1 SgβInt基因cDNA的克隆及序列特点测序结果拼接获得的SgβInt基因cDNA全长,提交至GenBank获得登录号KX925404,其全长为1168 bp,5′和3′分别含61 bp和18 bp的非编码区(UTR),开放阅读框(ORF)为1089 bp,共编码362个氨基酸,其中,在42~74位氨基酸和103~135位氨基酸处分别为EGF like和EGF结构域。同源性分析显示,SgβInt与家山羊(Capra hircus)和小鼠(Mus musculus)的相似性最高,分别为37%和36%;利用SignalP软件预测发现,SgβInt基因编码区前22位氨基酸序列为信号肽序列(图 1)。ExPASy预测重组后的SgβInt基因编码蛋白的理论等电点约为4.98,分子量大小为30.0 kDa。

|
图 1 SgβInt基因的核苷酸及其编码的氨基酸序列 Figure 1 The nudeotide and deduced amino acid squences of SgβInt 黑体加粗表示起始密码子和终止密码子;下划线表示信号肽;阴影部分表示Integrin结构域。 The start and stop codons are marked in bold, the signal peptide sequence is underline and the Integrin is shaded. |
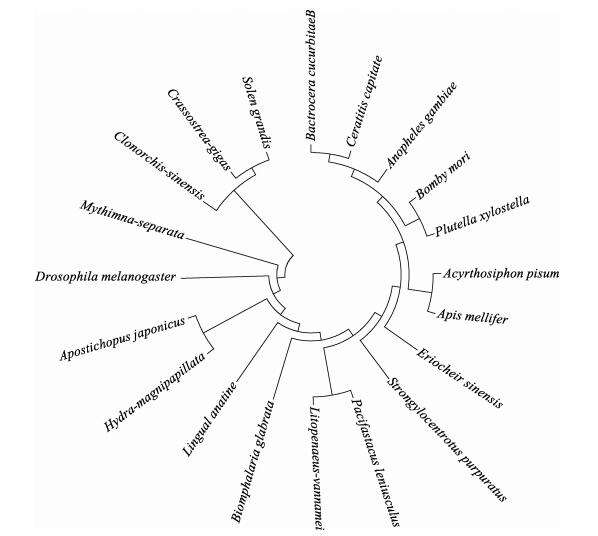
使用MEGA 4.1软件的邻接法构建系统进化树,所用Integrin的GenBank登录号如下:家蚕(NP_001161754.1)、通讯鳌虾(CAA67357.1)、紫海胆(XP_011679515.1)、双脐螺(AF060203.1)、凡纳滨对虾(ADK56123.1)、中华绒螯蟹(AKJ26284.1)、果蝇(AAC37169.1)、冈比亚按蚊(AAM11657)、仿刺参(AMR60824.1)、鸭嘴海豆芽(XM_013560388.1)、小菜蛾(GQ178290.1)、豌豆蚜(XM_003244399.3)、长牡蛎(EKC27174.1)、瓜实蝇(XP_011182368.1)、地中海实蝇(XP_004521716.1)、意大利蜂(XP_006564503.1)、华支睾吸虫(GAA31131.2)、粘虫(BAJ16205.1)、大乳头水螅(XP_002159375.2)。
用MEGA 4.1软件构建出SgβInt编码的氨基酸与20个物种的β-Integrin基因编码的氨基酸序列的系统进化树,结果显示,SgβInt编码氨基酸与长牡蛎β-Integrin编码氨基酸的亲缘关系最近,二者构成软体动物分支(图 2)。
|
图 2 SgβInt与其他物种β-Integrin的系统进化树 Figure 2 Phylogenetic tree based on SgβInt sequence with β-Integrin of other species |
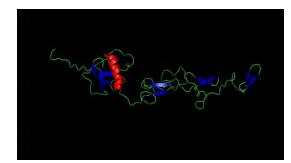
使用SWISS-MODEL预测SgβInt中EGF-like、EGF和Integrin-β-tail三个结构域的三级结构,由图 3可以看出,SgβInt编码氨基酸的三维结构包括1个α-螺旋和9个β-折叠,α-螺旋靠近其中3个β-折叠,另外6个β-折叠每2个形成1组。
|
图 3 SgβInt蛋白的三级结构 Figure 3 The predicted spatial structure of SgβInt 蓝色:β-折叠;红色:α-螺旋 Blue: β-sheets; Red: α-helices |
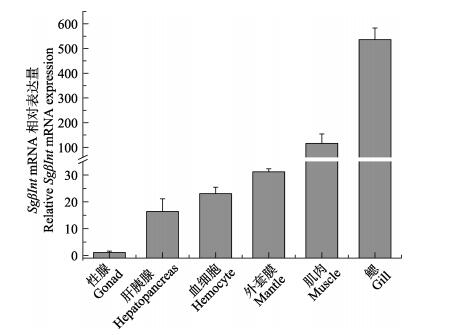
运用荧光定量PCR方法检测了SgβInt基因在健康大竹蛏不同组织中的表达规律,SgβInt基因在健康大竹蛏的各个组织中均有表达,在鳃中表达量最高,是性腺的487.5倍;在肌肉、外套膜、血细胞和肝胰腺的表达量分别为性腺表达量的105.7、28.3、21.0、14.9倍;在性腺中表达量最低(图 4)。
|
图 4 SgβInt mRNA在不同组织中的表达谱 Figure 4 SgβInt mRNA expression level in different tissues |
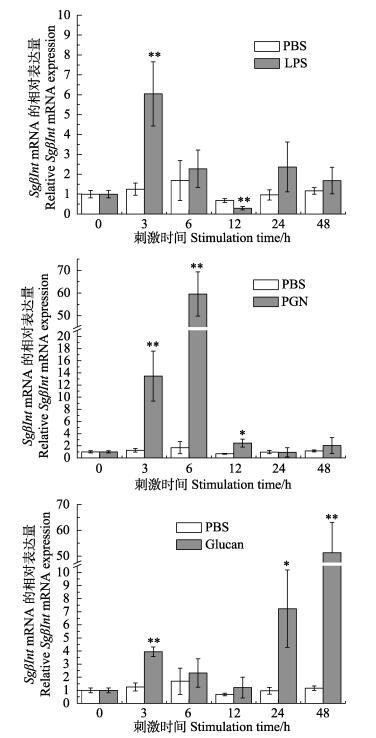
荧光定量PCR法检测LPS、PGN和Glucan刺激后大竹蛏血细胞中SgβInt基因的表达规律,结果显示,SgβInt基因的表达量在各种PAMPs刺激后均呈现上升趋势,并且都在刺激后3 h表现出极显著升高。其中,受到LPS刺激后,SgβInt基因表达量在3 h达到最高(P < 0.01),为空白对照的4.8倍,随后逐渐降低,在12 h达到最低(P < 0.01),为空白对照的0.4倍;PGN刺激使SgβInt基因的表达量上调幅度最大,继在刺激3 h时上升为空白组的10.8倍后(P < 0.01),在6 h达到最高,是空白对照的35.3倍(P < 0.01),随后显著降低;Glucan刺激也能诱导SgβInt基因的表达量出现上调,在刺激3 h时为空白对照的3.2倍(P < 0.01),随后逐渐降低,但与LPS、PGN刺激后的表达模式不同的是,SgβInt在24 h时再次出现显著升高(P < 0.05),并在48 h达到峰值,为空白对照的44.1倍(P < 0.01)(图 5)。
|
图 5 血细胞中SgβInt mRNA在PAMPs刺激后的表达水平 Figure 5 The SgβInt mRNA expression level in hemocytes after PAMPs stimulation |
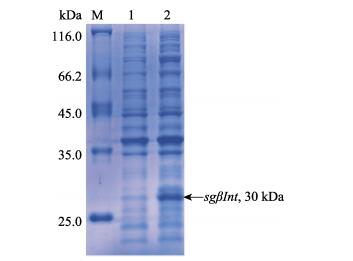
SDS-PAGE分析对比诱导前后的SgβInt蛋白重组菌株,诱导菌株的泳道明显看到诱导蛋白的条带,重组蛋白的分子量大小约为30 kDa,与预测的结果相一致,证明SgβInt基因编码蛋白被诱导表达(图 6)。
|
图 6 重组SgβInt的SDS-PAGE分析 Figure 6 SDS-PAGE analysis of recombinant SgβInt M:蛋白质分子量标准;1:未诱导的重组SgβInt;2:诱导的重组SgβInt M: Protein molecular standard; 1: Negative control for recombinant SgβInt (without induction); 2: IPTG induced recombinant SgβInt |
整合素是细胞膜上粘附因子的一种,属于具有保守αβ异构体的细胞表面受体大家族(Hagen et al, 2001)。高等动物的整合素Integrin已被证明可作为人肠道弧菌病毒、腺病毒、手足口病毒、乳头瘤病毒等多种病毒的受体。近几年,陆续有研究发现,无脊椎动物整合素Integrin也参与多种免疫反应。而有关海洋无脊椎动物整合素Integrin的研究还相对较少。本研究以大竹蛏为研究对象,克隆得到了β-Integrin基因的cDNA全长。通过Blast分析发现,该基因编码蛋白与家山羊和小鼠等脊椎动物的β-Integrin基因编码蛋白相似,而分析SgβInt基因编码蛋白的序列特点发现,在以邻接法构建的SgβInt与其他物种β-Integrin的系统进化树中,SgβInt与长牡蛎β-Integrin构成了软体动物分支;并且其三级结构包括1个α-螺旋和9个β-折叠,与孔雀鱼(Poecilia reticulata)和红鳍东方鲀(Takifugu rubripes)的β-Integrin基因编码蛋白三维结构相似。综合以上分析结果,SgβInt为β-Integrin家族成员。
仿刺参、长牡蛎、凡纳滨对虾等海洋无脊椎动物的Integrin基因具有组织分布广泛的特点,与以上报道类似,本研究发现,SgβInt在所有检测组织中均有表达。组织表达谱广与β-Integrin在机体的生命活动中参与多种过程密切相关。但是,这些物种的β-integrin基因的组织表达谱存在差异,尤其是它们呈现高表达量的组织部位不同,如仿刺参β-integrin在肌肉中的表达量最高(Wang et al, 2016),而长牡蛎和凡纳滨对虾β-integrin则分别在性腺和血细胞中表达量最高(Lin et al, 2013; Jia et al, 2015)。SgβInt在鳃的表达量最高,由于鳃是大竹蛏用于滤食和气体交换的器官,与水环境直接接触,考虑到水环境中存在多种外源微生物,SgβInt基因在鳃中的高表达暗示其可能在大竹蛏抵御外源微生物的过程中发挥重要作用。
为分析SgβInt是否参与大竹蛏抵御外源微生物的过程,本研究用LPS、PGN和Glucan等微生物多糖刺激大竹蛏,并检测血细胞中SgβInt mRNA的表达规律。微生物多糖LPS、PGN和Glucan是微生物表面某些共有的高度保守的分子结构,宿主细胞不能自主产生这些多糖,为微生物所特有,是微生物生存或致病必需的。LPS、PGN和Glucan刺激都能诱导SgβInt在大竹蛏血细胞中的表达显著上调,揭示SgβInt参与大竹蛏抵御多种外源微生物的免疫过程。其中,PGN和Glucan刺激后,SgβInt的表达量上调最为显著,说明SgβInt可能更容易被革兰氏阳性菌和真菌诱导。中华绒螯蟹(Huang et al, 2015)和长牡蛎(Jia et al, 2015)的β-Integrin在受到LPS刺激后6 h时达到最高表达量,而本研究中,一方面SgβInt的表达量在3 h时达到最高,大竹蛏SgβInt对于LPS的响应时间早于中华绒螯蟹和长牡蛎Integrin。另一方面,SgβInt在大竹蛏受到PGN和Glucan刺激后达到最高表达量的时间不一致,其对于不同微生物多糖的响应时间不同,推测其清除作用机制存在差异。
重组的基因编码蛋白是研究基因功能的有利工具。利用制备的重组蛋白,已有研究发现,中华绒螯蟹的β-Integrin可以包括凝集金黄色葡萄球菌、藤黄微球菌、大肠杆菌在内的多种细菌,并能够协助机体清除副溶血弧菌等致命菌(Huang et al, 2015);而长牡蛎和仿刺参的β-Integrin都对LPS有较高的亲和力(Lin et al, 2013; Wang et al, 2016);构建SgβInt编码蛋白的重组载体,为获得SgβInt重组蛋白,制备抗Integrin重组蛋白抗体,进一步分析SgβInt编码蛋白的功能提供了必要的实验材料。SgβInt编码蛋白对于外源微生物的作用方式还不明确,有待于进一步研究。
本研究中SgβInt基因的克隆、特性分析及其重组载体的构建,揭示了SgβInt基因的序列特点及其对于PAMPs的响应规律,为了解大竹蛏对外源微生物的免疫防御机理和进一步分析其作用机制奠定了基础。
| Coulson BS, Londrigan SL, Lee DJ. Rotavirus contains integrin ligand sequences and a disintegrin-like domain that are implicated in virus entry into cells. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(10): 5389-5394 DOI:10.1073/pnas.94.10.5389 | |
| Hagen HE, Kl ger SL. Integrin-like RGD-dependent cell adhesion mechanism is involved in the rapid killing of Onchocerca microfilariae during early infection of Simulium damnosum s.l.. Parasitology, 2001, 122(4): 433-438 | |
| Huang Y, Zhao LL, Feng JL, et al. A novel integrin function in innate immunity from Chinese mitten crab (Eriocheir sinensis). Developmental and Comparative Immunology, 2015, 52(2): 155-165 DOI:10.1016/j.dci.2015.05.005 | |
| Hynes RO. Integrins: Bidirectional, allosteric signaling machines. Cell, 2002, 110(6): 673-687 DOI:10.1016/S0092-8674(02)00971-6 | |
| Jackson T, Sheppard D, Denyer M, et al. The epithelial integrin alpha-vbeta 6 is a receptor for foot-and-mouth disease virus. Journal of Virology, 2000, 74(11): 4949-4956 DOI:10.1128/JVI.74.11.4949-4956.2000 | |
| Jia ZH, Zhang T, Jiang S, et al. An integrin from oyster Crassostrea gigas mediates the phagocytosistoward Vibrio splendidus through LPS binding activity. Developmental and Comparative Immunology, 2015, 53(1): 253-264 DOI:10.1016/j.dci.2015.07.014 | |
| Li DF, Zhang MC, Yang HJ, et al. β-integrin mediates WSSV infection. Virology, 2007, 368(1): 122-132 DOI:10.1016/j.virol.2007.06.027 | |
| Lin YC, Chen JC, Chen YY, et al. Characterization of whiteshrimp Litopenaeus vannamei integrin β and its role in immunomodulation by dsRNA-mediated gene silencing. Developmental and Comparative Immunology, 2013, 40(2): 167-179 DOI:10.1016/j.dci.2013.01.001 | |
| Mamali I, Lamprou I, Karagiannis F, et al. A β integrin subunit regulates bacterial phagocytosis in medfly haemocytes. Developmental and Comparative Immunology, 2009, 33(7): 858-866 DOI:10.1016/j.dci.2009.02.004 | |
| Moita LF, Vriend G, Mahairaki V, et al. Integrins of Anopheles gambiae and a putative role of a new β integrin, BINT2, in phagocytosis of E. coli. Insect Biochemistry and Molecular Biology, 2006, 36(4): 282-290 DOI:10.1016/j.ibmb.2006.01.004 | |
| Myat MM, Rashmi RN, Manna D, et al. Drosophila KASH-domain protein Klarsicht regulates microtubulestability and integrin receptor localization during collective cellmigration. Developmental Biology, 2015, 407(1): 103-114 DOI:10.1016/j.ydbio.2015.08.003 | |
| Nelsen-Salz B, Eggers HJ, Zimmermann H. Integrin alpha (v) beta3 (vitronectin receptor) is a candidate receptor for the virulent echovirus 9 strain Barty. Journal of General Virology, 1999, 80(9): 2311-2313 DOI:10.1099/0022-1317-80-9-2311 | |
| Relja B, Meder F, Wang M, et al. Simvastatin modulates the adhesion and growth of hepatocellular carcinoma cells via decrease of integrin expression and ROCK. International Journal of Oncology, 2011, 38(3): 879 | |
| Rose DM, Han J, Ginsberg MH. Alpha4 integrins and the immune response. Immunological Reviews, 2002, 186(1): 118-124 DOI:10.1034/j.1600-065X.2002.18611.x | |
| Schwartz MA, Schaller MD, Ginsberg MH. Integrins: Emerging paradigms of signal transduction. Annual Review of Cell Developmental Biololgy, 1995, 11: 549-599 DOI:10.1146/annurev.cb.11.110195.003001 | |
| Shahidul A, Yamazaki M, Maruyama S, et al. Differential expression of perlecan receptors, α-dystroglycan and integrin β1, before and after invasion of oral squamous cell carcinoma. Journal of Oral Pathology and Medicine, 2011, 40(7): 552-559 DOI:10.1111/jop.2011.40.issue-7 | |
| Stark KA, Yee GH, Roote CE, et al. A novel alpha integrin subunit associates with betaPS and functions in tissue morphogenesis and movement during Drosophiladevelopment. Development, 1997, 124(22): 4583-4594 | |
| von Andrian UH, Engelhardt B. Alpha4 integrins as therapeutic targets in autoimmune disease. New England Journal Medicine, 2003, 348(1): 68-72 DOI:10.1056/NEJMe020157 | |
| Wang ZH, Shao Y, Li CH. A β-integrin from sea cucumber Apostichopus japonicus exhibits LPS binding activity and negatively regulates coelomocyte apoptosis. Fish and Shellfish Immunology, 2016, 52: 103-110 DOI:10.1016/j.fsi.2016.03.031 | |
| Wickham TJ, Mathias P, Cheresh DA, et al. Integrins-alpha-v-beta-3 and alpha-v-beta-5 promote adenovirus internalization but not virus attachment. Cell, 1993, 73(2): 309-319 DOI:10.1016/0092-8674(93)90231-E | |
| Yang JL, Wang LL, Zhang Huan, et al. C-type lectin in Chlamys farreri (CfLec-1) mediating immune recognition and opsonization. PLoS One, 2011, 6(2): e17089 DOI:10.1371/journal.pone.0017089 | |
| Yee GH, Hynes RO. A novel, tissue-specific integrin subunit, beta nu, expressed in the midgut of Drosophila melanogaster. Development, 1993, 118(3): 845-858 | |
| Zhuang SF, Kelo L, Nardi JB, et al. Multiple α subunits of integrin are involved in cell-mediated responses of the Manduca immune system. Developmental and Comparative Immunology, 2008, 32(4): 365-379 DOI:10.1016/j.dci.2007.07.007 |




