2. 广东省水产优质环保养殖工程技术研究中心 华南师范大学生命科学学院 广州 510631
2. Guangdong Provincial Engineering Technology Research Center for Environmentally-Friendly Aquaculture, College of Life Sciences, South China Normal University, Guangzhou 510631
X盒结合蛋白1(Xbp1, X-box binding protein 1)是一种重要的细胞转录因子,与人体许多机能密切相关,如B细胞、肝细胞和树突状细胞的发育分化,心肌细胞的存活及肝脂肪的调节等(Wang et al, 2008; Iwakoshi et al, 2007; Tellier et al, 2016)。Xbp1为碱性亮氨酸拉链蛋白,有剪切型Xbp1(Xbp1 spliced, Xbp1-S)和未剪切型Xbp1(Xbp1 unspliced, Xbp1-U)两种类型。两种不同剪切类型的Xbp1具有不同的转录活性,其中,Xbp1-S的转录活性明显高于Xbp1-U (Zhou et al, 2008)。Xbp1-S是CREB/ATF蛋白家族的成员,最早由Liou等(1990)在研究人类B细胞的时候发现的一种转录因子。随后在内质网应激时的研究发现不同于Xbp1-U的另一种剪切形式Xbp1-S,是由Ⅰ型跨膜蛋白激酶核酸内切酶(TypeⅠ transmembrane protein kinase, ⅠRE1)剪切Xbp1-U的mRNA所产生(Yoshida et al, 2001; Calfon et al, 2002)。Xbp1参与B细胞向浆细胞的分化,是经过调控IL-6的生成并通过进一步非折叠蛋白质应答(Unfolded protein response, UPR)途径所促进的(Calfon et al, 2002; Iwakoshi et al, 2003)。在哺乳动物中,Xbp1的异常活动也可以促进恶性浆细胞的分化(Reimold et al, 2001)。作为剪切后的Xbp1-S具有更高的转录活性,能进去细胞核调节未折叠的蛋白质反应。
Xbp1-S是一种高度保守的蛋白,从低等酵母到高等哺乳动物中均有存在(Liou et al, 1990)。在硬骨鱼中,Xbp1-S的研究逐步增加,现已报道的鱼类包括斑马鱼(Danio rerio)(Hu et al, 2007; Bennett et al, 2007)、鲤鱼(Cyprinus carpio)(彭少卿等, 2013)、红鳍东方鲀(Takifugu rubripes)(Ohtani et al, 2006)、虹鳟(Oncorhynchus mykiss)(Barr et al, 2011)和大西洋鲑(Salmo salar)(Leong et al, 2010)等。Hu等(2007)在斑马鱼的胚胎细胞中发现,当UPR应对内质网应激时,Xbp1可以通过IGF1/Akt激活凋亡信号发挥抑制作用;Barr等(2011)利用Xbp1作为标记分子进行鉴定不同分化程度的B细胞亚类;Zwollo等(2005、2008)利用Xbp1以及Pax-5等转录因子对虹鳟鱼的肾脏进行分区,并进一步揭示虹鳟鱼B细胞的发育分化与Xbp1的表达相关。但关于尼罗罗非鱼Xbp1-S的研究还未见相关报道。另外,与哺乳动物相比,有关硬骨鱼Xbp1-S的研究还处于起步阶段,其在宿主应对病原侵染中的作用尚待进一步明确。
罗非鱼是联合国推荐养殖的优质水产养殖品种之一。我国是最大的罗非鱼生产国,近些年,因养殖规模扩大、高密度养殖、水体污染等,导致罗非鱼鱼病大规模暴发,如链球菌病,造成巨大经济损失(卢迈新, 2010)。本研究选用尼罗罗非鱼为实验鱼,旨在克隆Xbp1-S基因cDNA全长并序列比对,从基因和蛋白水平上分析无乳链球菌应激胁迫后尼罗罗非鱼各组织的时空表达模式,并查明该因子在不同分化程度B细胞亚类中的表达水平,为进一步研究尼罗罗非鱼Xbp1-S在防御链球菌侵染中所起作用及其调控B细胞发育分化机制提供理论基础。
1 材料与方法 1.1 实验材料实验用鱼购自广东省渔业种质保护基地,健康尼罗罗非鱼的体重为(200±10) g,体长为(13±2) cm。养殖温度为(29±1)℃,早晚投喂饲料,加气泵供氧,饲养14 d使其充分适应养殖环境,观察鱼体外观和活动能力,确认完全健康后用于实验。无乳链球菌菌株为本实验室保存菌株。PCR反应体系所用试剂、pMD-18T Vector、限制性内切酶、Trizol、反转录试剂盒(PrimeScript™RT reagent kit with gDNA eraser)和荧光定量试剂盒(SYBR Premix Ex TaqTM)均购自TaKaRa公司;E.coli DH5α感受态、E.coli BL21(DE3)感受态、胶回收试剂盒和质粒提取试剂盒(TIANprep mini plasmid kit)购自TIANGEN公司;pET32a(+) Vector由本实验室保存,SMARTTM RACE cDNA amplification kit购自BD Biosciences Clontech公司。Trizol、2×Prime Mix、Ex Taq、10×Buffer、dNTP、pMD 18-T Vector、Solution I和反转录试剂盒购自TaKaRa公司。氨苄青霉素、氯仿和异丙醇等试剂购自广州化学试剂公司,其余实验试剂均为国产分析纯。引物(表 1)由华大基因科技服务有限公司合成。
|
|
表 1 基因克隆和表达所用的引物 Table 1 Primers used in the cloning and expression |
采用Trizol(Invitrogen)法进行总RNA提取。取健康尼罗罗非鱼头肾,用匀浆器充分研磨,并按照Trizol试剂的使用说明书提取总RNA,RNA完整性和纯度用1%琼脂糖凝胶电泳检测,并用微量分光光度计NANO2000检测其浓度,-80℃保存。利用普通的反转录试剂盒进行反转录合成cDNA模板,使用SMARTTM RACE cDNA amplification kit将总RNA逆转录成5’、3’-RACE cDNA模板(Yao et al, 2016)。反转录结束后对模板进行有效性的检测,以β-actin作为内参基因进行PCR鉴定,合格后–20℃保存。
1.2.2 尼罗罗非鱼Xbp1-S的基因全长cDNA的克隆和测序在NCBI搜索尼罗罗非鱼的Xbp1基因,根据预测序列(XM_013276886.1),应用软件Primer Premier 5.0进行引物Xbp1-F1和Xbp1-R1设计(表 1),以尼罗罗非鱼头肾cDNA为模板,以Xbp1-F1和Xbp1-R1为引物进行Xbp1-S的cDNA的扩增,PCR反应的体系为25 μl,反应程序:94℃预变性3 min;94℃变性30 s;58.0℃退火30 s;72℃延伸1.0 min;30个循环。扩增的PCR产物经1%琼脂糖凝胶电泳检测后,送往北京六合华大基因公司进行测序。测序结果经NCBI (http://www.ncbi.nlm.nih.gov)比对,获得尼罗罗非鱼Xbp1-S的cDNA序列。
1.2.3 尼罗罗非鱼Xbp1-S的基因3’和5’-RACE扩增根据获得的Xbp1-S的CDS序列,设计Xbp1-S的5’-RACE PCR和3’-RACE PCR的引物Xbp1-F2、Xbp1-F3、Xbp1-R2和Xbp1-R3(表 1),采用巢式PCR方法进行3’和5’-RACE的扩增,先分别用Xbp1-F2、Xbp1-R2和UPM混合引物(混合浓度参照试剂盒说明书)进行首轮扩增,然后利用首轮扩增的PCR产物稀释10倍作为第二轮模板,再分别用Xbp1-F3、Xbp1-R3和NUP为引物进行第二轮扩增,全长克隆采用20 μl PCR反应体系(Yao et al, 2016)。反应程序:94℃预变性3 min;94℃变性30 s;68℃退火30 s;72℃延伸1 min,35个循环。扩增的PCR产物经1%琼脂糖凝胶电泳检测后,送往北京六合华大基因公司进行测序。测序结果与Xbp1-S的cDNA序列比对结果见图 1,找出起始密码子和polyA加尾信号。

|
图 1 尼罗罗非鱼Xbp1-S基因cDNA全序列以及由此推测的氨基酸序列 Figure 1 The cDNA and putative amino acid sequence of Xbp1-S in O. niloticus 起始密码子和终止密码子由细线框标出;下划线表示Xbp1-S的锌指结构区域;阴影部分表示原核表达的抗原结合区域;短虚线表示RACE结果的加尾信号 Start codon (atg) and stop codon (tga) were marked with filament box; regular underline represented the basic-region leucine zipper (bZIP) domain of X-box binding protein 1 (Xbp1); shadow represented the Prokaryotic expressed sequence, short dash underline represented tailing signal of RACE |
用DNAStar软件中的SeqMan程序去克隆载体,将3’、5’测序结果结合CDS序列进行拼接分析,进一步确认Xbp1-S扩增获得CDS的全长。用NCBI网站的BLAST程序进行编码蛋白序列的碱基同源性分析;用Bioedit软件将尼罗罗非鱼与其他鱼类的Xbp1-S的氨基酸序列进行多重比对;应用MEGA 6.0软件,采用邻位相接法(NJ法)构建系统发育树,并用Bootstrap重复1000次计算各分支的置信度。蛋白质理化性质预测使用ProtParam软件(http://web.expasy.org/protparam/),使用NCBI网站保守结构域(CDD)数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行氨基酸序列的保守结构域预测。
1.2.5 尼罗罗非鱼Xbp1-S多克隆抗体的制备根据Xbp1-S的CDS序列的锌指结构,选取包含锌指结构的起始密码子甲硫氨酸开始的前504 bp的碱基进行原核表达分析,构建pET32A-XBP1的蛋白表达载体,并导入到BL21中特异性表达出约40 kDa的目的片段(包含pPET32A载体本身的分子量)。并进一步进行蛋白的大批量表达和纯化,获得目的蛋白,将纯化后的重组蛋白浓缩后与弗氏佐剂(Sigma)混合,腹腔免疫小鼠(BALB/c, 8周),2周免疫1次,连续免疫4次,首次免疫使用弗氏完全佐剂,再次免疫使用弗氏不完全佐剂,每次免疫蛋白用量为50 μg/只。尾部静脉取血,获得抗血清后检测抗性,通过直接ELISA检测其效价。在第4次免疫后4 d (达到抗体效价最高),进行尾部静脉取血,获得抗血清,用于蛋白的检测和免疫组化等实验。
1.2.6 尼罗罗非鱼Xbp1-S组织表达采用荧光定量PCR的方法检测Xbp1在mRNA水平上在健康罗非鱼各组织中的表达量,用Western-blot的方法检测Xbp1蛋白在各组织中的分布。取健康的3尾尼罗罗非鱼,取头肾、后肾、脾脏、皮肤、鳃、肠、胸腺、肝脏和肌肉组织,用液氮速冻后置于–80℃保存。并进行各组织RNA及组织蛋白的提取后进行RT-PCR和Western-blot组织蛋白的检测。用于RT-PCR检测尼罗罗非鱼不同组织中表达的引物见表 1。反应条件:95℃ 3 min;95℃ 1 min;60℃ 30 s;72℃ 30 s,35个循环。每个样本重复3次,根据Ct (Threshold cycles)值(15<Ct<35),以β-actin基因为内参,利用公式2-ΔCt得出每个样本Xbp1基因的相对表达值。
1.2.7 无乳链球菌应激实验取60尾健康尼罗罗非鱼随机分成2组,即应激组和对照组。应激组腹腔分别注射100 μl浓度为5×105 CFU/μl的无乳链球菌(Tellez-Bañuelos et al, 2009; Gan et al, 2015);对照组腹腔注射100 μl无菌PBS,注射0、6、24、48、192、264 h后,分别在应激组和对照组随机取3尾鱼,取各组织用液氮速冻后保存于–80℃冰箱,用于后续各组织Xbp1基因的RT-PCR分析检测。RT-PCR扩增体系为20 μl,试剂添加按照SYBR® Premix Ex TaqTM Ⅱ说明书进行。反应程序:95℃ 3 min;95℃ 1 min;60℃ 30 s;72℃ 30 s,35个循环。2-ΔΔCt方法对荧光定量PCR检测结果进行分析,显著性用SPSS 17.0软件进行分析并用SigmaPlot 10.0作图。
1.2.8 Xbp1免疫组化选取健康尼罗罗非鱼的头肾白细胞用于免疫组化实验。头肾白细胞的分离采用Percoll密度梯度分离法进行,根据尼罗罗非鱼B细胞的比重,分别配制Percoll 40、50、60及70试剂,叠加后配成Percoll密度梯度分离液,从而分离开发育分化程度不同的B细胞亚类。在超净工作台取健康尼罗罗非鱼的头肾并加入3 ml 1640细胞培养液进行充分研磨,吸取上清液,去除大的组织块,备用。根据使用说明书,首先把Percoll(GE Healthcare)原液用10×PBS(NaH2PO4·2H2O 2.286 g,Na2HPO4·12H2O 29.14 g,NaCl 87.75 g) 9:1稀释为备用Percoll储存液,然后用1×PBS进一步配成Percoll 40、50、60和70,进行叠加各层分离B细胞。把分离的细胞进一步细胞涂片后进行采用EnVisionTM免疫组织化学二步法,主要步骤包括:切片用二甲苯脱蜡,梯度乙醇脱苯,去离子水水化;3%过氧化氢溶液室温避光孵育25 min阻断内源性过氧化物酶;3% BSA室温封闭30 min后滴加一抗,4℃孵育过夜;荧光二抗室温孵育30 min;荧光显微镜镜检,阳性细胞呈现明显的荧光,并对图像采集分析。
2 结果与分析 2.1 OnXbp1-S基因cDNA全长克隆及序列分析根据已经获得的ORF序列,进一步设计特异性RACE引物Xbp1-F2、Xbp1-F3及Xbp1-R2和Xbp1-R3 (表 1)。Xbp1-F2和Xbp1-R2与通用引物UPM以及Xbp1-F3和Xbp1-R3与通用引物NUP分别配对,进行3’-RACE和5’-RACE扩增(Yao et al, 2016),所得产物经测序拼接后,获得尼罗罗非鱼基因全长cDNA序列为1155 bp,3’端非编码区(3'UTR)长98 bp,5’端非编码区(5’UTR)长127 bp,3’端含有polyA尾以及多聚腺苷酸AATAA加尾信号(图 1)。氨基酸序列分析可知,OnXbp1-S基因可以编码384个氨基酸残基,其推导的分子量为41.32 kDa,理论等电点为4.36。由蛋白质的功能预测可知,OnXbp1-S含有174 bp的锌指结构区域(图 1下划线部分),该区域是比较保守的蛋白结构,该蛋白属于碱性亮氨酸拉链结构蛋白。
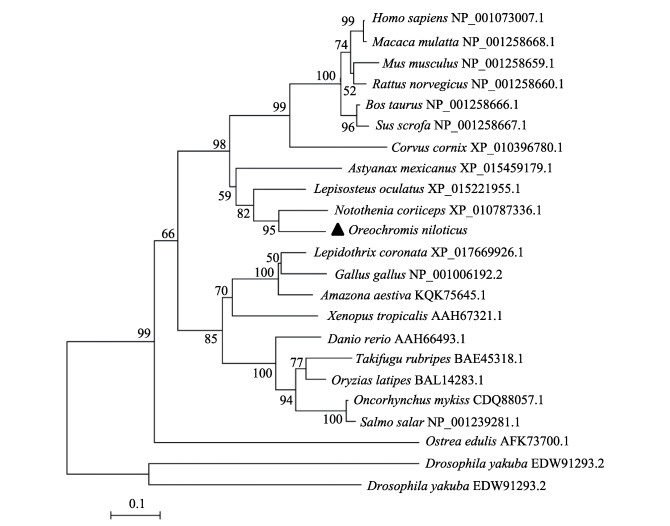
2.2 OnXbp1-S基因的同源性分析利用Bioedit软件对尼罗罗非鱼Xbp1基因编码的氨基酸序列与红鳍东方鲀、虹鳟、欧洲食用牡蛎(Ostrea edulis)、斑马鱼、斑点雀鳝(Lepisosteus oculatus)、墨西哥脂鲤(Astyanax mexicanus)、青鳉(Oryzias latipes)、南极鳕(Notothenia coriiceps)、原鸡(Gallus gallus)、小鼠(Mus musculus)及人(Homo sapiens)进行同源比对,与不同物种中锌指结构的同源性高达79%(图 2)。如图 2所示,黑色阴影表示同源性大于75%的区域,主要是集中在不同物种的锌指结构的保守区域。利用MEGA 6.0软件对已经公布的哺乳动物和常见的鱼类进行系统进化分析,显示尼罗罗非鱼Xbp1与南极鳕同属一个分支,同源性最高,与其他无脊椎动物的Xbp1聚为一类。而在哺乳类动物、两栖类动物、鸟类和鱼类中有明显分化(图 3)。

|
图 2 OnXbp1氨基酸序列与其他物种Xbp1序列比对 Figure 2 Alignment of Xbp1 amino acid sequences of O. niloticus with other species |
|
图 3 利用MEGA 6.0软件构建的基于Xbp1基因所编码氨基酸序列的NJ系统进化树 Figure 3 NJ phylogenetic tree based on Xbp1 amino acid sequences by MEGA 6.0 |
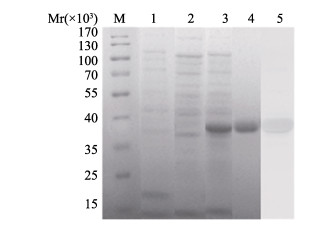
以尼罗罗非鱼OnXbp1-S基因片段为模板,使用特异性引物Xbp1-F4、R4(表 1)成功扩增到长度为504 bp的目的片段,将目的片段连接到pET32a质粒上,获得重组质粒pET32a-Xbp1。将重组质粒转入大肠杆菌BL21(DE3)后,将测序正确的阳性克隆进行诱导表达,诱导前的目的蛋白表达较弱(图 4),诱导后有明显表达的条带大小约为40 kDa,与融合蛋白的预测分子量一致(包括目的蛋白18 kDa和pET-32a标签蛋白21 kDa)。融合蛋白的可溶性分析结果显示,其主要以包涵体的形式存在。经SDS-PAGE检测,纯化蛋白在40 kDa处有较为单一条带。用抗His-tag的单克隆抗体Western-blot检测纯化后的蛋白,发现在40 kDa处存在单一条带,确定此蛋白为OnXbp1-S表达的融合蛋白。浓缩纯化后的蛋白,制作抗原免疫小鼠并获得抗血清,直接ELISA法检测其抗体效价为800, 000(units/ml),表明所制备的小鼠抗罗非鱼Xbp1-S多克隆抗血清效果良好。
|
图 4 Xbp1-S蛋白的原核表达及其纯化 Figure 4 Prokaryotic expression and purification of the Xbp1 protein M:蛋白Marker; 1:空载菌蛋白; 2:重组菌IPTG诱导前; 3:重组菌IPTG诱导后; 4:纯化后蛋白; 5:纯化后蛋白Western-blot M: Protein Marker; 1: Protein of empty plasmid vector; 2: Protein before IPTG induction; 3: Protein after IPTG induction; 4: Purification protein; 5: Western-blot of purification protein |
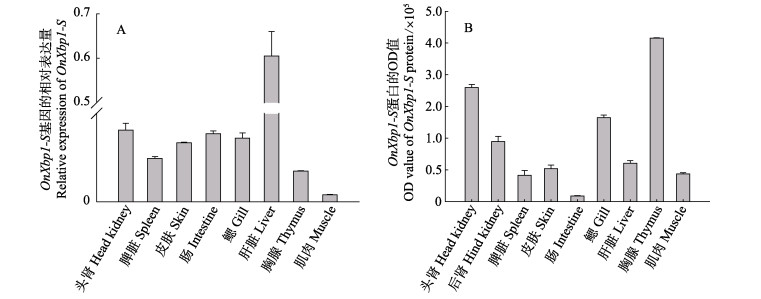
采用Real-time qPCR方法检测OnXbp1-S mRNA在健康尼罗罗非鱼不同组织中的相对表达量;并利用所制备的OnXbp1-S多抗Western-blot检测OnXbp1蛋白在不同组织的相对表达水平。mRNA相对表达量的结果显示,OnXbp1-S在所检测的8个组织中的表达量,由低到高依次为肌肉 < 胸腺 < 脾脏 < 皮肤 < 鳃 < 肠 < 头肾 < 肝脏,在肝脏的表达量最高,在头肾也有较高的表达,而在肌肉组织中几乎不表达(图 5 A)。OnXbp1-S蛋白的相对表达量的结果显示(图 5B ),OnXbp1-S蛋白在所检测的9个组织中的表达量,由低到高依次为肠 < 脾脏 < 肌肉 < 皮肤 < 肝脏 < 后肾 < 鳃 < 头肾 < 胸腺,在胸腺的表达量最高,在头肾、鳃中都有较高的表达,而在肠道肌肉中几乎没有表达。
|
图 5 Xbp1-S基因及蛋白水平在尼罗罗非鱼不同组织中的表达分布 Figure 5 The relative expression of Xbp1-S mRNA and protein in different tissues of O. niloticus |
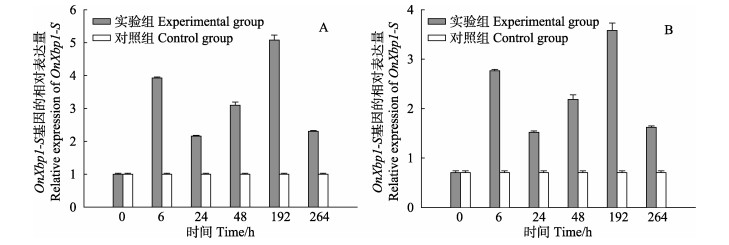
在经过腹腔注射链球菌后,与对照组相比,所检测的不同时间点里其肝脏和脾脏均呈上调表达的趋势,且其趋势基本一致。在早期即腹腔注射6 h后,OnXbp1-S基因的表达呈现显著性增高,其后的24 h和48 h的表达量有所下降,但在192 h达到基因表达量的最高水平(图 6A,图 6B),而后在264 h逐渐回落下降,趋向对照组的水平。
|
图 6 无乳链球菌应激后尼罗罗非鱼Xbp1-S基因的表达量变化 Figure 6 Expression of Xbp1-S gene in O. niloticus after Streptococcus agalactiae infection A:肝脏; B:脾脏 A:Liver; B:Spleen |
根据Zwollo等(2005)报道的Percoll密度分离法,分离出罗非鱼头肾B细胞不同亚类细胞:Percoll 40细胞(多为浆细胞,图 7A)、Percoll 50细胞(多为原浆B细胞,图 7B)、Percoll 60细胞(初分化成熟的B细胞,图 7C)、和Percoll 70细胞(多为未成熟的B细胞,图 7D)。如图 7所示,OnXbp1-S蛋白在不同B细胞亚类中表达量水平可由其红色荧光所显示,表达量的变化从低到高依次为Percoll 70 < Percoll 60 < Percoll 50 < Percoll 40,即OnXbp1-S在浆细胞中的表达最高,在原浆细胞有较高水平的表达,在初分化的B细胞中有少许表达,而在未成熟的B细胞中几乎不表达。

|
图 7 Xbp1在尼罗罗非鱼不同B细胞亚类中的表达 Figure 7 Xbp1-S protein level in different B cell subclass of O. niloticus A. Percoll 40; B. Percoll 50; C. Percoll 60; D. Percoll 70 |
细胞转录因子Xbp1表达与B细胞的发育分化及抗体的表达分泌息息相关(Zwollo et al, 2005、2008; Tellier et al, 2016)。Xbp1是内质网应激中蛋白质折叠能力的主要调控者之一,具有2种不同剪切类型(Xbp1-S和Xbp1-U),其中,Xbp1-S具有高度转录活性(Zhou et al, 2008)。内质网具有调节蛋白质的折叠、转录后修饰基因表达等多种功能, 一旦发生错误的折叠将导致抗凋亡反应并促进肿瘤细胞的无限增值(Hendershot, 2004; Robinson et al, 1994)。因此,Xbp1研究对于B细胞的发育分化和调控以及其在防御病原菌侵染的免疫功能分析具有重要的意义。
本研究克隆尼罗罗罗非鱼OnXbp1-S的基因序列,并利用外源蛋白原核表达系统(Salinas et al, 2011)成功构建OnXbp1-S的体外表达系统,制备多克隆抗体;组织表达分析发现,OnXbp1-S在尼罗罗非鱼的正常组织中广泛存在;在无乳链球菌应激实验期,OnXbp1-S在肝脏和脾脏表达具有较强的上调且反应趋于同步;并证实了在尼罗罗非鱼中可能也存在OnXbp1-S对于浆细胞即成熟B细胞的发育分化调节作用。
Xbp1在哺乳动物的体内广泛存在,在各个组织分析中都有表达,其中在肝细胞中高表达(Liou et al, 1990; Calfon et al, 2002)。本研究结果显示,尼罗罗非鱼OnXbp1-S在各个检测组织中都有表达,在mRNA水平上主要表达在肝脏中,这与哺乳动物中的发现相类似。然而,蛋白水平上的高表达主要在胸腺和头肾中,表明Xbp1-S的表达与免疫细胞(B细胞和T细胞)的发育分化可能有一定关联(Zwollo et al, 2005、2008; Tellier et al, 2016)。免疫系统中主要免疫细胞的发育分化与Xbp1-S表达的正相关反映了Xbp1-S转录因子可能在免疫反应中起重要调控作用,因为Xbp1-S因子不仅参与体液免疫,而且可能参与细胞免疫的促进作用。无乳链球菌应激实验显示,在应激后264 h期间,OnXbp1-S在脾脏和肝脏中都有明显的表达上调。腹腔注射链球菌6 h后,肝脏和脾脏中OnXbp1-S mRNA表达显著上调出现第一个峰值,这种应激后短时间内表达量激增的现象表明该因子很可能参与天然免疫反应。第二个更显著的表达高峰出现在链球菌应激后的192 h (8 d),这个显著上调很可能是由于参与适用性免疫反应的免疫细胞(B细胞和T细胞)中Xbp1-S因子的表达明显上调。
硬骨鱼的头肾组织类似于哺乳动物的骨髓,具有造血功能并且是免疫细胞发育的场所,因此,头肾组织含有不同血系的未成熟血细胞(Fange et al, 1986; Zapata et al, 1995)。头肾是免疫细胞发生、发育分化和增殖的重要场所,也是捕获抗原和产生抗体的主要器官(Kaattari et al, 1985; Bromage et al, 2004; Ye et al, 2010; Ma et al, 2013)。本研究尼罗罗非鱼的头肾组织采用Percoll密度梯度分离的方法获得不同发育分化程度的B细胞亚类(Zwollo et al, 2005),并采用免疫组化检测各类细胞荧光强度,发现OnXbp1-S高表达在分化程度高的成熟浆细胞和原浆细胞中,而在naïve B细胞和未成熟B细胞中表达量较低。尼罗罗非鱼不同B细胞亚类表达不同水平的OnXbp1-S现象,与已报道的红鳍东方鲀(Ohtani et al, 2006)和虹鳟鱼(Zwollo et al, 2008)相类似。B细胞分化程度与Xbp1-S因子的表达正相关表明,该因子对于成熟浆细胞以及浆母细胞的发育具有重要的促进作用,即对B细胞的分化起正调节作用,调控原浆细胞是在特定的生态位中进一步发育分化为浆细胞(Ye et al, 2011)。Xbp1-S的免疫功能尤其对于B细胞分化的作用研究有利于探索体液免疫B细胞的发育分化调控机制。综上所述,本研究将为进一步研究尼罗罗非鱼Xbp1-S因子应答病原菌侵染的机理及促进B细胞分化机制提供理论依据。
| Barr M, Mott K, Zwollo P. Defining terminally differentiating B cell populations in rainbow trout immune tissues using the transcription factor Xbp1. Fish and Shellfish Immunology, 2011, 31(6): 727-735 DOI:10.1016/j.fsi.2011.06.018 | |
| Bennett JT, Joubin K, Cheng S, et al. Nodal signaling activates differentiation genes during zebrafish gastrulation. Developmental Biology, 2007, 304(2): 525-540 DOI:10.1016/j.ydbio.2007.01.012 | |
| Bromage ES, Ye J, Owens L, et al. Use of staphylococcal protein A in the analysis of teleost immunoglobulin structural diversity. Developmental and Comparative Immunology, 2004, 28(7-8): 803-814 DOI:10.1016/j.dci.2003.12.001 | |
| Calfon M, Zeng H, Urano F, et al. IRE1 couples endoplasmic reticulum load to secretory capacity by processing the XBP-1 mRNA. Nature, 2002, 415(6867): 92-96 | |
| Fange R. Lymphoid organs in sturgeons (Acipenseridae). Veterinary Immunology and Immunopathology, 1986, 12(1-4): 153-161 DOI:10.1016/0165-2427(86)90119-4 | |
| Gan Z, Wang B, Lu Y, et al. Molecular characterization and expression of Lck in Nile tilapia (Oreochromis niloticus) in response to Streptococcus agalactiae stimulus. Applied Biochemistry and Biotechnology, 2015, 175(5): 2376-2389 DOI:10.1007/s12010-014-1443-8 | |
| Hendershot LM. The ER function BiP is a master regulator of ER function. Mount Sinai Journal of Medicine, 2004, 71(5): 289-297 | |
| Hu MC, Gong HY, Lin GH, et al. XBP-1, a key regulator of unfolded protein response, activates transcription of IGF1 and Akt phosphorylation in zebrafish embryonic cell line. Biochemical and Biophysical Research Communications, 2007, 359(3): 778-783 DOI:10.1016/j.bbrc.2007.05.183 | |
| Iwakoshi NN, Lee AH, Glimcher LH. The X-box binding protein-1 transcription factor is required for plasma cell differentiation and the unfolded protein response. Immunological Reviews, 2003, 194(1): 29-38 DOI:10.1034/j.1600-065X.2003.00057.x | |
| Iwakoshi NN, Pypaert M, Glimcher LH. The transcription factor XBP-1 is essential for the development and survival of dendritic cells. Journal of Experimental Medicine, 2007, 204(10): 2267-2275 DOI:10.1084/jem.20070525 | |
| Kaattari SL, Irwin MJ. Salmonid spleen and anterior kidney harbor populations of lymphocytes with different B cell repertoires. Developmental and Comparative Immunology, 1985, 9(3): 433-444 DOI:10.1016/0145-305X(85)90006-0 | |
| Leong JS, Jantzen SG, von Schalburg KR, et al. Salmo salar and Esox lucius full-length cDNA sequences reveal changes in evolutionary pressures on a post-tetraploidization genome. BMC Genomics, 2010, 11(1): 279 DOI:10.1186/1471-2164-11-279 | |
| Liou HC, Boothby MR, Finn PW, et al. A new member of the leucine zipper class of proteins that binds to the HLA DR alpha promoter. Science, 1990, 247(4950): 1581-1584 DOI:10.1126/science.2321018 | |
| Lu MX. Review of research on streptococcosis in Tilapia. South China Fisheries Science, 2010, 6(1): 75-79 [卢迈新. 罗非鱼链球菌病研究进展. 南方水产, 2010, 6(1): 75-79] | |
| Ma C, Ye J, Kaattari SL. Differential compartmentalization of memory B cells versus plasma cells in salmonid fish. European Journal of Immunology, 2013, 43(2): 360-370 | |
| Ohtani M, Miyadai T, Hiroishi S. Identification of genes encoding critical factors regulating B-cell terminal differentiation in torafugu (Takifugu rubripes). Comparative Biochemistry and Physiology Part D Genomics Proteomics, 2006, 1(1): 109-114 DOI:10.1016/j.cbd.2005.10.003 | |
| Peng SQ, An LG, Zhang Z, et al. Cloning and tissue-specific expression analysis of Xbp1 gene in Cyprinus carpio L. Journal of University of Jinan, 2013, 27(2): 1671-3359 [彭少卿, 安利国, 张珍, 等. 鲤鱼Xbp1基因克隆与组织特异性表达分析. 济南大学学报(自然科学版), 2013, 27(2): 1671-3359] | |
| Reimold AM, Iwakoshi NN, Manis J, et al. Plasma cell differentiation requires the transcription factor XBP-1. Nature, 2001, 412(6844): 300-307 DOI:10.1038/35085509 | |
| Robinson AS, Hines V, Wittrup KD. Protein disulfide isomerase overexpression increase secretion of foreign protein in Saccharomyces cerevisiae. Biotechnology, 1994, 12(4): 381-384 DOI:10.1038/nbt0494-381 | |
| Salinas I, Zhang YA, Sunyer JO. Mucosal immunoglobulins and B cells of teleost fish. Developmental and Comparative Immunology, 2011, 35(12): 1346-1365 DOI:10.1016/j.dci.2011.11.009 | |
| Tellez-Bañuelos MC, Santerre A, Casas-Solis J, et al. Oxidative stress in macrophages from spleen of Nile tilapia (Oreochromis niloticus) exposed to sublethal concentration of endosulfan. Fish and Shellfish Immunology, 2009, 27(2): 105-111 | |
| Tellier J, Shi W, Minnich M, et al. Blimp-1 controls plasma cell function through the regulation of immunoglobulin secretion and the unfolded protein response. Nature Immunology, 2016, 17(3): 323-330 DOI:10.1038/ni.3348 | |
| Wang H, Zhang Y, Yehuda-Shnaidman E, et al. Liver X receptor alpha is a transcriptional repressor of the uncoupling protein 1gene and the brown fat phenotype. Molecular and Cell Biology, 2008, 28(7): 2187-2220 DOI:10.1128/MCB.01479-07 | |
| Yao WL, He YY, Liu P, et al. The cDNA cloning and expression analysis of P38 MAPK gene of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2016, 37(2): 91-98 DOI:10.11758/yykxjz.20150304001 [姚万龙, 何玉英, 刘萍, 等. 中国对虾(Fenneropenaeus chinensis) p38 MAPK基因克隆及表达分析. 渔业科学进展, 2016, 37(2): 91-98] | |
| Ye J, Bromage ES, Kaattari SL. Plasma blasts and plasma cells and the organization of the teleost immune system. Developmental and Comparative Immunology, 2011, 35(12): 1273-1281 DOI:10.1016/j.dci.2011.03.005 | |
| Ye J, Bromage ES, Kaattari SL. The strength of B cell interaction with antigen determines the degree of IgM polymerization. Journal of Immunology, 2010, 184(2): 844-850 DOI:10.4049/jimmunol.0902364 | |
| Yoshida H, Matsui T, Yamamoto A, et al. XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor. Cell, 2001, 107(7): 881-891 DOI:10.1016/S0092-8674(01)00611-0 | |
| Zapata AG, Torroba M, Vicente A, et al. The relevance of cell microenvironments for the appearance of lympho-haemopoietic tissues in primitive vertebrates. Histology and Histopathology, 1995, 10(3): 761-778 | |
| Zhou M, Jacob A, Ho N, et al. Downregulation of protein disulfide isomerase in sepsis and its role in tumor necrosis factor-alpha release. Critical Care, 2008, 12(4) | |
| Zwollo P, Cole S, Bromage E, et al. B cell heterogeneity in the teleost kidney: Evidence for a maturation gradient from anterior to posterior kidney. Journal of Immunology, 2005, 174(11): 6608-6616 DOI:10.4049/jimmunol.174.11.6608 | |
| Zwollo P, Haines A, Rosato P, et al. Molecular and cellular analysis of B-cell populations in the rainbow trout using Pax5 and immunoglobulin markers. Developmental and Comparative Immunology, 2008, 32(12): 1482-1496 DOI:10.1016/j.dci.2008.06.008 |



