2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛市卓越海洋集团有限公司 青岛 266408
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Qingdao Excellence Ocean Group Co., Ltd., Qingdao 266408
近年来,水产养殖业的发展实现了由粗放式到集约化的转变,高密度养殖模式带来高产量、高收益,但同时存在水体残饵、粪便等有机物积累较快的问题。养殖水体氮浓度的快速上升,导致水体自净能力严重下降(刘道玉等, 2011)。由于氨氮和亚硝酸氮等物质对水生动物的毒性较大,严重影响了水产动物的健康和生长,给水产养殖业带来巨大损失。同时,未经处理的含高氮、高有机物的养殖废水排入沿海水域,也会加剧近海的富营养化,反过来影响养殖水质。因此,降低养殖系统中氮浓度是提高养殖水质的关键。
生物脱氮技术被认为是去除养殖污水氮元素最为有效且经济的方式,且无二次污染(Padhi et al, 2013; 姜磊等, 2013; Layva-Diaz et al, 2015)。Kozasa(1986)首次将微生物制剂应用于水产养殖业,此后,越来越多的硝化细菌从不同环境中分离筛选出来,并用于后续脱氮特性研究(汪晓晨等, 2014; 陆洪省等, 2014),但传统自养硝化细菌去除水体氨氮和亚硝酸氮之后,存在硝酸氮积累的问题,同时硝化细菌生长缓慢、培养困难且价格高(罗小溪等, 2013)。
水产养殖的特殊模式决定了脱氮过程中的硝化作用和反硝化作用只存在于好氧情况下(张小玲等, 2011)。但传统理论认为,自养硝化作用与厌氧反硝化作用是两个独立的部分,因此,硝化作用与反硝化作用不能在同一条件下进行(潘玉瑾等, 2016)。Robertson等(1984)在除硫和反硝化处理系统中首次分离出好氧反硝化菌泛养副球菌(Paracoccus pantotropha),异养硝化–好氧反硝化细菌的出现表明在好氧情况下可实现同时硝化反硝化(SND)。目前,筛选到的异养硝化–好氧反硝化细菌种类越来越多,已报道的脱氮细菌有假单胞菌属(Pseudomonas) (Myahara et al, 2012)、盐单胞菌属(Halomonas alkaliphila) (孙雪梅等, 2012)、芽孢杆菌属(Bacillus)(何伟等, 2009)、不动杆菌属(Acinetobacter)(辛玉峰等, 2011)和产碱菌属(Alcaligenes)(余润兰等, 2012)等。目前,大多数研究集中在异养硝化–好氧反硝化细菌的分离筛选以及脱氮特性(Ren et al, 2014; 梁贤等, 2015; 孙庆花等, 2016; 石小彤等, 2013; 成钰等, 2016),将异养硝化–好氧反硝化细菌应用于实际海水养殖环节的报道尚少。本研究将实验室筛选的3株高效异养硝化–好氧反硝化细菌进行不同组合后应用到圆斑星鲽(Verasper variegates)养殖过程中,以探究其在实际生产中的脱氮效果,并为其应用技术的建立提供参考。
1 材料与方法 1.1 实验材料3株异养硝化–好氧反硝化细菌均由本实验室筛选、保存,具有异养硝化–好氧反硝化功能。嗜碱盐单胞菌(Halomonas alkaliphila) X3筛选自浙江象山港网箱鱼类养殖区富营养沉积环境,在氨氮含量为42 mg/L的测试液中,24 h时,对氨氮、亚硝酸氮和硝酸氮的去除率分别为98.29%、99.07%和96.48%(孙雪梅等, 2012)。花津滩芽孢杆菌(Bacillus hwajinpoensis) SLWX2筛选自青岛市红岛刺参养殖池塘的水体环境,24 h对氨氮、亚硝酸氮和硝酸氮的去除率分别达到100%、99.5%和85.6%,在1%~8% NaCl条件下均能生长(成钰等, 2016)。
麦氏交替单胞菌(Alteromonas macleodii) SLNX2筛选自青岛市红岛刺参养殖池塘的沉积环境,24 h对氨氮、亚硝酸氮的去除率分别达到100%、36.1%,72 h对硝酸氮的去除率达到82.2%(拟另文发表)。下文以W代表SLWX2,X代表X3,N代表SLNX2。
圆斑星鲽由青岛卓越海洋集团有限公司提供,规格为(98±6)g。
实验所用饲料:碟类慢沉颗粒配合饲料,由常熟泉兴营养添加剂有限公司生产提供。
1.2 实验方法 1.2.1 实验设计与日常管理实验在青岛卓越海洋集团有限公司养殖车间进行,选取规格一致的圆斑星鲽,在养殖池中暂养10 d后,从中挑选健康、有活力的240尾进行实验,每个规格为50 L的塑料整理箱中加入30 L消毒海水和10尾已消毒圆斑星鲽;设置8个处理组,以不添加脱氮细菌的为对照组,细菌投放组合类型如表 1所示,每个处理组3个平行。实验期间,第5、11、17天各投菌1次,菌液终浓度控制在1.3×106 CFU/ml。实验共进行21 d。
|
|
表 1 实验设计 Table 1 The experimental design |
实验期间,各池保持不换水,定时补充新鲜淡水,维持水体体积不变。使用充气泵充氧,使溶氧维持在7~9 mg/L。每日09:00投喂饲料。
1.2.2 水样采集与检测每2天09:00投饵前,使用YSI-556多功能水质分析仪测定水质pH、溶解氧、温度和盐度。将箱内水混合均匀后,在中央距离水面10 cm处采集水样。使用离心机将水样6000 r/min离心5 min,取上清液。参照中华人民共和国国家质量监督检验检疫总局等《海洋监测规范》(GB 17378.4-2007),氨氮的测定采用次溴酸盐氧化法,亚硝酸氮的测定采用盐酸萘乙二胺分光光度法,硝酸氮的测定采用锌–镉还原法,化学需氧量(COD)的测定采用碱性高锰酸钾法,总氮测定使用总有机碳(Total organic carbon, TOC)分析仪(TOC-VCPH, TNM-1)。
1.3 数据处理利用Excel软件进行数据处理,实验数据用平均数±标准差(Mean±SD)表示;采用SPSS 19统计软件对数据作统计分析,显著水平P采用0.05,极显著水平P采用0.01。
2 结果与分析 2.1 各组pH、溶氧、温度和盐度的变化实验期间,pH、溶氧(DO)、温度(T)和盐度(S)指标各组之间无显著差异(P > 0.05)。pH为7.69±0.23、DO为(8.325±0.385) mg/L、T为(21.95±0.55)℃、S为29.7±0.6。各组各项指标值均处于正常范围内,满足圆斑星鲽养殖条件。具体指标测定数值见表 2。
|
|
表 2 指标测定值 Table 2 The determined value of each parameter |
随着养殖时间的推移,各组氨氮浓度呈逐渐升高的趋势。如图 1所示,第5天第1次加菌后,各加菌组氨氮浓度上升幅度均低于对照组,并于第7~9天,各实验组氨氮浓度与对照组出现极显著性差异(P < 0.01),说明第5天投加不同组合菌液之后,氨氮去除效果显著。从第11天开始,实验组中单菌组对氨氮的去除效果开始下降,但复合组的去除能力持续有效,其中,W+X+N组合优势最为明显,与其他各实验组存在极显著性差异(P < 0.01),尤其在第17天第3次加菌后,氨氮浓度明显下降。到第21天时,W+X+N组、W+X组、W+N组、X+N组、X组、W组及N组氨氮浓度比对照组分别降低68.55% (P < 0.01)、54.38%(P < 0.01)、52.61%(P < 0.01)、44.93% (P < 0.01)、40.74%(P < 0.01)、33.48%(P < 0.01)和26.16%(P < 0.01),说明异养硝化–好氧反硝化细菌对氨氮有很好的去除效果,其中,W+X+N组去除效果最明显,能将氨氮浓度维持在较低水平。

|
图 1 各组氨氮浓度的变化 Figure 1 The variation of ammonia-nitrogen concentration in different groups |
实验期间,各加菌组与对照组亚硝酸氮浓度9 d前均处于较低浓度,第11天开始逐渐积累增加。如图 2所示,第5天第1次加菌后,加菌组的亚硝酸氮浓度始终低于对照组,第7~15天,除单菌组(W组、X组和N组)之外,复合菌组均与对照组存在显著性差异(P < 0.05)。从第17天第3次加菌后开始,各加菌组均与对照组产生显著性差异(P < 0.05),可能是3株细菌已经逐步适应养殖环境。到第19天时,W+X+N组、W+X组、W+N组、X+N组、X组、W组及N组亚硝酸氮浓度与对照组差异达到最大值,分别比对照组降低48.36%(P < 0.01)、41.25%(P < 0.01)、35.56%(P < 0.01)、25.42%(P < 0.01)、26.38%(P < 0.01)、29%(P < 0.01)和17.99%(P < 0.01),说明复合细菌在去除氨氮的同时,对亚硝酸氮也有良好的去除效果。

|
图 2 各组亚硝酸氮浓度的变化 Figure 2 The variation of nitrite-nitrogen concentration in different groups |
整个养殖期间,各组硝酸氮浓度的变化呈现大致先升高后下降再升高的规律(图 3)。第5天第1次加菌后,第7天开始,除N组外,各加菌组硝酸氮浓度均低于对照组,说明投加的菌液起到反硝化的作用。其中,W+X+N组反硝化作用最好,第1~13天将水体硝酸氮浓度维持在较低水平,并于第13天达到最低浓度0.51 mg/L。到第21天时,对照组的硝酸氮已达到7.05 mg/L,各加菌组均与对照组存在显著差异(P < 0.05)(除N组外),但各加菌组间差异不显著(P > 0.05)。第21天时,W+X+N、W+X、W+N、X+N、X、W及N组的硝酸氮浓度分别比对照组降低58.38%、31.66%、53.04%、53.20%、50.97%、42.61%和14.26%。说明复合细菌对硝酸氮也有良好的去除效果。
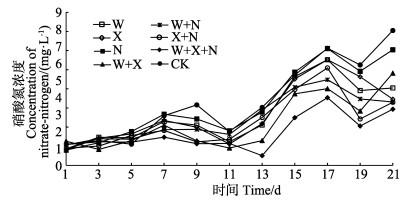
|
图 3 各组硝酸氮浓度的变化 Figure 3 The variation of nitrate-nitrogen concentration in different groups |
如图 4所示,第1~5天,对照组与各加菌组之间重合度高,不存在显著性差异(P > 0.05)。第5天第1次加菌后,第7天开始,除N组外,各加菌组COD浓度始终低于对照组,且均与对照组存在显著性差异(P < 0.05),说明投加异养硝化–好氧反硝化细菌对COD有一定的降解作用。实验期间,W+X+N组对COD的去除效果最佳,与对照组存在极显著差异(P < 0.01),W+X组次之。第13天时,W+X+N组、W+X组、W+N组、X+N组、X组、W组及N组的COD浓度与对照组达到最大差异值,分别与对照组降低27.47%、23.08%、14.29%、17.58%、10.99%、8.79%和3.30%。说明复合细菌在去除无机氮的同时,对有机物也有一定去除效果。
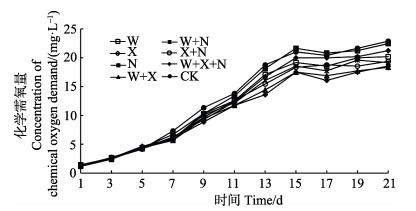
|
图 4 各组化学需氧量的变化 Figure 4 The variation of chemical oxygen demand in different groups |
随着实验进行,各组总氮浓度缓慢上升,如图 5所示,除N组外,其余各加菌组总氮浓度均低于对照组。整个实验期间,W+X+N组及W+X组的总氮浓度均与对照组有极显著差异(P < 0.01)。第15天,W+X+N、W+X、W+N、X+N、X、W及N组的总氮浓度分别比对照组降低40.02%、29.61%、18.58%、12.34%、29.45%、11.3%和2.65%。结果表明,3株细菌可在养殖环境中去除一定的总氮。

|
图 5 各组总氮浓度的变化 Figure 5 The variation of total nitrogen concentration in different groups |
实验初始,各养殖箱中放入圆斑星鲽10尾。第21天,对照组出现大量死亡现象。如表 3所示,圆斑星鲽存活数量分别为4、5和4尾,存活率为40%、50%和40%,随即停止实验。各加菌组除W组、N组、X+N组出现少量死亡外,其余组均无死亡现象。表明添加的3株异养硝化–好氧反硝化细菌对圆斑星鲽无毒害及致病作用,并通过改善水体环境保证了圆斑星鲽的存活率。
|
|
表 3 不同实验组中圆斑星鲽的存活率 Table 3 The survival rate of V. variegatus in different experimental groups |
研究结果显示,与未添加异养硝化–好氧反硝化细菌的对照组相比,W+X+N组合对氨氮、亚硝酸氮、硝酸氮、总氮及化学需氧量的去除效果优于其他组合,分别低于对照组68.55%、48.36%、58.38%、40.02%及27.47%,该组合与赵留群等(2014)投加EM菌实验结果相比,对氨氮和亚硝酸氮去除率分别提高了11.63%和166.01%,与郑佳佳等(2013)复合菌实验结果相比,硝酸氮的去除率提高了3.16%。预示这些菌构成的复合异养硝化–好氧反硝化细菌菌剂能有效地降低水体中氮素含量,改善水质。各种无机氮指标基本可维持在较低水平,满足养殖的水质要求,在海水养殖生产上具有很好的应用前景。
3株细菌对化学需氧量有一定的去除作用,虽然最大去除率仅为27.47%,不及马梦雪等(2016)利用硝化细菌和反硝化细菌的复合菌剂处理模拟污水的效果,但优于自养硝化细菌,且3株细菌对COD的去除仅为辅助功能,相对于传统异养反硝化菌而言,不但不需添加额外碳源,反而可消除原有的有机物。
花津滩芽孢杆菌(SLWX2)和嗜碱盐单胞菌(X3)对各项指标的去除效果均优于麦氏交替单胞菌(SLNX2),这与3株细菌前期进行的脱氮特性研究所取得的结果一致。同时,相同接种浓度、不同细菌组合对氨氮、亚硝酸氮、硝酸氮、总氮及化学需氧量均有去除作用,但去除效果不一。总体而言,3株菌复合组优于2株菌复合组,并优于单株菌组,说明3株细菌复合之后有很好的协同作用,但协同作用效果不一。
3株细菌对硝酸氮和总氮均有去除效果,3株细菌在实际生产中可起到反硝化作用。为探究脱氮细菌反硝化机制,黄廷林等(2014)利用PCR技术从3株好氧反硝化细菌中均成功检测到周质硝酸盐还原酶亚基基因(napA),表明其可以利用napA还原硝酸氮实现反硝化功能。Li等(2012)利用斯氏假单胞菌(Pseudomonas stutzeri)T13对硝酸盐还原酶进行检测,检测到硝酸盐还原酶占脱氮酶基因的30%以上。目前,被分离筛选出的众多异养硝化–好氧反硝化细菌均能实现生物脱氮功能,但不同种类菌株在脱氮途径和酶学特征上有较大的差异(吴伟等, 2013; 李嘉伟等, 2015; 李鹏章等, 2015)。此外,本研究3株细菌的脱氮途径和机制尚不清楚,3株细菌组合效果最优的原因可能为3株细菌存在的脱氮酶系不同,具有互补作用,下一步需要通过分子生物学技术,对其相关基因进行深入研究,探究3株细菌的脱氮途径与机制,来加以验证。
4 结论3株细菌在养殖环境中均具有硝化–反硝化作用,可实现生物脱氮功能,但对圆斑星鲽养殖水质各项指标的去除效果不一,其中,SLWX2单株效果最佳。组合菌效果好于单株菌,其中,SLWX2+X3+SLNX2组合对圆斑星鲽养殖水质净化效果最佳,可使养殖水体3种无机氮的浓度维持在较低范围,SLWX2+X3组合净化效果次之。3株细菌对圆斑星鲽生长无毒害作用,使用安全。
| Cheng Y, Li QF, Fei YT, et al. Screening and nitrogen removing characteristics of heterotrophic nitrification aerobic denitrification bacteria SLWX2 from sea water. Environmental Science, 2016, 37(7): 2681-2688 [成钰, 李秋芬, 费聿涛, 等. 海水异养硝化-好氧反硝化芽孢杆菌SLWX2的筛选及脱氮特性. 环境科学, 2016, 37(7): 2681-2688] | |
| He W, Wang W, Wang J, et al. Isolation, identification and its mixed application of a strain of aerobic denitrifying bacteria. Journal of Ecology and Rural Environment, 2009, 25(2): 88-93 [何伟, 王薇, 王洁, 等. 一株好氧反硝化细菌的分离鉴定及其混合应用特性研究. 生态与农村环境学报, 2009, 25(2): 88-93] | |
| Huang TL, Zhou N, Zhang HH, et al. Isolation and identification of three oligotrophic aerobic denitrifying bacteria and denitrification characteristics. Chinese Journal of Environmental Engineering, 2014, 8(12): 5507-5513 [黄廷林, 周娜, 张海涵, 等. 3株贫营养好氧反硝化细菌的分离鉴定及反硝化特性. 环境工程学报, 2014, 8(12): 5507-5513] | |
| Jiang L, Xu CB, Ma XP, et al. Identification and denitrification characteristics of an aerobic denitirfier. Environmental Science & Technology, 2013, 36(3): 12-15 [姜磊, 徐成斌, 马溪平, 等. 1株好氧反硝化菌的分离鉴定和反硝化特性研究. 环境科学与技术, 2013, 36(3): 12-15] | |
| Kozasa M. Toyocerin (Bacillus toyoi) as growth promotor for animal feeding. Microbiology Aliment Nutrition, 1986, 4(1): 121-135 | |
| Layva-Diaz JC, Gonzalez-Martinez A, Gonzalez-Lopez J, et al. Kinetic modeling and microbiological study of two-step nitrification in a membrane bioreactor and hybrid moving bed biofilm reactor-membrane bioreactor for wastewater treatment. Chemical Engineering Journal, 2015, 259: 692-702 DOI:10.1016/j.cej.2014.07.136 | |
| Robertson LA, Kuenen JG. Aerobic denitrification: A controversy revived. Archives of Microbiology, 1984, 139(4): 351-354 DOI:10.1007/BF00408378 | |
| Li A, Gai Z, Cui D, et al. Genome sequence of a highly efficient aerobic denitrifying bacterium Pseudomonas stutzeri T13. Journal of Bacteriology, 2012, 194(20): 5720 DOI:10.1128/JB.01376-12 | |
| Li JW. SND biological denitrification process N2O generation and key enzymes and their activity. Guangdong Chemical Industry, 2015, 42(1): 91-93 [李嘉伟. SND生物脱氮过程N2O的产生与关键酶及其活性. 广东化工, 2015, 42(1): 91-93] | |
| Li PZ, Wang SY, Liu Y, et al. Effect of electron competition on N2O production during domestic sewage biological denitrification process. Journal of Basic Science and Engineering, 2015, 23(4): 645-655 [李鹏章, 王淑莹, 刘越, 等. 生活污水生物脱氮反硝化过程中电子竞争对N2O产生的影响. 应用基础与工程科学学报, 2015, 23(4): 645-655] | |
| Liang X, Ren YX, Yang L, et al. Characteristics of nitrogen removal by a heterotrophic nitrification-aerobic denitrify-cation bacterium YL. Environmental Science, 2015, 36(5): 1749-1756 [梁贤, 任勇翔, 杨垒, 等. 异养硝化-好氧反硝化菌YL的脱氮特性. 环境科学, 2015, 36(5): 1749-1756] | |
| Liu DY, Wu W. Research on water pollution and microbial remediation of aquaculture. Modern Agricultural Science and Technology, 2011(17): 253-256 DOI:10.3969/j.issn.1007-5739.2011.17.147 [刘道玉, 吴伟. 水产养殖水体污染及微生物修复的研究. 现代农业科技, 2011(17): 253-256] | |
| Lu HS, Zhao XS, Wang YS, et al. Isolation and identification of a heterotrophic nitrifying strain from saline-alkali soil and analysis of its nitration abilities. Journal of Anhui Agricultural University, 2014, 41(1): 164-168 [陆洪省, 赵晓舒, 王亚舒. 盐碱地中1株硝化细菌的分离、鉴定及其硝化能力的分析. 安徽农业大学学报, 2014, 41(1): 164-168] | |
| Luo XX, Gao JZ, Chen ZZ. Research progress on enrichment culture and application of nitrifying bacteria. Fisheries Science & Technology Information, 2013, 40(6): 320-323 [罗小溪, 高建忠, 陈再忠. 硝化细菌富集培养及应用研究进展. 水产科技情报, 2013, 40(6): 320-323] | |
| Ma MX, Yang XY, Jia RM, et al. Research on the complex microbial community for biological denitrification. Shandong Chemical Industry, 2016, 45(10): 12-19 DOI:10.3969/j.issn.1008-021X.2016.10.004 [马梦雪, 杨欣玥, 贾茹梦, 等. 生物脱氮复合菌剂研究. 山东化工, 2016, 45(10): 12-19] | |
| Myahara M, Kim SW, Zhou S, et al. Survival of the aerobic denitrifier Pseudomonas stuzeri strain TR2 during co-culture with activated sludge under denitrifying conditions. Bioscience Biotechnology and Biochemistry, 2012, 76(3): 495-500 DOI:10.1271/bbb.110785 | |
| Padhi SK, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater. International Biodeterioration & Biodegradation, 2013, 78(3): 67-73 | |
| Pan YJ, Liu F, Meng S, et al. Isolation and characterization of an aerobic denitrifying-heterotrophic bacterium. Environ-mental Engineering, 2016, 34(1): 41-46 DOI:10.11835/j.issn.1005-2909.2016.01.009 [潘玉瑾, 刘芳, 孟爽, 等. 好氧反硝化菌P. chengduensis ZPQ2的筛选及其反硝化条件优化. 环境工程, 2016, 34(1): 41-46] | |
| Ren YX, Lei Y, Liang X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB. Bioresource Technology, 2014, 171: 1-9 DOI:10.1016/j.biortech.2014.08.058 | |
| Shi XT, Li YQ, Xing GW, et al. Screening and primary identification of an aerobic denitrifier isolate with salt tolerance. Biotechnology Bulletin, 2013(3): 175-180 [石小彤, 李彦芹, 邢国伟, 等. 一株耐盐好氧反硝化细菌的分离筛选及鉴定. 生物技术通报, 2013(3): 175-180] | |
| State Administration of quality supervision, inspection and Quarantine, People's Republic of China. GB17378.4-2007, Marine monitoring standard. Beijing: China Standard Press [中华人民共和国国家质量监督检验检疫总局. 海洋监测规范, GB17378. 4-2007. 北京: 中国标准出版社] | |
| Sun QH, Yu DS, Zhang PY, et al. Identification and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification strain isolated from marine environment. Environmental Science, 2016, 37(2): 648-654 [孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及脱氮特性. 环境科学, 2016, 37(2): 648-654] | |
| Sun XM, Li QF, Zhang Y, et al. Phylogenetic analysis and nitrogen removal characteristics of a heterotrophic nitrifying-aerobic denitrifying bacteria strain from marine environment. Acta Micro Biologica Sinica, 2012, 52(6): 687-695 [孙雪梅, 李秋芬, 张艳, 等. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性. 微生物学报, 2012, 52(6): 687-695] | |
| Wang XC, Yu DS, Li J, et al. Separation of nitrifying bacterium from anammox reactors with different substrates and characteristics of heterotrophic AOB. Chinese Journal of Environmental Engineering, 2014, 8(6): 2617-2625 [汪晓晨, 于德爽, 李津, 等. 不同基质条件下厌氧氨氧化反应器中硝化细菌的分离及选育异养AOB菌株的特性. 环境工程学报, 2014, 8(6): 2617-2625] | |
| Wu W, Liu DY, Qu JH, et al. The changes of nitrate and nitrite reductase activity of Paracoccus denitrificans and its inorganic nitrogen removal for aquaculture water. Journal of Agro-Environment Science, 2013, 32(6): 1244-1252 [吴伟, 刘道玉, 瞿建宏, 等. 脱氮副球菌硝酸盐/亚硝酸盐还原酶的活性变化及对养殖水体中无机氮素的转化. 农业环境科学学报, 2013, 32(6): 1244-1252] | |
| Xin YF, Qu XH, Yuan MD, et al. Isolation and identification of a heterotrophic nitrifying and aerobic denitrifying Acinetobacter sp. YF14 and its denitrification activity. Acta Microbiologica Sinica, 2011, 51(12): 1646-1654 [辛玉峰, 曲晓华, 袁梦冬, 等. 一株异养硝化-反硝化不动杆菌的分离鉴定及脱氮活性. 微生物学报, 2011, 51(12): 1646-1654] | |
| Yu RL, Miao L. Character of ammonia removal by heterotrophic nitrifying bacteria Alcaligenes sp. S3 and its kinetics. Chinese Journal of Environmental Engineering, 2012, 6(3): 869-872 [余润兰, 苗雷. 异养硝化细菌Alcaligenes sp. S3除氮特性及动力学.环境工程学报, 2012, 6(3): 869-872] | |
| Zhang XL, Zhang X. Denitrification characteristics of an aerobic denitrifying bacterium Bacillus sp. H2. Environmental Science & Technology, 2011, 34(10): 53-57 [张小玲, 张霞. 好氧反硝化菌Bacillus sp. H2脱氮特性研究.环境科学与技术, 2011, 34(10): 53-57] | |
| Zhao LQ, Xiao S, Liu T, et al. Effect of three probiotics on cultured water quality for sea cucumber apostichopus japonicus. Journal of dalian polytechnic university, 2014, 33(6): 391-394 [赵留群, 肖珊, 刘彤, 等. 3种微生态制剂对幼刺参养殖水体水质的影响. 大连工业大学学报, 2014, 33(6): 391-394] | |
| Zheng JJ, Peng LS, Zhang XP, et al. Effects of complex probiotics on water quality and microbial communities in grass carp (Ctenopharyngodon idellus) culture. Journal of Fisheries of China, 2013, 37(3): 457-464 [郑佳佳, 彭丽莎, 张小平, 等. 复合益生菌对草鱼养殖水体水质和菌群结构的影响. 水产学报, 2013, 37(3): 457-464] |



