2. 上海海洋大学食品学院 上海 201306;
3. 中国海洋大学食品科学与工程学院 青岛 266003
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306;
3. College of Food Science and Engineering, Ocean University of China, Qingdao 266003
海参(Apostichopus japonicus)是我国传统的名贵海珍品,营养丰富,蛋白质含量高,脂肪含量低,不含胆固醇,富含多种微量营养成分(Shi et al, 2016)。此外,海参还具有较高的药用价值,对治疗肺结核、再生障碍性贫血、糖尿病等有一定疗效(林威威等, 2011)。海参多糖是海参体壁重要的活性成分之一,其化学组成能直接反映海参的品质(姜健等, 2004)。目前,在海参体壁中发现的多糖分为两大类:海参糖胺聚糖和海参岩藻多糖。海参糖胺聚糖是由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸、L-岩藻糖和硫酸酯基组成的分支杂多糖,相对分子量为4~5万道尔顿;海参岩藻多糖是由L-岩藻糖构成的支链匀多糖,相对分子量为8~10万道尔顿(樊绘曾, 2001)。海参多糖含量可占干参总有机物的6%以上(刘琪等, 2015),具有抗肿瘤(Song et al, 2013)、抗凝血(Pomin, 2012)、抗氧化(Liu et al, 2012)、抗高血脂(Olivera-Castillo et al, 2013)、抗高血糖(Hu et al, 2013)等多种生物学功能。
高效阴离子交换色谱-脉冲安培检测法(HPAEC-PAD)近年来发展迅速,在糖和糖醇等的应用已较为成熟(刘婷, 2009),比如食用菌和植物多糖的单糖分析等,在动物多糖单糖分析上的相关报道较少,海参中仅用于硫酸基含量的测定(尹利昂, 2009)。和植物多糖不同,海参多糖不能采用水提等非降解法,需要采用酶解的方式提取后再水解成单糖,增加了前处理的难度。海参多糖含有中性糖、氨基糖和糖醛酸,优化淋洗液浓度和梯度以确保每种单糖都能出峰。本研究采用HPAEC-PAD方法首次建立了以CarboPac PA10糖分析柱、NaOH溶液和NaAC溶液梯度淋洗,分析海参中的10种单糖,包括中性糖、氨基糖和糖醛酸,为海参及其制品中单糖含量的检测方法及标准的制定提供参考。
1 材料与方法 1.1 材料、试剂与仪器 1.1.1 实验材料实验用活刺参样品均于2016年6月购于山东省青岛市新贵都水产批发市场,重量为(200±10) g/只,淡干刺参即鲜活刺参经去内脏清洗后煮制40 min后烘干制成;冻干刺参即鲜活刺参经去内脏清洗后放入冷冻干燥机中冻干制成;盐干刺参即鲜活刺参经去内脏清洗后盐渍再烘干制成。
1.1.2 主要试剂10种单糖标准物质:L-岩藻糖(L-Fucose)、D-半乳糖(D-Galactosamine)、D-甘露糖(D-Mannose)、D-阿拉伯糖(D-Arabinose)、D-葡萄糖(D-Glucose)、D-乳糖(D-Lactose)、D-氨基葡萄糖(D-Glucosamine)、D-氨基半乳糖(D-Galactosamine)、D-半乳糖醛酸(D-Galacturonic acid)、D-葡萄糖醛酸(D-Glucuronic acid),纯度均≥98%,购于美国Sigma公司。
无水乙醇、苯酚、浓硫酸、丙酮、三氯甲烷、正丁醇、乙酸钠、EDTA、L-半胱氨酸、50%氢氧化钠溶液(色谱纯,购于美国麦克林公司)、木瓜蛋白酶(分析纯,美国Sigma公司),其余试剂为国产分析纯。
1.1.3 仪器与设备ICS-3000离子色谱仪(配备电化学检测器),CarboPac PA10糖保护柱(美国戴安);CarboPac PA10糖分析柱(0.4 mm×250 mm,美国戴安);V1800型可见分光光度计(尤尼柯上海仪器有限公司);高速离心机(赛默飞世尔);DFY-300型摇摆式高速万能粉碎机(温岭市林大机械);SP-7417电动研磨搅拌机(德清拜杰电器);ZRD-A7080全自动新型鼓风干燥箱(上海智试分析仪器)。
1.2 实验方法 1.2.1 蛋白去除方法的优化酶解法是动物多糖提取常用的方法,但经酶解法提取的海参多糖保留长度不一的肽链,为了进一步纯化海参多糖及减少对离子色谱柱的影响,海参多糖中残留的多肽还要通过其他方式去除。比较三氯乙酸法、Sevag法、乙酸锌和亚铁氰化钾法3种方法去蛋白的效果,进一步提高海参多糖得率。
三氯乙酸法:向海参多糖水溶液中加入30%的三氯乙酸溶液缓慢搅拌至不再出现浑浊,静置、离心后去沉淀。
乙酸锌和亚铁氰化钾法:向海参多糖水溶液中加入乙酸锌和亚铁氰化钾溶液,混匀后静置离心。
Sevag法:Sevag试剂是将氯仿和正丁醇以5: 1的比例混匀。向海参多糖水溶液中加入1/4体积的Sevag试剂,混匀后取出上层水溶液,重复操作3次。
1.2.2 色谱条件的优化淋洗液为NaOH溶液,分别采用400、120、80、20 mmol/L NaOH溶液,通过分析单糖的分离效果,选择中性糖和氨基糖的最佳淋洗液浓度。采用200 mmol/L NaOH和1 mol/L NaAC混合淋洗液,设置不同浓度梯度分离糖醛酸,选择糖醛酸分离的最佳淋洗液梯度。
1.2.3 方法重复性和加标回收实验将5 μg/ml的单糖标准混合液进样6次,计算相对标准偏差。对于海参样品中不含有的单糖及含量低的单糖按照1.0、2.0和5.0 mg/g的添加量进行加标回收实验;对于样品中含量高的单糖按照含量的0.5倍、1倍和2倍的添加量进行加标回收实验。平行测定6份,计算平均回收率和相对标准偏差。
1.2.4 单糖含量的测定称取2 g(精确到0.001 g)海参样品,分别加入30 ml 0.1 mol/L乙酸钠缓冲溶液、100 mg木瓜蛋白酶、10 ml EDTA溶液和10 ml半胱氨酸溶液,置于60℃下振荡反应24 h之后,反应混合物离心。向上清液中加入2倍体积95%乙醇,4℃静置过夜,离心弃上清液。沉淀经无水乙醇、丙酮洗涤后重新溶解并定容至100 ml,取4 ml多糖水溶液采用Sevag法去蛋白。取2 ml海参多糖水溶液加入1 ml 2 mol/L三氟乙酸溶液,充氮封管,120℃水解2 h (GB/T 33108-2016),中和后定容至10 ml。取多糖水解液过0.45 μm水系滤膜,采用HPAEC-PAD进行单糖分析及含量测定。前处理方法参考盛文静等(2007),并在原来的基础上稍加改进。
1.2.5 数据分析实验重复3次,每组实验设3组平行,结果以平均值±标准差(Mean±SD)表示。使用SPSS 18.0统计软件单因素分析(One-way ANOVA)对不同处理的差异进行统计分析,统计差异显著性水平为P < 0.05,比较采用Ducan法分析。
2 结果与分析 2.1 海参多糖最佳去蛋白方法分别采用三氯乙酸法、乙酸锌和亚铁氰化钾法及Sevag法去除海参多糖中的蛋白质,结果见表 1。结果显示,3种去蛋白的方法差异性显著(P < 0.05),其中乙酸锌和亚铁氰化钾去除蛋白的方法得到的海参多糖含量最低,表明多糖有损失,效率低,同时该法也引入了杂质离子,因此,不适用于离子交换色谱法。虽然三氯乙酸法得到的海参多糖含量最高,但三氯乙酸引起多糖不必要的水解,不利于海参多糖的纯化。Sevag法去蛋白后和不去蛋白得到的海参多糖含量差异不显著,表明Sevag法对蛋白去除的效果明显,不会引起多糖的损失,同时能够去除小分子多肽对离子色谱柱和离子色谱仪的影响。
|
|
表 1 不同蛋白沉淀剂对海参多糖纯化的影响 Table 1 The effect of protein precipitants on the polysaccharide purification of sea cucumber |
结果显示,当浓度为400 mmol/L NaOH溶液时,各单糖的色谱峰几乎不能分开,表明淋洗液强度太大,单糖在色谱柱上保留变弱,导致保留时间太短,不能实现单糖的有效分离,因此,需要降低NaOH的浓度(李静等, 2012)。由图 1可见,随着淋洗液浓度的降低,单糖与离子基团交换时间长,各单糖标准品逐渐分离,当NaOH溶液浓度为20 mmol/L时,单糖实现了有效分离。在该条件下,8种中性糖和氨基糖(Fuc、Glc、Lac、Gal、Man、Ara、GlcN和GalN)实现了较好分离。
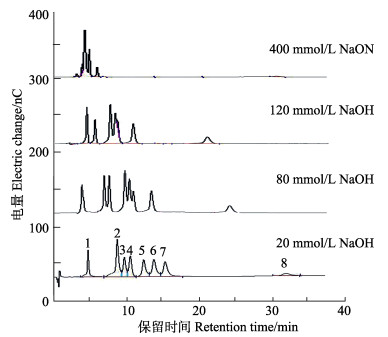
|
图 1 淋洗液浓度对单糖分离的影响 Figure 1 The effect of eluent concentration on the monosaccharide separation 1:岩藻糖;2:氨基半乳糖;3:阿拉伯糖;4:氨基葡萄糖;5:半乳糖;6:甘露糖;7:葡萄糖;8:乳糖 1: Fucose; 2: Galactosamine; 3: Arabinose; 4: Glucosamine; 5: Galactose; 6: Mannose; 7: Glucose; 8: Lactose |
采用160 mmol/L NaOH-200 mmol/L NaAC混合淋洗液分离2种更难洗脱的糖醛酸,葡萄糖醛酸和半乳糖醛酸混合标准溶液的色谱图见图 2。
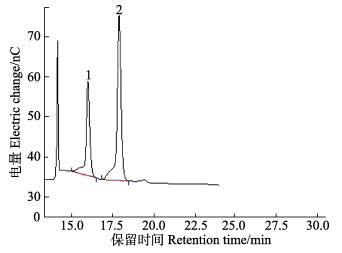
|
图 2 5 μg/ml 2种糖醛酸混合标准溶液的离子色谱 Figure 2 HPAEC-PAD chromatogram of two mixed uronic acid standards (5 μg/ml) 1:葡萄糖醛酸;2:半乳糖醛酸 1: Glucuronic acid; 2: Galacturonic acid |
HPAEC-PAD的色谱条件经优化后,各单糖标准线性方程的相关系数均大于99.8%,线性良好,线性范围在0.25~50 μg/ml之间。将5 μg/ml的单糖标准混合液进样6次,相对标准偏差在0.81%~3.81%之间。加标回收率在83.6%~113.1%之间,结果见表 2。
|
|
表 2 淡干刺参中10种单糖的加标回收率 Table 2 The recovery rate of ten monosaccharides in dried sea cucumber (n=6) |
将刺参多糖的单糖水解液进行HPAEC-PAD测定,将刺参样品的色谱图与单糖标准品色谱图进行对比分析,根据保留时间定性,峰面积定量,计算各海参中单糖的含量,结果见表 3。刺参多糖含有岩藻糖、氨基半乳糖、氨基葡萄糖、半乳糖、甘露糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸,加工方式的不同影响海参中单糖的组成比例。
|
|
表 3 海参多糖单糖组成测定结果 Table 3 The composition of monosaccharide in sea cucumber polysaccharide |
海参多糖提取的同时,与糖连接的蛋白也同时被提取(王远红等, 2005),残留的蛋白会堵塞分析柱,且会影响离子色谱仪的稳定性,因此,蛋白去除是海参多糖进一步纯化和分级的前提(殷涌光等, 2006),张红静(2006)比较不同蛋白去除方法发现,Sevag法去蛋白的效率最高,可用于动物多糖的纯化。李苹苹等(2006)研究紫贻贝(Mytilus edulis)多糖蛋白质脱除方法,发现酶法与Sevag法结合能有效去除紫贻贝多糖中的蛋白质,蛋白脱除率为78.5%。因此,Sevag法能够有效去除海参多糖中的小分子肽,同时不会引起多糖的损失,是动物多糖蛋白去除最常用的方法。
3.2 淋洗液浓度对单糖分离效果的影响HPAEC-PAD是利用糖分子在pH > 10的淋洗液中带负电的形式,能够结合在阴离子交换柱上并被分离,因此,调节分离效率和选择性的重要参数是氢氧化物浓度(曹莉, 2012)。
在淋洗液浓度为20 mmol/L的条件下,葡萄糖醛酸和半乳糖醛酸没有分离,原因可能是NaOH的浓度太低,不能将糖醛酸解析出来,因此,需要更高浓度的淋洗液。在研究中发现,当单独采用NaOH溶液并不能分离糖醛酸,需加入洗脱能力更强的NaAC溶液作为淋洗液(吴胜芳等, 2005; 彭云云等, 2009; 戴军等, 2006)。但在研究中发现,如果淋洗液的浓度过高会造成基线不稳,同时会影响中性糖和氨基糖的分离。因此,可采用2种不同的色谱条件分别分离海参多糖中的单糖,即采用低淋洗液浓度条件分离海参多糖中的中性糖和氨基糖,采用高淋洗液浓度条件分离海参多糖中的糖醛酸。
3.3 单糖含量测定结果的比较海参多糖由不同类型的单糖组成,且单糖存在互变异构、差向异构以及各单糖具有相似结构等特征,所以海参多糖的单糖组成分析是进行海参多糖质量控制和获取多糖基本信息的重要环节(Fonseca et al, 2009)。HPAEC-PAD分析单糖组成具有简单、精密度高、无需衍生等优点,在植物多糖和真菌多糖的应用广泛,本研究首次将HPAEC-PAD应用于动物多糖的单糖分析。将本研究结果和PMP-HPLC分析海参多糖的单糖组成结果(田鑫等, 2014)相比,就单糖种类来看,发现PMP-HPLC的测定结果缺少Ara和GalUA这2种单糖,HPAEC-PAD测得的海参中单糖的种类更全面,这可能和海参多糖的提取方法有关。
3.4 加工工艺对海参中单糖含量的影响传统淡干海参的加工工艺都要经过煮制和烘干,煮制的过程会丢失部分海参单糖,会对海参的营养价值有影响。冻干海参一定程度上保留了海参多糖,但盐干海参和盐渍后再脱水而成的淡干海参单糖的含量明显降低,单糖的种类明显减少。没有经过煮制而直接烘干的海参,其单糖的含量明显高于其他加工方式的海参,表明海参的加工还需要新的科技条件的支撑,最大限度地保留海参单糖。
4 结论本研究采用HPAEC-PAD对海参多糖水解得到的单糖进行分析,使用CarboPac PA10糖分析柱,以一定浓度NaOH溶液和NaAC溶液为淋洗液进行梯度淋洗。该方法可测定海参中的中性糖、氨基糖和糖醛酸,分离效果好,操作简单,无需衍生,精密度高,可为海参中单糖检测标准的制定提供参考。
| Cao L. Separation and detection of monosaccharide by ion chromatography. Chinese Journal of Medical Guide, 2012(10): 1839-1840, 1838 [曹莉. 单糖的离子色谱法分离及检测. 中国医药导刊, 2012(10): 1839-1840, 1838] | |
| Dai J, Liang LN, Yin HP, et al. Analysis of monosaccharide compositions in polysaccharides from D. salina by high-performance anion-exchange chromatography. Food and Fermentation Industries, 2006, 32(11): 131-135 DOI:10.3321/j.issn:0253-990X.2006.11.033 [戴军, 梁立娜, 尹鸿萍, 等. 高效阴离子交换色谱法分析杜氏盐藻多糖的单糖组成. 食品与发酵工业, 2006, 32(11): 131-135] | |
| Fan HZ. Study on development of sea cucumber and its components in health care. Chinese Journal of Marine Drugs, 2001, 82(4): 37-44 [樊绘曾. 海参:海中人参——关于海参及其成分保健医疗功能的研究与开发. 中国海洋药物, 2001, 82(4): 37-44] | |
| Fonseca R, Sabtos G, Mouro P. Effects of polysaccharides enriched in 2, 4-disulfated fucose units on coagulation, thrombosis and bleeding: Practical and conceptual implications. Throbosis and Haemostasis, 2009, 102(5): 829-836 | |
| GB/T33108-2016, determination of saponins in sea cucumbers and their products by high performance liquid chromatography [GB/T33108-2016, 海参及其制品中海参皂苷的测定高效液相色谱法] | |
| Hu S, Chang Y, Wang J, et al. Fucosylated chondroitin sulfate from sea cucumber in combination with rosiglitazone improved glucosemetabolism in the liver of the insulin-resistant mice. Bioscience Biotechnology & Biochemistry, 2013, 77(11): 2263-2268 | |
| Jiang J, Yang BL, Tai Y. Studies on resources and bioactive substances of sea cucumber. Letters in Biotechnology, 2004, 15(5): 537-540 [姜健, 杨宝灵, 邰阳. 海参资源及其生物活性物质的研究. 生物技术通讯, 2004, 15(5): 537-540] | |
| Li J, Li RY, Liang LN. Determination of monosaccharide constituents in Lycium barbarum polysaccharide using capillary ion chromatography with pulsed amperometric detection. Chinese Journal of Analytical Chemistry, 2012, 40(9): 1415-1420 [李静, 李仁勇, 梁立娜. 毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成. 分析化学, 2012, 40(9): 1415-1420] | |
| Li PP, Ding XL. Study on method of protein removal from crude Mytilus edulis Linnaeus polysaccharides. Journal of Shanghai Fisheries University, 2006, 15(3): 3328-3332 [李苹苹, 丁霄霖. 紫贻贝多糖脱除蛋白质方法的研究. 上海水产大学学报, 2006, 15(3): 3328-3332] | |
| Lin WW, Zhang J, Wang MJ. Purification and physico-chemical analysis of polysaccharides from sea cucumber. Shandong Fishery, 2011, 28(3): 40-43 [林威威, 张健, 王茂剑. 海参多糖的纯化及理化分析研究进展. 齐鲁渔业, 2011, 28(3): 40-43] | |
| Liu Q, Dai QC. Study on the activity of polysaccharides in sea cucumber. Heilongjiang Science and Technology Information, 2015(9): 54 [刘琪, 代岐昌. 海参多糖活性研究进展. 黑龙江科技信息, 2015(9): 54] | |
| Liu T. Studies of detecting polysaccharides with IC. Masterxs Thesis of Southwest University, 2009: 11-16. [刘婷. 多糖类物质的离子色谱检测技术研究. 西南大学硕士研究生学位论文y, 2009: 11-16.] | |
| Liu X, Sun Z, Zhang M, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicas. Carbohydrate Polymers, 2012, 90(4): 1664-1670 DOI:10.1016/j.carbpol.2012.07.047 | |
| Olivera-Castillo L, Davalos A, Grant G, et al. Diets containing sea cucumber (Isostichopus badionotus) meals are hypocholesterolemic in young rats. PLoS One, 2013, 8(11): e79446 DOI:10.1371/journal.pone.0079446 | |
| Peng YY, Wu SB, Cheng JN, et al. Determination of monosaccharide and uronic acid in bagasse hemicellulose by ion chromatography. Science and Technology of Papermaking, 2009, 28(5): 10-12, 86 [彭云云, 武书彬, 程江娜, 等. 离子色谱法测定蔗渣半纤维素中的单糖及糖醛酸含量. 造纸科学与技术, 2009, 28(5): 10-12, 86] | |
| Pomin VH. Fucanomics and galactanomics: Marine distribution, medicinal impact, conceptions, and challenges. Marine Drugs, 2012, 10(4): 793-811 | |
| Sheng WJ, Xue CH, Zhao QX, et al. Chemical component analysis of polysaccharides from different sea cucumbers. Chinese Journal of Marine Drugs, 2007, 26(1): 44-49 [盛文静, 薛长湖, 赵庆喜, 等. 不同海参多糖的化学组成分析比较. 中国海洋药物杂志, 2007, 26(1): 44-49] | |
| Shi SJ, Feng WJ, Hu S. Bioactive compounds of sea cucumbers and their therapeutic effects. Chinese Journal of Oceanology and Limnology, 2016, 34(3): 549-558 DOI:10.1007/s00343-016-4334-8 | |
| Song Y, Jin SJ, Cui LH, et al. Immunomodulatory effect of Stichopus japonicus acid mucopolysaccharide on experimental hepatocellular carcinoma in rats. Molecules, 2013, 18(6): 7179-7193 DOI:10.3390/molecules18067179 | |
| Tian X, Sheng WJ, Zhao YY, et al. Simultaneous determination of uronic acids, amino sugars and neutral sugars in polysaccharide from sea cucumber. Science and Technology of Food Industry, 2014, 35(15): 85-89, 94 [田鑫, 盛文静, 赵园园, 等. 刺参多糖中糖醛酸、氨基糖和中性单糖的同步测定方法研究. 食品工业科技, 2014, 35(15): 85-89, 94] | |
| Wang YH, Lü ZH, Jiang TF, et al. Extraction and determination of polysaccharides in the Holothutia. Journal of Ocean University of China (Natural Science), 2005, 35(6): 109-112 [王远红, 吕志华, 姜廷福, 等. 梅花参中多糖提取工艺及含量测定的研究. 中国海洋大学学报(自然科学版), 2005, 35(6): 109-112] | |
| Wu SF, Wang SY, Tao GJ, et al. Determination of galacturonic acid and glucuronic acid in the hydrolyzed polysaccharide solution by ion chromatography. Journal of Food Science and Biotechnology, 2005, 24(4): 86-88 [吴胜芳, 王树英, 陶冠军, 等. 离子色谱法测定多糖水解液中的半乳糖醛酸和葡萄糖醛酸. 食品与生物技术学报, 2005, 24(4): 86-88] | |
| Yin LA. Isolation, purification and characterization of different kinds of sea cucumber polysaccharides. Masterxs Thesis of Ocean University of China, 2009: 37-40. [尹利昂. 不同海参多糖的分离纯化及生化性质分析. 中国海洋大学硕士研究生学位论文, 2009: 37-40.] | |
| Yin YG, Han YZ, Ding HW. Progress in research on animal polysaccharides. Food Science, 2006, 27(3): 256-263 [殷涌光, 韩玉珠, 丁宏伟. 动物多糖的研究进展. 食品科学, 2006, 27(3): 256-263] | |
| Zhang HJ. Polysaccharide fractionation by ultrafiltration-a novel method for isolation and purification of lentinan from Lentinus edodes. Masterxs Thesis of Tianjin University, 2006. [张红静. 超滤法提取与纯化香菇多糖. 天津大学硕士研究生学位论文, 2006.] |



