2. 山东信诺检测技术有限公司 青岛 266101;
3. 青岛大学药学院 青岛 266021
2. Shandong Cigna Detection Technology Co., Ltd, Qingdao 266101;
3. College of Pharmacy, Qingdao University, Qingdao 266021
岩藻黄素(Fucoxanthin)亦称岩藻黄质、褐藻素,化学名为3-(乙酰氧基)-6', 7'-二脱氢-5, 6-环氧-5, 5', 6, 6', 7, 8-六氢-3, 5'-二氢基-8-氧代-β, β-胡萝卜素,分子式为C42H58O6,分子量为658.91,结构式如图 1所示。岩藻黄素是褐藻、硅藻等海洋藻类和无脊椎动物所含有的一种重要的类胡萝卜素,是使褐藻类呈现出褐色的物质,也是硅藻类植物的指标性色素(Yao et al, 2006)。褐藻中岩藻黄素的含量达到自然界中类胡萝卜素总量的10%以上。世界海洋中,每年海藻岩藻黄素的产量可达6.8×106 t,资源量十分丰富(严小军等, 2001; 汪曙晖等, 2010)。

|
图 1 岩藻黄素的化学结构式 Figure 1 The chemical structure of fucoxanthin |
岩藻黄素具有良好的抑制肥胖(Maeda et al, 2005; Miyashita et al, 2011)、调节糖代谢(Maeda et al, 2007)、抗肿瘤(张文源等, 2015; Wang et al, 2012)、抑制血管新生、抑制炎症(Shiratori et al, 2005)的作用,在海藻保健食品及医药制品开发领域展现出良好的应用前景。受加工技术限制,国内应用岩藻黄素的产品极少,而以其为功能因子的膳食补充剂在美国、韩国和日本等国早已上市。寻找最佳的岩藻黄素来源、加快相关产品的开发成为目前国内海藻加工行业关注的热点。建立快速、准确的海藻岩藻黄素色谱分析方法,对于保证行业健康发展、实现市场有效监管和维护消费者合法权益十分重要。
岩藻黄素属丙二烯型类胡萝卜素,含有5, 6-单环氧基、9个共轭双键,还有羰基和羟基(张文源等, 2015; Wang et al, 2014)。这些特征性结构的存在导致岩藻黄素极不稳定,在强光或高温条件下易被氧化和异构化,从而发生降解(张文源等, 2015; Zhao et al, 2014)。干制过程是海藻初级加工品及海藻化工生产过程中的关键环节,不同干制过程对岩藻黄素的影响不同。确定加工生产过程中应选取的最佳干制方式,对于最大限度地获取海藻岩藻黄素资源具有指导意义。因此,本研究建立了基于C18柱固相萃取前处理、RP-HPLC-DAD检测的海藻中岩藻黄素定量分析方法,并采用该方法对新鲜及不同干制方式预处理的代表性褐藻中岩藻黄素含量进行了检测,以期为海藻岩藻黄素资源的合理开发利用提供理论指导和技术支撑。
1 材料与方法 1.1 实验材料新鲜海带(Saccharina japonica)及马尾藻(Sargassum sp.)由山东寻山集团提供,采集于2016年6月,运至实验室后贮藏于-20℃冰箱中备用;岩藻黄素标准品购于Sigma公司;C18固相萃取柱购于天津博纳艾杰尔科技有限公司;色谱纯甲醇购于Burdick & Jackson公司;分析纯甲醇购于国药集团化学试剂有限公司;实验用水为自制超纯水。
1.2 仪器设备1260 InfinityⅡ型液相色谱系统(二极管阵列检测器)(美国Agilent公司);ZORBAX SB-C18色谱柱(4.6×150 mm, 5 μm)(美国Agilent公司);UV1102Ⅱ型紫外-可见分光光度计(上海天美科学仪器有限公司);BAS224S-CW型电子天平(北京赛多利斯科学仪器有限公司);SB-4200DTD型超声波清洗机(宁波新芝生物科技股份有限公司);RE-52AA型旋转蒸发器、SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);ZMQS50001型Milli-Q超纯水系统(美国Millipore公司)。
1.3 实验方法 1.3.1 不同干制方式褐藻样品的制备称取1.00 kg新鲜褐藻样品,粉碎,混合均匀后分成4等份:1份作为新鲜褐藻样品;另3份分别采用自然晾干、烘干(45±3℃)、真空冷冻干燥3种方式进行处理,待干燥至恒重后分别加入研磨机中粉碎,制备得到晾干褐藻、烘干褐藻、冻干褐藻样品。
1.3.2 样品前处理称取2.00 g样品于棕色具塞三角瓶中,加入10 ml甲醇,超声提取30 min,静置后移取5 ml提取液,补加3 ml甲醇、2 ml水至提取液中(甲醇与水的体积比为4: 1),得到10 ml样品液。C18固相萃取柱经10 ml甲醇、10 ml水活化处理后,将上述10 ml样品液移至萃取柱进行吸附,而后采用10 ml 80%甲醇溶液淋洗,弃淋洗液,最后采用20 ml 90%甲醇溶液进行洗脱,收集洗脱液至25 ml棕色容量瓶,定容,混匀,过0.45 μm微孔滤膜后供色谱分析用。
1.3.3 色谱条件色谱柱:ZORBAX SB-C18色谱柱(4.6×150 mm, 5 μm);流动相A为水;流动相B为甲醇;梯度洗脱程序见表 1;流速为0.7 ml/min,进样量为10 μl,柱温为35℃,检测波长为450 nm;外标法定量。
|
|
表 1 液相色谱梯度洗脱程序 Table 1 The gradient elution program of HPLC |
实验结果采用Excel 2013进行处理,以平均值±标准差(Mean±SD)表示。
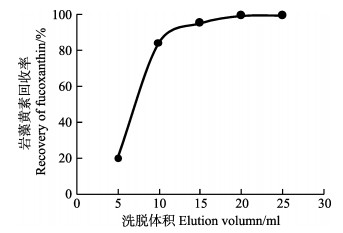
2 结果与分析 2.1 样品前处理方法的选择本研究采用C18柱固相萃取法进行褐藻及其干制品中岩藻黄素的分离净化,优化了样品提取效果,有效去除了其他脂质成分对色谱检测的影响。以岩藻黄素回收率为评价指标,对洗脱溶剂中甲醇比例、洗脱液体积(图 2)进行了选择。结果显示,洗脱液中甲醇浓度为60%~80%时,不能实现对吸附在C18柱上岩藻黄素的完全洗脱,当甲醇浓度增加至90%时,岩藻黄素的洗脱回收率达到99.3%,因此,确定洗脱液选用90%甲醇溶液。由图 2可知,随着洗脱液用量的增大,岩藻黄素回收率逐渐提高,当洗脱体积达到20 ml时,岩藻黄素回收率达到99.3%,继续增大洗脱剂用量,岩藻黄素回收率不再有明显上升,说明采用20 ml以上体积洗脱液可以实现岩藻黄素的理想回收。因此,最终确定采用20 ml 90%甲醇溶液进行C18柱固相萃取洗脱。
|
图 2 C18柱固相萃取岩藻黄素洗脱曲线 Figure 2 C18-SPE elution curve of fucoxanthin |
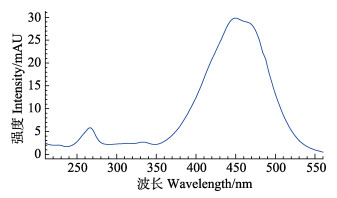
对岩藻黄素标准品在200~600 nm波长范围内进行全波长扫描,吸收光谱如图 3所示。结果显示,岩藻黄素在450 nm波长处具有最大吸收,因此,确定色谱检测波长为450 nm。
|
图 3 岩藻黄素紫外-可见全波长扫描吸收光谱 Figure 3 The UV-Vis wavelength scanning absorption spectra of fucoxanthin standard |
按仪器信噪比(S/N)为3测定得到方法检出限为0.03 mg/L。
分别以岩藻黄素的质量浓度(X)为横坐标、以对应的峰面积(Y)为纵坐标绘制岩藻黄素的标准曲线,得到线性回归方程:Y=38.46X+0.8899,R2=0.9999,线性区间为0.11~50 mg/L。在实验质量浓度范围内,峰面积与质量浓度呈良好的线性关系,可以通过外标法实现准确定量。
2.4 加标回收实验为验证方法的准确度,测定了加标回收率,结果见表 2。在100~600 mg/kg加标浓度范围内,岩藻黄素的加标回收率为92.66%~109.06%,相对标准偏差(RSD)为3.46%~4.61%。本色谱方法的加标回收效果良好,准确度高,可用于褐藻样品中岩藻黄素含量的测定。
|
|
表 2 回收率实验结果 Table 2 The spike recoveries of fucoxanthin |
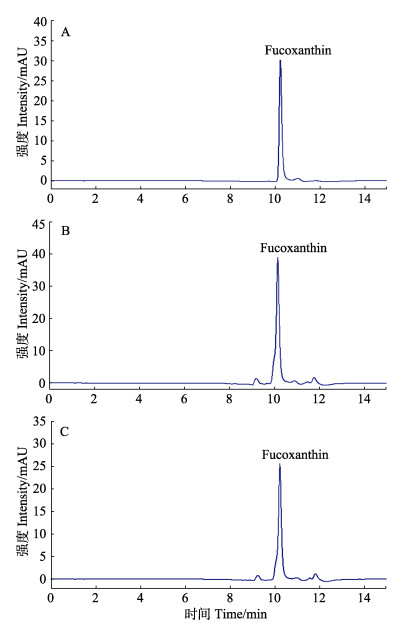
对新鲜及不同干制方式处理的海带和马尾藻样品中岩藻黄素的含量进行了测定,结果见图 4、表 3。经C18柱固相萃取洗脱净化后,在确定的色谱条件下,岩藻黄素标准品出峰时间为10.223 min,海带和马尾藻样品检测基本无干扰,杂质峰较少,可实现准确定量(图 4)。由表 3可知,新鲜海带中岩藻黄素含量(干基)为559.2 mg/kg,自然晾干、烘干和冻干海带中岩藻黄素含量(干基)分别为204.5、205.9和322.4 mg/kg;新鲜马尾藻中岩藻黄素含量(干基)为680.4 mg/kg,自然晾干、烘干和冻干马尾藻中岩藻黄素含量(干基)分别为220.4、225.9和458.8 mg/kg。不同干制方式褐藻中岩藻黄素的含量明显低于新鲜褐藻,其中,经真空冷冻干燥处理后,褐藻岩藻黄素的保留率最高,自然晾干与烘干处理造成的岩藻黄素损失程度基本相同。
|
图 4 岩藻黄素标准品(A)、鲜海带(B)和鲜马尾藻(C)反相高效液相分离图谱 Figure 4 The RP-HPLC spectrum of fucoxanthin standard (A), fresh kelp (B) and fresh sargassum (C) |
|
|
表 3 新鲜及干制褐藻样品中岩藻黄素含量测定结果 Table 3 The fucoxanthin contents of the fresh and dried brown seaweed samples |
目前,关于海藻样品中岩藻黄素的含量研究已有报道,但大部分仍局限于采用分光光度法进行测定(任丹丹等, 2011; 詹冬梅等, 2016; 秦云等, 2013),采用色谱方法进行岩藻黄素定量分析的报道相对较少。宫平等(2012)采用乙醇抽提-高效液相色谱法检测海带中岩藻黄素的含量,方法线性范围为0.3125~10 mg/L,检测限为0.01 mg/L。汪曙晖(2010)采用丙酮抽提-高效液相色谱法检测硅藻中岩藻黄素的含量,方法线性范围为7.2~144 mg/L,检测限为0.72 mg/L。本实验方法采用甲醇抽提-C18柱固相萃取-高效液相色谱法检测褐藻中岩藻黄素的含量,方法线性范围为0.11~50 mg/L,检测限为0.03 mg/L。对比可知,本检测方法定量限更低,灵敏度更高,适合于海藻及其相关制品中低含量岩藻黄素的定量分析。本检测方法改善了样品的前处理方式,采用C18柱固相萃取法完成样品岩藻黄素粗提物的净化,液相色谱图显示该前处理方法明显优化了提取效果,有效去除了其他杂质成分对岩藻黄素检测的影响。经C18柱固相萃取净化后,采用甲醇与水作为流动相进行梯度洗脱即可实现岩藻黄素与其他杂质成分的分离,免除了缓冲盐溶液、乙腈及其他有机试剂等的使用,简化了色谱流动相的组成,减少了检测过程中有毒试剂的使用。同时,本实验确定的C18柱固相萃取洗脱条件也为后期海藻岩藻黄素的规模化分离制备提供了参考。
采用建立的反相高效液相色谱法测定得到新鲜海带和马尾藻中岩藻黄素含量(干基)为559.2 mg/kg和680.4 mg/kg,与他人的研究结果基本一致(任丹丹等, 2011; 詹冬梅等, 2016; 宫平等, 2012)。经不同干燥方式处理后,2种褐藻中岩藻黄素均出现不同程度的损失:采用真空冷冻干燥法作为褐藻的干制方式,可以保留原料中约55%~65%的岩藻黄素;而采用自然晾干法或烘干法作为褐藻的干制方式,仅能保留原料中约35%的岩藻黄素,这与岩藻黄素在强光或高温条件下易被氧化和异构化,从而发生降解有关(张文源等, 2015; Zhao et al, 2014)。因此,在开发海藻岩藻黄素资源时,宜采用新鲜或冻干海藻作为原料,以提高岩藻黄素的得率。
4 结论本研究确定了一种新的可用于海藻中岩藻黄素定性定量分析的反相高效液相色谱法。与现有的检测方法相比,该方法采用C18柱固相萃取法进行样品岩藻黄素粗提物的净化,明显优化了提取效果,色谱检测梯度洗脱流动相也得到简化;同时该方法还具有检测限低、线性范围宽、杂质干扰小、回收率高等特点。
干制褐藻样品中岩藻黄素的含量明显低于新鲜褐藻,经真空冷冻干燥处理后,褐藻岩藻黄素的保留率最高,自然晾干与烘干处理造成的岩藻黄素损失程度基本相同。在开发海藻岩藻黄素资源时,宜采用新鲜或冻干海藻作为原料,从而保证岩藻黄素的得率。本研究为后期海藻岩藻黄素资源的规模化开发提供了理论指导和技术支持。
| Gong P, Chen F, Hui BD. Determination of fucoxanthin from Laminaria japonica by C18-HPLC-PDA. Science and Technology of Food Industry, 2012(1): 342-343 [宫平, 陈菲, 惠伯棣. 海带中岩藻黄质的C18-HPLC-PDA检测. 食品工业科技, 2012(1): 342-343] | |
| Maeda H, Hosokawa M, Sashima T, et al. Fucoxanthin from edible seaweed, Undaria pinnatifida, shows antiobesity effect through UCP1 expression in white adipose tissues. Biochemical and Biophysical Research Communications, 2005, 332(2): 392-397 DOI:10.1016/j.bbrc.2005.05.002 | |
| Maeda H, Hosokawa M, Sashima T, et al. Dietary combination of fucoxanthin and fish oil attenuates the weight gain of white adipose tissue and decreases blood glucose in obese/ diabetic KK-Ay mice. Journal of Agriculture and Food Chemistry, 2007, 55(19): 7701-7706 DOI:10.1021/jf071569n | |
| Miyashita K, Nishikawa S, Beppu F, et al. The allenic carotenoid fucoxanthin, a novel marine nutraceutical from brown seaweeds. Journal of Science and Food Agriculture, 2011, 91(7): 1166-1174 DOI:10.1002/jsfa.v91.7 | |
| Qin Y, Meng LY, Wang FW. Extraction and antioxidant activity of fucoxanthin from Laminaria japonica. Food Science, 2013, 34(16): 279-283 DOI:10.7506/spkx1002-6630-201316057 [秦云, 孟丽媛, 王凤舞. 复合酶法提取海带岩藻黄素及其抗氧化活性分析. 食品科学, 2013, 34(16): 279-283] | |
| Ren DD, Chen Q, Qin ZZ, et al. Effects of different treatments on carotenoid levels in kelp Laminaria japonica. Fisheries Science, 2011, 30(11): 673-676 DOI:10.3969/j.issn.1003-1111.2011.11.004 [任丹丹, 陈倩, 秦振中, 等. 不同处理方式对海带类胡萝卜素含量的影响. 水产科学, 2011, 30(11): 673-676] | |
| Shiratori K, Ohgami K, Ilieva I, et al. Effects of fucoxanthin on lipopolysaccharide-induced inflammation in vitro and in vivo. Experimental Eye Research, 2005, 81(4): 422-428 DOI:10.1016/j.exer.2005.03.002 | |
| Wang J, Chen S, Xu S, et al. In vivo induction of apoptosis by fucoxanthin, a marine carotenoid, associated with down-regulating STAT3/EGFR signaling in sarcoma 180 (S180) xenografts-bearing mice. Marine Drugs, 2012, 10(9): 2055-2068 | |
| Wang SH. Studies on the isolation, identification, and antitumor bioactivities of fucoxanthin in algae. Masterxs Thesis of Ocean University of China, 2010: 39-49 [汪曙晖. 海藻中岩藻黄素的分离鉴定及抗肿瘤活性研究. 中国海洋大学硕士研究生学位论文, 2010: 39-49] | |
| Wang SH, Xue CH. Chemical structure, properties and bioactivities of fucoxanthin. Science and Technology of Food Industry, 2010, 31(6): 408-410 [汪曙晖, 薛长湖. 岩藻黄素的结构、性质和功能. 食品工业科技, 2010, 31(6): 408-410] | |
| Wang SK, Li Y, White WL, et al. Extracts from New Zealand Undaria pinnatifida containing fucoxanthin as potential functional biomaterials against cancer in vitro. Journal of Functional Biomaterials, 2014, 5(2): 29-42 DOI:10.3390/jfb5020029 | |
| Yan XJ, Fan X, Lou QX, et al. Isolation and quantification of carotenoids from marine algae. Studia Marine Sinica, 2001(1): 108-114 [严小军, 范晓, 娄清香, 等. 海藻中类胡萝卜素的提取及含量测定. 海洋科学集刊, 2001(1): 108-114] | |
| Yao P, Yu ZG, Deng CM. Pigment signatures of some diatoms isolated from China seas. Acta Oceanologica Sinica, 2006, 25(1): 108-118 | |
| Zhan DM, Wang XY, Xin ML, et al. Nutritional constituents of three kinds of Sargassum. Journal of Guangxi Academy of Sciences, 2016, 32(3): 221-225 [詹冬梅, 王翔宇, 辛美丽, 等. 三种马尾藻的营养组成分析. 广西科学院学报, 2016, 32(3): 221-225] | |
| Zhang WY, Gao BY, Lei XQ, et al. Progress on physicochemical and biological properties, preparation techniques and physiological activities of fucoxanthin. Chinese Journal of Marine Drugs, 2015, 34(3): 81-95 [张文源, 高保燕, 雷学青, 等. 岩藻黄素的理化与生物学特性、制备技术及其生理活性研究进展. 中国海洋药物, 2015, 34(3): 81-95] | |
| Zhao D, Kim SM, Pan CH, et al. Effects of heating, aerial exposure and illumination on stability of fucoxanthin in canola oil. Food Chemistry, 2014, 145: 505-513 DOI:10.1016/j.foodchem.2013.08.045 |



