2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
白斑综合征病毒(White spot syndrome virus, WSSV)是迄今对虾养殖业危害最大的一种病毒。其具有很强的感染力,被感染对虾在3~10 d内的死亡率高达100%,致使全球对虾养殖业遭受了巨大的经济损失(薛晖等, 2010; Cavalli et al, 2008)。为了解和控制疾病的发生,减少经济损失,诸多学者投身于对虾WSSV的研究中,探究WSSV的防治措施(闫冬春, 2006)。然而,这些方法都不能有效控制WSSV的大规模暴发(Verbruggen et al, 2016)。病毒的大量增殖以及疫情大规模暴发受许多因素的影响,包括传播媒介、宿主种类以及外界环境等,其中,温度与白斑综合征发生密切相关(李侃等, 2013)。
凡纳滨对虾(Litopenaeus vannamei)和斑节对虾(Penaeus monodon)在人工注射感染WSSV后,其病毒复制的时间和抵抗力存在明显差异(孙成波等, 2006)。中国明对虾(Fenneropenaeus chinensis)和日本囊对虾(Marsupenaeus japonicus)人工感染WSSV后,日本囊对虾的存活时间长于中国明对虾(Jiang et al, 2006)。盖春雷等(2013)研究发现,在人工投喂感染WSSV后,中国明对虾比日本囊对虾的发病时间早并且发病率高。本文研究凡纳滨对虾与中国明对虾在不同温度条件下人工感染WSSV后的存活时间、累积死亡率以及对虾肌肉内的病毒载量变化情况,以期阐明不同温度条件下这2种对虾抗WSSV性能的差异,可为实践中优化养殖条件和选育策略,以及为减少和控制对虾疾病的暴发提供参考。
1 材料与方法 1.1 实验材料实验在中国水产科学研究院黄海水产研究所对虾性状测试车间进行。实验所用凡纳滨对虾群体来自河北海壬水产种业科技有限公司,为凡纳滨对虾新品种"壬海1号";中国明对虾群体来自青岛海水养殖引种育种中心的"黄海2号"。选取凡纳滨对虾平均体长和体重约为48.99 mm和1.34 g,中国明对虾平均体长和体重约为38.82 g和0.41 g,数量均为1200尾。实验用水为经砂滤的自然海水,海水盐度为30±1。养殖水箱体积为130 L,保证24 h充气。实验前暂养8 d,每日投喂3次(06:00、14:00、22:00)配合饲料(日投饵量占对虾总体重3%~5%),吸污1次,换水1次(约为50%)。实验前2种对虾各随机抽取3尾对虾经绝对实时荧光定量RT-PCR检测其体内WSSV病毒载量,结果均为阴性。文中L代表凡纳滨对虾,F代表中国明对虾。
1.2 WSSV毒饵的制备取甲壳有明显白斑、发病濒死的对虾肌肉组织,并加入可食用红色素,在充分预冷的组织匀浆机中搅拌,制成混合均匀、颜色醒目的毒饵。其制备过程须在低温环境中快速进行,-80℃冰箱保存。经实时荧光定量PCR检测毒饵WSSV拷贝数,毒饵病毒载量为1×106 copies/mg。
1.3 分组及管理凡纳滨对虾与中国明对虾各设置3个温度环境(24℃、28℃和32℃),每个温度各设置3个平行实验组和1个空白对照组,每组各100尾。实验前暂养期间,海水自然温度为24℃,28℃和32℃组均用加热棒进行升温,每天升温0.5℃,直至各组水温均达到实验所需温度,并且每日均用相应温度的海水分别进行换水处理。
1.4 人工饲喂感染饲喂毒饵前,对虾饥饿处理6 h,保证其胃肠排空,用WSSV毒饵进行人工口饲感染。分别将不同实验组的虾捞出放入单独容器中,将新鲜制备的毒饵置于冰上,用镊子夹取毒饵(约10 mg)轻轻送至对虾口器处,待抱食后的对虾胃部出现明显的红色,将其放回养殖水箱;对照组饲喂经检验为WSSV阴性的健康对虾肌肉。饲喂完毕后,正常投饵、换水,观察对虾死亡情况。
1.5 样品采集及处理实验开始分别在12、24、48、72、96、120、144、168 h共8个时间点活体取样,每组各取3尾对虾肌肉组织用于检测其病毒载量。第15天,在32℃组再各取3尾对虾肌肉组织(24℃和28℃两组对虾已全部死亡),并置于-80℃保存,实验共进行15 d。
1.6 WSSV载量检测方法取8个时间点的各组对虾肌肉组织按照王伟继(2008)的方法进行DNA提取。DNA经1%的琼脂糖凝胶电泳,利用凝胶成像系统(BioImaging Systems)检测其完整性,使用超微量紫外分光光度计(Biodropsis BD-2000)测定DNA质量及浓度,并将其稀释至40 ng/μl。WSSV载量测定采用TaqMan实时荧光定量PCR法(Durand et al, 2002),目标片段长度为69 bp,引物及探针由生工生物工程(上海)股份有限公司合成。荧光定量PCR反应体系(20 μl):1×Premix Ex TaqTM (Probe qPCR)、正反向引物各0.25 μmol/L(表 1)、ROX Reference DyeⅡ 0.25 μmol/L、探针0.125 μmol/L、病毒DNA模板2 μl,灭菌双蒸水补足体积。PCR反应程序:95℃预变性10 s;95℃变性5 s,60℃退火及延伸34 s;共40个PCR循环。以本实验室自行制备含有目的片段的重组质粒pUCm-T/WSSV69为标准品,将WSSV标准品进行10倍系列梯度稀释,共7个梯度,分别为(1.02×102)~(1.02×108) copies/μl,无菌双蒸水作为阴性对照,每个稀释度设置3个平行,用作阳性对照及标准曲线的构建。每个DNA样品平行检测3次,取其平均值作为该样品的WSSV载量。
|
|
表 1 实验所用引物 Table 1 PCR primers used in this study |
从实验出现第1尾对虾死亡开始,每隔1 h进行观察,捞出死亡对虾并记录其死亡时间、组别、体长和体重,装入取样管并放置于-20℃冰箱中,直至实验结束。统计感染WSSV后每组对虾的平均存活时间,结果表示为平均值±标准差(Mean±SD)。采用SPSS 19.0软件和Origin 9.0进行数据统计分析,并用单因素方差(One-way ANOVA)分析对虾平均存活时间和体内肌肉组织病毒载量的差异。
2 结果 2.1 WSSV感染后对虾各性状描述性统计经WSSV感染后,2种对虾24℃组和28℃组死亡率均为100%。L-24℃组和F-24℃最大存活时间分别为324 h和214 h,L-28℃和F-28℃最大存活时间分别为198 h和130 h,2种对虾28℃组最大存活时间均小于24℃组;而L-32℃和F-32℃截至实验结束,均有存活对虾,存活率分别为45.74%和23.47%。24℃组和28℃组中凡纳滨对虾最大存活时间均长于中国明对虾;在32℃组中,凡纳滨对虾存活率大于中国明对虾(表 2)。
|
|
表 2 凡纳滨对虾和中国明对虾经WSSV感染后各性状描述性统计 Table 2 The characteristics of L. vannamei and F. chinensis after WSSV infection |
L-24℃和F-24℃、L-28℃和F-28℃和L-32℃和F-32℃各组到达死亡率为10%的时间分别为108 h和48 h、68 h和38 h、128 h和38 h;到达死亡率为50%的时间分别为178 h和98 h、98 h和74 h、292 h和78 h。在相同温度、相同死亡率时,凡纳滨对虾的存活时间均大于中国明对虾。
凡纳滨对虾和中国明对虾到达相同死亡率时的时间,28℃组均小于24℃组和32℃组。中国明对虾32℃组到达不同死亡率时的时间均小于24℃组(图 1)。
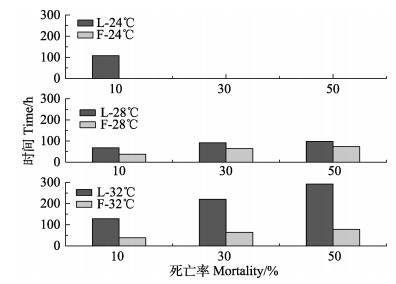
|
图 1 不同温度下2种对虾WSSV感染后到达不同累积死亡率的时间 Figure 1 The time vs mortality of two shrimps after the WSSV infection at different temperature |
在24℃组中,L-24℃组和F-24℃组第2天死亡尾数分别为4尾和23尾;F-24℃组第3天死亡尾数较高,第4天达到死亡高峰,为56尾;L-24℃组前4 d死亡尾数一直较少,到第5天出现死亡高峰,为33尾;F-24℃组从第5~8天死亡数量持续下降,至第9天全部死亡;L-24℃组第6~9天死亡数量持续保持较高的水平(平均值约为25尾),第10天迅速下降,到第15天全部死亡(图 2上)。
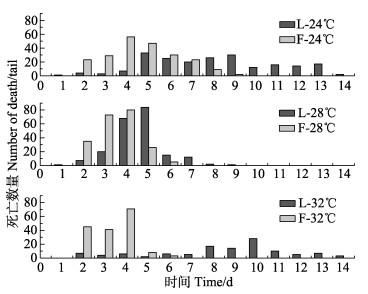
|
图 2 WSSV感染后不同时间段对虾死亡数量 Figure 2 The time point vs death of shrimps after the WSSV infection |
在28℃组中,L-28℃组和F-28℃组第2天死亡尾数分别为7尾和35尾;F-28℃组第3天死亡尾数急剧上升,到第4天达到死亡高峰,为80尾;L-28℃组第3天死亡尾数急剧上升,到第5天达到死亡高峰,为84尾;第6天2组死亡尾数均迅速下降,L-28℃组到第7天全部死亡,F-28℃组到第10天全部死亡(图 2中)。
在32℃组中,L-32℃组从第1~7天的死亡尾数保持较低水平,第8天开始上升,到第10天达到死亡高峰,为28尾;F-32℃组死亡尾数从第2天迅速上升,到第4天达到死亡高峰,为71尾,第7天后无死亡对虾(图 2下)。
2.4 WSSV感染后各组对虾累积死亡率在24℃组中,L-24℃组和F-24℃组在3 d时累积死亡率分别为3.81%和24.06%;8 d时分别达到56.57%和99.00%;2组分别在14 d和9 d累积死亡率达到100%。在28℃组中,L-28℃组和F-28℃组在3 d时累积死亡率分别为13.36%和49.32%;5 d时分别达到85.74%和97.54%;2组分别在9 d和6 d累积死亡率达到100%。在32℃组中,L-32℃组和F-32℃组在3 d时累积死亡率分别为5.21%和39.23%;4 d分别达到8.07%和71.51%;到14 d时,2组累积死亡率分别为54.26%和76.53%(图 3)。
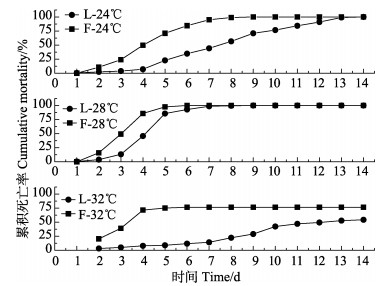
|
图 3 WSSV感染后对虾累积死亡率 Figure 3 The cumulative mortality of shrimps after the WSSV infection |
在24℃组中,L-24℃组和F-24℃组在24 h之前对虾肌肉组织病毒载量分别为(8.61×102±1.08×103)和(9.74×101±6.70×101) copies/ng DNA;2 d时,L-24℃组为(8.12×102±1.01×103) copies/ng DNA,F-24℃组已达到(2.45×106±2.92×106) copies/ng DNA,2组差异显著(P < 0.05);至6 d,2组分别达到(2.97×106± 7.44×106)和(8.08×106±3.22×106) copies/ng DNA,差异极显著(P < 0.01)。
在28℃组中,L-28℃组和F-28℃组在24 h对虾肌肉组织病毒载量分别为(1.65×102±1.92×102)和(1.23×103±1.73×103) copies/ng DNA,2组差异不显著(P > 0.05);F-28℃组在2 d首先达到(1.51×106±2.49×106) copies/ng DNA,L-28℃组在4 d达到(4.40×106± 2.31×106) copies/ng DNA;至6 d,L-28℃组和F-28℃组分别达到(6.73×106±1.49×106)和(1.20×107±6.15×105) copies/ng DNA,2组差异极显著(P < 0.01)。
在32℃组中,L-32℃组和F-32℃组在前48 h对虾肌肉组织病毒载量较低;F-32℃组在3 d首先达到(5.53×104±4.78×104) copies/ng DNA;L-32℃组5 d达到(1.04×104±1.12×104) copies/ng DNA;至15 d,L-32℃组和F-32℃组分别为(5.18×103±4.32×103)和(3.78×104±8.97×103) copies/ng DNA,2组差异显著(P < 0.05)(图 4)。

|
图 4 WSSV感染后对虾肌肉组织病毒载量变化 Figure 4 The change of viral load in muscle tissue of shrimps after WSSV infection |
在感染对虾的众多病原中,WSSV的危害最为严重(Escobedo-Bonilla et al, 2007)。研究不同种类对虾对WSSV的敏感性,对于虾的遗传选育有重要意义(刘庆慧等, 2005)。现已有中国明对虾和日本囊对虾(盖春蕾等, 2013)、凡纳滨对虾和斑节对虾(Wongtavatchai et al, 2010)、日本沼虾(Macrobrachium nipponensis)、凡纳滨对虾(戚兰等, 2003)、中国明对虾和凡纳滨对虾(冯亚萍等, 2017)以及不同家系的中国明对虾(董世瑞等, 2015)对疾病的敏感性差异研究。
3.1 对虾自身特点宿主对WSSV的敏感性和抵抗力因种而异,如WSSV引起印度对虾(Penaeus indicus)、斑节对虾、巨掌沼虾(Macrobrachium superbum)100%死亡率的时间分别为感染后的72 h、48 h、5 d和8 d,而罗氏沼虾(Macrobrachium rosenbergii)在注射感染WSSV 15 d后没有死亡(Sahul Hameed et al, 2000)。吴仲庆等(2003)研究表明,日本囊对虾和凡纳滨对虾在感染WSSV后20 d的累积死亡率分别是100.00%和83.33%,存在统计学差异。Syed等(2006)研究表明,通过对波纹龙虾(Panulirus homarus)和锦绣龙虾(Panulirus ornatus)肌肉注射相同剂量的WSSV病毒粒子,其达到100%累积死亡率的时间分别是168 h和120 h。李素红等(2007)研究表明,即使同一种属不同家系之间的中国明对虾,对WSSV的敏感性也存在较大差异。黄永春等(2013)对凡纳滨对虾进行WSSV感染实验,发现不同家系的对虾对WSSV的抗性不同。本研究中,凡纳滨对虾和中国明对虾对WSSV的耐受性存在差异,其在平均存活时间、累积死亡率和对虾体内病毒载量均存在显著差异。
3.2 选育效果90年代以前,我国北方对虾养殖品种主要是中国明对虾。2001年后,由于凡纳滨对虾性状优良,在我国沿海养殖规模迅速扩大,成为我国对虾养殖的绝对优势种(黄永春等, 2013)。本研究所用凡纳滨对虾是中国水产科学研究院黄海水产研究所与青岛海壬水产种业科技有限公司合作,培育出生长优势显著、存活率高的凡纳滨对虾"壬海1号"。其平均存活时间长,各时间点累积死亡率低,并且随着实验时间的延长其肌肉内病毒载量增殖速度慢。而中国明对虾是采用群体、家系与多性状复合育种技术,培育出中国明对虾养殖新品种(品种登记号:GS01-002 -2008)。其表现出明显的抗病性,能有效阻止WSSV的感染规模以及感染进程(逄锦菲等, 2013)。作者曾就中国明对虾抗病新品种"黄海2号"与中国明对虾野生群体进行抗WSSV性能实验,"黄海2号"与之相比表现出了明显的抗病优势,在一定程度上说明中国明对虾的选育工作取得了一定的进步和成果。通过抗病良种选育,可提高对虾的免疫机能和抗病能力,是有效预防对虾白斑病的重要措施之一(纪荣兴等, 2008)。
3.3 不同温度环境对WSSV增殖以及对对虾耐受性的影响对虾白斑综合征的暴发与水温密切相关(Withyachumnarnkul et al, 2003)。Rahman等(2007)研究水温变化(27℃、33℃)对斑节对虾幼体感染WSSV的影响,发现33℃组死亡率很低。You等(2010)分析了高温(31℃)对感染WSSV的日本对虾幼体和成体的死亡率、免疫反应和病毒复制的影响,发现31℃能大幅度降低死亡率(与27℃相比),高温组对虾成体的PO活性、血细胞总数与未感染对虾无显著差异(P > 0.05),证实高温抑制病毒复制,而不是提高对虾免疫反应。吴晓果等(2012)研究表明,高水温(≥32℃)能不同程度地降低和减缓对虾白斑综合征引起的死亡。李侃等(2013)通过研究环境温度与病毒增殖速度的相关性,得出高温(33℃)对病毒的增殖具有一定的抑制作用,并且明显改变了病毒基因的转录。
本研究中,凡纳滨对虾24℃组和28℃组最大存活时间分别为324 h和214 h,中国明对虾分别为198 h和130 h,28℃组最大存活时间均小于24℃组(表 2)。3个温度组中,2种对虾28℃组死亡高峰时的尾数均大于24℃和32℃,并且均最先达到100%的累积死亡率(图 2和图 3)。至第15天时,2种对虾24℃组和28℃组累积死亡率均为100%,而32℃组依然有45.74%和23.47%的对虾存活。从对虾肌肉内病毒载量的增殖情况来看,凡纳滨对虾24℃组和28℃组病毒载量最大值为6.40×106和8.94×106 copies/ng DNA,32℃组为6.04×104 copies/ng DNA;中国明对虾24℃组和28℃组病毒载量最大值为2.71×107和3.67×107 copies/ng DNA,32℃组为1.15×105 copies/ng DNA(图 4)。综上所述,3组温度相比较,28℃组最大存活时间最短、病毒复制速度最快;32℃组15 d后依然有存活对虾,且病毒复制水平低,表现出对WSSV增殖速度的抑制,减缓了白斑综合征引起的死亡。
3.4 体型规格对对虾抗病性的影响本研究所使用的2种对虾由于其对生长季节的要求不同等原因,致使相同时间段凡纳滨对虾与中国明对虾相比规格较大,其平均体长相差约1.02 cm。黄旭雄等(2006)研究不同规格中国明对虾的非特异性免疫水平,表明实验用中国明对虾的免疫水平与体长或体重基本无关。董世瑞等(2015)研究不同家系中国对虾形态性状与抗病力的关系,表明体长、全长和体重均不是影响各家系对虾感染WSSV存活时间的主要相关性状。而李优等(2016)对3种规格凡纳滨对虾抗WSSV进行了初步研究,表明其具有规格越大抗WSSV性能越弱的趋势。凡纳滨对虾规格相对较大,而表现出的抗WSSV性能与中国明对虾相比较强,推断2种对虾完全相同规格的情况下,凡纳滨对虾对WSSV的耐受性更强。
3.5 对虾的争胜行为通过观察实验,发现中国明对虾的争胜行为要强于凡纳滨对虾,并且温度越高,对虾间相互啃食现象越严重。张沛东等(2008)通过研究中国明对虾和凡纳滨对虾仔虾的行为,发现中国明对虾仔虾自残行为高发,攻击频率高;凡纳滨对虾仔虾自残现象少,攻击频率低。李玉全(2014)研究发现,日本囊对虾的争斗性行为发生的概率随着温度的升高而增加。赵玉超等(2016)研究发现,凡纳滨对虾个体在密度越高的环境下争斗次数越高。本研究中,中国明对虾32℃组前期残食现象严重,死亡数量较多;随着密度的减小,死亡数量逐渐减少。
本研究中,2种对虾在3种温度条件下感染WSSV后,凡纳滨对虾耐受WSSV能力要高于中国明对虾,凡纳滨对虾选育群体"壬海1号"在人工感染WSSV条件下表现出了较好的抗病性能,为我国对虾抗病良种选育工作提供有价值的参考。
| Cavalli LS, Marins LF, Netto S, et al. Evaluation of white spot syndrome virus (WSSV) in wild shrimp after a major outbreak in shrimp farms at Laguna, southern Brazil. Atlantica, Rio Grande, 2008, 30(1): 45-52 | |
| Dong SR, Lü YF. Path analysis of effects of morphometric traits on resistance to WSSV among different families in Fenneropenaeus chinensis. Chinese Fishery Quality and Standards, 2015, 5(2): 15-21 [董世瑞, 吕瑜峰. 不同家系中国对虾形态性状与抗病力的关系. 中国渔业质量与标准, 2015, 5(2): 15-21] | |
| Durand SV, Lightner DV. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp. Journal of Fish Diseases, 2002, 25(7): 381-389 DOI:10.1046/j.1365-2761.2002.00367.x | |
| Escobedo-Bonilla CM, Alday-Sanz V, Wille M, et al. A review on the morphology, molecular characterization, morphogenesis and pathogenesis of white spot syndrome virus. Journal of Fish Diseases, 2007, 31(1): 1-18 DOI:10.1111/jfd.2008.31.issue-1 | |
| Feng YP, Kong J, Luo K, et al. The comparison of the sensitivity to the white spot syndrome virus between Fenneropenaeus chinensis and Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(6): 78-84 [中国对虾(Fenneropenaeus chinensis)和凡纳滨对虾(Litopenaeus vannamei)对白斑综合征病毒的敏感性比较. 渔业科学进展, 2017, 38(6): 78-84] | |
| Gai CL, Xu L, Ye HB, et al. The difference of sensitivity to the white spot syndrome virus between Fenneropenaeus chinensis and Penaeus japonicas. Fisheries Science & Technology Information, 2013, 40(4): 207-209 [盖春蕾, 许拉, 叶海斌, 等. 中国对虾和日本对虾对白斑综合征病毒(WSSV)敏感性的比较. 水产科技情报, 2013, 40(4): 207-209] | |
| Huang XX, Zhou HQ. The innate immune activity of the shrimp Fenneropenaeus chinensis with different sizes. Journal of Shanghai Fisheries University, 2006, 15(1): 7-11 [黄旭雄, 周洪琪. 不同规格中国明对虾的非特异性免疫水平. 上海水产大学学报, 2006, 15(1): 7-11] | |
| Huang YC, Ai HS, Pan ZC, et al. Establishment and WSSV resistant characteristics of selective breeding families for resistance to the white spot syndrome virus of Litopenaeus vannamei. Journal of Fisheries of China, 2013, 37(3): 359-366 [黄永春, 艾华水, 潘忠诚, 等. 凡纳滨对虾抗WSSV选育家系的建立及其抗病特性. 水产学报, 2013, 37(3): 359-366] | |
| Ji RX, Zou WZ, Yan QP, et al. Immunogenicity and WSSV resistance of anti-WSSV Penaeus japonicus F3. Journal of Fisheries of China, 2008, 32(1): 98-104 [纪荣兴, 邹文政, 鄢庆枇, 等. 日本对虾抗白斑病子三代的抗白斑综合征病毒感染能力及免疫特性. 水产学报, 2008, 32(1): 98-104] | |
| Jiang G, Yu R, Zhou M. Studies on nitric oxide synthase activity in haemocytes of shrimps Fenneropenaeus chinensis and Marsupenaeus japonicus after white spot syndrome virus infection. Nitric Oxide, 2006, 14(3): 219-277 DOI:10.1016/j.niox.2005.11.005 | |
| Li K, Luo SY, Xu LM, et al. A study on the mechanism of temperature impact on the proliferation of white spot syndrome virus (WSSV). Journal of Applied Oceanography, 2013, 32(1): 61-66 [李侃, 罗淑娅, 徐丽美, 等. 温度影响对虾白斑综合症病毒增殖机制的研究. 应用海洋学学报, 2013, 32(1): 61-66] | |
| Li SH, Zhang TS, Meng XH, et al. Analysis of the resistance of heterosis in Fenneropenaeus chinensis to natural infection with white spot syndrome virus. Journal of Fisheries of China, 2007, 31(1): 68-75 [李素红, 张天时, 孟宪红, 等. 中国对虾杂交优势对自然感染白斑综合征病毒的抗病力分析. 水产学报, 2007, 31(1): 68-75] | |
| Li Y, Chen LZ, Yu XY, et al. Preliminary study on resistance to WSSV of three species of Litopenaeus vannamei. Shandong Fisheries, 2016(8): 1-4 [李优, 陈禄芝, 余霞艳, 等. 三种规格凡纳滨对虾抗WSSV性能的初步研究. 齐鲁渔业, 2016(8): 1-4] | |
| Li YQ. The relationship with Penaeus japonicas winning behavior and temperature. Journal of Jiangsu Agricultural Sciences, 2014(8): 231-232 [李玉全. 日本囊对虾的争胜行为及其与温度的关系. 江苏农业科学, 2014(8): 231-232] | |
| Liu QH, Huang J, Yang B, et al. Changes of immune and biochemical factors in two selected populations of prawn (Fenneropenaeus chinensis) infected by white spot syndrome virus. Marine Fisheries Research, 2005, 26(6): 22-27 [刘庆慧, 黄倢, 杨冰, 等. 人工选育中国对虾两个群体WSSV感染相关免疫与生化因子的变化. 海洋水产研究, 2005, 26(6): 22-27] | |
| Pang JF, Kong J, Meng XH, et al. Real-time assay for quantifying WSSV load in Fenneropenaeus chinensis "Huang hai No.2". Oceanologia et Limnologia Sinica, 2013, 44(3): 782-787 DOI:10.11693/hyhz201303037037 [逄锦菲, 孔杰, 孟宪红, 等. 中国对虾(Fenneropenaeus chinensis)"黄海2号"人工感染WSSV的荧光定量分析. 海洋与湖沼, 2013, 44(3): 782-787] | |
| Qi L, Ke HF, Zheng CY, et al. Studies on immunological factors of Macrobrnahium Nipponese and Penaeus Vannmei. Journal of Shaoxing University, 2003, 23(10): 65-67 DOI:10.3969/j.issn.1008-293X.2003.10.017 [戚兰, 柯慧芬, 郑春燕, 等. 日本沼虾和南美白对虾免疫因子的比较研究. 绍兴文理学院学报, 2003, 23(10): 65-67] | |
| Rahman MM, Corteel M, Dantas-Lima JJ, et al. Impact of daily fluctuations of optimum (27℃) and high water temperature (33℃) on Penaeus vannamei juveniles infected with white spot syndrome virus (WSSV). Aquaculture, 2007, 269(1-4): 107-113 DOI:10.1016/j.aquaculture.2007.04.056 | |
| Sahul Hameed AS, Charles MX, Anilkumar M. Tolerance of Macrobrachium rosenbergii to white spot syndrome virus. Aquaculture, 2000, 183(3-4): 207-213 DOI:10.1016/S0044-8486(99)00305-1 | |
| Sun CB, He JG, Li ZL, et al. Sensitivity Difference to WSSV of Penaeus monodon and Litopenaeus vannamei. Journal of Zhanjiang Ocean University, 2006, 26(3): 17-20 [孙成波, 何建国, 黎子兰, 等. 凡纳滨对虾和斑节对虾对WSSV敏感性的比较. 广东海洋大学学报, 2006, 26(3): 17-20] | |
| Syed MS, Sudhakaran R, Balasubramanian G, et al. Experimental transmission and tissue tropism of white spot syndrome virus (WSSV) in two species of lobsters, Panulirus homarus and Panulirus ornatus. Journal of Invertebrate Pathology, 2006, 93(2): 75-80 DOI:10.1016/j.jip.2006.06.006 | |
| Verbruggen B, Bickley L, van Aerle R, et al. Molecular mechanisms of white spot syndrome virus infection and perspectives on treatments. Viruses, 2016, 8(1): 23 DOI:10.3390/v8010023 | |
| Wang WJ. Genetic mapping of the Chinese shrimp Fenneropenaeus chinensis using AFLP markers and commercial traits QTL mapping. Doctoral Dissertation of Ocean University of China, 2008: 66-73 [王伟继. 中国对虾(Fenneropenaeus chinensis) AFLP分子标记遗传连锁图谱的构建以及相关性状的QTL定位. 中国海洋大学博士研究生学位论文, 2008: 66-73] | |
| Withyachumnarnkul B, Boonsaeng V, Chomsoong R, et al. Seasonal variation in white spot syndrome virus-positive samples in broodstock and post-larvae of Penaeus monodon in Thailand. Diseases of Aquatic Organisms, 2003, 53(2): 167-171 | |
| Wongtavatchai J, Lópezdóriga MV, Francis MJ. Effect of AquaVac™ Vibromax™ on size and health of post larva stage of Pacific White shrimp Litopenaeus vannamei and black tiger shrimp Penaeus monodon. Aquaculture, 2010, 308(3-4): 75-81 DOI:10.1016/j.aquaculture.2010.08.017 | |
| Wu XG, Xiong HT, Du HH, et al. Advances on possible mechanism of hyperthermia inhibition of white spot syndrome in shrimp. Fisheries Science, 2012, 31(9): 568-572 [吴晓果, 熊海涛, 杜华华, 等. 高温抑制对虾白斑综合征的机理研究进展. 水产科学, 2012, 31(9): 568-572] | |
| Wu ZQ, Lin XG, Miu S, et al. The study of sensitivity to the white spot syndrome virus between Penaeus japonicas and Litopenaeus vannamei. China Fisheries Society National Conference on Seawater Cultured Facilities, 2003. [吴仲庆, 林学国, 缪嵩, 等. 日本囊对虾和凡纳滨对虾对白斑易感程度的比较研究. 中国水产学会全国海水设施养殖学术研讨会, 2003.] | |
| Xue H, Ding ZF, Zhou G, et al. Survey and research of the white spot syndrome virus (WSSV) infection in several kinds of economic types of freshwater crustaceans. Jiangsu Agricultural Sciences, 2010(3): 294-297 [薛晖, 丁正峰, 周刚, 等. 白斑综合征病毒(WSSV)在几种经济类淡水甲壳动物中的感染与流行调查研究. 江苏农业科学, 2010(3): 294-297] | |
| Yan DC. Prevention and cure of shrimp white spot syndrome virus. Journal of Fishery Sciences of China, 2006, 25(4): 202-204 [闫冬春. 防治对虾白斑综合征病毒(WSSV)的主要措施. 水产科学, 2006, 25(4): 202-204] | |
| You XX, Su YQ, Mao Y, et al. Effect of high water temperature on mortality, immune response and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults. Aquaculture, 2010, 305(1): 133-137 | |
| Zhang PD, Zhang XM, Li J, et al. Observation of behavior in Fenneropenaeus chinensis and Litopenaeus vannamei postlarvae. Journal of Fisheries of China, 2008, 32(2): 223-228 [张沛东, 张秀梅, 李健, 等. 中国明对虾、凡纳滨对虾仔虾的行为观察. 水产学报, 2008, 32(2): 223-228] | |
| Zhao YC, Qin H, Li YQ, et al. Effects of stocking density and food types on growth and agonistic behavior in pacific white leg shrimp Litopenaeus vannamei. Chinese Journal of Fisheries, 2016, 29(3): 44-48 [赵玉超, 秦浩, 李玉全, 等. 密度和饲料种类对凡纳滨对虾Litopenaeus vannamei争胜行为和生长的影响. 水产学杂志, 2016, 29(3): 44-48] |



