2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
中国明对虾(Fenneropenaeus chinensis)是我国重要的土著海水养殖种类之一,近十几年来,其养殖产业饱受病害困扰。在诸多病原中,白斑综合征病毒(White spot syndrome virus, WSSV)是对对虾养殖生产毒害最大的病毒之一(Lightner, 1996),它所导致的疾病传播快、破坏性强且防治困难,已经给我国乃至全球的对虾养殖业造成了极大危害,严重制约了对虾养殖业的健康发展。国内外学者展开了大量的研究工作,如消除传染源、切断传播途径、控制水质量、提高对虾抵抗力等,以降低其危害,但效果不显著(Yang et al, 2001; He et al, 2012; Yang et al, 2012; 曹家旺等, 2017)。研究对虾对病原感染的免疫应答机制,可以为有效地进行对虾的病害防治提供重要的理论指导。
果糖1, 6-二磷酸醛缩酶(Fructose-1, 6-bisphosphate aldolase, FBA)(EC 4.1.2.13)是糖酵解和糖异生过程中的一种关键酶,它普遍存在于动植物及微生物体内。到目前为止,醛缩酶已在多个物种,尤其是细菌和脊椎动物中得到了广泛研究,研究重点在其结构、动力学参数、酶活特性和治疗中的潜在功能(Giegé et al, 2003; Lorentzen et al, 2004; Rodaki et al, 2006; Dawson et al, 2013)。哺乳动物醛缩酶通过与控制肌动蛋白聚合的WASP/Arp2/3复合物相互作用,从而在细胞内吞中起作用,最终影响了细胞增殖(Lew et al, 2012、2013)。尤其引人注意的是,醛缩酶基因的干扰可以抑制细胞增殖,单核酸突变也可以降低酶活并抑制脊椎动物的生长(Van den Berghe, 1994; Haake et al, 1999)。最新研究表明,醛缩酶还在控制RNA聚合酶Ⅲ转录中起作用(Cieśla et al, 2014)。而在水产动物中,该基因相关的研究报道则较少,仅在电鳗(Electrophorus electricus)、文蛤(Meretrix meretrix)、草鱼(Ctenopharyngodon idellus)、红耳龟(Trachemys scripta)等少数物种中,有部分酶活分析和SNP研究(De-Simone et al, 2006; Wang et al, 2012; 曹婷婷等, 2012; 李玺洋等, 2012; Dawson et al, 2013)。
在中国明对虾感染WSSV后的表达谱芯片研究中,我们发现醛缩酶基因出现了显著差异表达。此外,该基因内部出现了与抗病性状呈显著关联的SNP位点。因此,本研究采用RACE技术克隆中国明对虾的醛缩酶基因(以下称FcFBA基因),研究其在感染WSSV后的时空表达特点,并进一步利用基因干扰技术初步分析其在对虾染病后的表达特点,以期为中国明对虾抗WSSV育种提供理论依据和实践材料。
1 材料与方法 1.1 实验材料中国明对虾实验群体取自中国水产科学研究院黄海水产研究所遗传育种中心,对虾大小均匀,体重为(1.01±0.21) g。实验前,暂养1周。实验用水为砂滤后海水,养殖期间的水温为24.8℃~25.4℃,盐度为28,持续充氧,每天换水,并投喂配合饲料。
1.2 总RNA提取及cDNA合成使用Trizol法提取中国明对虾肝胰腺组织的总RNA,具体操作方法参照说明书(Invitrogen, 美国)。采用紫外分光光度计与琼脂糖凝胶电泳,检测所提取RNA的质量及完整性。利用SMARTTM RACE Amplification Kit(Clontech, 美国)反转录合成cDNA第一条链。
1.3 FcFBA基因全长cDNA的克隆及测序根据本实验室的中国明对虾454转录组测序获得的醛缩酶基因的部分EST序列,使用Primer Premier 5.0软件设计5' RACE和3' RACE引物(表 1),利用AD酶,分别进行RACE扩增。扩增产物经1.2%琼脂糖凝胶电泳检测后,利用胶回收试剂盒回收目的片段,连接到pMD18-T simple载体上,转化入Top 10感受态细胞。使用M13引物(表 1)对克隆进行菌落PCR鉴定,阳性克隆经确定后送生工生物工程(上海)股份有限公司进行测序。
|
|
表 1 引物序列及信息 Table 1 Primer sequences in RACE, qRT-PCR and RNAi |
通过NCBI网站上的BLASTX对测序结果进行序列同源性比对分析,利用DNASTAR软件进行全长序列拼接,在线生物学软件ExPASy对全长序列编码的氨基酸序列进行生物信息学分析,使用MEGA 5.0软件的邻接法(NJ)构建系统进化树。
1.5 人工WSSV感染实验实验前随机挑选暂养的健康中国明对虾180尾,平均分为2组(WSSV感染组和对照组),每组3个平行。WSSV感染组,从第5腹节处注射病毒含量为103 copies/μl的病毒悬液10 μl,各组分别在实验开始后的0、6、12、24、48 h,取鳃、肝胰腺和肌肉组织,每个时间点各取3尾存于液氮中,用于后续RNA的提取及荧光定量验证。
1.6 FcFBA dsRNA的合成以中国明对虾肝胰腺cDNA为模板,用正向引物RNAi F和反向引物RNAi R,PCR扩增FcFBA基因的cDNA片段。采用rTaq酶进行扩增,PCR扩增体系为20 μl,包括模板2 μl,正反向引物(10 μmol/L各1 μl,PCR Buffer 2 μl,dNTP (2.5 mmol/L each)1.6 μl。PCR程序为95℃预变性5 min,1个循环;95℃变性30 s,60℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min,1个循环。PCR结束后,采用胶回收试剂盒进行纯化。由此,获得FcFBA dsRNA的体外转录模板。采用in vitro Transcription T7 Kit进行体外转录,实验方法参见(for siRNA Synthesis)说明书(TaKaRa, 日本)。
1.7 dsRNA干扰设置dsRNA实验组和PBS对照组,每组30尾对虾,2个平行。注射前,取3尾虾作为空白对照。对照组每尾对虾从第5腹节处注射10 μl的PBS,实验组每尾对虾从第5腹节处注射10 μl的dsRNA (100 ng/μl),注射后的6、12、24、48和72 h分别取肝胰腺组织用于RNA提取,以进行后续的基因表达分析。在干扰后的24 h,2组分别再注射10 μl 103 copies/μl的WSSV病毒悬液,统计2组的死亡率。
1.8 基因的时空表达分析以18S rRNA作为real-time PCR反应的内参基因,采用TaKaRa的荧光定量PCR试剂盒对基因进行荧光定量PCR(qRT-PCR)检测。所用仪器为ABI 7500型荧光定量PCR仪,各个基因引物序列见表 1。20 μl反应体系包含:2×SYBR Green PCR Master Mix 10 μl,正向和反向引物各1 μl (2 μmol/L),稀释后的cDNA模板1 μl (1:10稀释),循环参数参照说明书。实验重复3次,以平均值进行后续数据分析。根据2-ΔΔCt方法计算出每个基因的相对表达量,所得数据用SPSS 18.0进行单因素方差分析(One-way ANOVA),比较均值的差异显著性(P < 0.05)。
2 结果与分析 2.1 FcFBA基因cDNA全长序列的克隆根据实验室前期获得的醛缩酶基因部分EST序列设计RACE引物,获得5'RACE片段和3'RACE片段,长度分别为594 bp和1366 bp,拼接后得到全长cDNA序列。FcFBA cDNA序列全长为2496 bp,其中,ORF为1098 bp,编码365个氨基酸(GenBank No. KJ686589),含有5个保守的氨基酸位点,包括Lys231。该蛋白预测的理论等电点为6.6,分子量为39.8 kDa。序列中的5' UTR长79 bp,3' UTR长1319 bp,终止密码子为TAA(图 1)。

|
图 1 FcFBA cDNA全长序列及其编码的氨基酸序列 Figure 1 The full-length cDNA sequence and deduced amino acid sequence of the FcFBA gene 起始密码子和终止密码子用下划线表示,保守位点用框表示 The start codon (ATG) and stop codon (TAA) are underlined. The conserved active sites and their codons are boxed |
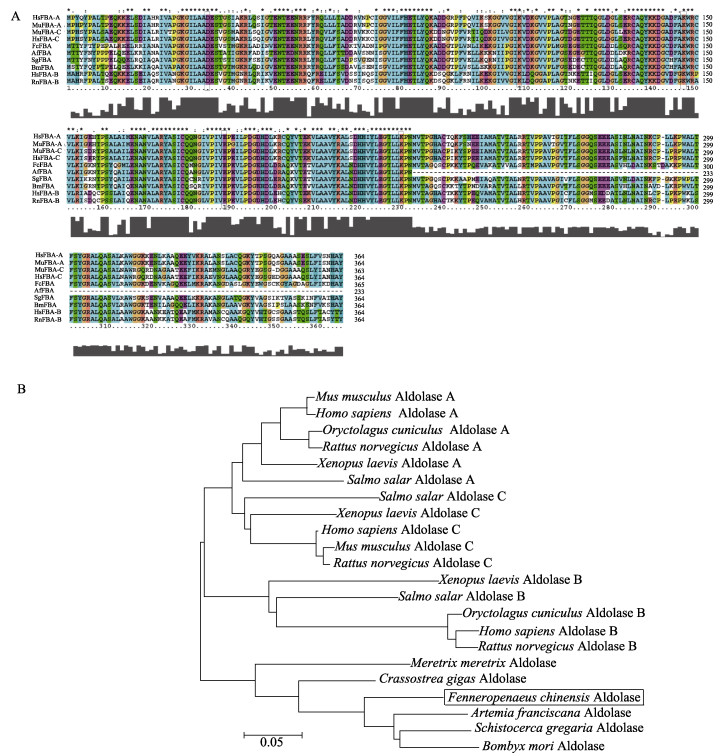
氨基酸序列比对表明,FcFBA的蛋白序列与节肢动物的相似度最高,如与卤虫(Artemia franciscana)、家蚕(Bombyx mori)、沙漠蝗(Schistocerca gregaria)的相似度分别是86%、79%和78%,而与小鼠(Mus musculus)醛缩酶的A型、C型、B型的相似度分别是68%、66%和62%。系统进化分析表明,包括中国明对虾在内的节肢动物的醛缩酶自成一类,然后再和高等动物的聚为一类(图 2)。
|
图 2 FcFBA的氨基酸序列比对(A)及系统进化分析(B) Figure 2 The analysis of amino acid sequence (A) and phylogenetic tree analysis (B) of FcFBA from various species A:氨基酸序列比对,序列如下:人的A型醛缩酶(HsFBA-A, AAH16800),小鼠的A型(MuFBA-A, AAH89495),人的C型(HsFBA-C, AAC09348),小鼠C型(MuFBA-C, NP_033787),人的B型(HsFBA-B, BAA00125),大鼠B型(RnFBA-B, CAA26156),中国明对虾(FcFBA, KJ686589),家蚕(BmFBA, NP_001091766),沙漠蝗(SgFBA, AEV89754),卤虫(AfFBA, ACH81781) A: The amino acid sequence: Homo sapiens aldolase A (HsFBA-A, AAH16800), M. musculus aldolase A (MuFBA-A, AAH89495), H. sapiens aldolase C (HsFBA-C, AAC09348), M. musculus aldolase C (MuFBA-C, NP_033787), H. sapiens aldolase B (HsFBA-B, BAA00125), Rattus norvegicus aldolase B (RnFBA-B, CAA26156), F. chinensis aldolase (FcFBA, KJ686589), B. mori aldolase (BmFBA, NP_001091766), S. gregaria aldolase (SgFBA, AEV89754), and A. franciscana aldolase (AfFBA, ACH81781) |
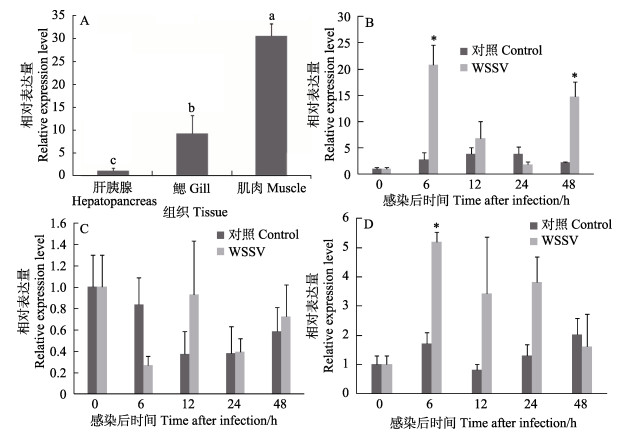
FcFBA基因在中国明对虾各组织中的相对表达量分析结果显示,该基因在鳃、肝胰腺、肌肉中均有表达。其中,肌肉中的表达量最高,鳃中次之,肝胰腺中的表达量最少(图 3A)。
|
图 3 FcFBA mRNA的组织表达 Figure 3 The expression profiles of FcFBA mRNA in hepatopancreas, gill and muscle A:正常组织;B:感染后肝胰腺;C:感染后鳃;D:感染后肌肉 A: Control shrimp, B: Hepatopancreas post WSSV challenge; C: Gill post WSSV challenge; D: Muscle post WSSV challenge |
FcFBA基因在感染WSSV的对虾不同组织中的相对表达量变化结果显示(图 3),与对照组相比,FcFBA基因在肝胰腺中,表现为先上调后下降再上调的趋势,在6 h和48 h显著上调,分别是对照组的20.7和14.7倍(P < 0.05);鳃中,表现为先下调后上升的趋势,在6 h达到最低,为对照组的0.31倍,在12 h达到最高,为对照组的2.15倍,但差异均不显著;肌肉中,表现为先上调后再下降的趋势,6 h达到最高,为对照组的2.88倍(P < 0.05),12 h和24 h均高于对照组,但无显著性差异(P > 0.05)。
2.4 FcFBA基因在RNAi后的表达变化对虾肝胰腺FcFBA基因在干扰后的相对表达量结果显示,与对照组相比,干扰组FcFBA基因的表达量表现出先上调再下调的趋势,感染后6 h干扰组FcFBA表达为对照组1.8倍(P > 0.05),24 h干扰组的表达量达到最低,为对照组的0.28倍(P < 0.05) (图 4A)。

|
图 4 dsRNA注射后的死亡率及干扰后FcFBA基因的表达 Figure 4 The mortality of shrimp after dsRNA injection and the FcFBA expression after RNAi A:干扰后的基因表达变化;B:累计死亡率*表示实验组和对照组之间差异显著(P < 0.05) A: Expression profile after RNAi; B: Mortality of shrimp * indicated the difference between experiment and control group was statistically significant (P < 0.05) |
dsRNA干扰组和PBS对照组在干扰以后24 h再进行WSSV病毒感染实验,共持续9 d。感染后的死亡结果显示,各组累计死亡率均为100% (图 4B)。对照组中,在感染后48 h开始出现死亡个体。干扰组中,感染后24 h出现1尾死亡对虾,但没有表现出白斑症状,推测原因是注射后由于对虾自身的抵抗力弱而导致的死亡。从感染后42 h开始,2组出现的死亡个体都具有明显的白斑症状。
3 讨论本研究是醛缩酶在对虾中的首次系统研究,克隆的FcFBA基因ORF全长为1098 bp,编码365个氨基酸。序列分析表明,其含有醛缩酶的保守功能位点,包含Ⅰ型醛缩酶的功能位点Lys231。氨基酸的进化分析表明,该醛缩酶基因与其他节肢动物的醛缩酶基因明显聚为一类。ORF序列分析、蛋白保守位点分析及蛋白的系统进化分析均表明,FcFBA基因与其他物种的醛缩酶具有较高的相似性,因此,确定本研究克隆的FcFBA基因为中国明对虾的醛缩酶基因。
自然界中存在2种不同机制的醛缩酶:Ⅰ型和Ⅱ型,前者存在于高等真核生物尤其是动物和高等植物中,它们能在底物的羰基和自身活性部位的赖氨酸之间形成一个西弗碱中间物(Schnarrenberger, 1990);后者则存在于真核绿藻、真菌以及原核细菌中,催化裂合反应的时候需要一个二价的过渡态金属离子如Zn2+(Rutter, 1964)。脊椎动物中,Ⅰ型醛缩酶分为3种组织特异性的同工酶:A型、B型和C型。A型在肌肉中表达,B型在肝脏、肾脏、胃及肠道中表达,而C型则在脑、心脏及卵巢中表达(余南等, 2005)。这些同工酶有不同的催化功能:3种同工酶都参与糖酵解,B型相对于A型和C型来说,又参与糖异生。在本研究中,FcFBA基因在肌肉中的表达量最高,暗示中国明对虾的醛缩酶是A型醛缩酶。
本研究还分析了对虾在感染WSSV后该基因的表达趋势。结果显示,肝胰腺和肌肉中该基因出现了明显的上调表达,其中,肝胰腺对WSSV感染最敏感,说明WSSV对该基因是一个明显的刺激,这和已有的研究报道结果一致。有学者在中国明对虾感染WSSV后获得的差异表达基因中,发现了醛缩酶基因的表达量在感染后的6 h提高了100多倍(Wang et al, 2006),凡纳滨对虾(Litopenaeus vannamei)在感染WSSV后,醛缩酶基因的表达在6 h和36 h显著上调,在感染后12 h则下调(Wang et al, 2007)。以上结果表明,该基因与对虾抗WSSV有关,在对虾抗病中起作用,为对虾抗病相关基因。
已有研究显示,利用dsRNA干扰对任何一个基因产生的敲降作用为正常基因表达水平的10%~40% (Collins et al, 2005)。据报道,目的基因dsRNA的注射量在一定范围内与干扰效率呈正相关,一旦超出这一范围,干扰效果将不再增加,可能原因是目标基因mRNA结合的siRNA已达到饱和。Robalino等(2004)将体外转录获得的WSSV的外壳蛋白VP19的编码基因的dsRNA导入凡纳滨对虾体内,发现不同剂量的dsRNA抑制病毒的效率有很大的差别。注射10 μg特异dsRNA时,对虾的保护率是81%;注射1 μg时,保护率是72%,而注射0.1 μg保护率仅为29%。此外,不同物种dsRNA的有效注射量是不同的,如蜜蜂中dsRNA的注射量为每克软体重50 μg,对虾的注射量为15 μg (Robalino et al, 2004);太平洋牡砺(Crassostrea gigas)以每克软体重注射20 μg dsRNA时,产生的干扰效率为80%,而当每克软体重注射量为4~5 μg时,干扰效率为14%(Fabioux et al, 2009)。在对虾基因干扰的研究中,很多学者采用1 μg/g的剂量进行注射,取得了较好的结果。本研究通过前期对不同干扰计量的摸索发现,注射dsRNA的浓度为100 ng/μl时(按照体重估算是1 μg/g),干扰效果最好(未发表数据)。研究人员发现,长dsRNA引起靶基因的沉默效率要高于短dsRNA,一般情况下,体外合成dsRNA的长度不小于300 bp (Robalino et al, 2004),无脊椎动物对长dsRNA的吸收率高于短dsRNA,因此,本研究设计的dsRNA为600 bp左右,符合基因干扰实验对长度的要求。与PBS对照组相比,醛缩酶基因在干扰以后表达量随时间下降,尤其是在干扰后24 h,dsRNA注射组的基因表达量显著低于对照组,说明干扰成功。同时,通过干扰后对虾的死亡率比较,发现干扰对虾在WSSV感染后,明显提高了死亡速度。
本研究首次在中国明对虾中获得了醛缩酶基因的全长cDNA序列,分析了WSSV感染后,该基因在不同组织中的表达特征,并进一步通过基因干扰结果分析,推断该基因可能在对虾抗病中起作用,但其在病毒感染后的作用机制仍需要进一步研究。
| Cao JW, Kong J, Luo K, et al. Immune priming response induced by heat-inactivated WSSV on Fenneropenaeus chinensis at different temperature. Progerss in Fishery Sciences, 2017, 38(2): 128-136 DOI:10.11758/yykxjz.20151223001 [曹家旺, 孔杰, 罗坤, 等. 热灭活WSSV诱导的中国明对虾(Fenneropenaeus chinensis)在不同温度下的免疫致敏反应. 渔业科学进展, 2017, 38(2): 128-136] | |
| Cao TT, Bai JJ, Yu LY, et al. Polymorohisms of SNPs in ALDO B gene and association analysis with growth traits in grass carp (Ctenopharyngodon idellus). Journal of Fisheries of China, 2012, 36(4): 481-488 [曹婷婷, 白俊杰, 于凌云, 等. 草鱼醛缩酶B基因部分序列的SNP多态性及其与生长性状的关联分析. 水产学报, 2012, 36(4): 481-488] | |
| Cieśla M, Mierzejewska J, Adamczyk M, et al. Fructose bisphosphate aldolase is involved in the control of RNA polymerase Ⅲ-directed transcription. Biochimica et Biophysica Acta,Biochimica et Biophysica Acta, 2014, 1843(6): 1103-1110 DOI:10.1016/j.bbamcr.2014.02.007 | |
| Collins RE, Cheng XD. Structural domains in RNAi. FEBS Letters, 2005, 579(26): 5841-5849 DOI:10.1016/j.febslet.2005.07.072 | |
| Dawson NJ, Biggar KK, Storey KB. Characterization of fructose-1, 6-bisphosphate aldolase during anoxia in the tolerant turtle, Trachemys scripta elegans: An assessment of enzyme activity, expression and structure. PLoS One, 2013, 8(7): e68830 DOI:10.1371/journal.pone.0068830 | |
| De-Simone SG, de Salles CM, Batista e Silva CM, et al. Purification and amino acid sequence of fructose-1, 6-bisphosphate aldolase from the electric organ of Electrophorus electricus (L.). Zeitschrift fur Naturforschung C, 2006, 61(11-12): 884-888 | |
| Fabioux C, Corporeau C, Quillien V, et al. In vivo RNA interference in oyster-vasa silencing inhibits germ cell development. FEBS Journal, 2009, 276(9): 2566-2573 DOI:10.1111/ejb.2009.276.issue-9 | |
| Giegé P, Heazlewood JL, Roessner-Tunali U, et al. Enzymes of glycolysis are functionally associated with the mitochondrion in Arabidopsis cells. Plant Cell, 2003, 15(9): 2140-2151 DOI:10.1105/tpc.012500 | |
| Haake V, Geiger M, Walch-Liu P, et al. Changes in aldolase activity in wild-type potato plants are important for acclimation to growth irradiance and carbon dioxide concentration, because plastid aldolase exerts control over the ambient rate of photosynthesis across a range of growth conditions. Plant Journal, 1999, 17(5): 479-489 DOI:10.1046/j.1365-313X.1999.00391.x | |
| He YD, Zhang XB. Comprehensive characterization of viral miRNAs involved in white spot syndrome virus (WSSV) infection. RNA Biology, 2012, 9(7): 1019-1029 DOI:10.4161/rna.20741 | |
| Lew CR, Tolan DR. Aldolase sequesters WASP and affects WASP/Arp2/3-stimulated actin dynamics. Journal of Cellular Biochemistry, 2013, 114(8): 1928-1939 DOI:10.1002/jcb.v114.8 | |
| Lew CR, Tolan DR. Targeting of several glycolytic enzymes using RNA interference reveals aldolase affects cancer cell proliferation through a non-glycolytic mechanism. Journal of Biological Chemistry, 2012, 287(51): 42554-42563 DOI:10.1074/jbc.M112.405969 | |
| Li XY, Bai JJ, Yu LY, et al. Association analysis between mutation of aldolase A 3'-UTR and growth traits in Ctenopharyngodon idella. Freshwater Fisheries, 20012, 42(5): 13-16 [李玺洋, 白俊杰, 于凌云, 等. 草鱼醛缩酶A3 -UTR突变与生长性状相关研究. 淡水渔业, 20012, 42(5): 13-16] | |
| Lightner DV. Epizootiology, distribution and the impact on international trade of two penaeid shrimp viruses in the Americas. Revue Scientifique et Technique, 1996, 15(2): 579-601 DOI:10.20506/rst.issue.15.2.2491 | |
| Lorentzen E, Siebers B, Hensel R, et al. Structure, function and evolution of the Archaeal class Ⅰ fructose-1, 6-bisphosphate aldolase. Biochemical Society Transactions, 2004, 32(2): 259-263 DOI:10.1042/bst0320259 | |
| Robalino J, Browdy CL, Prior S, et al. Induction of antiviral immunity by double-stranded RNA in a marine invertebrate. Journal of Virology, 2004, 78(19): 10442-10448 DOI:10.1128/JVI.78.19.10442-10448.2004 | |
| Rodaki A, Young T, Brown AJP. Effects of depleting the essential central metabolic enzyme fructose-1, 6-bisphosphate aldolase on the growth and viability of Candida albicans: Implications for antifungal drug target discovery. Eukaryotic Cell, 2006, 5(8): 1371-1377 DOI:10.1128/EC.00115-06 | |
| Rutter WJ. Evolution of aldolase. Federation Proceedings, 1964, 23: 1248-1257 | |
| Schnarrenberger C. Characterization and compartmentation, in green leaves, of hexokinases with different specificities for glucose, fructose, and mannose and for nucleoside triphosphates. Planta, 1990, 181(2): 249-255 DOI:10.1007/BF02411547 | |
| Van den Berghe G. Inborn errors of fructose metabolism. Annual Review of Nutrition, 1994, 14: 41-58 DOI:10.1146/annurev.nu.14.070194.000353 | |
| Wang B, Li FH, Dong B, et al. Discovery of the genes in response to white spot syndrome virus (WSSV) infection in Fenneropenaeus chinensis through cDNA microarray. Marine Biotechnology, 2006, 8(5): 491-500 DOI:10.1007/s10126-005-6136-4 | |
| Wang C, Wang HX, Li Y, et al. Identification of a fructose-1, 6-bisphosphate aldolase gene and association of the single nucleotide polymorphisms with growth traits in the clam Meretrix meretrix. Molecular Biology Reports, 2012, 39(4): 5017-5024 DOI:10.1007/s11033-011-1298-9 | |
| Wang HC, Wang HC, Leu JH, et al. Protein expression profiling of the shrimp cellular response to white spot syndrome virus infection. Developmental & Comparative Immunology, 2007, 31(7): 672-686 | |
| Yang F, He J, Lin XH, et al. Complete genome sequence of the shrimp white spot bacilliform virus. Journal of Virology, 2001, 75(23): 11811-11820 DOI:10.1128/JVI.75.23.11811-11820.2001 | |
| Yang JY, Chang CI, Liu KF, et al. Viral resistance and immune responses of the shrimp Litopenaeus vannamei vaccinated by two WSSV structural proteins. Immunology Letters, 2012, 148(1): 41-48 | |
| Yu N, He A, Li ZY, et al. Characterization and analysis of Toxoplasma gondii aldolase gene and intron. Chinese Journal of Zoonoses, 2005, 21(7): 580-583 [余南, 何蔼, 李卓雅, 等. 刚地弓形虫醛缩酶基因及其内含子的分析. 中国人兽共患病杂志, 2005, 21(7): 580-583] |



