2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
白化是由于黑色素代谢障碍导致眼睛、皮肤、毛发黑色素量减少或缺乏而引起的一种体色异常现象。自然界中,哺乳类(柯永亮, 2006)、鱼类(李仰真等, 2014)、鸟类(梁伟等, 2000)、爬行类(张秋金等, 2009)等都存在白化个体。白化个体通常出现一系列病理学上的改变,且因自身缺乏保护色而易被捕食,因此,白化个体的生存能力大大低于正常个体。白化具有广泛的遗传异质性,是最早被研究的遗传性疾病之一(Farabee, 1903)。哺乳动物如人和小鼠中白化研究最多,截止到2011年,在小鼠中已发现的与体色、毛发相关的基因突变多达378个(http://www.espcr.org/micemut/)。
自然界中生物体有多种多样不同的体色,这是由于自身色素细胞能产生不同的色素。虽然哺乳动物中白化突变位点众多,但色素细胞只有一种,即黑色素细胞。鱼类中已发现的色素细胞共有6种:黑色素细胞、红色素细胞、黄色素细胞、虹彩细胞、白色素细胞和蓝色素细胞,暗示其可能的白化机制较哺乳动物更为复杂。白化在鱼类中的研究主要集中于模式鱼类斑马鱼(Danio rerio)、青鳉(Oryzias latipes)和穴居鱼类(Koga et al, 1997),而养殖鱼类中的研究较少。
牙鲆(Paralichthys olivaceus)是一种冷温性底栖肉食鱼类,最适温度为17℃~20℃,具有很高的营养和经济价值,深受消费者的喜爱,市场十分广阔,为我国重要的海水经济鱼种。牙鲆育苗过程中经常出现苗种高比例体色异常现象,即有眼侧皮肤白化和无眼侧黑化现象,严重影响了商品鱼价值(朱学武等, 2017)。目前,认为牙鲆白化主要与营养(Seikai et al, 1987; Yamamoto et al, 1992)、环境(Takahashi, 1994; Seikai, 2010)和生理因素(Burton et al, 1995; Seikai, 1992; Yoo et al, 2000)等相关,而不管是营养还是生理方面,归根到底都是由于分子水平的变化引起的。
MicroRNA(miRNA)多为21~25 nt高度保守的单链非编码小RNA,能够通过与靶mRNA的3′端非翻译区(UTR)互作而沉默靶mRNA,在转录后调控过程中发挥重要作用。已发现有多个miRNA参与调控哺乳动物黑色素细胞发育及相关疾病(Kim et al, 2014; Zhu et al, 2010; Dong et al, 2012)。牙鲆白化现象中是否涉及miRNA的表达及调控也值得深入研究。我们在前期研究中已经利用高通量测序技术获得了一批在牙鲆正常和白化皮肤中差异表达的基因和miRNA。本研究在此基础上,选取tyrosinase related protein 1 (tyrp1)和mmu-miR-143-5p_R+2(mmu-143)开展了不同组织表达模式研究、靶基因预测及验证分析等,将为牙鲆白化发生分子机制的阐明提供重要的基础资料。
1 材料与方法 1.1 实验材料本实验用鱼为发育状况良好且无伤病的有眼侧皮肤全为黑色的正常牙鲆和发育状况良好且无伤病的有眼侧皮肤白化牙鲆,由山东省海阳市黄海水产有限公司提供。分别取5月龄正常和白化牙鲆的有眼侧皮肤、无眼侧皮肤、有眼侧肌肉、无眼侧肌肉、性腺、鳃、脑、肠、眼、心脏、肾脏、脾脏、肝脏13个组织样品,立即放入液氮中保存,以备后续提取RNA使用。293T细胞培养于37℃、5% CO2条件下的细胞培养箱。
1.2 牙鲆各组织Total RNA的提取和cDNA第1链的合成采用TIANGEN miRcute miRNA提取分离试剂盒提取牙鲆各组织的Total RNA,然后用1%的琼脂糖凝胶电泳检测所提RNA的质量,用紫外分光光度计检测RNA的浓度。RNA样品于–80℃保存。
各取1 μg的Total RNA用FastQuant cDNA第一链合成试剂盒(去基因组)进行反转录合成cDNA第1链,–20℃保存,用于克隆基因中间片段。用SMARTer® RACE 5'/3'Kit (Clontech)合成5'和3' Ready,用于5'和3 RACE的克隆。
1.3 tyrp1基因的克隆利用转录组测序结果鉴定出tyrp1的2个转录本:tyrp1 GS_012029(tyrp1-29)和tyrp1 GS_009038 (tyrp1-38),此处以tyrp1-29为例进行基因克隆介绍。以正常牙鲆有眼侧皮肤cDNA为模板,以tyrp1-29-F1和tyrp1-29-R1(表 1)为引物进行中间片段的PCR扩增,反应体积为50 μl,反应程序:94℃,5 min;94℃ 30 s,54℃ 30 s,72℃ 50 s (35个循环);72℃,10 min。将PCR产物回收后与pMD18-T进行连接转化反应,挑取3~5个阳性克隆送到瑞博兴科公司测序。利用Vector NTI Advance 11软件进行测序结果的对比分析。
|
|
表 1 本研究所使用的引物 Table 1 Primers used in this study |
利用验证的中间片段设计引物tyrp1-29-5'GSP、tyrp1-29-5'NGSP、tyrp1-29-3'GSP和tyrp1-29-3'NGSP (表 1),以合成的Ready为模板进行tyrp1-29 5'和3'RACE的巢式PCR扩增。一轮反应结束后,将一轮PCR产物稀释50倍作为二轮PCR的模板进行二轮PCR,将PCR产物回收后与pMD18-T进行连接转化反应,挑取3~5个阳性克隆送到瑞博兴科公司测序。利用Vector NTI Advance 11软件进行测序结果的对比分析。
1.4 tyrp1基因序列拼接及蛋白分析在成功得到tyrp1-29和tyrp1-38基因的中间片段、5'端及3'端后,用Vector NTI Advance 11进行序列拼接,获得完整的tyrp1-29和tyrp1-38序列,然后进行开放阅读框分析和蛋白质翻译。从NCBI中下载其他不同物种的Tyrp1的氨基酸序列,与得到的牙鲆Tyrp1氨基酸序列进行同源性比对,用MEGA 5.0软件中NJ法(Neighbor-joining Method)构建系统进化树,设置1000次bootstraps进行系统进化评估。
1.5 tyrp1基因实时荧光定量PCR用SYBR Premix Ex Taq试剂盒(TaKaRa)进行实时荧光定量PCR,用Primer 6.0设计定量引物tyrp1a-qF和tyrp1a-qR(表 1)进行tyrp1a基因的荧光定量检测。以β-actin为内参,以正常和白化牙鲆的13个组织的cDNA为模板,各组织均选取3个平行的实验个体,每个实验个体3次重复。ABI 7500 Realtime PCR仪(Applied Biosystems, 美国)扩增标准程序:95℃ 30 s;95℃ 5 s,60℃ 34 s (40循环);95℃ 15 s;60℃ 1 min;95℃ 15 s。
1.6 tyrp1a与miRNA的互作关系预测利用RNAhybrid (https://bibiserv.cebitec.uni-Bielefeld.de/rnahybrid?id=rnahybrid_view_submission)将已克隆得到的tyrp1a基因3xUTR序列与miRNA进行靶基因预测,预测到tyrp1a与mmu-143可能的靶向关系。
1.7 miRNA的提取、反转录及荧光定量由于TIANGEN miRcute miRNA提取分离试剂盒提取的牙鲆各组织的Total RNA中包含miRNA等small RNA,因此,可直接用TIANGEN miRcute miRNA cDNA第一链合成试剂盒进行反转录。
得到miRNA的cDNA后,用TM Utility 1.5-iTech设计mmu-143上游定量引物mmu-143-F(下游由定量试剂盒中提供)进行荧光定量检测。以5S rRNA(表 1)为内参,以正常和白化牙鲆的13个组织的miRNA cDNA为模板,各组织均选取3个平行的实验个体,每个实验个体重复3次。用miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green, TIANGEN)进行定量实验,反应体系:10 μl 2×miRcute Plus miRNA Premix(with SYBR & ROX),mmu-143-F(10 μmol/L)和Reverse Primer (10 μmol/L)各0.4 μl,2 μl 50×ROX Reference Dye,1.5 μl miRNA第一链cDNA,5.7 μl ddH2O,总体积20 μl。反应程序:95℃ 15 min;94℃ 20 s,60℃ 34 s(40循环);熔解曲线分析。
1.8 双荧光素酶载体pmiR-RB-REPORTTM的构建及转染实验为了证明tyrp1a 3'UTR与miRNA mmu-143存在靶对应关系,采用双荧光素酶实验在293T细胞中进行验证,所用的双荧光素酶报告载体pmiR-RB-REPORTTM及mmu-143 mimic和mimic Ncontrol均为广州市锐博生物科技有限公司设计提供。
用Primer 6.0设计分别带有Xho I和Not I酶切位点的上下游引物tyrp1a-3' UTR_F和tyrp1a-3' UTR_ R(表 1),以正常牙鲆皮肤的cDNA为模板,PCR扩增tyrp1a 3' UTR区片段并插入到pmiR-RB-REPORTTM载体的hRluc下游,构建成载有靶片段的完整载体,与mmu-143 mimic共转染至293T细胞中(表 2,A组)。另外,将pmiR-RB-REPORTTM上的靶片段用TaKaRa MutanBEST Kit进行突变后与mmu-143共同转染至293T细胞中,作为一组对照实验(表 2,B组)。正常和突变的载体分别与miRNA的阴性对照NC共转染作为2组对照(表 2,C组和D组)。
|
|
表 2 细胞转染体系成分 Table 2 The composition of cell transfection |
取对数生长期的293T细胞以每孔大约5×104细胞接种于24孔板中,于37℃、5%的CO2的条件下培养过夜后,采用lipofectamine 2000按照表 2的体系进行细胞转染,37℃培养48 h后,用碧云天公司提供的双萤光素酶报告基因检测试剂盒来检测并分析miRNA与靶片段是否有互作关系。
1.10 数据计算方法定量PCR实验中基因或miRNA的相对表达水平采用2(−ΔΔCt)方法计算,其数据为平均数±标准误(Mean± SE)。用SPSS 17.0分析软件采用单因素方差分析(One-way ANOVA),并进行Duncan多重比较,当P < 0.05时认为差异显著,当P < 0.01认为差异极显著。
2 结果 2.1 牙鲆tyrp1基因全长及其蛋白分析通过RACE方法成功克隆了tyrp1-29和tyrp1-28,tyrp1-29基因cDNA全长为2145 bp,开放阅读框(ORF)为1566 bp,5' UTR区为127 bp,3 UTR区为452 bp (图 1)。用Vector NTI Advance 11软件查找ORF区并翻译成蛋白质,基因编码区编码521个氨基酸,预测蛋白质分子量为58.34 kDa。分析蛋白质结构发现,第1~17个氨基酸为信号肽,第84~112个氨基酸为EGF区,第172~407个氨基酸为PFAM结构域,469~491个氨基酸为跨膜区。

|
图 1 牙鲆tyrp1-29基因序列及其开放阅读框(ORF)预测的氨基酸序列 Figure 1 ORF sequence and deduced amino acid sequence of tyrp1-29 in Japanese flounder 小方框内为翻译起始位点和终止位点,下同 The start locus (ATG) and the terminal locus (TGA) are boxed in the short frame, the same as below |
tyrp1-38基因cDNA全长1792 bp,开放阅读框(ORF)为1602 bp,5' UTR区为49 bp,3' UTR区为141 bp(图 2)。用Vector NTI Advance 11软件查找ORF区并翻译成蛋白质,基因编码区编码533个氨基酸,预测蛋白质分子量为61.10 kDa。分析蛋白质结构发现,第27~70个氨基酸为NH区,第137~190个氨基酸为GLA区,第475~497个氨基酸为跨膜区。

|
图 2 牙鲆tyrp1-38基因序列及其开放阅读框(ORF)预测的氨基酸序列 Figure 2 ORF sequence and deduced amino acid sequence of tyrp1-38 in Japanese flounder |
将在NCBI和Ensemble查找到的11种Tyrp1蛋白序列:刺鱼(Gasterosteus aculeatus) Tyrp1a (ENSG ACG00000019503)、青鳉Tyrp1a (ENSORL G000 00 00 4326)、河豚(Fugu rubripes) Tyrp1a (ENSTR UG 00000012615)、斑马鱼Tyrp1a (ENSDARG000000 29 204)、刺鱼Tyrp1b (ENSGACG00000015912)、青鳉Tyrp1b (ENSORLG00000004723)、斑马鱼Tyrp1b (NP_001002749.1)、热带爪蟾(Xenopus tropicalis) Tyrp1 (NP_001016476.1)、鸡(Gallus gallus) Tyrp1 (NP_990376.2)、小鼠(Mus musculus)Tyrp1 (NP_ 112479.1)及人(Homo sapiens) Tyrp1 (NP_000541.1)与牙鲆的Tyrp1-29和Tyrp1-38一起利用MEGA 5.0软件构建蛋白序列系统进化树(图 3),序列号为NP开头的来自于NCBI,以ENS开头的来自于在线软件Ensembl。结果显示,热带爪蟾、鸡、小鼠及人的tyrp1只有一个转录本,牙鲆tyrp1-29基因与硬骨鱼类中刺鱼、青鳉、河豚和斑马鱼的tyrp1a亲缘关系较近,而牙鲆tyrp1-38基因与刺鱼、青鳉和斑马鱼的tyrp1b亲缘关系较近。由此将牙鲆tyrp1-29和tyrp1-38分别鉴定为tyrp1a和tyrp1b基因,NCBI GenBank登录号分别为MF095844和MF095845。

|
图 3 以NJ法建立的系统进化树 Figure 3 The phylogenetic tree based on NJ method 括号内为蛋白序列在GenBank/Ensembl的登录号(除P. olivaceus外) GenBank/Ensembl numbers of nucleotide sequences are shown in the brackets (except P. olivaceus) |
由图 4可以看出,tyrp1a的表达量在正常牙鲆的眼中表达量最高,皮肤次之,第三是性腺,在肝脏、脑和脾中也均有表达,在腹部皮肤、背部肌肉、腹部肌肉、鳃、肠、肾和心脏中几乎不表达;tyrp1a的表达量在白化牙鲆的眼中表达量最高,性腺次之,第三是腹部肌肉,在皮肤、鳃和脑中也均有表达,在腹部皮肤、背部肌肉、肝脏、肠、脾、肾和心脏中几乎不表达。
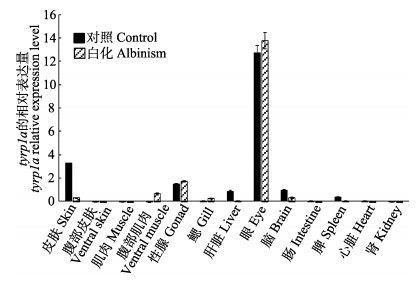
|
图 4 tyrp1a基因在正常和白化牙鲆不同组织中的表达 Figure 4 Expression of tyrp1a in various tissues of control and albinism of P. olivaceus |
用Bielefeld BioInformatics Service RNAhybrid软件进行靶基因预测后,得出tyrp1a 3'UTR区的第119~ 126 bp处与mmu-143可能存在靶对应关系(图 5)。

|
图 5 mmu-143的靶基因预测 Figure 5 Target prediction of mmu-143 |
由图 6可以看出,miRNA mmu-143在正常牙鲆的性腺中表达量最高,鳃次之,第三是肠,除了在肝脏中几乎不表达外,其他各组均有表达;mmu-143在白化牙鲆的腹部肌肉中表达量最高,肠次之,第三是性腺,在皮肤、腹部皮肤、鳃、脑、背部肌肉、肝脏、肠、脾、肾和心脏中均有表达。将mmu-143的定量结果与tyrp1a的定量结果比较发现,tyrp1a在正常皮肤中的表达量明显高于白化皮肤,而mmu-143=在白化皮肤中的表达量约为正常皮肤中的2倍,这一结果与之前的高通量测序结果一致。
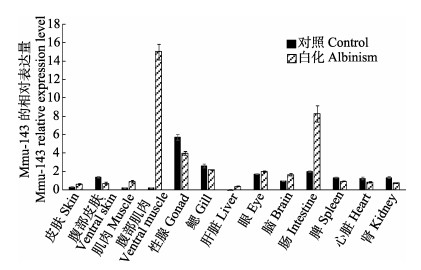
|
图 6 mmu-143在正常和白化牙鲆不同组织中的表达 Figure 6 Expressions of mmu-143 in various tissues of control and albinism of P. olivaceus |
MiRNA mmu-143与其预测靶基因tyrp1a的双荧光素酶实验结果如图 7所示。一般情况下,mmu-143 mimics跟阴性对照相比,报告荧光值下调30%及以上,则认为mmu-143 mimics对tyrp1a基因有调控作用。分析该实验双荧光素酶报告基因结果显示,mmu-143 mimic将tyrp1a-WT的报告荧光下调38.2%,对其预测靶位点进行突变后,tyrp1a-MU的报告荧光下调15.2%。该结果表明,tyrp1a很可能是mmu-143的靶基因,mmu-143通过调控tyrp1a基因的表达来影响牙鲆的白化情况。

|
图 7 双荧光素酶实验结果 Figure 7 The results of dual luciferase experiment 不同的字母代表组间差异显著(P < 0.05) Different letters represented significant difference between groups (P < 0.05) |
黑色素主要起到吸收光照和色素沉积的作用,而牙鲆皮肤白化主要是因为缺乏黑色素。黑色素是由酪氨酸酶及相关酶发挥作用合成的,在脊椎动物中,酪氨酸酶基因家族主要由三位成员组成:tyrosinase (tyr)、tyrp1和tyrp2(Nowak et al, 1997)。Tyrp1被称为酪氨酸酶相关蛋白-1,定位于小鼠brown位点,该基因在真黑素形成中发挥的关键作用已引起研究者们的高度重视(Ito, 2003; Jiménez-Cervantes et al, 1994)。研究发现,Tyrp1是一种由内质网合成的跨膜蛋白,通过高尔基体转运到黑色素体内(Ghanem et al, 2011),其编码蛋白与酪氨酸酶(TYR)编码蛋白同源性高达40%(Jackson et al, 1992),与酪氨酸相关蛋白2 (Tyrp2)共同构成酪氨酸家族来调控体内黑色素合成,并且对黑色素细胞的发育、生存和功能起重要调节作用(Jiménez-Cervantes et al, 1994; Del et al, 1993; Hearing, 1999)。有实验证明,tyrp1突变或缺失会导致狗(Schmutz et al, 2002)、猫(Schmidt-Küntzel et al, 2005)、牛(Berryere et al, 2003)、羊(Gratten et al, 2007)和日本鹌鹑(Nadeau et al, 2007)的毛色变成灰色。已有报道显示,硬骨鱼类中大多存在2种tyrp1的同源基因,即tyrp1a和tyrp1b(Braasch et al, 2007、2009)。本研究在牙鲆转录组数据中也发现了tyrp1的2个转录本,分析进一步证实这2个转录本tyrp1-29和tyrp1-38分别为tyrp1a和tyrp1b基因。
Tyrp1a基因在正常和白化牙鲆的有眼侧皮肤、无眼侧皮肤、有眼侧肌肉、无眼侧肌肉、性腺、鳃、脑、肠、眼、心脏、肾脏、脾脏、肝脏这13个组织中的表达情况差异明显。正常和白化牙鲆各组织中tyrp1a表达量最高的是眼组织,且远远高于其他各组织的表达量,这一结果与彩鲤中的表达情况一致(李康乐, 2014),猜测tyrp1a可能参与牙鲆变态过程中眼睛的偏转及骨骼的重塑。定量结果显示,正常牙鲆皮肤中tyrp1a基因的表达量应远高于白化皮肤中的表达量,这与tyrp1a基因能促进黑色素细胞中黑素体的形成相关(崔嘉等, 2009),且与高通量测序结果一致。其次,tyrp1a基因在正常和白化牙鲆的性腺和脑中均有表达,在腹部皮肤、背部肌肉、肠、肾和心脏中几乎不表达。
在哺乳动物和鸟类中已有实验证明,miRNA能通过调控靶基因来控制黑色素的形成,如miR508-3p (Zhang et al, 2017)、miR-21a-5p (Wang et al, 2016)、lpa-miR-nov-66 (Yang et al, 2015)、miR-204 (Apopo et al, 2015)等。MicroRNA-203能通过与驱动蛋白5b相互作用,从而调控黑色素细胞中黑色素转运和酪氨酸酶表达(Noguchi et al, 2014; Zhang et al, 2014)。因此,通过对牙鲆miRNA的表达分析,可以帮助我们去探讨miRNA在基因表达调控中的功能,更好地解释miRNA在牙鲆白化中的分子调控机制。
通过tyrp1a基因与mmu-143的定量结果可以看出,二者在正常和白化牙鲆皮肤、肌肉、性腺、肝、脑和肠中的表达呈一定的反比例关系,例如tyrp1a在正常牙鲆皮肤中的表达量远高于白化皮肤,而mmu-143在白化牙鲆皮肤中的表达量约为正常皮肤中的2.1倍。RNAhybrid软件预测结果显示,可基本确定二者存在靶基因关系,双荧光素酶实验进一步证实了这种负调控关系,说明mmu-143是通过调控tyrp1a基因的表达来影响牙鲆白化发生的。
本研究成功鉴定出牙鲆存在2种tyrp1基因,tyrp1a和tyrp1b基因,定量结果显示,tyrp1a在正常牙鲆皮肤中的表达量显著高于白化皮肤中的表达量,与mmu-143在正常和白化皮肤中的表达量刚好相反,均与高通量测序结果一致。双荧光素酶实验结果证明tyrp1a与mmu-143存在靶基因互作关系。这一结果丰富了对牙鲆白化分子机制的认识。
| Apopo S, Liu H, Jing L, et al. Identification and profiling of microRNAs associated with white and black plumage pigmentation in the white and black feather bulbs of ducks by RNA sequencing. Animal Genetics, 2015, 46(6): 627-635 DOI:10.1111/age.2015.46.issue-6 | |
| Berryere TG, Schmutz SM, Schimpf RJ, et al. TYRP1 is associated with dun coat colour in Dexter cattle or how now brown cow?. Animal Genetics, 2003, 34(3): 169-175 DOI:10.1046/j.1365-2052.2003.00985.x | |
| Braasch I, Liedtke D, Volff JN, et al. Pigmentary function and evolution of tyrp1 gene duplicates in fish. Pigment Cell & Melanoma Research, 2009, 22(6): 839-850 | |
| Braasch I, Liedtke D, Volff JN, et al. Pigmentary function and evolution of tyrp1 gene duplicates in fish. Pigment Cell & Melanoma Research, 2009, 22(6): 839-850 | |
| Braasch I, Schartl M, Volff JN. Evolution of pigment synthesis pathways by gene and genome duplication in fish. BMC Evolutionary Biology, 2007, 7: 74 DOI:10.1186/1471-2148-7-74 | |
| Burton D, Vokey J, Mayo D. Adrenoceptors in cryptic patterning of a flatfish, Pleuronectes americanus. Proceedings of the Royal Society Biological Sciences, 1995, 261(1361): 181-186 DOI:10.1098/rspb.1995.0134 | |
| Cui J, Sun SR, Miao LX, et al. The research progress of TYRP1 regulate animal pigment formation. Chinese Veterinary Surgeon, 2009, 36(9): 94-96 [崔嘉, 孙守荣, 苗鲁旭, 等. TYRP1基因控制动物色素形成的研究进展. 中国畜牧兽医, 2009, 36(9): 94-96] | |
| Del MV, Ito S, Jackson I, et al. TRP-1 expression correlates with eumelanogenesis in human pigment cells in culture. FEBS Letters, 1993, 327(3): 307-310 DOI:10.1016/0014-5793(93)81010-W | |
| Dong C, Wang H, Xue L, et al. Coat color determination by miR-137 mediated down-regulation of microphthalmia-associated transcription factor in a mouse model. RNA, 2012, 18(9): 1679-1686 DOI:10.1261/rna.033977.112 | |
| Farabee WC. Notes on negro albinism. Science, 1903, 17(419): 75 | |
| Ghanem G, Fabrice J. Tyrosinase related protein 1 (TYRP1/gp75) in human cutaneous melanoma. Molecular Oncology, 2011, 5(2): 150-155 DOI:10.1016/j.molonc.2011.01.006 | |
| Gratten J, Slate J. Compelling evidence that a single nucleotide substitution in TYRP1 is responsible for coat-colour polymorphism in a free-living population of Soay sheep. Proceedings of the Royal Society B Biological Sciences, 2007, 274(1610): 619-626 DOI:10.1098/rspb.2006.3762 | |
| Hearing VJ. Biochemical control of melanogenesis and melanosomal organization. Journal of Investigative Dermatology Symposium Proceedings, 1999, 4(1): 24-28 DOI:10.1038/sj.jidsp.5640176 | |
| Ito S. The IFPCS presidential lecture: a chemist's view of melanogenesis. Pigment Cell Research, 2003, 16(3): 230-236 DOI:10.1034/j.1600-0749.2003.00037.x | |
| Jackson IJ, Chambers DM, Tsukamoto K, et al. A second tyrosinase-related protein, TRP-2, maps to and is mutated at the mouse slaty locus. Embo Journal, 1992, 11(2): 527-535 | |
| Jiménez-Cervantes C, Solano F, Kobayashi T, et al. A new enzymatic function in the melanogenic pathway. The 5, 6-dihydroxyindole-2-carboxylic acid oxidase activity of tyrosinase-related protein-1 (TRP1). Journal of Biological Chemistry, 1994, 269(27): 17993-18000 | |
| Ke YL. Albino disease in humans and animals. Science and Culture, 2006: 11 [柯永亮. 人与动物中的白化病. 科学与文化, 2006: 11] | |
| Kim KH, Bin BH, Kim J, et al. Novel inhibitory function of miR-125b in melanogenesis. Pigment Cell & Melanoma Research, 2014, 27(1): 140-144 | |
| Koga A, Hori H. Albinism due to transposable element insertion in fish. Pigment Cell Research, 1997, 10(6): 377-381 DOI:10.1111/pcr.1997.10.issue-6 | |
| Li KL. Molecular cloning and expression analysis of pigmentation-related genes, Sox10, Agouti, Tyrp1 and Dct, in Oujiang color commom carp, Cyprinus carpio var. Color. Master's Thesis of Shanghai Ocean University, 2014 [李康乐. 瓯江彩鲤体色相关基因Sox10、Agouti、Tyrp1、Dct的分子克隆与表达分析. 上海海洋大学硕士研究生学位论文, 2014] | |
| Li YZ, Chen SL, Xing HF, et al. Preliminary study on the albinism of half-smooth tougue sole (Cynoglossus semilaevis). Journal of Fisheries of China, 2014, 38(1): 76-83 [李仰真, 陈松林, 邢贺飞, 等. 半滑舌鳎白化现象的初步研究. 水产学报, 2014, 38(1): 76-83] | |
| Liang W, Guo DS, Song J, et al. An example of a white silver larynx was found in the Xiaolongmen forest of Beijing. Chinese Journal of Zoology, 2000, 35(1): 59 [梁伟, 郭冬生, 宋杰, 等. 北京小龙门林场发现一例白化银喉长尾山雀. 动物学杂志, 2000, 35(1): 59] | |
| Nadeau NJ, Mundy NI, Gourichon D, et al. Association of a single-nucleotide substitution in TYRP1 with roux in Japanese quail (Coturnix japonica). Animal Genetics, 2007, 38(6): 609-613 DOI:10.1111/j.1365-2052.2007.01667.x | |
| Noguchi S, Kumazaki M, Yasui Y, et al. MicroRNA-203 regulates melanosome transport and tyrosinase expression in melanoma cells by targeting kinesin superfamily protein 5b. Journal of Investigative Dermatology, 2014, 134(2): 461-469 DOI:10.1038/jid.2013.310 | |
| Nowak MA, Boerlijst MC, Cooke J, et al. Evolution of genetic redundancy. Nature, 1997, 388(6638): 167-171 DOI:10.1038/40618 | |
| Schmidt-Küntzel A, Eizirik E, O'Brien SJ, et al. Tyrosinase and tyrosinase related protein 1 alleles specify domestic cat coat color phenotypes of the albino and brown loci. Journal of Heredity, 2005, 96(4): 289-301 DOI:10.1093/jhered/esi066 | |
| Schmutz SM, Berryere TG, Goldfinch AD. TYRP1 and MC1R genotypes and their effects on coat color in dogs. Mammalian Genome, 2002, 13(7): 380-387 DOI:10.1007/s00335-001-2147-2 | |
| Seikai T, Watanabe T, Shimozaki M. Influence of three geographically different strains of Artemia nauplii on occurrence of albinism in hatchery-reared flounder Paralichthys olivaceus. Bulletin of the Japanese Society of Scientific Fisheries, 1987, 53(2): 195-200 DOI:10.2331/suisan.53.195 | |
| Seikai T. Influences of fluorescent light irradiation, ocular side pigmentation, and source of fishes on the blind side pigmentation in the young Japanese flounder, Paralichthys olivaceus. Suisanzoshoku, 2010, 39(1): 21-60 | |
| Seikai T. Process of pigment cell differentiation in skin on the left and right sides of the Japanese flounder, Paralichthys olivaceus, during metamorphosis. Ichthyological Research, 1992, 39(1): 85-92 | |
| Takahashi YI. Influence of stocking density and food at late phase of larval period on hypermelanosis on the blind body side in juvenile Japanese flounder. Nihon-suisan-gakkai-shi, 1994, 60(5): 593-598 DOI:10.2331/suisan.60.593 | |
| Wang P, Zhao Y, Fan R, et al. MicroRNA-21a-5p functions on the regulation of melanogenesis by targeting Sox5 in mouse skin melanocytes. International Journal of Molecular Sciences, 2016, 17(7): 959 DOI:10.3390/ijms17070959 | |
| Yamamoto T, Fukusho K, Okauchi M, et al. Effect of various foods during metamorphosis on albinism in juvenile of flounder. Nihon-suisan-gakkai-shi, 1992, 58(3): 499-508 DOI:10.2331/suisan.58.499 | |
| Yang S, Fan R, Shi Z, et al. Identification of a novel microRNA important for melanogenesis in alpaca (Vicugna pacos). Journal of Animal Science, 2015, 93(4): 1622-1631 DOI:10.2527/jas.2014-8404 | |
| Yoo JH, Takeuchi T, Tagawa M, et al. Effect of thyroid hormones on the stage-specific pigmentation of the Japanese flounder Paralichthys olivaceus. Zoological Science, 2000, 17(8): 1101-1106 DOI:10.2108/zsj.17.1101 | |
| Zhang B, Zhang J, Sun L. In-depth profiling and analysis of host and viral microRNAs in Japanese flounder (Paralichthys olivaceus) infected with megalocytivirus reveal involvement of microRNAs in host-virus interaction in teleost fish. BMC Genomics, 2014, 15(1): 1-15 DOI:10.1186/1471-2164-15-1 | |
| Zhang J, Liu Y, Zhu Z, et al. Role of microRNA508-3p in melanogenesis by targeting microphthalmia transcription factor in melanocytes of alpaca. Animal, 2017, 11(2): 236-243 DOI:10.1017/S1751731116001294 | |
| Zhang QJ, Chen YL, Xie SH. An example of an albino Wang Jin snake was found in the Shaowu of Fujian. Chinese Journal of Zoology, 2009, 44(2): 47 [张秋金, 陈友铃, 谢少和. 福建邵武发现一例白化王锦蛇. 动物学杂志, 2009, 44(2): 47] | |
| Zhu XW, Xu YJ, Liu XZ, et al. Physiological mechanisms for degeneration of blind-side hypermelanosis in pond-cultured Japanese flounder (Paralichthys olivaceus). Progress in Fishery Sciences, 2017, 38(1): 103-110 [朱学武, 徐永江, 柳学周, 等. 池塘养殖牙鲆(Paralichthys olivaceus)无眼侧体色黑化消褪机理. 渔业科学进展, 2017, 38(1): 103-110] | |
| Zhu Z, He J, Jia X, et al. MicroRNA-25 functions in regulation of pigmentation by targeting the transcription factor MITF in Alpaca (Lama pacos) skin melanocytes. Domestic Animal Endocrinology, 2010, 38(3): 200-209 DOI:10.1016/j.domaniend.2009.10.004 |



