2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
4. 中国海洋大学水产学院 青岛 266003
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
4. Fisheries College, Ocean University of China, Qingdao 266003
气候变化导致的海洋酸化和暖化对海洋生物及海洋生态系统有显著影响(刘晓辉等, 2017)。温度是重要的环境因子,影响海洋生物的繁殖(吴伟峰等, 1999)、生长、发育、生物量、分布迁移等方面。首先,温度影响海洋鱼类的性别分化(程晓春等, 2007),升温能促进性腺发育(张亚晨等, 2016)和生殖(徐永江等, 2011; 管卫兵等, 2011; 张亚晨等, 2016),缩短发育时间(陈政强等, 1996)。其次,在适宜的温度下,随温度升高,酶活性加强,代谢加快(戴超等, 2014; Messmer et al, 2017),发育周期缩短(吴珍等, 2016)。再者,海水温度影响海洋资源生物量(谷德贤等, 2017),随温度升高,平均浮游生物量和海洋渔获产量增加(李恒等, 2013; 靳少非等, 2014; Punzón et al, 2016; 赵希岳等, 2016);温度直接作用于产卵群体、鱼卵仔稚鱼及成体的空间分布(万瑞景等, 2014; Holmquist et al, 2016),如暖化造成海洋生物向纬度更高、水层更深处偏移(苏杭等, 2015; Punzón et al, 2016)。pH也是重要的环境因子之一,一方面,酸化通过降低珊瑚、贝类、甲壳类等海洋钙化生物的钙化率(Zhan, 2017),造成死亡率上升(Hoegh-Guldberg et al, 2007);另一方面,pH对海洋鱼类等非钙化生物的生殖、发育、感官等方面有影响,pH值的高低会影响鱼卵的活性(刘鉴毅等, 2014; 顾正选等, 2017)和孵化率(冯广朋等, 2009),并影响其代谢速率及蛋白质合成量(Franke et al, 2011),从而关系到鱼类生长(Munday et al, 2011; Branch et al, 2013)及死亡(Munday et al, 2009; Baumann et al, 2012)。酸化还能够降低海洋鱼类嗅觉、听觉等感觉器官的敏感性(Munday et al, 2009、2010; 王晓杰等, 2015),从而增加低营养级鱼类被捕食的风险,并降低高营养级鱼类的捕食效率(杨林林, 2014)。
综上所述,海洋酸化和暖化不仅会对海洋生物产生影响,还对海洋生态系统的结构和功能发挥作用(Munday et al, 2010; Pimentel et al, 2016)。本文以重要的经济种类黄姑鱼(Nibea albiflora)为研究对象,基于IPCC对2100年海洋温度和pH的预测值,通过温度和pH调控,研究了海洋暖化和酸化对黄姑鱼早期生长发育的影响,以期为气候变化背景下海洋鱼类生态学研究提供参考。
1 材料与方法 1.1 实验材料本研究所用的黄姑鱼受精卵、鱼苗均购于福建省宁德市南海水产科技有限公司。黄姑鱼受精卵为端黄卵,无色透明,平均卵径为(0.82±0.27) mm。放卵时,剔除死卵,选择处于尾鳍形成期(64%)、尾部游离期(30%)、晶体形成期和出膜前期(6%)的活受精卵约计45000 ind.,每桶(150 L)鱼卵密度0.3 ind./ml。鱼苗购入时已孵化35 d,在实验室自然海水(T=25.0℃, pH=7.80, DO=4.5~5.5 mg/L, S=23)条件下暂养1 d,放苗时,平均鱼体长为(27.60±6.70) mm,平均体重为(0.42±0.27) g,放养密度为0.6 ind./L。
1.2 实验方法根据IPCC(2013)对2100年全球海洋变化的预测,选择减缓温室气体排放情景(RCP 2.6)和高温室气体排放情景(RCP 8.5):根据RCP 2.6,到2100年全球海洋平均温度将升高0.6℃,海水pH将下降0.07个单位;根据RCP 8.5,到2100年全球海洋平均温度将升高2.0℃,海水酸度将下降0.31个单位,设置温度和酸度2个因子开展实验,设定当前海洋温度和pH分别为26.0℃和7.8,实验梯度分别是T1=26.0℃、T2=26.6℃、T3=28.0℃;pH1=7.80、pH2=7.73、pH3=7.49。实验采用3×3交叉组合设计,每组设置2个重复。选择T1(26.0℃)×pH1(7.80)、T2(26.6℃)×pH2(7.73)、T3(28.0℃)×pH3(7.49)分别作为对照组、处理组(一)和处理组(二)。根据鱼类早期生长发育阶段,把实验分为两部分,第一部分为黄姑鱼受精卵孵化及仔稚鱼期生长发育阶段,第二部分为幼鱼期生长发育阶段。实验周期为2个月。
实验过程中,通过恒温加热棒控制养殖温度,温度变化幅度控制在±0.2℃;用CO2法控制养殖水体pH值,pH变化幅度控制在±0.05,每天隔4 h测量1次化学指标,包括T、S(±23)、pH、DO(4.5~5.5 mg/L),受精卵孵化2 d后开始投喂轮虫(Brachionus rotundiformis) [加小球藻(Nannochloropsis oculata)强化]作为开口饵料,从12 d后开始投喂卤虫(Artemia saline),35日龄后的幼鱼投喂粒径为2.00 mm的配合饲料。养殖过程中,仔细观察和记录受精卵的孵化和死亡情况,并记录幼鱼死亡个体数。定期用吸管吸出浮在表面的死鱼,每天用虹吸法吸出底层杂质并换水,前一个月换水量为30%,后期换水量为100%。实验前8 d,每天取样20~30尾鱼;孵化后9~23 d,隔3 d取样1次,每次取10~20尾鱼;24 d后,每周取样1次,每次取8尾鱼。样品用75%的乙醇现场固定保存,带回实验室进行生物学测量。第一阶段(0~24 d)显微镜下测量鱼体长;第二阶段(24 d后)测量鱼体长和体重,鱼体长以mm为单位,测量标准为从吻前端到脊椎骨末端的长度作为鱼体长,体重以g为单位,精确到0.01 g。
1.3 生长研究方法采用SPSS 13.0和Excel 2013处理数据,并检验不同组别之间生长率和死亡率的差异显著性,显著水平P < 0.05。分别用von Bertalanffy生长方程、Logistic生长方程、Logarthmic生长方程和一般线性方程拟合黄姑鱼早期生长方程并检验拟合效果。生长率、死亡率及AIC(Akaikes information criterion)检验方程如下:
von Bertalanffy生长方程:
| $ {L_t} = L\infty (1 - {{\rm{e}}^{ - k(t - {t_0})}}) $ | (1) |
式中,Lt为生长天数为t时的鱼体长,单位mm;L∞为预测条件下,鱼体长能够达到的最大值;k为VB生长常数;t0为预测条件下,假设鱼体长为0时的生长天数。
Logistic生长方程:
| $ {\rm{}}{L_t} = \frac{{{L_\infty }}}{{1 + {{\rm{e}}^{\left({a - rt} \right)}}}} $ | (2) |
式中,Lt为生长天数为t时的鱼体长,单位mm;L∞为预测条件下,鱼体长能够达到的最大值;a为逻辑斯蒂生长参数;r为代表瞬时生长率。
Logarithmic生长方程:
| $ {L_t} = {b_0} + {b_1}{\rm{ln}}t $ | (3) |
式中,Lt为生长天数为t时的鱼体长,单位mm;b0、b1为Logarithmic生长参数。
一般线性方程:
| $ {L_t} = {b_0}t + {b_1} $ | (4) |
式中,Lt为生长天数为t时的鱼体长,单位mm;b0、b1为生长参数。
死亡率:
| $ M = \frac{{TM}}{T} $ | (5) |
式中,M为死亡率,单位%;TM为实验过程中鱼死亡个体数,单位ind.;T为放苗总数,单位ind.,在本实验中该值为90 ind.。
生长率:
| $ r = \frac{1}{t}\mathop \sum \limits_t \left({{L_t} - {L_{t - 1}}} \right) $ | (6) |
式中,r为生长率,单位mm/d;Lt为生长天数为t时的鱼体长,单位mm;Lt–1为生长天数为t–1时的鱼体长,单位mm;t为生长天数。
AIC准则:
| $ {\rm{AIC}} = 2 \times k + n \times {\rm{Ln}}\left({\frac{{SSR}}{n}} \right) $ | (7) |
式中,k为拟合方程中参数常数的数量;n为样本数;SSR为残差平方和。
2 结果 2.1 温度对黄姑鱼早期生长发育的影响 2.1.1 对发育的影响放卵时,受精卵大部分处于尾鳍形成期(64%),放卵后,经4 h观察,受精卵全部孵化,初孵仔鱼均匀分布于水体。在本实验条件下,结合第一阶段的数据,黄姑鱼的早期生活史分为5个阶段:1~2日龄为卵黄囊期仔鱼,3~11日龄为前弯曲期仔鱼,12~16日龄为弯曲期仔鱼,17~22日龄为后弯曲期仔鱼,22日龄后进入稚鱼期(表 1)。
|
|
表 1 黄姑鱼早期生活史阶段及特点 Table 1 The developmental characteristics of N. albiflora during early life history |
以第二阶段实验数据为依据,分别保持pH为7.80、7.73和7.49时,生长温度分别为26.0℃、26.6℃和28.0℃时,其死亡率的变化范围分别为3.9%~22.2%、19.4%~31.1%和21.7%~ 32.8%,生长温度为26.6℃组死亡率最高,显著高于其他2组(P < 0.05)。生长温度为28.0℃组的死亡率均高于生长温度为26.0℃组的死亡率,但差异不显著(P > 0.05),黄姑鱼在温度为28.0℃组的死亡率相较于温度为26.6℃组有所降低,说明黄姑鱼对温度具有较强的适应能力。随着生长温度的升高,死亡率先升高后降低,生长温度为26.6℃时死亡率最高,生长温度为26.0℃时死亡率最低(图 1)。
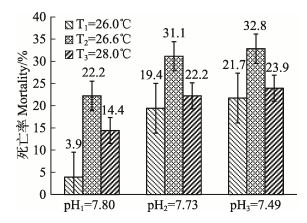
|
图 1 不同生长温度下黄姑鱼早期死亡率 Figure 1 The mortality of N. albiflora during early development stage under different temperature |
黄姑鱼早期生长率随温度升高而升高(图 2),保持pH=7.80,随着温度升高,生长率增加,温度为28.0℃组的生长率要显著高于其他2组(P < 0.05),达到0.78 mm/d;保持pH=7.73时,生长率随温度的升高先降低后升高,温度为26.6℃组的生长率最低,为0.71 mm/d,温度为28.0℃组的生长率显著高于其他2组(P < 0.05),达到0.76 mm/d;保持pH=7.49,随着生长温度从26.0℃升到28.0℃,其生长率也从0.70 mm/d升高到0.76 mm/d,且其组间差异显著(P < 0.05),说明温度是影响鱼类早期生长率的重要因子。

|
图 2 不同生长温度下黄姑鱼早期生长率 Figure 2 The growth rate of N. albiflora during early development stage under different temperature |
保持温度不变,对受酸度影响下的黄姑鱼死亡率进行方差分析。随着生长酸度的增加,黄姑鱼早期死亡率逐渐增加,酸度是影响早期死亡率的重要环境因子(图 3)。当保持温度为26.0℃时,受酸度的影响,死亡率由pH=7.80时的3.9%增加到pH=7.49时的21.7%,差异显著(P < 0.05),约增加了5.5倍。当保持生长温度为26.6℃时,pH为7.80、7.73和7.49时的死亡率分别为22.2%、31.1%和32.8%。生长温度保持在28.0℃时,死亡率随着酸度的降低而升高,pH=7.80时,死亡率最低为14.4%,pH=7.49时,死亡率最高为23.9%。
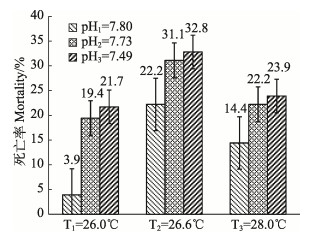
|
图 3 不同生长酸度下黄姑鱼早期死亡率 Figure 3 The mortality of N. albiflora during early development stage under different acidity |
通过对不同酸度条件下的黄姑鱼早期生长率进行方差分析,结果显示,随着酸度的降低,生长率有降低趋势,但差异不显著(P > 0.05)。保持温度为26.0℃时,pH在7.80~7.49的变化范围内,其生长率分别为0.73、0.72和0.70 mm/d。保持温度为26.6℃时,pH在7.80~7.49的变化范围内,其生长率分别为0.74、0.71和0.74 mm/d。保持温度为26.6℃时,生长率在pH=7.80时最高,为0.78 mm/d,其他2组生长率相同,均为0.76 mm/d (图 4)。
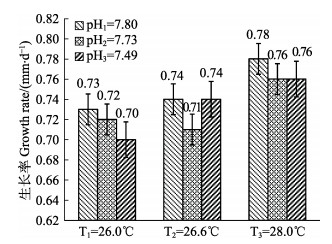
|
图 4 不同生长酸度下黄姑鱼早期生长率 Figure 4 The growth rate of N. albiflora during early development stage under different acidity |
多因素方差分析表明,在一定的温度范围(T1=26.0℃、T2=26.6℃、T3=28.0℃)和酸度范围(pH=7.80、pH=7.73、pH=7.49)内,温度和酸度交互效应对黄姑鱼早期生长率影响不显著(P > 0.05),温度和酸度交互作用与温度或酸度单一因子对早期生长率的影响相比较没有显著差异(P > 0.05),说明养殖水体的酸度不是影响黄姑鱼早期生长率的主要因素,但其交互作用对黄姑鱼早期死亡率的影响显著(P < 0.05),表现为温度和酸度的交互作用增加了鱼类早期死亡率,温度和酸度的共同作用效果大于由温度、酸度单一因子的作用(表 2)。
|
|
表 2 酸化和暖化黄姑鱼早期生长率和死亡率的方差分析 Table 2 The variance analysis on the growth rate and mortality of N. albifora under experimental condition |
根据IPCC 2013典型浓度路径对全球海洋的预测,依据RCP 2.6预测,在处理组(一)条件下,到2100年,黄姑鱼早期生长率将会下降至0.71 mm/d,同比于对照组下降了0.02 mm/d,死亡率将会增加到31.1%,约为对照组死亡率(3.9%)的8倍。依据RCP 8.5预测,在处理组(二)条件下,到2100年,其早期生长率和死亡率相较于当前海洋条件(对照组)均会上升,生长率将会达到0.76 mm/d,相比于对照组条件增加了0.03 mm/d,死亡率将会增加到23.9%,约为对照组死亡率的6倍。其生长率的增加和死亡率的上升对黄姑鱼早期补充机制有相互拮抗效应,如生长率增加在一定程度会增加黄姑鱼早期补充量,而死亡率的上升在一定程度上会减少黄姑鱼早期补充量。
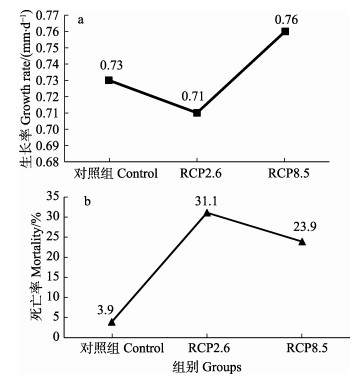
|
图 5 不同RCP情景下黄姑鱼早期生长的死亡率和生长率 Figure 5 The mortality and growth rate of N. albifora during early development stage under different scenarios 对照组Control group: T1=26.0℃, pH1=7.80; RCP 2.6: T2=26.6℃, pH2=7.73; RCP 2.6: T2=28.0℃; pH2=7.49 |
分别用4种生长方程(式1、2、3、4)拟合鱼类早期生长鱼体长与时间的关系,生长模型采用规划求解的方法求得,通过AIC准则检验拟合效果(式7)。在不同温度和pH交互影响下,黄姑鱼早期生长的生长方程参数存在差异,但最佳拟合方程均为Logistic生长方程,von Bertalanffy生长方程拟合效果次之,Logarithmic生长方程拟合效果最差,下图为Logistic生长方程拟合图以及拟合方程参数(图 6, 表 3)。
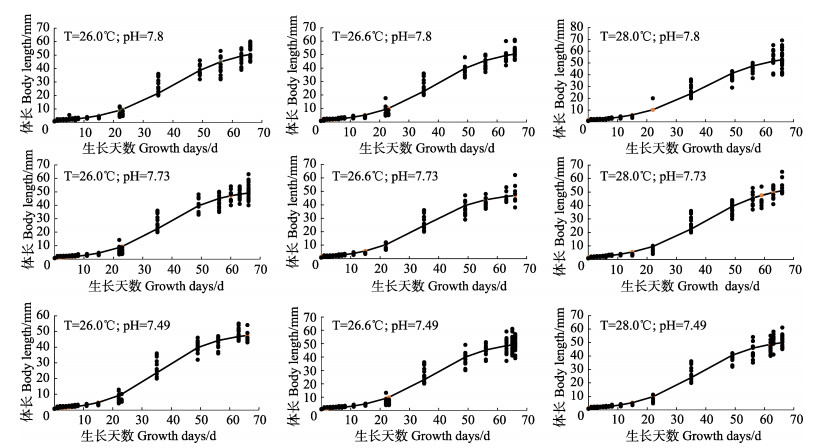
|
图 6 不同酸度温度组合下的黄姑鱼早期生长(Logistic生长方程拟合) Figure 6 The growth of N. albiflora during early development stage under different experimental condition (Logistic model) |
|
|
表 3 不同酸度温度组合下黄姑鱼早期生长方程(Logistic生长方程) Table 3 The growth model of N. albiflora during early development stage under different experimental condition (Logistic model) |
黄姑鱼受精卵发育与大多数硬骨鱼类似,其早期生活史分为五个阶段(表 1),与耿智等(2012)在温度为24.0℃养殖的黄姑鱼早期生活史阶段相比,当从基础温度24.0℃上升到26.0℃~28.0℃时,生长速度加快,完成孵化及生活史阶段进入稚鱼期由原来的25 d缩短到22 d,提前进入稚鱼期。根据有效积温法则,发育期的平均水温(有效温度)与发育所经过的天数或时数的乘积是一个常数,说明生长率随温度升高加快,完成某一阶段的生长需要更短的时间。黄姑鱼是变温动物,温度通过影响生物化学反应而直接影响其机体的新陈代谢速率,在适宜的温度范围内,黄姑鱼的生长速率和温度呈正相关(常杰等, 2016),如适当升高鱼类发育早期的温度,可以明显加快代谢速率,增加基因和肌肉表达,其心、肝、脑等器官的活性增强,生长率加快(Gutierrez de Paula et al, 2014; 牟金婷等, 2017),但当超过其最适宜的温度时,鱼类就会表现出应激反应(李文龙等, 2017)、耗氧率和排氨率下降(邢道超等, 2017)、不正常个体的比例增加(Cole et al, 2016; 张廷廷等, 2016)、死亡率增加。在本研究中,死亡率随着温度的增加(26.0℃、26.6℃和28.0℃)先升高后降低,其可能原因是温度为26.6℃时,更加有利于鱼类寄生虫的生殖和繁衍,例如,引发养殖鱼类发生白点病的刺激隐核虫,同时,黄姑鱼对水体环境有一个适应机制,在孵化生长的过程中可能逐渐适应生存环境而出现与常态相反的现象。
pH也是重要的环境因子之一,吴萍等(2001)在黄颡鱼(Pelteobagrus fulvidraco)对pH的适应性实验中发现,黄颡鱼在pH偏低的情况下生长缓慢;同时,在较酸水体中生活的鱼类表现为不爱活动、耗氧下降、代谢低落、摄食减少、消化差、生长受到抑制(上海水产学院, 1982),可能是因为鱼体中的酶发挥活性需要合适的pH,pH过高或过低都会影响酶促反应的进行,从而影响鱼类的早期生长。在本研究中,随pH的降低,黄姑鱼早期死亡率逐渐升高;但pH对生长率的影响较小,从整体看,生长率随pH的降低呈降低趋势。
3.2 在2100年海洋酸化和暖化条件下黄姑鱼早期生长率和死亡率的变化在海洋酸化和暖化的共同作用下,黄姑鱼早期生长受到的影响会加剧,即“1+1 > 2效应”,酸化能够加剧暖化带来的负面效应,并与其正面影响有拮抗作用,随着海洋变化的加剧,在接下来的一个世纪里,海洋酸化的影响可能会超过海洋暖化(Horvath et al, 2016)。本研究表明,到2100年,在酸化和暖化的共同作用下,黄姑鱼早期生长率将增加,早期死亡率将升高,早期补充量会因生长率的升高而有所增加,但同时会因死亡率的升高而有所下降,其具体补充机制需要进一步探究。
严格来说,能够准确描述某种鱼类生长特点的生长模型并不存在,只有通过大量的实验来寻找更加适合鱼类早期生长特点的生长模型。在理想的状态下,种群可以无限制增加,但在实际情况中,种群的增加会受到各种外界环境的影响,逻辑斯蒂生长方程能够较好地模拟种群生长的趋势(许永明, 1985)。在对黄姑鱼早期生长发育研究中,通过对鱼类早期生长方程进行拟合,发现逻辑斯蒂生长方程能够更好地表明黄姑鱼早期生长特点,在实验过程中,养殖水体溶解氧含量以及饵料投喂充足,其生长曲线呈“S”型增长,主要是因为受到环境因子(温度、酸度)的制约。
国内外研究表明,海洋酸化和暖化对鱼类、贝类、海胆类、藻类等海洋生物均有显著影响。温度升高会缩短大泷六线鱼(Hexagrammos otakii)胚胎发育的时间(胡发文等, 2012),并能提高大菱鲆(Scophthalmus maximus)幼鱼的生长率(李文龙等, 2017),但当温度超过最适宜温度时,纹缟
本研究根据IPCC对2100年海洋理化环境的预测设计实验,探究温度和酸度两个环境因子对黄姑鱼早期生长率和死亡率的影响,并预测在2100年黄姑鱼在海洋酸化和暖化条件下的生长与死亡情况。本研究表明,到2100年,黄姑鱼早期发育周期缩短、生长速率加快、死亡率升高,这将影响到黄姑鱼的早期补充机制,从而影响到黄姑鱼海洋捕捞产量。
致谢: 感谢福建省宁德市南海水产科技有限公司的总经理彭立成、助理工程师黄伟卿等人提供养殖技术支持及养殖平台。| Baumann H, Talmage SC, Gobler CJ. Reduced early life growth and survival in a fish in direct response to increased carbon dioxide. Nature Climate Change, 2012, 2(1): 38-41 | |
| Branch TA, DeJoseph BM, Ray LJ, et al. Impacts of ocean acidification on marine seafood. Trends in Ecology & Evolution, 2013, 28(3): 178-186 | |
| Chang J, Xu GF, Li SG, et al. Effect of temperature and salinity on the survival and growth of larval and juvenile stage manchurian trout (Brachymystax lenok Pallas). Journal of Hydroecology, 2016, 37(5): 87-91 [常杰, 徐革锋, 李树国, 等. 温度与盐度对细鳞鲑仔、稚鱼存活和生长的影响. 水生态学杂志, 2016, 37(5): 87-91] | |
| Chen ZQ, Lin JZ, Zhang YZ, et al. Effects of temperature on embryornic development and larval and post-larval survival in the autumn-winter spawning groups of the red bream, Pagrus major. Journal of Xiamen Fisheries College, 1996, 18(1): 63-70 [陈政强, 林锦宗, 张雅芝, 等. 温度对秋冬季生殖真鲷胚胎发育及仔、稚鱼存活的影响. 厦门水产学院学报, 1996, 18(1): 63-70] | |
| Cheng XC, Lin DJ, You YL. Influence of temperature on sex differentiation of teleost, Pseudobarus vachelli. Zoological Research, 2007, 28(1): 73-80 [程晓春, 林丹军, 尤永隆. 温度对江黄颡鱼性分化的影响. 动物学研究, 2007, 28(1): 73-80] | |
| Cole VJ, Parker LM, OxConnor SJ, et al. Effects of multiple climate change stressors: Ocean acidification interacts with warming, hyposalinity, and low food supply on the larvae of the brooding flat oyster Ostrea angasi. Marine Biology, 2016, 163(5): 1-17 | |
| Dai C, Wang F, Fang ZH, et al. Effects of temperature on the respiratory metabolism and activities of related enzymes of swimming crab Protunus trituberculatus. Progress in Fishery Sciences, 2014, 35(2): 90-96 DOI:10.11758/yykxjz.20140213 [戴超, 王芳, 房子恒, 等. 温度对三疣梭子蟹呼吸代谢及其相关酶活力的影响. 渔业科学进展, 2014, 35(2): 90-96] | |
| Feng GP, Zhuang P, Zhang LZ, et al. The adaptability of embryos and larvae of Tridentiger trigonocephalus at the Yangtze River estuary to ecological factors. Acta Ecologica Sinica, 2009, 29(10): 5185-5194 DOI:10.3321/j.issn:1000-0933.2009.10.003 [冯广朋, 庄平, 章龙珍, 等. 长江口纹缟虾虎鱼早期发育对生态因子的适应性. 生态学报, 2009, 29(10): 5185-5194] | |
| Franke A, Clemmesen C. Effect of ocean acidification on early life stages of Atlantic herring (Clupea harengus L. ). Biogeosciences Discussions, 2011, 8(4): 7097-7126 DOI:10.5194/bgd-8-7097-2011 | |
| Geng Z, Xu DD, Shi HL, et al. Study on development and growth of early life stages of Nibea albiflora Richardson. Advances in Marine Science, 2012, 30(1): 77-86 [耿智, 徐冬冬, 史会来, 等. 黄姑鱼(Nibea albiflora Richardson)早期生长发育研究. 海洋科学进展, 2012, 30(1): 77-86] | |
| Gu DX, Liu GS, Wang XY, et al. Preliminary study on fish resources and its relationship with environmental factors in Tianjin Sea area based on generalized additive model (GAM). Journal of Tianjin Agricultural University, 2017, 24(1): 38-43 [谷德贤, 刘国山, 王晓宇, 等. 基于GAM模型的天津海域鱼类资源和环境因子关系的初步研究. 天津农学院学报, 2017, 24(1): 38-43] | |
| Gu ZX, Ding SH. Influence of pH and different concentrations of NaCl solution on Schizothorax prenanit sperm vitality. Journal of Southwest University (Natural Science Edition), 2017, 39(7): 72-76 [顾正选, 丁诗华. pH值及不同百分浓度NaCl溶液对齐口裂腹鱼精子活力的影响. 西南大学学报(自然科学版), 2017, 39(7): 72-76] | |
| Guan WB, Chen HH, He WH. Reproductive characteristics and condition status of Coilia mystus (Linnaeus) in the Changjiang River estuary. Progress in Fishery Sciences, 2011, 32(5): 1-9 [管卫兵, 陈辉辉, 何文辉. 长江口凤鲚生殖群体的动态特征. 渔业科学进展, 2011, 32(5): 1-9] | |
| Gutierrez de Paula PT, de Almeida FL, Carani FR, et al. Rearing temperature induces changes in muscle growth and gene expression in juvenile pacu (Piaractus mesopotamicus). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2014, 169(1): 31-37 | |
| He SY, Lin CX, He MX, et al. Impacts of ocean acidification on the development of Pinctada martensii embryo and early larva. Chinese Journal of Ecology, 2011, 30(4): 747-751 [何盛毅, 林传旭, 何毛贤, 等. 海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响. 生态学杂志, 2011, 30(4): 747-751] | |
| Hoegh-Guldberg O, Mumby PJ, Hooten AJ, et al. Coral reefs under rapid climate change and ocean acidification. Science, 2007, 318(5857): 1737-1742 DOI:10.1126/science.1152509 | |
| Holmquist JR, Booth RK, Macdonald GM. Boreal peatland water table depth and carbon accumulation during the holocene thermal maximum, Roman Warm Period, and Medieval Climate Anomaly. Palaeogeography, Palaeoclimatology, Palaeoecology, 2016, 444: 15-27 DOI:10.1016/j.palaeo.2015.11.035 | |
| Horvath KM, Castillo KD, Armstrong P, et al. Next-century ocean acidification and warming both reduce calcification rate, but only acidification alters skeletal morphology of reef-building coral Siderastrea siderea. Scientific Reports, 2016(6): 29613 | |
| Hu FW, Pan L, Gao FX, et al. Embryonic development of Hexagrammos otakii and its relationship with incubation temperature. Progress in Fishery Sciences, 2012, 33(1): 28-33 [胡发文, 潘雷, 高凤祥, 等. 大泷六线鱼胚胎发育及其与水温的关系. 渔业科学进展, 2012, 33(1): 28-33] | |
| Huang XY. The impact of ocean acidification on larval development in sea urchin Strongylocentrotus intermedius. Masterxs Thesis of Dalian Ocean University, 2014 [黄显雅. 海洋酸化对中间球海胆(Strongylocentrotus intermedius)浮游幼体发育的影响. 大连海洋大学硕士研究生学位论文, 2014] | |
| Jin SF, Tang FH, Dai LF, et al. Diversity of zooplankton in the squid fishing ground in the North Pacific Ocean, 2010. Marine Environmental Science, 2014, 33(4): 503-508 [靳少非, 唐峰华, 戴立峰, 等. 2010年北太平洋柔鱼渔场浮游动物多样性. 海洋环境科学, 2014, 33(4): 503-508] | |
| Langdon C, Takahashi T, Sweeney C. Effect of calcium carbonate saturation state on the calcification rate of an experimental coral reef. Global Biogeochemical Cycles, 2000, 14(2): 639-654 DOI:10.1029/1999GB001195 | |
| Li H, Li MZ, Cao J, et al. Effects of temperature on nitrogen uptake and growth in several species of macroalgae. Progress in Fishery Sciences, 2013, 34(1): 159-165 [李恒, 李美真, 曹婧, 等. 温度对几种大型海藻硝氮吸收及其生长的影响. 渔业科学进展, 2013, 34(1): 159-165] | |
| Li WL, Liang XM, Liang MQ, et al. Effects of temperature on growth and enzyme activity related to immunity in juvenile turbot Scophthalmus maximus. Fisheries Science, 2017, 36(3): 311-316 [李文龙, 梁兴明, 梁萌青, 等. 温度对大菱鲆幼鱼生长及免疫相关酶活性的影响. 水产科学, 2017, 36(3): 311-316] | |
| Liu JY, Huang XR, Zhang LZ, et al. Effects of salinity, temperature and pH on spermatozoa motility in two kinds of rabbitfish. Marine Fisheries, 2014, 36(6): 523-528 [刘鉴毅, 黄晓荣, 章龙珍, 等. 盐度、温度和pH对2种篮子鱼精子活性的影响. 海洋渔业, 2014, 36(6): 523-528] | |
| Liu SX, Xu JT, Jiang DC. The effects of temperature on the growth and photosynthesis of economic red macroalga Gracilaria lemaneiformis. Journal of Anhui Agricultural Sciences, 2009, 37(33): 16322-16324 [刘树霞, 徐军田, 蒋栋成. 温度对经济红藻龙须菜生长及光合作用的影响. 安徽农业科学, 2009, 37(33): 16322-16324] | |
| Liu XH, Sun DQ, Huang B, et al. Acidification and the factors in surface seawater of the East China Sea coast. Oceanologia et Limnologia Sinica, 2017, 48(2): 398-405 [刘晓辉, 孙丹青, 黄备, 等. 东海沿岸海域表层海水酸化趋势及影响因素研究. 海洋与湖沼, 2017, 48(2): 398-405] | |
| Messmer V, Pratchett MS, Hoey AS, et al. Global warming may disproportionately affect larger adults in a predatory coral reef fish. Global Change Biology, 2017, 23(6): 2230-2240 DOI:10.1111/gcb.13552 | |
| Mu JT, Xie SD, Yong PZ, et al. Effect of temperature on feeding behavior and growth rate of the yellow seahorse, Hippocampus kuda Bleeker. Journal of Fishery Sciences of China, 2017, 24(2): 355-361 [牟金婷, 谢尚端, 雍朋政, 等. 温度对大海马摄食行为及生长速率的影响. 中国水产科学, 2017, 24(2): 355-361] | |
| Munday PL, Dixson DL, Donelson JM, et al. Ocean acidification impairs olfactory discrimination and homing ability of a marine fish. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 1848-1852 DOI:10.1073/pnas.0809996106 | |
| Munday PL, Dixson DL, McCormick MI, et al. Replenishment of fish populations is threatened by ocean acidification. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(29): 12930-12934 DOI:10.1073/pnas.1004519107 | |
| Munday, P L, Gagliano M, Donelson JM, et al. Ocean acidification does not affect the early life history development of a tropical marine fish. Marine Ecology Progress Series, 2011, 423(12): 211-221 | |
| Pimentel MS, Faleiro F, Marques T, et al. Foraging behaviour, swimming performance and malformations of early stages of commercially important fishes under ocean acidification and warming. Climatic Change, 2016, 137(3): 1-15 | |
| Pistevos JCA, Nagelkerken I, Rossi T, et al. Antagonistic effects of ocean acidification and warming on hunting sharks. Oikos, 2017, 126(2): 241-247 | |
| Punzón A, Serrano A, Sánchez F, et al. Response of a temperate demersal fish community to global warming. Journal of Marine Systems, 2016, 161: 1-10 DOI:10.1016/j.jmarsys.2016.05.001 | |
| Shanghai Fisheries College. Ichthyology and marine fish culture. Beijing: Agricultural Press, 1982: 8. [上海水产学院. 鱼类学与海水鱼类养殖. 北京: 农业出版社, 1982: 8.] | |
| Su H, Chen XJ, Wang JT. Influence of sea surface temperature changes on Scomber japonicas habitat in the Yellow Sea and East China Sea. Haiyang Xuebao, 2015, 37(6): 88-96 [苏杭, 陈新军, 汪金涛. 海表水温变动对东、黄海鲐鱼栖息地分布的影响. 海洋学报, 2015, 37(6): 88-96] | |
| Todgham AE, Hofmann GE. Transcriptomic response of sea urchin larvae Strongylocentrotus purpuratus to CO2-driven seawater acidification. Journal of Experimental Biology, 2009, 212: 2579-2594 DOI:10.1242/jeb.032540 | |
| Wan RJ, Zeng DY, Bian XD, et al. Species composition and abundance distribution pattern of ichthyoplankton and their relationship with environmental factors in the East China Sea ecosystem. Journal of Fisheries of China, 2014, 38(9): 1375-1398 [万瑞景, 曾定勇, 卞晓东, 等. 东海生态系统中鱼卵、仔稚鱼种类组成、数量分布及其与环境因素的关系. 水产学报, 2014, 38(9): 1375-1398] | |
| Wang XJ, Song JK, Fan CX, et al. Impacts of ocean acidification on sensory system and behavior in marine fish. Asian Journal of Ecotoxicology, 2015, 10(6): 13-20 [王晓杰, 宋佳坤, 范纯新, 等. 海洋酸化对鱼类感觉和行为影响的研究进展. 生态毒理学报, 2015, 10(6): 13-20] | |
| Wu P, Cao ZH, Yang LR, et al. Effects of pH on survival and growth of Pseudobagrus fulvidraco Richardson. Reservoir Fisheries, 2001, 21(6): 3-4, 6 [吴萍, 曹振华, 杨立荣, 等. pH对黄颡鱼生存和生长的影响. 水利渔业, 2001, 21(6): 3-4, 6] | |
| Wu WF, Wang DF. Influence of environmental factors on the reproductive activities of fish. Fisheries Economy Research, 1999(3): 40-41 [吴伟峰, 王东风. 环境因素对鱼类生殖活动的影响. 渔业经济研究, 1999(3): 40-41] | |
| Wu Z, Zhang H, Cen JY, et al. Effects of temperature on the growth and carbohydrate production of Gambierdiscus pacificus. Journal of Tropical Oceanography., 2016, 35(5): 55-61 [吴珍, 张华, 岑竞仪, 等. 温度对太平洋冈比亚藻Gambierdiscus pacificus的生长和多糖产量的影响. 热带海洋学报, 2016, 35(5): 55-61] | |
| Xing DC, Song XF, Peng L, et al. Effects of temperature and salinity on oxygen consumption rate and ammonia excretion rate of junevile Epinephelus groupers. Fishery Modernization, 2017, 44(3): 7-14 [邢道超, 宋协法, 彭磊, 等. 温度与盐度对云龙石斑鱼幼鱼耗氧率和排氨率的影响. 渔业现代化, 2017, 44(3): 7-14] | |
| Xu YJ, Liu XZ, Wang QY, et al. Relationships between serum sex steroids levels and gonadal development and photothermal regulation during the annual maturation of captive Cynoglossus semilaevis Günther. Oceanologia et Limnologia Sinica, 2011, 42(1): 67-74 DOI:10.11693/hyhz201101010010 [徐永江, 柳学周, 王清印, 等. 半滑舌鳎(Cynoglossus semilaevis)血浆性类固醇激素表达与卵巢发育及温光调控的关系研究. 海洋与湖沼, 2011, 42(1): 67-74] | |
| Xu YM. Preliminary studies on the growth of file fish Novadon septentrinalis population. Chinese Journal of Ecology, 1985(2): 6-9 [许永明. 鱼类种群增长的初步研究. 生态学杂志, 1985(2): 6-9] | |
| Yang LL. Marine acidification makes fish prone to predators. Fishery Information and Strategy, 2014(3): 236-237 [杨林林. 海洋酸化对捕食性鱼类有利. 渔业信息与战略, 2014(3): 236-237] | |
| Zhan YY, Hu WB, Duan LZ, et al. Effects of seawater acidification on early development of the sea urchin Hemicentrotus pulcherrimus. Aquaculture International, 2017, 25(2): 655-678 DOI:10.1007/s10499-016-0064-3 | |
| Zhang ML, Zou J, Fang JG, et al. Impacts of marine acidification on calcification, respiration and energy metabolism of Zhikong scallop Chlamys farreri. Progress in Fishery Sciences, 2011, 32(4): 48-54 [张明亮, 邹健, 方建光, 等. 海洋酸化对栉孔扇贝钙化、呼吸以及能量代谢的影响. 渔业科学进展, 2011, 32(4): 48-54] | |
| Zhang TT, Chen C, Shi ZH, et al. Effects of temperature on the embryonic development and larval activity of Epinephelus moara. Progress in Fishery Sciences, 2016, 37(3): 28-33 DOI:10.11758/yykxjz.20150121003 [张廷廷, 陈超, 施兆鸿, 等. 温度对云纹石斑鱼(Epinephelus moara)胚胎发育和仔鱼活力的影响. 渔业科学进展, 2016, 37(3): 28-33] | |
| Zhang YC, Wen HS, Li LM. Effects of acute temperature stress on the reproductive endocrine function of gestational ovoviviparous black rockfish (Sebastes schlegelii). Periodical of Ocean University of China, 2016, 46(9): 29-37 [张亚晨, 温海深, 李兰敏, 等. 急性温度胁迫对妊娠期许氏平鲉生殖内分泌机能的影响. 中国海洋大学学报, 2016, 46(9): 29-37] | |
| Zhao XY, Song HY, Cai ZQ, et al. Study of β-glucanase dynamics at different temperature by batch fermentation. Food Science, 2016, 37(19): 211-215 DOI:10.7506/spkx1002-6630-201619035 [赵希岳, 宋厚煜, 蔡志强, 等. 不同温度对β-葡聚糖酶分批发酵动力学的影响. 食品科学, 2016, 37(19): 211-215] |



