2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 大连海洋大学水产与生命学院 大连 116023;
4. 上海海洋大学水产与生命学院 上海 201306;
5. 莱州明波水产有限公司 烟台 261400
2. National Laboratory of Marine Science and Technology, Laboratory of Marine Fisheries Science and Food Production, Qingdao 266071;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
5. Laizhou Mingbo Aquatic Co., Ltd., Yantai 261400
一位著名的遗传学家曾说过:“地球的历史记载于地壳中,而生物的历史却记载在染色体上”(吴政安, 1985)。随着细胞遗传学和分子生物学取得重大成就,生物学家认识到染色体结构、形态与功能存在着密切的联系,染色体是研究物种演化、分类必不可少的重要手段。利用染色体组型分析比较,对于探讨种群进化路线和亲缘关系,以及原位杂交、基因定位、杂交育种、多倍体育种等研究都具有重要作用。
石斑鱼已成为重要的海水养殖对象,国内外研究者对其人工繁育(何永亮等, 2008)、养殖和疾病防控(罗鸣等, 2013)、生长相关基因挖掘(林浩然, 2003)、线粒体基因分析(黄小林等, 2013)等做了大量研究。“云龙斑”(英文名为Yunlong grouper)是云纹石斑鱼(Epinephelus moara♀)×鞍带石斑鱼(Epinephelus lanceolatus♂)杂交后代。鞍带石斑鱼主要分布在热带海域,云纹石斑鱼主要分布在温带海域,2种鱼在分布生态环境、繁殖时间和温度等方面具有较大差异,存在着明显的生殖隔离,在自然环境中无法杂交产生后代。田永胜等(2017a)通过建立鞍带石斑鱼的精子冷冻库突破了不同品种、不同地理环境、不同繁殖时间和温度造成的生殖隔离,实现了鞍带石斑鱼冷冻精子和云纹石斑鱼的杂交育种,在我国首次培育出了具有生长快、成活率高、适温范围广的杂交种“云龙斑”。
云龙斑作为新杂交种,养殖历史较短,近年来主要对其胚胎和变态发育(吴水清等, 2016)、低温胁迫对血清生化指标的影响(邵彦翔等, 2017)、数量遗传性状(田永胜等, 2017b)等进行了研究,但尚未见关于其染色体核型的研究报道。本研究选择了云龙斑的不同组织,利用不同梯度的低渗时间、不同的低渗液和冷热2种制片方法,探索了制备石斑鱼染色体的最适方法,对云龙斑染色体核型与其父母本及同属间鱼类进行对比分析,以期为鱼类杂交新品种选育和种质鉴定技术提供重要的参考依据。
1 材料与方法 1.1 实验材料实验用鱼在山东省莱州明波水产有限公司培育,2017年3~6月利用鞍带石斑鱼冷冻精子与云纹石斑鱼杂交授精,培育了30个云龙斑半同胞和全同胞家系。鞍带石斑鱼和云纹石斑鱼均为雌雄同体,在发育过程中,具有“先雌后雄”性逆转的现象,其杂交后代云龙斑生长到2月龄时,未能观察到性腺发育,云龙斑雌雄性腺是否发育还有待进一步观察。随机选取体长为15~20 cm、体重为60~100 g、体态正常、无畸形鱼苗进行实验,云龙斑的形态见图 1。

|
图 1 云龙斑(云纹石斑鱼♀×鞍带石斑鱼♂) Figure 1 Yonglong grouper (E.moara.♀×E.lanceolatus♂) |
1 mg/ml的植物血球凝集素(PHA)溶液(溶剂为海水鱼用生理盐水),海水鱼用生理盐水(氯化钠8.0 g/L、氯化钾0.45 g/L、氯化钙0.2 g/L、碳酸氢钠0.02 g/L,用蒸馏水配成1 L),1‰秋水仙素溶液(秋水仙素0.1 g,灭活生理盐水100 ml溶解,避光保存),8‰的柠檬酸溶液,0.075 mol/L氯化钾,固定液(甲醇:冰醋酸=9:1),卡诺固定液(甲醇:冰醋酸=3:1)。吉姆萨使用液(原液1份,pH=7.4磷酸缓冲液9份稀释),使用液不宜长期保存,均为现用现配。
1.3 快速制备染色体的方法 1.3.1 PHA和秋水仙素处理采用李雅娟等(2012)的方法并稍作修改。在幼鱼腹腔注射植物血球凝集素(PHA),剂量为6 μg/g(占鱼体重),实验室暂养;注射后18 h,第2次注射PHA溶液,剂量同上。3.5 h后活体腹腔注射0.1%秋水仙素溶液,剂量为6 μg/g(占鱼体重),效应时间3 h,实验室水族箱暂养。
1.3.2 取材将以上处理的幼鱼利用MS-222 (180 mg/L)麻醉,臀鳍后方3 cm处斜向上剪一刀放血5 min;由泄殖孔处将腹腔剪开,剪掉两侧多余肌肉,拨开内脏,取出头肾,将头肾放入海水生理盐水中冲洗。剪开鳃盖,取出鳃丝,将鳃丝放入海水生理盐水中冲洗。
1.3.3 低渗从海水生理盐水中取头肾和鳃片,分别放入盛有2 ml 8‰的柠檬酸溶液和2 ml 0.075 mol/L的KCl的烧杯中进行低渗处理,并将头肾和鳃片分成5份,分别在室温下低渗30、35、40、45、50 min,期间每隔5 min利用吸管轻轻吹打1次。分别进行冷滴片和热滴片,观察统计有丝分裂指数;统计有丝分裂指数=细胞分裂中期相数/细胞总数×100%,筛选低渗液、处理时间和滴片方法。
1.3.4 固定将低渗液用吸管吸出,放入固定液(甲醇:冰醋酸=9:1),固定7~10 min,弃去固定液,加入100%冰醋酸处理1~2 min,弃去100%冰醋酸;加入卡诺固定液(甲醇:冰醋酸=3:1),固定15 min,重复2~3次,最后加入新的卡诺固定液,放入–20℃冰箱冷冻过夜。
1.3.5 滴片分别采用冷滴片法和热滴片法,将实验材料从冷冻中取出后,放入小烧杯中,加入1~2滴50%冰醋酸,将小烧杯放置在冰上,将组织块剪碎、研磨成细胞悬液,加入新的固定液过滤。冷滴片前,提前30 min将载玻片放入盛有乙醇的烧杯中,放入冰箱。热滴片前,将载玻片放在干净的大理石板上,大理石板提前30 min在烤炉上烤热。将细胞悬浮液利用移液枪滴于载玻片上,高度不低于30 cm,在酒精灯上过火看到玻片上燃起蓝色火焰,然后空气自然干燥。
1.3.6 吉姆萨染色使用吉姆萨染色液,染色30 min,之后用蒸馏水轻轻冲洗,室温下晾干待观察。
1.4 观察和统计用Nikon80i显微镜进行观察,先用低倍镜查找分裂相,之后用油镜观察并拍照。
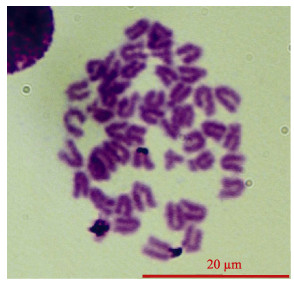
染色体计数及核型分析:吉姆萨染色之后,在显微镜下选取75个分散良好、图像清晰的中期分裂相,统计染色体数目(图 1)。
1.5 核型分析选取5个数目完整、形态清晰、分散效果良好、没有重叠、着丝点清楚、长度适中(正中期)、2条染色单体适度分开的染色体分裂相。利用Photoshop软件处理图片并测量相对长度,再根据其形态特征和大小,初步目测配对;分别测量染色体总长度、长臂和短臂长,对相同的染色体间配对(着丝点类型相同、相对长度相近),再将配对好的染色体分类、排列其组型,采用Excel 2003对云龙石斑染色体核型的各参数进行统计整理,利用函数功能的编辑公式计算出5组染色体的相对长度和臂指数:
染色体相对长度=(每条染色体长度/染色体组总长)×100
臂指数=长臂长度/短臂长度
通常着丝点在每条染色体上只有1个,且位置恒定,常作为描述染色体的标记。根据着丝点的位置,以Levan等(1964)提出的标准划分染色体类型(表 1)。
|
|
表 1 Levan染色体划分标准 Table 1 Chromosome division criteria proposed by Levan |
在染色体制片过程中,采用鳃丝、头肾2种组织进行染色体制作处理,并对不同低渗时间及不同低渗液进行筛选,同时利用冷滴片、热滴片2种方法制片。结果显示,采用石斑鱼鳃丝时,片中多为破碎的细胞杂质,分裂相较少。采用石斑鱼头肾时,可形成较多的染色体分裂相,分裂相数目完整、清晰;因此,取头肾作为实验材料较为理想。分别采用柠檬酸和氯化钾溶液,低渗30、35、40、45、50 min,每组随机选取10个分裂相观察。结果显示,采用柠檬酸低渗40 min时,可形成较多分裂相,分裂相分散效果好,形态清晰。采用不同的滴片方式,随机选取20个视野,统计有丝分裂指数,冷滴片法为21.74%,热滴片法为8.66%,冷滴片法更佳。
2.2 染色体数目选取不同个体分散良好、形态清晰、数目完整的75个云龙斑细胞的染色体中期分裂相,经观察统计,染色体数目从45~56不等,但48条正常二倍体染色体出现的频率最高,其所占比例为81.33%(表 2),占绝对优势,表明云纹斑二倍体染色体众数是48,即2n=48。
|
|
表 2 云龙石斑鱼的染色体数目统计 Table 2 Counts of the chromosomes in cells of Yunlong grouper |
分别对5个中期分裂相(图 2)进行镜检和测量,没有发现随体、次缢痕或者异形染色体存在,也未发现多倍体的存在,统计染色体的相对长度、臂比以及染色体类型(表 3)。根据染色体的相对长度、着丝点位置和特征,48条染色体中有2对亚中部着丝点染色体(sm),3对亚端部着丝点染色体(st),19对端部着丝点染色体(t),核型公式为2n=48,4sm+6st+38t,NF=56,其核型各项参数见表 3,染色体组型见图 3。
|
图 2 云龙斑头肾细胞染色体中期分裂相 Figure 2 The chromosomal metaphase of head kidney cell of Yunlong grouper |

|
图 3 云龙斑染色体组型 Figure 3 The karyotype of Yunlong grouper |
|
|
表 3 云龙斑的染色体相对长度和臂比 Table 3 The relative length and ratio of chromosomes of Yunlong grouper |
通过对石斑鱼属中27种石斑鱼染色体核型分析比较,发现在27种石斑鱼中有13种染色体核型为2n=48t,其染色体仅有24对端部着丝点染色体,另外14种石斑鱼染色体核型发生了变异,出现亚端部着丝粒、亚中部着丝粒和中部着丝粒染色体,且端部、亚端部着丝粒染色体较多,中部、亚中部着丝粒染色体较少(表 4)。
|
|
表 4 27种石斑鱼的核型特征比较 Table 4 Comparison of karyotypes of the related 27 species of groupers |
根据实际研究的条件和目的,选择合适的鱼类组织和处理方法是实验成功的基本前提。在制备染色体时,选用生命活动旺盛和分裂增生快的器官组织易于获得更多的分裂相。目前为止,鱼类染色体制备主要采用的组织有胚胎、鳍条、鳃丝、头肾、脾脏、血液等(毛连菊等, 2002; 王云新等, 2004)。本研究在选取鱼类材料时,考虑到鱼类的鳃丝和头肾作为主要的代谢器官,在整个鱼类的生长过程中,细胞分裂都十分旺盛,因此,选取了鳃丝、头肾2个组织。
掌握好低渗的处理时间也是一个重要的因素,低渗液是指渗透压和离子强度均低于正常细胞生理条件的溶液,例如水、低浓度的柠檬酸钠或NaCl、甘油磷酸钾(0.65 mol/L)、KCl(0.075 mol/L)等。低渗的效果取决于低渗液的化学组成、低渗的温度和处理时间。低渗处理凭借反渗透作用使细胞膨胀、染色体铺展,同时可使粘附于染色体的核仁物质散开,以便能在一个平面上观察所有染色体形态。本研究采用柠檬酸溶液,低渗时间为40 min时,染色体分散良好、形态清晰、数目最完整。另外,在低渗过程中要每隔5 min用吸管轻轻吹打几下,这样使组织低渗液混合均匀,低渗更充分;另一方面主要使细胞充分分离,形成细胞悬浊液,滴片时形成更多的染色体分裂相。
滴片是染色体制备的最后一步,首先,载玻片要干净,提前将其放入70%的乙醇溶液中浸泡;其次,细胞悬浊液的量、滴加距离都会影响染色体分散的效果,尤其是制片方式是染色体制备的关键点。取云龙斑头肾的柠檬酸溶液低渗细胞悬浊液,发现选用冷滴片较热滴片易获得更好的染色体分裂相,这与王世锋(2007)研究6种石斑鱼核型的滴片方法相同。究其原因,冷滴片时玻片能更好地使染色体附着,不易在冲洗的时候发生染色体丢失,而且滴片后有一个过火的过程,冷热交替,细胞容易破碎,使染色体分裂相更多且分散良好。
3.2 石斑鱼染色体核型研究概况目前,国内外已经报道了27种石斑鱼核型(表 4),染色体数目均为2n=48,推测2n=48可能是石斑鱼属最基本的核型特征,是这一分类种群的原始核型类群,可见石斑鱼进化过程中,染色体数目具有较高的保守性。但是,其中有13种石斑鱼染色体核型为2n=48t,属于石斑鱼的原始类群;另外14种石斑鱼出现了亚端部(st)、亚中部(sm)染色体核型,2种杂交石斑鱼珍珠龙胆和云龙斑也出现了染色体特化的现象。鱼类染色体核型有随着鱼类进化而特化的趋势,具有非端部着丝粒染色体的鱼类属于比较特化的种类,而端部着丝粒染色体为原始类型。原始的端部着丝粒染色体经过染色体易位、倒位等染色体结构变异进化,使得端部着丝点染色体形成双臂染色体,然后经过多次染色体重组,形成多对双臂染色体(赵金良, 2000)。按照这种推论,属于同属的石斑鱼特化类群的形成,是不是经过了近缘种间的杂交形成了新的种群,这一点有待于从石斑鱼种群的遗传演化中深入研究。在我国已研究过的鱼类染色体中,能鉴别出性染色体的鱼类染色体核型并不多,说明大部分鱼类没有进化到具有性染色体机制的程度,即使有些鱼类可能具有性别分化机制,也还没有分化出形态异形的性染色体(楼允东, 1997)。许多研究表明,次缢痕是核仁组织区所在区域,但在本研究中没有发现次缢痕和随体的存在,杨坤等(2013)在对麦穗鱼(Pseudorasbora parva)的研究中也没有发现染色体上存在次缢痕和随体,推测其染色体上可能已经存在次缢痕的结构,但无法从细胞学基础进行辨别。
3.3 云龙斑染色体与其父母本的对比分析郭丰等(2006)对云纹石斑鱼染色体核型研究,染色体核型为2n=48,2st+46t,NF=50;而郭明兰等(2008)的研究结果为2n=48,4sm+44t,NF=52。王德祥等(2003)对鞍带石斑鱼染色体核型的研究表明,2n=48,4st+44t,NF=50;而舒琥等(2012)对鞍带石斑鱼染色体核型的研究结果为2n=2sm+6st+40t,NF=50。可能是由于不同种群所表现出的染色体多态性,也可能不同研究者的实验方法不同,配组和测量误差造成的差异,出现同一种鱼类染色体核型不同的结果。鞍带石斑鱼和云纹石斑鱼杂交后代云龙斑的染色体核型为2n=48,4sm+6st+38t,NF=56,染色体数目与2个亲本相同,但在杂交后代中出现了2对亚中部着丝点染色体(sm),这一点与郭明兰等(2008)研究的云纹石斑鱼染色体核型中亚中部着丝粒染色体数相同。与舒琥等(2012)研究的鞍带石斑鱼染色体核型相似,都有亚中部着丝粒染色体(sm)和亚端部着丝粒染色体(st),其中,亚端部着丝粒染色体(st)数目一致,亚中部着丝粒染色体(sm)比父本鞍带石斑鱼多2对。所以,从核型特征上看,云龙斑染色体核型同时具有母本的亚中部着丝粒染色体和父本的亚端部着丝粒染色体,以及共有的多数端部着丝粒染色体,体现了杂交后代云龙斑兼具2个亲本的遗传物质。在表型性状上,云龙石斑鱼表型性状如体色、花纹与母本云纹石斑鱼相似度高,而生长速度和体型与父本相似,14个表型数量性状中与母本云纹石斑鱼的相似率达到27.27%,与父本鞍带石斑鱼的相似率达到54.54%(田永胜等, 2017b),从染色体核型的分布和表型数量性状上判断,杂交后代云龙斑在遗传上近似于鞍带石斑鱼。但对云龙斑线粒体基因结构的测序及种群遗传距离分析显示,其线粒体遗传特征趋向了母体遗传(Gao et al, 2017),因此,关于杂交后代云龙斑与2个亲本之间的亲缘关系及遗传距离还需要通过其他生物学手段深入研究。
3.4 杂交后代染色体核型与杂种优势理论上杂交后代云龙斑的染色体遗传了父本和母本各1套染色体,从核型公式来看,杂交后代云龙斑染色体数量和父母本保持一致,为杂交二倍体,不是单倍体、雌核发育或雄核发育等,但核型组成并不完全按照染色体重组,杂交后代染色体不能全部在亲本中找到原型,其间发生复杂的染色体变异,可能同时存在罗伯逊易位和臂间倒位现象。刘莉等(2016)发现,珍珠龙胆(棕点石斑鱼Epinephelus fuscoguttatus♀×鞍带石斑鱼Epinephelus lanceolatus♂)与父本鞍带石斑鱼的染色体数目、核型基本一致,而与母本棕点石斑鱼的核型存在很大差异。杂交后代在进行染色体重组时,可能会使染色体的形态和大小发生变化,其中涉及大量基因的相互作用。王祖雄等(1986)发现,决定鱼类杂交不亲和的主要因素是亲本间核型的差异和核质的不同。杂交后代云龙斑具有生长速度快,适温范围广和肉质鲜美等特点,表现出优于杂交双亲的优势,通过染色体核型分析可为探讨杂交优势的形成以及种质的鉴别提供一定的遗传基础。
| Aguilar CT, Galetti PM. Chromosomal studies in South Atlantic serranids (Pisces, Perciformes). Cytobios, 1997, 89(357): 105-114 | |
| Alvarez MC, Thode G, Cano J. Somatic karyotypes of two Mediterranean teleost species: Phycis phycis (Gadidae) and Epinephelus alexandrines (Serranidae). Cytobios, 1983, 38(150): 91-95 | |
| Cai Y, Zhou YC, Xie RM, et al. A study on the karyotype, Ag-NORs and C-banding in Epinephelus bleekeri. Journal of Fisheries of China, 2012, 36(5): 647-651 [蔡岩, 周永灿, 谢瑞敏, 等. 布氏石斑鱼的染色体核型、银染和C-带. 水产学报, 2012, 36(5): 647-651] | |
| Cai Y, Zhou YC, Zhang B, et al. Chromosome karyotype analysis of E. trimaculatus Trimaculatus. Journal of Tropical Organisms, 2011, 2(2): 97-100 [蔡岩, 周永灿, 张本, 等. 海南野生三斑石斑鱼染色体核型分析. 热带生物学报, 2011, 2(2): 97-100] | |
| Ding SX, Wang SF, Wang DX, et al. Analysis of the karyotypes of Epinephelus coioides. Journal of Xiamen University (Natural Science), 2004, 43(3): 426-428 [丁少雄, 王世锋, 王德祥, 等. 斜带石斑鱼染色体核型分析. 厦门大学学报(自然科学版), 2004, 43(3): 426-428] | |
| Gao FT, Wei M, Zhu Y, et al. Characterization of the complete mitochondrial genome of the hybrid Epinephelus moara♀× Epinephelus lanceolatus♂, and phylogenetic analysis in subfamily epinephelinae. Oceanic and Coastal Sea Research, 2017, 16(3): 555-563 | |
| Guo ML. Comparative Studies of Epinephelus moara and Epinephelus bruneus. Doctoral Dissertation of Xiamen University, 2008 [郭明兰. 云纹石斑鱼与褐石斑鱼的比较研究. 厦门大学博士研究生学位论文, 2008] | |
| Guo F, Wang J, Su YQ, et al. Study on the karpyotype of Epinephelus moara. Marine Science, 2006, 30(8): 1-3 [郭丰, 王军, 苏永全, 等. 云纹石斑鱼染色体核型研究. 海洋科学, 2006, 30(8): 1-3] | |
| He YL, Ou YJ, Li JE, et al. Advance in research on artificial breeding technique of groupers. South China Fisheries Science, 2008, 4(3): 75-79 [何永亮, 区又君, 李加儿, 等. 石斑鱼人工繁育技术研究进展. 南方水产, 2008, 4(3): 75-79] | |
| Hong MX, Yang JH. Studies on the karyotype of Epinephelus awoara. Journal of Xiamen University (Natural Science), 1988, 27(6): 714-715 [洪满贤, 杨俊慧. 青石斑鱼染色体组型的研究. 厦门大学学报(自然科学版), 1988, 27(6): 714-715] | |
| Huang XL, Lu GM, Liu FYZ, et al. Mitochondrial genome characteristics and phylogenetic information of genus Epinephelus (Perciformes: Serranidae) fishes. Journal of Biology, 2013, 30(3): 9-13 [黄小林, 吕国敏, 刘付永忠, 等. 石斑鱼属鱼类线粒体基因组序列特征及系统发育信息评估. 生物学杂志, 2013, 30(3): 9-13] | |
| Levan A, Fredga K, Sandberg AA. Nomenclature for centromeric position on chromosomes. Hereditas, 1964, 52(2): 201-220 | |
| Li XQ, Peng YD. Studies on karyotype of Epinephelus Fasciatomaculatus and Eplinephelus Fasciatus. Journal of Zhanjiang Fisheries College, 1994, 14(2): 22-26 [李锡强, 彭跃东. 斑带石斑鱼和黑边石斑鱼核型的研究. 湛江水产学院学报, 1994, 14(2): 22-26] | |
| Li YJ, Qian C, Yin J, et al. The chromosome sets stability of hybrid progeny in different ploidy loach. Journal of Dalian Ocean University, 2012, 27(4): 326-332 [李雅娟, 钱聪, 印杰, 等. 不同倍性泥鳅杂交后代染色体数目组成的研究. 大连海洋大学学报, 2012, 27(4): 326-332] | |
| Liao JQ, Yin SW, Chen GH, et al. Study on the karpyotype of Epinephelus bruneus. Fisheries Science, 2006, 25(11): 567-569 DOI:10.3969/j.issn.1003-1111.2006.11.008 [廖经球, 尹绍武, 陈国华, 等. 褐点石斑鱼的核型研究. 水产科学, 2006, 25(11): 567-569] | |
| Lin HR. Progress in research on genes related to reproductive and growth regulation of grouper. China Association for Science and Technology 2003 Annual Conference Proceedings, 2003, 895-896 [林浩然. 石斑鱼生殖和生长调控相关功能基因的研究进展. 中国科协2003年学术年会论文集(下). 2003, 895-896] | |
| Liu L, Zhang Y, Chen C, et al. Preparation of chromosomes and analysis of karyotypes of hybrid F1(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂) groupers. Progress in Fishery Sciences, 2016, 37(2): 33-40 DOI:10.11758/yykxjz.20141231001 [刘莉, 张岩, 陈超, 等. 棕点石斑鱼(Epinephelus fuscoguttatus♀) ×鞍带石斑鱼(Epinephelus lanceolatus♂)F1染色体制备方法及核型分析. 渔业科学进展, 2016, 37(2): 33-40] | |
| Lou XD. Progress of fish karyotype studies in China. Journal of Fisheries of China, 1997(S1): 82-96 [楼允东. 中国鱼类染色体组型研究的进展. 水产学报, 1997(S1): 82-96] | |
| Luo M, Chen FX, Liu LL, et al. Progress in disease research of grouper aquaculture in China. Fisheries Science, 2013, 32(9): 549-554 [罗鸣, 陈傅晓, 刘龙龙, 等. 我国石斑鱼养殖疾病的研究进展. 水产科学, 2013, 32(9): 549-554] | |
| Ji HS, Zhou YC, Cai Y, et al. The karyotype and Ag-NORs of grouper Epinephelus sexfasciatus. Fisheries Science, 2011, 30(8): 463-466 [吉华松, 周永灿, 蔡岩, 等. 六带石斑鱼染色体核型和银染研究. 水产科学, 2011, 30(8): 463-466] | |
| Mao LJ, Li YJ. Karyotype Analyses of five species of marine fishes. Journal of Dalian Ocean University, 2002, 17(2): 108-113 [毛连菊, 李雅娟. 5种海水鱼类染色体的组型分析. 大连水产学院学报, 2002, 17(2): 108-113] | |
| Martínez-Rodríguez G, Thode G, álvarez MDC, et al. C-banding and Ag-NOR reveal heterogeneity among karyotypes of Serranids (Perciformes). Cytobios, 1989, 58(232): 53-60 | |
| Molina WF, Maia-Lima FA, Affonso PRAM. Divergence between karyotypical pattern and speciation events in Serranidae fish (Perciformes). Caryologia, 2002, 55(4): 299-305 DOI:10.1080/00087114.2002.10797880 | |
| Natarajan R, Subrahmanyam K. A karyotype study of some teleost from Portonovo waters. Proceedings of the Indian Academy of Sciences-Mathematical Science, 1974, 79(5): 173-196 | |
| Rodríguez-Daga R, Amores A, Thode G. Karyotype and nucleolus organizer regions in Epinephelus caninus (Pisces, Serranidae). Caryologia, 1993, 46(1): 71-76 DOI:10.1080/00087114.1993.10797248 | |
| Ruiz-Carus R. Chromosome analysis of the sexual phases of the protogynous hermaphrodites Epinephelus guttatus and Thalassoma bifasciatum (Serranidae and Labridae; Teleostei). Caribbean Journal of Science, 2002, 38(1-2): 44-51 | |
| Shao YX, Chen C, Li YL, et al. Effects of low temperature stress on serum biochemical indices of the juvenile hybrid of Epinephelus moara♀ × Epinephelus lanceolatus♂. Progress in Fishery Sciences, 2017, 38(2): 70-76 DOI:10.11758/yykxjz.20160103001 [邵彦翔, 陈超, 李炎璐, 等. 低温胁迫对云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代血清生化指标的影响. 渔业科学进展, 2017, 38(2): 70-76] | |
| Shu H, Wei QL, Luo LJ, et al. Karyotypes analysis of four grouper fishes from coastal waters of Guangdong. Guangdong Agricultural Science, 2012, 39(8): 124-127 [舒琥, 魏秋兰, 罗丽娟, 等. 广东沿海4种石斑鱼的染色体组型分析. 广东农业科学, 2012, 39(8): 124-127] | |
| Sola L, De Innocentiis S, Gornung E, et al. Cytogenetic analysis of Epinephelus marginatus (Pisces: Serranidae), with the chromosome localization of the 18S and 5S rRNA genes and of the (TTAGGG)n telomeric sequence. Marine Biology, 2000, 137(1): 47-51 DOI:10.1007/s002270000334 | |
| Tian YS, Chen ZF, Duan HM, et al. The family line establishment of the hybrid Epinephelus moara(♀)×E. lanceolatus(♂) by using cryopreserved sperm and the related genetic effect analysis. Journal of Fisheries of China, 2017a, 41(10): 1-12 [田永胜, 陈张帆, 段会敏, 等. 鞍带石斑鱼冷冻精子与云纹石斑鱼杂交家系建立及遗传效应分析. 水产学报, 2017a, 41(10): 1-12] | |
| Tian YS, Tang J, Duan HM, et al. Analysis of phenotypic quantitative traits of kelp grouper, giant grouper and hybrid progeny. Journal of Shanghai Ocean University, 2017b, 26(6): 1-10 [田永胜, 唐江, 段会敏, 等. 云纹石斑鱼、鞍带石斑鱼及杂交后代的表型数量性状分析. 上海海洋大学学报, 2017b, 26(6): 1-10] | |
| Wang DX, Su YQ, Wang SF, et al. Study on the karyotype of Promicrops lanceolarus. Journal of Oceanography in Taiwan Strait, 2003, 22(4): 465-468 [王德祥, 苏永全, 王世锋, 等. 宽额鲈染色体核型研究及制作方法的比较. 台湾海峡, 2003, 22(4): 465-468] | |
| Wang SF. Comparative karyotype characterization and chromosomal evolution of six groupers. Doctoral Dissertation of Xiamen University, 2007 [王世锋. 六种石斑鱼核型特征比较和染色体进化研究. 厦门大学博士研究生学位论文, 2007] | |
| Wang YX, Wang HD, Zhang HF, et al. Karyotypes of Epinephelus coioides and Epinephelus akaara. Journal of Zhanjiang Ocean University, 2004, 24(3): 4-8 [王云新, 王宏东, 张海发, 等. 斜带石斑鱼与赤点石斑鱼的核型研究. 湛江海洋大学学报, 2004, 24(3): 4-8] | |
| Wang XL, Zheng YS, Dai Y, et al. Studies on the karyotype of Epinephelus tauvina. Reservoir Fisheries, 2008, 28(3): 62-63 [王小丽, 郑元升, 戴云, 等. 巨石斑鱼染色体核型分析. 水利渔业, 2008, 28(3): 62-63] | |
| Wang ZX, Zhang JX, Jin GQ. Study on the incompatibility of fish hybridization. Acta Hydrobiologica Sinica, 1986, 10(2): 171-179 [王祖熊, 张锦霞, 靳光琴. 鱼类杂交不亲和性的研究. 水生生物学报, 1986, 10(2): 171-179] | |
| Wu SQ, Zheng LY, Huang ZC, et al. Embryonic and morphological development in larva, juvenile, and young stages of hybrid grouper (Epinephelus moara ♀ ×E. lanceolatus♂). Journal of Fisheries Research, 2016, 38(1): 27-35 [吴水清, 郑乐云, 黄种持, 等. 云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎发育及仔稚幼鱼形态观察. 渔业研究, 2016, 38(1): 27-35] | |
| Wu ZA. The history of life written on chromosomes. Zoological Journal, 1985(4): 49-52 [吴政安. 写在染色体上的生活史. 动物学杂志, 1985(4): 49-52] | |
| Yang K, Zhu DM, Wang WM. Studies on fin tissues cultivation, Ag-NORs and C-banding patterns of Pseudorasbora parva. South China Fisheries Science, 2013, 9(3): 20-25 [杨坤, 祝东梅, 王卫民. 麦穗鱼鳍条组织培养及染色体Ag-NORs和C-带研究. 南方水产科学, 2013, 9(3): 20-25] | |
| Zhao JL. A survey of karyotype study of marine and brackish water fish in China. Journal of Shanghai Fisheries University, 2000, 9(4): 344-347 [赵金良. 我国海水鱼和咸淡水鱼染色体组型研究概述. 上海水产大学学报, 2000, 9(4): 344-347] | |
| Zheng L, Liu CW, Li CL. Studies on the karyotype of 4 groupers. Marine Sciences, 2005, 29(4): 51-55 [郑莲, 刘楚吾, 李长玲. 4种石斑鱼染色体核型研究. 海洋科学, 2005, 29(4): 51-55] | |
| Zhong SP, Chen C, Wang J, et al. Chromosome karyotype of seven-band grouper Epinephelus septemfasciatus. Journal of Fishery Sciences of China, 2010, 17(1): 150-155 [钟声平, 陈超, 王军, 等. 七带石斑鱼染色体核型研究. 中国水产科学, 2010, 17(1): 150-155] | |
| Zou JX, Yu QX, Zhou F. The karyotypes, C-bands patterns and Ag-NORs of Epinephelus malabaricus. Journal of Fisheries of China., 2005, 29(1): 33-37 [邹记兴, 余其兴, 周菲. 点带石斑鱼的核型、C带、Ag-NORs. 水产学报, 2005, 29(1): 33-37] |



