2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 福州大学生物科学与工程学院 福州 350116
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
4. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116
L-精氨酸主要通过“精氨酸酶”途径和“NO”途径参与机体代谢过程。精氨酸酶(Arginase)催化L-精氨酸生成鸟氨酸和尿素,鸟氨酸是合成多胺类物质的前体,而多胺是重要的代谢调控物质。一氧化氮合酶(NOS)分解L-精氨酸生成瓜氨酸和一氧化氮(Munder et al, 2009)。两条途径之间相互抑制,共同调节精氨酸的代谢。病理条件下,精氨酸酶和一氧化氮合酶的动态平衡被打破,多胺、NO等产物含量发生变化,导致多种病理反应和免疫失调(孙红暖等, 2014; 王琦, 2015)。
巨噬细胞是脊椎动物先天性免疫反应和特异性免疫的主要执行者,在免疫防御和组织修复等过程中发挥重要作用。精氨酸酶是巨噬细胞极化的重要标志,在替代激活型巨噬细胞中高表达,参与机体免疫反应(Morris et al, 1998)。在炎症发生过程中,活化的巨噬细胞能够将L-精氨酸水解成L-鸟氨酸、NO和多种活性氮物质,发挥抵御病毒、细菌和肿瘤细胞等的作用(MacMicking et al, 1997)。精氨酸酶有Ⅰ和Ⅱ两种亚型,二者具有相似的结构特征和酶特性,区别在于各自的亚细胞定位、组织分布和免疫反应不同(Jenkinson et al, 1996)。目前,Arg-Ⅰ和Arg-Ⅱ基因仅在大西洋鲑鱼(Salmo salar)(Benedicenti et al, 2016)、香鱼(Plecoglossus altivelis)(丁斐斐等, 2016)、虹鳟(Oncorhynchus mykiss) (Wright et al, 2004)、鲤鱼(Cyprinus carpio L.)(Joerink, 2006)等少数硬骨鱼中被克隆和鉴定出来,推测精氨酸酶在鱼类抗菌免疫应答中发挥重要作用。刘华等(2016)在牙鲆(Paralichthys olivaceus)中克隆得到了284 bp的中间片段,并对其二级结构进行了初步分析,但没有分析其与免疫的相关性。
牙鲆俗称牙片、偏口等,是中国重要的海水养殖鱼类之一(雷霁霖, 2011),因其具有极好的营养价值与经济价值而受到大家的喜爱。但由于过度捕捞,野生牙鲆数量锐减。同时,工厂化养殖近亲繁殖严重,使得种质资源严重退化。传染病造成的牙鲆大面积死亡现象时有发生,给养殖场造成了巨大的损失(雷霁霖, 2011; 莫照兰等, 2003)。从鱼类自身的免疫调控入手,对其抗菌感染的分子机制进行深入研究,挖掘抗病相关基因显得尤为重要(陈松林等, 2016)。本研究对精氨酸酶Ⅱ(ArginaseⅡ, Arg-Ⅱ)进行了全长克隆分析,检测了Arg-Ⅱ基因在正常组织和迟缓爱德华氏菌(Edwardsiella tarda)感染后的不同组织和巨噬细胞中的表达水平,为研究Arg-Ⅱ在鱼类免疫分子机制中的作用奠定基础。
1 材料与方法 1.1 材料实验用牙鲆为健康2龄牙鲆,取自山东黄海水产有限公司,感染所用迟缓爱德华氏菌由本实验室保存。RNAiso试剂、反转录试剂盒、Ex Taq DNA聚合酶、dNTPs和SYBR Premix Ex Taq试剂盒均购自TaKaRa公司(日本)。引物合成及序列测定由睿博兴科生物有限公司(北京)完成。
1.2 方法 1.2.1 组织样品的采集随机选取9尾2龄牙鲆,分别取肠、脾、鳃、心、皮肤、脑、肌肉、肝脏、肾脏等组织,立即投到液氮中保存,随后转移到–70℃冰箱保存。参考郑卫卫等(2016)的方法,取6个月牙鲆用于迟缓爱德华氏菌感染实验,实验组按照半致死浓度LD50为2.63×104 CFU/ml的剂量进行腹腔注射,对照组注射等量PBS溶液,分别在注射后0、6、12、24、48 h共5个时间点取样,每个时间点3个样本,分别取肾脏、鳃、脾脏和肝脏组织。体外培养巨噬细胞感染实验参考孙璐明等(2016)的方法,实验组按照感染复数20:1接种到吞噬细胞中,对照组加入等量PBS溶液,在感染后0、4、8、12、24 h共5个时间点取样,每个时间点3个重复。
1.2.2 牙鲆Arg-Ⅱ的克隆及序列分析通过生物信息学方法在牙鲆基因组及转录组数据库(Shao et al, 2016)中筛选Arg-Ⅱ基因信息,用Primer 5.0软件设计特异性引物,通过PCR扩增中间序列,扩增程序:95℃预变性5 min;95℃变性10 s,60℃退火20 s,72℃延伸30 s,30个循环;72℃延伸5 min。测序验证序列的准确性。根据中间序列设计5-RACE扩增引物Arg-Ⅱ-5'N、Arg-Ⅱ-5'R和3-RACE扩增引物Arg-Ⅱ-3'R、Arg-Ⅱ-3'N (表 1),通过TaKaRa RACE扩增试剂盒说明书进行扩增,获得5'UTR和3'UTR区域序列,测序验证序列的准确性。序列分析使用DNAstar软件和NCBI-CDD search网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/)。
|
|
表 1 本研究用到的引物 Table 1 Primers used in this study |
参考位战飞等(2016)的方法,利用荧光定量PCR技术检测Arg-Ⅱ基因在各个组织中的表达情况。对采集的正常牙鲆组织样品分别进行总RNA抽提和反转录。以β-actin为内参,采取三步法进行PCR扩增:95℃预变性15 min;95℃变性10 s,60℃退火20 s,最后72℃延伸30 s,同时采集荧光信号,共40个循环,之后加入熔解曲线程序。利用相对标准曲线法2–ΔΔCT对定量结果进行计算,分析Arg-Ⅱ基因在各个组织的相对表达量。
1.2.4 迟缓爱德华氏菌感染对牙鲆免疫组织以及巨噬细胞Arg-Ⅱ mRNA表达的影响对迟缓爱德华氏菌感染牙鲆的肝、脾、肾、鳃等免疫组织和体外培养的巨噬细胞,分别进行总RNA抽提和反转录。采用实时荧光定量PCR技术检测Arg-Ⅱ mRNA的表达变化,方法同1.2.3。
1.3 数据分析实验结果用平均值±标准差(Mean±SD)表示,采用SPSS 19.0.0软件进行单因素方差分析(One-way ANOVA)进行统计,P < 0.05为差异显著。
2 结果 2.1 牙鲆Arg-Ⅱ基因的序列分析依据基因组和转录组序列设计特异引物,PCR扩增及测序显示,牙鲆Arg-Ⅱ基因由1882个核苷酸组成,包含一个1050 bp的开放阅读框,编码349个氨基酸。分子量预测为38.02 kDa,等电点为6.42。通过5'RACE和3'RACE向两端扩增,获得5'UTR长度为150 bp,3'UTR长度为708 bp。保守结构域预测牙鲆Arg-Ⅱ基因编码的氨基酸具有典型的Arginase结构特征,在氨基酸的第22、26、104、108、153、333、349位存在7个糖基化位点(图 1)。氨基酸的多重比对结果显示,牙鲆Arg-Ⅱ N端比ArgⅠ多120个氨基酸,C端相似性较高,推测二者具有不同的功能。牙鲆Arg-Ⅱ与其他生物Arg-Ⅱ具有多个保守氨基酸区段(图 2)。进化树分析显示,牙鲆与其他物种的Arg-Ⅱ氨基酸序列聚为一簇,相似性为58%~93%。其中,和鲈鱼(Lates calcarifer)Arg-Ⅱ基因的同源性最高,为93%。与两栖动物、鸟类及哺乳动物的Arg-Ⅱ的氨基酸序列的同源性不高,仅为58%~69%。牙鲆ArgⅠ与大鼠(Rattus norvegicus)和小鼠(Mus musculus)的ArgⅠ聚为一簇(图 3)。

|
图 1 牙鲆Arg-Ⅱ cDNA序列及推导的氨基酸序列 Figure 1 The Arg-Ⅱ cDNA sequence and deduced amino acids in P. olivaceus 小写字母代表 5'和3'端非编码区;大写字母代表编码区序列,上面为核苷酸序列,下面对应为氨基酸序列;起始密码子ATG、终止密码子TGA、polyA尾均加下划线;红色大写字母代表磷酸化修饰位点; Lowercase letters represent the sequence of 5' and 3' unstranslated region, capital letters represent the coding sequence. The nucleotide sequence is above and the coded amino sequence is below. The initiation codon ATG, the stop codon TGA, and the polyadenylation are underlined; Red capitals represent phosphorylation sites |

|
图 2 牙鲆与其他物种Arg-Ⅱ和Arg-Ⅰ氨基酸序列多重比对 Figure 2 Multiple alignment of Arg-Ⅱ and Arg-Ⅰ amino acid sequence between P. olivaceus and other species XP_019962845 Paralichthys olivaceus Arg-Ⅱ, XP_019965324 Paralichthys olivaceus Arg-Ⅰ, XP_018537157 Lates calcarifer Arg-Ⅱ, XP_010754895 Larimichthys crocea Arg-Ⅱ, XP_003445522 Oreochromis niloticus Arg-Ⅱ, XP_008311803 Cynoglossus semilaevis Arg-Ⅱ, XP_004082141 Oryzias latipes Arg-Ⅱ, XP_021441146 Oncorhynchus mykiss Arg-Ⅱ, AMJ39609 Plecoglossus altivelis Arg-Ⅱ, NP_955905 Danio rerio Arg-Ⅱ, CAI38847 Cyprinus carpio Arg-ⅡA, CAF02014 Cyprinus carpio Arg-ⅡB, CAI38846 Cyprinus carpio Arg-ⅡC, NP_001079511 Xenopus laevis Arg-Ⅱ, NP_001186633 Gallus gallus Arg-Ⅱ, DAA25083 Bos Taurus Arg-Ⅱ, NP_001163 Homo sapiens Arg-Ⅱ, AAA98611 Mus musculus Arg-Ⅰ, AAA40760 Rattus norvegicuss Arg-Ⅰ |

|
图 3 基于Neighbor-Joining法构建牙鲆及其他物种Arg-Ⅱ及Arg-Ⅰ氨基酸序列的系统进化树 Figure 3 Phylogenetic tree of Arg-Ⅱ and Arg-Ⅰ amino acid sequence of P. olivaceus and other species based on neighbor-joining |
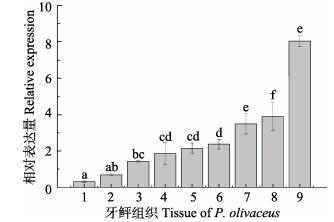
取健康牙鲆的肝、脾、肾、脑、鳃和肠组织进行qRT-PCR检测。牙鲆Arg-Ⅱ基因扩增产物的大小为111 bp,内参β-actin基因扩增产物大小为92 bp。结果显示(图 4),健康牙鲆Arg-Ⅱ mRNA主要在肝、肾、肠中高表达,其次是鳃、心、脑,在其他组织中微弱表达。
|
图 4 牙鲆Arg-Ⅱ mRNA的组织表达
Figure 4 The tissue expression of Arg-Ⅱ mRNA in P. olivaceus
1:肌肉; 2:皮肤; 3:脾脏; 4:心脏; 5:脑; 6:鳃; 7:肠; 8:肾脏; 9:肝脏。上标字母为SPSS软件中Duncan算法计算出的子集分组 The letters above the columns were subsets by Duncan algorithm. 1: Muscle; 2: Skin; 3: Spleen; 4: Heart; 5: Brain; 6: Gill; 7: Intestine; 8: Kidney; 9: Liver |
根据Arg-Ⅱ在健康牙鲆组织中的表达特征,选取迟缓爱德华氏菌感染牙鲆的肝、肾、鳃、脾组织、体外培养巨噬细胞,进行qRT-PCR检测。图 5显示,在牙鲆的肾组织中Arg-Ⅱ mRNA的相对表达量在感染后6 h开始增加,12 h时显著高于对照组,为对照组的1.98倍,24 h略有下降,48 h基本降至对照组;在鳃组织中,6 h和12 h时显著高于对照组,分别为对照组的1.53倍和2.1倍;在脾组织中,在6 h开始增加,12 h和24 h显著高于对照组,12 h时为对照组的5.23倍,48 h与对照组无显著差异;肝组织中,Arg-Ⅱ的表达量在6 h时显著增加,为对照组的3.8倍,12 h时略有下降,24 h时恢复至对照组水平;巨噬细胞中,4 h开始增加,8 h时达到最大,为对照组的6.1倍,24 h后恢复到对照组水平。

|
图 5 迟缓爱德华氏菌感染对牙鲆重要组织及细胞的Arg-Ⅱ mRNA表达的影响 Figure 5 mRNA expressions of Arg-Ⅱ in differernt tissues of P. olivaceus infected with E. tarda A:肾; B:鳃; C:脾脏; D:肝脏: E:吞噬细胞。感染组与对照组之间的差异显著性(*: P < 0.05; **: P < 0.01) A: Kidney; B: Gill; C: Spleen; D: Liver: E: Phagocytes. Difference between the treatment and control group (*: P < 0.05; **: P < 0.01) |
本研究通过牙鲆转录组测序数据设计Arg-Ⅱ基因的特异性引物,获得全长cDNA序列。刘华等(2016)克隆得到的精氨酸酶片段为本研究克隆得到的精氨酸酶Ⅱ序列全长的一部分。通过多重序列比对可知,牙鲆与哺乳动物的Arg-Ⅱ基因有更多的相似性,而Arg-Ⅱ是线粒体蛋白,需要N-末端线粒体靶向肽进入线粒体基质(Korte et al, 1997; Todgham et al, 2001)。作者推测,Arg-Ⅱ发挥免疫作用的主要信号通路可能有两条:在甘氨酸鸟氨酸循环信号通路中,精氨酸可以在Arg-Ⅱ的作用下分解成尿素和鸟氨酸,鸟氨酸有利于细胞再生以及伤口的愈合,同时,鸟氨酸是合成多胺类物质的前体,多胺在生物学调控中发挥着巨大作用,调控巨噬细胞的功能(Kepkalenhart et al, 2001)。在精氨酸循环信号通路中,iNOS可以长时间产生大量的NO,而过量的NO生成会引起肠黏膜和肠屏障功能损伤,对胃肠道的运动也有不利影响;同时,精氨酸由于NO的释放不平衡也会造成全身炎症反应的加剧,在免疫反应中,来源于精氨酸的NO起了主导作用。而Arg-Ⅱ与一氧化氮合酶(NOS)竞争L-精氨酸,调节机体免疫功能(Corraliza et al, 1995; 朱琳楠等, 2010; 陶璇, 2012)。
巨噬细胞作为先天免疫系统的重要组成部分,分泌一系列促炎症因子,M2型巨噬细胞分泌的精氨酸酶可以与iNOS竞争性地结合底物精氨酸,分解精氨酸为多胺,促进细胞分裂和胶原的形成,对炎症后期由病原微生物造成的组织损伤进行修复和重塑,在机体抵御细胞内病原体的感染中起到重要作用(Mantovani et al, 2002; Gordon et al, 2003)。已有研究显示,精氨酸酶I具有免疫抑制功能,特别是对T淋巴细胞功能的抑制,但对Arg-Ⅱ的研究还鲜有报道(Ckless et al, 2008; 张乃春等, 2015)。本研究中,Arg-Ⅱ在迟缓爱德华氏菌感染巨噬细胞后显著上调,推测与上述2条免疫通路有关,通过上调Arg-Ⅱ基因的表达来增强机体免疫能力。
组织分布表明,Arg-Ⅱ在各个组织中都有表达,尤其是在肝脏等组织中表达最高,这与鲤鱼、虹鳟中的研究结果较一致(Wright et al, 2004; Joerink et al, 2006)。Marathe等(2006)研究表明,Arg-Ⅱ直接调控肝受体X(LRX),而LRX能抑制iNOS在巨噬细胞中的表达,提高免疫效果。与哺乳动物相比,鱼类的Arg-Ⅱ基因免疫方面的研究相对较少,在已有的研究中,揭示了Arg-Ⅱ基因可能与鱼类免疫有关。在鳗弧菌(Vibrio anguillarum)感染的香鱼中,香鱼肝组织中Arg-Ⅱ基因4 h之后开始增加,8 h之后为对照组的5.2倍(Benedicenti et al, 2016)。在阿米巴变形虫感染的大马哈鱼(Oncorhynchus keta)组织中,脾脏的表达量为对照组的2.75倍(Morris et al, 1998)。本研究中,迟缓爱德华氏菌注射牙鲆,免疫相关组织(如肝脏、肾脏等)中Arg-Ⅱ mRNA的表达量明显上调,与上述研究结果一致。同时,肾、鳃等免疫组织以及巨噬细胞中Arg-Ⅱ mRNA的表达量也明显上调,揭示了Arg-Ⅱ可能与牙鲆免疫应答密切相关,可能通过巨噬细胞发挥作用,但具体作用机制有待进一步深究。
4 结论牙鲆Arg-Ⅱ基因cDNA序列与鲈鱼Arg-Ⅱ序列最相似。健康牙鲆中,Arg-Ⅱ基因主要在肝、肾、肠中表达;迟缓爱德华氏菌感染后,Arg-Ⅱ基因表达量显著上调,揭示了Arg-Ⅱ与牙鲆抗病原感染的免疫反应密切相关。
| Benedicenti O, Wang T, Wangkahart E, et al. Characterisation of arginase, paralogues in salmonids and their modulation by immune stimulation/infection. Fish & Shellfish Immunology, 2016, 61: 138-151 | |
| Chen SL, Shao CW, Xu P. Development strategy for fisheries biotechnology. China Engineering Science, 2016, 18(3): 49-56 [陈松林, 邵长伟, 徐鹏. 水产生物技术发展战略研究. 中国工程科学, 2016, 18(3): 49-56] | |
| Ckless K, Lampert A, Reiss J, et al. Inhibition of arginase activity enhances inflammation in mice with allergic airway disease, in association with increases in protein S-nitrosylation and tyrosine nitration. Journal of Immunology, 2008, 181(6): 4255-4264 DOI:10.4049/jimmunol.181.6.4255 | |
| Corraliza IM, Soler G, Eichmann K, et al. Arginase induction by suppressors of nitric oxide synthesis (IL-4, IL-10 and PGE2) in murine bone-marrow-derived macrophages. Biochemical & Biophysical Research Communications, 1995, 206(2): 667-673 | |
| Ding FF, Li CH, Chen J, et al. cDNA cloning of arginase Ⅱ Gene in Ayu (Plecoglossus altivelis) and the correlation between its expression and Vibrio anguillarum infection. Biotechnology Bulletin, 2016, 32(2): 109-115 [丁斐斐, 李长红, 陈炯, 等. 香鱼精氨酸酶Ⅱ基因的cDNA克隆及其表达与鳗弧菌感染的相关性. 生物技术通报, 2016, 32(2): 109-115] | |
| Gordon S. Alternative activation of macrophages. Nature Reviews Immunology, 2003, 3(1): 23 DOI:10.1038/nri978 | |
| Jenkinson CP, Grody WW, Cederbaum SD. Comparative properties of arginases. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1996, 114(1): 107-132 DOI:10.1016/0305-0491(95)02138-8 | |
| Joerink M, Savelkoul HF, Wiegertjes GF. Evolutionary conservation of alternative activation of macrophages: Structural and functional characterization of arginase 1 and 2 in carp (Cyprinus carpio L.). Molecular Immunology, 2006, 43(8): 1116-1128 DOI:10.1016/j.molimm.2005.07.022 | |
| Kepkalenhart D, Mistry SK, Wu G, et al. Arginase I: A limiting factor for nitric oxide and polyamine synthesis by activated macrophages?. American Journal of Physiology, Regulatory Integrative & Comparative Physiology, 2001, 279(6): R2237-2242 | |
| Korte JJ, Salo WL, Cabrera VM, et al. Expression of carbamoyl-phosphate synthetase Ⅲ mRNA during the early stages of development and in muscle of adult rainbow trout (Oncorhynchus mykiss). Journal of Biological Chemistry, 1997, 272(10): 6270-6277 DOI:10.1074/jbc.272.10.6270 | |
| Lei JL. Theory and technology of marine fish culture. Beijing: China Agriculture Press, 2011: 482-483. [雷霁霖. 海水鱼类养殖理论与技术. 北京: 中国农业出版社, 2011: 482-483.] | |
| Liu H, Shi TT, Shi ZY. Cloning and sequencing of gene fragments of Paralichthys olivaceus arginase. Guangdong Agricultural Sciences, 2016, 43(12): 108-114 [刘华, 施婷婷, 施志仪. 牙鲆精氨酸酶基因片段的克隆及序列分析. 广东农业科学, 2016, 43(12): 108-114] | |
| MacMicking J, Xie QW, Nathan C. Nitric oxide and macrophage function. Annual Review of Immunology, 1997, 15: 323-350 DOI:10.1146/annurev.immunol.15.1.323 | |
| Mantovani, Alberto, Sozzani, et al. Macrophage polarization: Tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends in Immunology, 2002, 23(11): 549-555 DOI:10.1016/S1471-4906(02)02302-5 | |
| Marathe C, Bradley MN, Hong C, et al. The arginase Ⅱ gene is an anti-inflammatory target of liver X receptor in macrophages. Journal of Biological Chemistry, 2006, 281(43): 32197-32206 DOI:10.1074/jbc.M605237200 | |
| Mo ZL, Mao YX, Chen SY, et al. Identification and phylogenetic analysis of one pathogenic bacterium associated with swollen abdomen of cultured flounder (Paralichthys olivaceus) larvae. Oceanologia et Limnologia Sinica, 2003, 34(2): 131-141 DOI:10.11693/hyhz200302002002 [莫照兰, 茅云翔, 陈师勇, 等. 养殖牙鲆鱼苗腹水症病原菌的鉴定及系统发育学分析. 海洋与湖沼, 2003, 34(2): 131-141] | |
| Morris JS, Kepkalenhart D, Chen LC. Differential regulation of arginases and inducible nitric oxide synthase in murine macrophage cells. American Journal of Physiology, 1998, 275(1): 740-747 | |
| Munder M. Arginase: An emerging key player in the mammalian immune system. British Journal of Pharmacology, 2009, 158(3): 638-651 DOI:10.1111/j.1476-5381.2009.00291.x | |
| Shao CW, Bao BL, Xie ZY, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry. Nature Genetics, 2017, 49(1): 119-124 DOI:10.1038/ng.3732 | |
| Sun HN, Yang HM, Wang ZY, et al. Nutrition physiological and immune functions of arginine in animals. Chinese Journal of Animal Nutrition, 2014, 26(1): 54-62 [孙红暖, 杨海明, 王志跃, 等. 精氨酸对动物的营养生理及免疫作用. 动物营养学报, 2014, 26(1): 54-62] | |
| Sun LM, Yu MJ, Chen YD, et al. Half smooth tongue sole AKT-ineracting protein immune cloning and gene expression analysis. Acta Hydrobiologica Sinica, 2016, 40(3): 467-473 DOI:10.7541/2016.62 [孙璐明, 于孟君, 陈亚东, 等. 半滑舌鳎AKT-ineracting protein基因的克隆及免疫应答表达分析. 水生生物学报, 2016, 40(3): 467-473] | |
| Tao X. Study on the expression and correlation of arginine I and inducible nitric oxide synthase in hepatocellular carcinoma. Masterxs Thesis of Fujian Medical University, 2012 [陶璇. 精氨酸酶Ⅰ和诱导型一氧化氮合成酶在肝细胞癌中的表达及其相关性研究. 福建医科大学硕士研究生学位论文, 2012] http://cdmd.cnki.com.cn/Article/CDMD-10392-1012038056.htm | |
| Todgham AE, Anderson PM, Wright PA. Effects of exercise on nitrogen excretion, carbamoyl phosphate synthetase Ⅲ activity and related urea cycle enzymes in muscle and liver tissues of juvenile rainbow trout (Oncorhynchus mykiss). Comparative Biochemistry & Physiology Part A: Molecular & Integrative Physiology, 2001, 129(2-3): 527-539 | |
| Wang Q. Changed expression of arginase Ⅰ in the brain of UT-B null mice accompanied by inflammatory reactions. Masterxs Thesis of Medical University of Chongqing, 2015, 38-42 [王琦. UT-B基因敲除小鼠脑中精氨酸酶Ⅰ的表达变化及炎症反应的发生. 重庆医科大学硕士研究生学位论文, 2015, 38-42] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D791601 | |
| Wei ZF, Guo H, Li HL, et al. Cloning and immunologic function analysis of CD40 from half-smooth tongue sole (Cynoglossus semilaevis). Journal of Fishery Sciences of China, 2016, 23(5): 1063-1072 [位战飞, 郭华, 李海龙, 等. 半滑舌鳎CD40基因克隆及其免疫功能分析. 中国水产科学, 2016, 23(5): 1063-1072] | |
| Wright PA, Campbell A, Morgan RL, et al. Dogmas and controversies in the handling of nitrogenous wastes: Expression of arginase Type Ⅰ and Ⅱ genes in rainbow trout: Influence of fasting on liver enzyme activity and mRNA levels in juveniles. Journal of Experimental Biology, 2004, 207(12): 2033-2042 DOI:10.1242/jeb.00958 | |
| Zhang NC, Huang L, Wang SS, et al. Expression of arginase I in peripheral superficial lymph node of HIV-infected individuals. Chinese Journal of Experimental and Clinical Virology, 2015, 29(1): 44-46 [张乃春, 黄磊, 王松山, 等. 精氨酸酶Ⅰ在HIV感染者外周浅表淋巴结中表达的研究. 中华实验和临床病毒学杂志, 2015, 29(1): 44-46] | |
| Zheng WW, Chen SL, Li ZY, et al. Analyzing of heritability and breeding value of disease resistance for Edwardsiella tarda in Japanese flounder (Paralichthys olivaceus). Journal of Agricultural Biotechnology, 2016, 24(8): 1181-1189 [郑卫卫, 陈松林, 李泽宇, 等. 牙鲆抗迟缓爱德华氏菌性状的遗传力和育种值分析. 农业生物技术学报, 2016, 24(8): 1181-1189] | |
| Zhu LN, Hou YZ, Zhao Y. Molecular expression regulation of arginine I and inducible nitric oxide synthase in macrophages. Chinese Journal of Immunology, 2010, 26(8): 748-753 [朱琳楠, 侯玉柱, 赵勇. 精氨酸酶Ⅰ及诱生性一氧化氮合酶在巨噬细胞中的分子表达调控. 中国免疫学杂志, 2010, 26(8): 748-753] |



