先天免疫系统是生物体抵抗病原微生物侵害的第一道防线,它通过模式识别受体(Pattern recognition receptor, PRR)识别多种病原相关分子模式(Pathogen associated molecule pattern, PAMP)并传递信号启动免疫防御反应(Janeway, 2002)。NLRs(NOD样受体家族)是一类重要的PRR,主要识别细胞浆内的PAMP (Inohara, 2003; Franchi et al, 2009)。NOD2(又称作CARD15)基因是NLR受体家族重要的成员之一,NOD2蛋白具有3个结构域:N端有2个连续的CARD结构域,C端是LRR结构域,中间是保守性最强的NOD结构域(Imagawa et al, 1991)。
在哺乳动物中,NOD2被证实能够特异识别肽聚糖(PGN)的降解产物胞壁酰二肽(MDP) (Girardin et al, 2003),在识别到配体MDP的基础上,NOD2利用CARD-CARD相互作用招募RIP2(Bertin et al, 1999; Ogura et al, 2001),通过一系列酶联反应激活NF-κb和MAPK信号通路,包括p38、ERK(Extracellular signal-regulated protein kinase)和JNK(c-Jun N-terminal kinase)信号通路等(McCarthy et al, 1998; Navas et al, 1999; Takeda et al, 2001)。在部分硬骨鱼类中,NOD2基因已被克隆并进行功能探究,比如斑马鱼(Danio rerio)(Maharana et al, 2015)、印度鲮鱼(Cirrhinus mrigala) (Swain et al, 2013)、虹鳟(Oncorhynchus mykiss)(Chang et al, 2011)等,生物信息学分析证明,NOD2在硬骨鱼中保守性很高。在斑马鱼中,NOD2的基因沉默会削弱斑马鱼幼鱼抵抗病原微生物侵染和控制全身感染的能力(Zou et al, 2016)。在虹鳟中,过表达NOD2有效结构域的表达基因,能够诱导IL-1β等促炎症细胞因子的产生,并且增强IFN-β等抗病毒因子的表达(Chang et al, 2011)。Zou等(2016)对斑马鱼NOD2的结构域进行了详细研究,发现CARD和NACHT结构域是NOD2激活NF-κb信号通路的结构基础,而具备LRR和NACHT结构域时,NOD2对IFN具有激活活性。总之,鱼类NOD2广泛参与抗菌、抗病毒的炎症反应,其反应机制有待进一步探究。
牙鲆(Paralichthys olivaceus)是我国重要的海水养殖鱼类,随着养殖规模的扩大,其病害防御问题也引起关注。迟缓爱德华氏菌(Edwardsiella tarda)是一类人畜共患菌,能够侵害各种脊椎动物,包括从低等的鱼类到高等哺乳类(Okuda et al, 2006)。作为胞内菌,迟缓爱德华氏菌侵染生物机体后,会在细胞内发生内化并大量繁殖。因为有细胞膜的保护,胞内的迟缓爱德华氏菌会避开体液中溶菌酶的溶解作用以及吞噬细胞的吞噬作用等,引起鱼类出现皮肤损伤、肠道积水、多种内脏器官的脓肿出血等,并产生严重的消化道炎症反应,最终导致鱼体死亡(Srinivasa Rao et al, 2001)。在以往报道中,迟缓爱德华氏菌会使牙鲆、大菱鲆(Scophthalmus maximus)等鲆鲽鱼类产生严重病害,出现大量致死的病例(Ling et al, 2000; Castro et al, 2006; Mohanty et al, 2007)。因此,本研究进行了迟缓爱德华氏菌牙鲆体内攻毒以及牙鲆鳃细胞系的迟缓爱德华氏菌免疫刺激实验,从体内和体外两方面对PoNOD2进行表达和功能分析,探究PoNOD2在抗病原菌侵染方面的作用,将为牙鲆的抗病原菌侵染机理提供理论基础,为牙鲆的抗病育种提供一定的参考。
1 材料与方法 1.1 材料 1.1.1 牙鲆本实验所用牙鲆体长为20~22 cm,来源于山东省黄海水产有限公司,实验前,置于充气海水中,22℃暂养7 d。实验期间,所有实验材料均按照中国海洋大学动物管理与使用委员会(OUC-IACUC)相关规定进行处理和使用。
1.1.2 牙鲆鳃细胞系(FG9307)牙鲆鳃细胞系(FG9307)来源于中国海洋大学细胞工程技术实验室。该细胞用DMEM培养基培养,加入10% (v/v) FBS (Fetal bovine serum), 1% (v/v) NEAA,和100 U/ml Penicillin,24℃培养。
1.1.3 迟缓爱德华氏菌实验所用迟缓爱德华氏菌菌株来自于中国海洋大学海洋微生物研究中心。将该菌株划线接种于LB固体培养基中,28℃活化培养12 h。活化后将单克隆菌落接种于LB液体培养基中,28℃摇晃培养12 h。用PBS缓冲液稀释使其终浓度为107 CFU/ml。
1.2 方法 1.2.1 获得PoNOD2核心片段序列在NCBI和Ensembl两个数据库搜取可获得的硬骨鱼NOD2同源序列,包括斑马鱼NOD2和青鳉(Oryzias latipes) NOD2。将2条序列与实验室已建转录组数据库进行同源比对,得到PoNOD2基因的cDNA序列,根据比对结果设计扩增PoNOD2 ORF序列的特异性引物NOD2-ORF-FW/RV(表 1),利用PCR技术克隆验证。
|
|
表 1 实验所用引物 Table 1 Primers used in the study |
利用SMART预测PoNOD2的蛋白结构域,同时利用DNAman对PoNOD2的氨基酸和核酸进行序列比对。通过NCBI和Ensembl两个数据库得到尼罗罗非鱼(Oreochromis niloticus)、斑马鱼、家犬(Canislupus familiaris)、老鼠(Mus musculus)和人(Homo sapiens)NOD2的氨基酸序列,利用MEGALIGN和DNASTAR对牙鲆与上述5个物种的氨基酸序列进行分析,观察NOD2蛋白结构域在各个物种间的保守性。为了探究NOD2在硬骨鱼与其他脊椎动物之间的进化关系,从NCBI和Ensembl中获得多个物种NOD2的氨基酸序列(表 2),利用邻位相连法(Neighbor-Joining)对NOD2蛋白进行系统进化分析,利用MEGA 6构建进化树。
|
|
表 2 实验所用NOD2基因编号 Table 2 NOD2 sequences used in the study |
本实验所用组织表达分析的定量cDNA模板是3条雌鱼和3条雄鱼的混合模板,每条鱼都经过麻醉后解剖,取心、肝、脾、肾、脑、鳃、肌、肠8个组织。
1.2.4 牙鲆p-EGFP-NOD2质粒构建为了深入探究PoNOD2基因的功能,在PoNOD2基因的ORF两端,即ATG处和TAG处分别利用引物NOD2-Fw2和NOD2-Rv2设计XhoⅠ和KpnⅠ酶切位点。通过双酶切得到PoNOD2的ORF克隆片段,连接到p-EGFP-C1质粒中,得到p-EGFP-NOD2重组质粒。
1.2.5 迟缓爱德华氏菌刺激实验取224条生长状态良好的牙鲆,分为空白对照组(4条)、对照组(130条)和实验组(90条)。空白对照组牙鲆不做处理,对照组牙鲆腹腔注射1 ml PBS,实验组腹腔注射1 ml浓度为107 CFU/ml的迟缓爱德华氏菌菌液。随后将注射组和对照组分开暂养,在刺激1、3、5、8、12、24、48、72、96和110 h时取样。每个时间点,空白对照组(1 h时取)、对照组和实验组分别取4条鱼,经麻醉后解剖,取鳃、肾和脾。组织存于液氮中,-80℃保存待用。
1.2.6 免疫刺激实验将状态良好、单层培养的牙鲆鳃细胞系接板到12孔板,待24 h后细胞覆盖度达到90%~95%,汇集成单层。向每个孔中加入PGN,Poly Ⅰ:C和迟缓爱德华氏菌菌液,使终浓度分别为50 μg/ml、50 μg/ml和5×106 CFU/ml。对照组加入相同浓度的PBS。分别在刺激后0、1、2、4、8和12 h时,收集细胞样品,存于Trizol中待用。
1.2.7 细胞转染将状态良好的牙鲆鳃细胞系接板到12孔板,待细胞覆盖度达到90%左右。吸走培养基,PBS清洗2遍后,换上新鲜DMEM培养基,用Lipofectamine™ 3000进行p-EGFP-PoNOD2的质粒转染,操作步骤严格按照说明书。对照组转染p-EGFP-C1质粒。转染48 h后,将实验组和对照组细胞分别用PBS清洗3次,4% PFA固定10 min,PBS再清洗3次。在每孔中加入DAPI染液,使作用浓度为10 μg/ml,10 min后用PBS清洗3次,激光共聚焦显微镜(Nikon A1R)下观察拍照。
1.2.8 抗菌检测实验将转染p-EGFP-NOD2质粒24 h以后的牙鲆鳃细胞,用800 μg/ml的G418进行阳性细胞筛选,得到PoNOD2过表达鳃细胞。对照组转染p-EGFP-C1质粒。用迟缓爱德华氏菌对鳃细胞进行侵染,菌落数与细胞比例(MOI)为10:1。在侵染4 h以后,迟缓爱德华氏菌侵染到胞内,用新鲜培养基缓缓清洗细胞3次,尽量洗净胞外细菌。之后用含有200 μg/ml庆大霉素的DMEM培养基继续培养细胞2 h,胞外未侵染进细胞的迟缓爱德华氏菌已被杀死。用新鲜培养基清洗细胞3次,换上正常DMEM继续培养细胞15 h,此时,胞内的迟缓爱德华氏菌会在细胞内正常生存、繁殖。此后,用正常培养基继续培养,在6 h和15 h,分别用胰酶消化细胞,EP管收集离心,取沉淀。PBS清洗沉淀3次后,用1% Triton X-100裂解细胞10 min,梯度稀释细胞裂解液,涂LB固体培养基板,计数。
1.2.9 免疫调节检测实验将转染p-EGFP-NOD2质粒48 h以后的牙鲆鳃细胞,用50 μg/ml的PGN进行刺激,对照组用PBS处理。在刺激24 h以后,收集细胞样品,提取RNA,用qRT-PCR检测IL-1β、IL-6和IL-8的表达变化情况。
1.2.10 实时荧光定量PCR(qRT-PCR)根据PoNOD2 cDNA序列设计qRT-PCR引物,选用β-actin作为内参基因。运用Light Cycler 480进行qRT-PCR扩增,反应条件:95℃,2 min;95℃,15 s,60℃,45 s,40个循环。实验中每个待测样品均设置3次重复,保证准确性。实验得到的数据采用2-ΔΔCt法处理数据,经计算得到PoNOD2的相对表达量。数据以变化倍数呈现,代表实验组与对照组之间相对表达量的比值。所有定量引物序列均在表 1中列出。
1.2.11 数据分析本实验所涉及数据差异性分析,均利用SPSS 20.0软件,使用单因素方差分析(One-way ANOVA)进行比较。所有数据以平均值±标准误(Mean±SE)(n=3)表示,各个组之间的差异性用*表示(*P < 0.05; **P < 0.01)。
2 结果 2.1 PoNOD2的ORF序列扩增以牙鲆混合组织为模板,扩增得到PoNOD2基因的ORF序列,与牙鲆转录组数据库中牙鲆NOD2 ORF序列完全一致。PoNOD2的ORF长为2964 bp,编码988个氨基酸。通过在线蛋白结构预测软件SMART分析发现,PoNOD2的蛋白结构域与其他脊椎动物一样,包含3个典型结构域:CARD、NACHT和LRR(图 1)。利用DNAman对PoNOD2核酸序列与氨基酸序列比对分析(图 1),结果显示,PoNOD2的N端的2个不连续CARD结构域,其位置分别在1~93 bp、107~198 bp;中间是NACHT结构域,其位置在259~444 bp;C端的多个LRR结构域,其位置在737~979 bp。
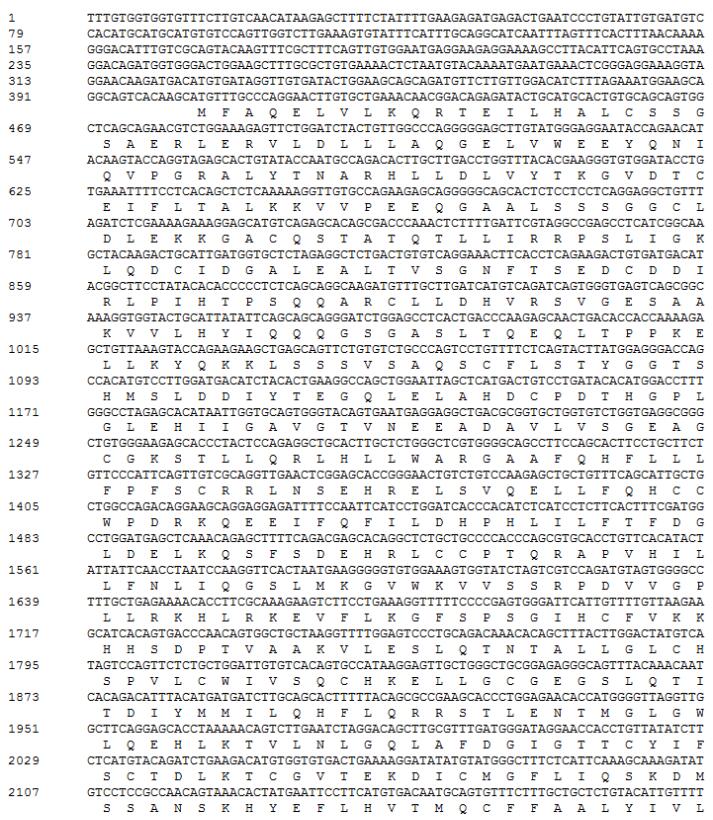
|
图 1 PoNOD2基因的核苷酸序列与氨基酸序列对应图 Figure 1 The nucleotide and deduced amino acid sequences of PoNOD2 CARD、NACHT、LRR结构域均用方框圈出,各结构域名称在图片左侧标注 All structure domain amino acid residues are marked by boxes, the CARD, NACHT, and LRR are listed in the left |
在牙鲆、尼罗罗非鱼、斑马鱼、家犬、老鼠和人中,氨基酸序列比对结果显示(图 2),NOD2基因的3个结构域在脊椎动物中保守性很强,其中NACHT结构域最为保守。为了探究NOD2在脊椎动物中的进化关系,本研究利用MEGA 6构建了由不同脊椎动物的NOD2基因组成的系统进化树(图 3),鸭嘴兽(Ornithorhynchus anatinus)NOD2被选为外类群,其中,鱼类和其他脊椎动物分别形成2个亚支。在鱼类亚支中,牙鲆与红鳍东方鲀(Takifugu rubripes)最为接近,它们与青鳉、虹鳟和新月鱼(Xiphophorus maculatus)组成一支,区别于由斑马鱼、草鱼(Ctenopharyngodon idella)、露斯塔野鲮(Labeo rohita)等组成的另外一支。

|
图 2 脊椎动物NOD2氨基酸多序列比对 Figure 2 The multiple alignment of NOD2 amino acid sequences in Japanese flounder and other species 相同的氨基酸以中等灰度着色。CARD、NACHT和LRR结构域使用SMART预测,并将结构域标注在上方的黑色条中 Identical amino acids are shaded in medium grey. CARD, NACHT and LRR were predicted by using the SMART program, and these domains are indicated as black bars above the alignment |
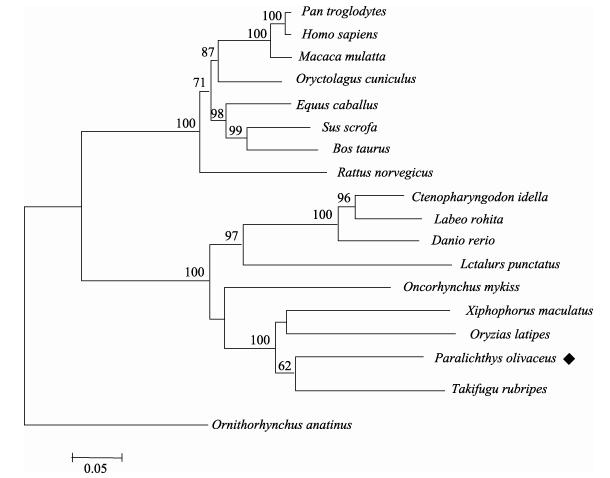
|
图 3 脊椎动物NOD2基因系统进化分析 Figure 3 The phylogenetic analysis of NOD2 in different representative vertebrates based on their amino acid sequences |
如图 4所示,PoNOD2在脾中具有最高表达量,其次是肝,随后是肾、肌肉、鳃、心脏和脑。
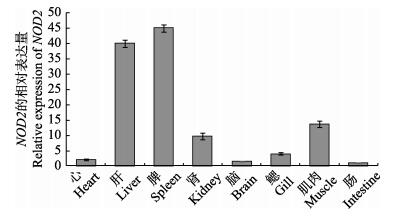
|
图 4 PoNOD2基因在不同组织的RT-qPCR分析 Figure 4 Relative expression of PoNOD2 in different tissues of Japanese flounder β-actin基因是定量分析的内参对照,误差线代表平均值±标准误(n=3) β-actin gene expression was used as internal control, vertical bars represent the Mean±SE (n=3) |
实验结果显示(图 5),牙鲆NOD2蛋白与其他脊椎动物蛋白一样,在细胞质中表达,从图 5可以看出,牙鲆鳃细胞的细胞质(绿色)与细胞核(蓝色)界限分明。
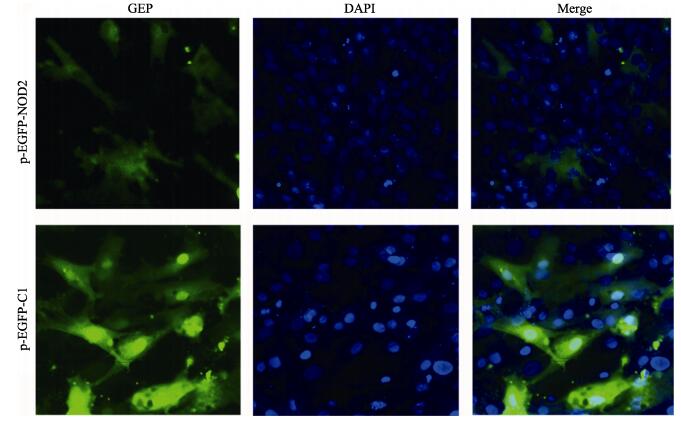
|
图 5 PoNOD2蛋白的亚细胞定位 Figure 5 Subcellular localization of PoNOD2 in Japanese flounder FG cells 激光共聚焦显微镜下,PoNOD2(绿色荧光)在细胞质中,核DNA用DAPI染色,pEGFP-C1用做阴性对照 Localization of PoNOD2 in FG cells under confocal microscope. PoNOD2 was mainly detected in cytoplasm. Nuclear DNA of the cells was counterstained with DAPI. The cells transfected with pEGFP-C1 were used as negative controls |
在迟缓爱德华氏菌侵染牙鲆成体鱼的不同时期,分别取了迟缓爱德华氏菌组和对照组的鳃、肾、脾组织,探究PoNOD2在迟缓爱德华氏菌刺激下的表达,结果显示,在各个组织中,迟缓爱德华氏菌的刺激能够引起PoNOD2不同程度表达上调。
在肾中(图 6A),迟缓爱德华氏菌刺激后,PoNOD2的表达呈现先升高后降低再升高再降低的趋势,3个升高点分别出现在3、48和110 h,在这3个时期,实验组的PoNOD2表达量分别是对照组表达量的2.6倍、3.14倍和2.15倍。在脾中(图 6B),迟缓爱德华氏菌对PoNOD2的诱导作用随刺激时间的延长而升高,到96 h时达到最高。在鳃中(图 6C),迟缓爱德华氏菌从5 h开始对PoNOD2发挥诱导作用;在96 h时,NOD2的表达量达到最高,是对照组的3.27倍。
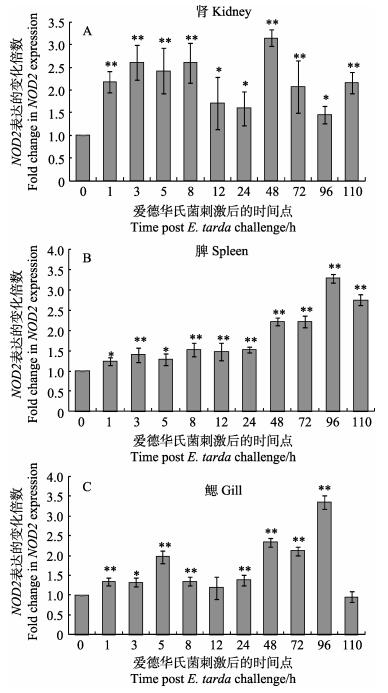
|
图 6 迟缓爱德华氏菌刺激下PoNOD2在牙鲆组织的表达 Figure 6 Expression profile of PoNOD2 mRNA in kidney, spleen and gill of Japanese flounder following E. tarda challenges β-actin基因是定量分析的内参对照,时间点0 h表达量用作参照样品。所有数据以平均值±标准误(n=4)表示,各个组之间的差异性用*表示(*P < 0.05; **P < 0.01) β-actin gene expression was used as internal control and the time point 0 h was used as reference sample. Vertical bars represent Mean±SE (n=4). Significant difference between E. tarda-challenged tissues and blank control (at 0 h) are indicated by asterisk (*P < 0.05; **P < 0.01) |
为更进一步探讨牙鲆NOD2在抗病原菌侵染方面发挥的重要作用,分别用PBS、PGN、Poly I:C和迟缓迟缓爱德华氏菌刺激牙鲆鳃细胞系,并在0~12 h的不同时间点取样,对牙鲆NOD2进行qRT-PCR分析,结果表明,不同的刺激均使牙鲆NOD2表达上调(图 7)。
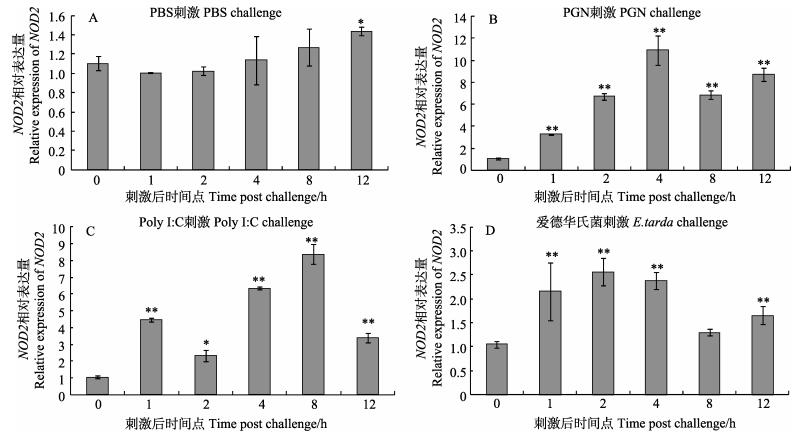
|
图 7 PoNOD2在免疫刺激牙鲆鳃细胞中的表达 Figure 7 Expression profiles of PoNOD2 mRNA in Japanese flounder FG cells subjected under different stimuli PoNOD2的mRNA水平在不同刺激下的FG细胞的定量表达,包括PBS、PGN、Poly I:C和Edwardsiella tarda。β-actin基因表达用作内参对照,时间点0 h用作参照样品。误差线表示平均值±标准误(n=3)。刺激组与空白对照(0 h)之间的显著差异由星号表示(*P < 0.05; **P < 0.01) Quantitative expression profile of PoNOD2 mRNA in FG cells following different challenges, including PBS, PGN, Poly I:C, and E. tarda. β-actin gene expression was used as internal control, and the time point 0 h was used as reference sample. Vertical bars represent Mean±SE (n=3). Significant difference between stimuli-or bacteria-challenged and blank control (at 0 h) are indicated by asterisk (*P < 0.05; **P < 0.01) |
PBS刺激时(图 7A),PoNOD2在前5个时期表达无明显差异,12 h时有略微上调。PGN刺激时(图 7B),PoNOD2表达先升高后降低再升高。在4 h时,达到一个峰值,是0 h时的10.9倍,在12 h时再次升高,达到0 h的8.74倍。在Poly I:C刺激时(图 7C),NOD2的表达在1 h时突然升高,达到0 h的4.4倍,在2 h时,NOD2表达降低,直到8 h时,达到了最高点,此时为0 h的8.37倍。迟缓爱德华氏菌刺激时(图 7D),PoNOD2的表达在前4 h一直是高表达,在8 h时降低,12 h时再次升高。
2.7 PoNOD2抑制迟缓爱德华氏菌生长实验结果见图 8,在6 h时,观察到PoNOD2对胞内菌抑制效果不明显,与对照组相比,没有显著性差异。然而,随着时间推移到细菌侵染后15 h,迟缓爱德华氏菌在牙鲆鳃细胞内繁殖,对照组胞内菌数目增加到4.55×105 CFU/12孔,而实验组胞内菌数目为2.86×105 CFU/12孔,相比对照组下降了30%。
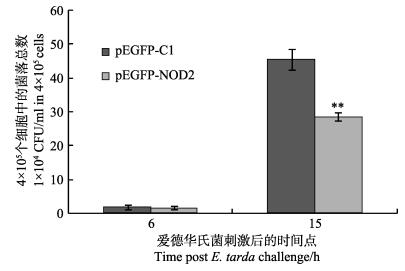
|
图 8 PoNOD2在牙鲆鳃细胞中的抗菌检测 Figure 8 Antibacterial assays of PoNOD2 in Japanese flounder FG cells 误差线表示平均值±标准误(n=3)。在6 h和15 h时,pEGFP-NOD2组与pEGFP-C1组之间的显著差异由星号表示(*P < 0.05; **P < 0.01) The results were expressed as Mean±SE of three independent experiments, with each performed in triplicate. Significant difference between pEGFP-NOD2 group and pEFFP-C1 group at different time are indicated by asterisk (*P < 0.05; **P < 0.01) |
基于获得了PoNOD2过表达的牙鲆细胞系,检测了在PGN刺激24 h后FG细胞中促炎细胞因子的表达情况。结果显示(图 9),相比转染p-EGFP-C1的对照组,PoNOD2的过表达能明显上调IL-1β、IL-6和IL-8的表达水平,表达量分别高11.6倍、4.6倍和8.76倍。
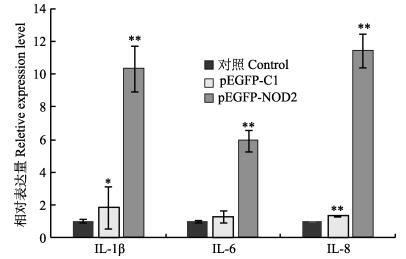
|
图 9 NOD2过表达对PGN刺激的FG细胞中促炎细胞因子的表达的影响 Figure 9 Effect of NOD2 overexpression on the expression of pro-inflammatory cytokines in PGN-stimulated Japanese flounder FG cells 误差线表示平均值±标准误(n=3)。pEGFP-NOD2与pEGFP-C1和对照组之间的显著差异由星号表示(*P < 0.05; **P < 0.01) Vertical bars represent the Mean±SE (n=3). Significant difference between pEGFP-NOD2 and pEGFP-C1 and the control is indicated by asterisk (*P < 0.05; **P < 0.01) |
本研究结果显示,PoNOD2蛋白具有3种典型结构域CARD、NACHT和LRR,蛋白质多重序列比对得知,这3类结构域都相对保守,其中NACHT保守性最高。由此可以推测,牙鲆可能利用NOD2基因的CARD、NACHT和LRR结构域完成识别信号、启动免疫信号通路的功能(Zurek et al, 2012; Maharana et al, 2015)。
NOD2广泛分布在哺乳动物和鱼类的各种组织中,本研究利用qRT-PCR检测到PoNOD2在牙鲆各个组织广泛表达,在脾脏中表达最高,其次是肝脏。在印度鲮、草鱼中,类似的组织表达研究显示,NOD2广泛分布在各个组织,印度鲮NOD2在肝脏中表达最高(Swain et al, 2013),草鱼NOD2在肾脏中表达最高(Chen et al, 2010),这种表达差异可能与鱼种类不同有关。肾脏是鱼类重要免疫器官,在鱼类抵御外来病原菌入侵过程中最先产生免疫调节作用。鱼类脾的免疫功能仅次于肾,同时,承载着造血和免疫作用。肝脏是鱼类重要的解毒器官,在鱼类维持生理平衡、抵御异物侵染中发挥重要作用。PoNOD2在肝脏与脾中的高表达表明其具有重要的免疫功能。PoNOD2在迟缓爱德华氏菌感染的牙鲆鳃、肾和脾中的定量表达结果显示,在肾中PoNOD2随着迟缓爱德华氏菌的侵染呈现先升高又降低再升高的趋势;在脾和鳃中,PoNOD2随着迟缓爱德华氏菌的侵染表达逐渐升高。PoNOD2表达模式的不同可能与组织功能不同有关,表明PoNOD2能够参与牙鲆抗迟缓爱德华氏菌感染的免疫反应,NOD2具有抗胞内菌作用。
PGN是革兰氏阳性菌和阴性菌细胞壁的重要组成成分,NOD2能够特异识别PGN的降解产物胞壁酰二肽(MDP)(Girardin et al, 2003)。Poly I:C是一种干扰素抑制剂,作为双链RNA的类似物,在实验中常被用来模拟病毒刺激(Fujimoto et al, 2004)。本研究结果表明,PGN、Poly I:C和迟缓爱德华氏菌均能上调PoNOD2的表达,但上调的程度和时间不同。PGN与迟缓爱德华氏菌相比,能够引起PoNOD2更大幅度的上调,在4 h时,是对照组表达量的10倍。PGN是细菌细胞壁的组成成分,能够被NOD2特异识别;而迟缓爱德华氏菌刺激时,除了激活NOD2信号通路,还会引起其他一些受体基因的先天免疫应答。因此,PoNOD2表达上的差异可能与细胞应对专一刺激物和活菌的反应机制不同有关。而PGN、迟缓爱德华氏菌与Poly I:C的不同,可能由PoNOD2对病毒和细菌的识别机制不同导致。总之,本研究发现,PoNOD2的表达能够被细菌、病毒类似物以及细菌降解产物的刺激所激活,表明PoNOD2在牙鲆免疫反应中发挥重要的作用。
哺乳动物中NOD2-RIPK2途径可以调节先天性免疫反应和控制细胞因子的产生,并可以诱发适应性免疫应答来促进宿主抗微生物反应(Magalhaes et al, 2011)。以往在斑马鱼中的研究表明(Zou et al, 2016),NOD2过表达并不能够起到抑制胞内迟缓爱德华氏菌繁殖的能力。为了探讨PoNOD2是否可以发挥与哺乳动物一样的效果,本研究用过表达NOD2的牙鲆鳃细胞系进行迟缓爱德华氏菌侵染实验。实验结果显示,在侵染6 h后,过表达NOD2的实验组和对照组相比,体内细菌数量没有显著性降低,但在15 h时,实验组相比对照组降低了30%。这与哺乳动物中的研究结果相一致,但与斑马鱼的研究结果不同。在斑马鱼研究中(Zou et al, 2016),作者并没有进行6 h以后的跟踪实验。本研究认为,牙鲆和斑马鱼实验结果的不同可能有3种原因:PoNOD2作为一个胞内识别受体,它通过识别胞内菌引起系列先天免疫反应,该反应随着时间的延长,抑菌效果逐渐增强;牙鲆NOD2和斑马鱼NOD2在应对迟缓爱德华氏菌侵染过程中发挥的作用不同;2个实验所用的细胞系不同,本实验用的是牙鲆鳃细胞系,斑马鱼实验用的胚胎细胞系,鳃是鱼类先天性免疫的重要器官,鳃细胞系对免疫应答的表现可能比胚胎细胞系更加直观和清楚。
IL-1β和IL-6等白介素家族成员是细胞炎症反应中的重要因子(Scheller et al, 2011)。本研究利用PGN刺激转染p-EGFP-NOD2的牙鲆鳃细胞系,探讨NOD2是否能够抑制或者激活这些细胞炎症因子的表达。结果表明,PoNOD2过表达能够引起IL-1β、IL-6和IL-8的表达上调。其中,IL-1β和IL-8的上调程度高于IL-6,这可能与PoNOD2对3种基因的调节作用不同有关。PoNOD2过表达能够抑制迟缓爱德华氏菌在细胞内的增殖,而PoNOD2过表达能够上调IL-1β、IL-6和IL-8等细胞炎症因子的表达。因此,PoNOD2发挥抑菌作用可能通过上调炎症细胞因子的表达,从而促进细胞炎症反应,达到抑菌的目的。
本研究克隆了PoNOD2基因,并分别研究了PoNOD2基因在成体鱼和细胞水平的表达特征,研究结果表明,该基因可能在牙鲆先天性免疫中起重要作用。同时,PoNOD2过表达能够激活炎症细胞因子IL-1β、IL-6和IL-8等的表达,参与了牙鲆的免疫应答反应,对胞内迟缓爱德华氏菌的感染起到抑制作用。本研究为今后更深入研究牙鲆细菌感染的分子机制及免疫应答机理提供了详实的数据,奠定了理论基础。
| Bertin J, Nir WJ, Fischer CM, et al. Human CARD4 protein is a novel CED-4/Apaf-1 cell death family member that activates NF-κB. Journal of Biological Chemistry, 1999, 274(19): 12955-12958 DOI:10.1074/jbc.274.19.12955 | |
| Castro N, Toranzo AE, Barja JL, et al. Characterization of Edwardsiella tarda strains isolated from turbot, Psetta maxima (L. ). Journal of Fish Diseases, 2006, 29(9): 541-547 DOI:10.1111/jfd.2006.29.issue-9 | |
| Chang M, Wang T, Nie P, et al. Cloning of two rainbow trout nucleotide-binding oligomerization domain containing 2 (NOD2) splice variants and functional characterization of the NOD2 effector domains. Fish and Shellfish Immunology, 2011, 30(1): 118-127 DOI:10.1016/j.fsi.2010.09.014 | |
| Chen WQ, Xu QQ, Chang MX. Molecular characterization and expression analysis of nuclear oligomerization domain proteins NOD1 and NOD2 in grass carp Ctenopharyngodon idella. Fish and Shellfish Immunology, 2010, 28(1): 18-29 DOI:10.1016/j.fsi.2009.09.012 | |
| Franchi L, Eigenbrod T, Nunez G. Cutting edge: TNF-α mediates sensitization to ATP and silica via the NLRP3 inflammasome in the absence of microbial stimulation. Journal of Immunology, 2009, 183(2): 792-796 DOI:10.4049/jimmunol.0900173 | |
| Fujimoto C, Nakagawa Y, Ohara K, et al. Polyriboinosinic polyribocytidylic acid [Poly (I: C)]/TLR3 signaling allows class I processing of exogenous protein and induction of HIV-specific CD8+ cytotoxic T lymphocytes. International Immunology, 2004, 16(1): 55-63 DOI:10.1093/intimm/dxh025 | |
| Girardin SE, Boneca IG, Viala J, et al. Nod2 is a general sensor of peptidoglycan through muramyl dipeptide (MDP) detection. Journal of Biological Chemistry, 2003, 278(11): 8869-8872 DOI:10.1074/jbc.C200651200 | |
| Imagawa T, Hashimoto Y, Kon Y, et al. Immunoglobulin containing cells in the head kidney of carp (Cyprinus carpio L.) after bovine serum albumin injection. Fish and Shellfish Immunology, 1991, 1(3): 173-185 DOI:10.1016/S1050-4648(10)80003-8 | |
| Inohara N, Nuñez G. NODs: Intracellular proteins involved in inflammation and apoptosis. Nature Reviews Immunology, 2003, 3(5): 371-382 DOI:10.1038/nri1086 | |
| Janeway CA, Medzhitov R. Innate immune recognition. Annual Review of Immunology, 2002(20): 197-216 | |
| Ling SH, Wang XH, Xie L, et al. Use of green fluorescent protein (GFP) to study the invasion pathways of Edwardsiella tarda in vivo and in vitro fish models. Microbiology, 2000, 146(1): 7-19 DOI:10.1099/00221287-146-1-7 | |
| Magalhaes JG, Lee J, Geddes K, et al. Essential role of Rip2 in the modulation of innate and adaptive immunity triggered by Nod1 and Nod2 ligands. European Journal of Immunology, 2011, 41(5): 1445-1455 DOI:10.1002/eji.201040827 | |
| Maharana J, Dehury B, Sahoo JR, et al. Structural and functional insights into CARDs of zebrafish (Danio rerio) NOD1 and NOD2, and their interaction with adaptor protein RIP2. Molecular BioSystems, 2015, 11(8): 2324-2336 DOI:10.1039/C5MB00212E | |
| McCarthy JV, Ni J, Dixit VM. RIP2 is a novel NF-κB-activating and cell death-inducing kinase. Journal of Biological Chemistry, 1998, 273(27): 16968-16975 DOI:10.1074/jbc.273.27.16968 | |
| Mohanty BR, Sahoo PK. Edwardsiellosis in fish: A brief review. Journal of Biosciences, 2007, 32(7): 1331-1344 | |
| Navas TA, Baldwin DT, Stewart TA. RIP2 is a Raf1-activated mitogen-activated protein kinase kinase. Journal of Biological Chemistry, 1999, 274(47): 33684-33690 DOI:10.1074/jbc.274.47.33684 | |
| Ogura Y, Inohara N, Benito A, et al. Nod2, a Nod1/Apaf-1 family member that is restricted to monocytes and activates NF-κB. Journal of Biological Chemistry, 2001, 276(7): 4812-4818 DOI:10.1074/jbc.M008072200 | |
| Okuda J, Arikawa Y, Takeuchi Y, et al. Intracellular replication of Edwardsiella tarda in murine macrophage is dependent on the type Ⅲ secretion system and induces an up-regulation of anti-apoptotic NF-kappaB target genes protecting the macrophage from staurosporine-induced apoptosis. Microbial Pathogenesis, 2006, 41(6): 226-240 DOI:10.1016/j.micpath.2006.08.002 | |
| Scheller J, Chalaris A, Schmidt-Arras D, et al. The pro-and anti-inflammatory properties of the cytokine interleukin-6. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2011, 1813(5): 878-888 DOI:10.1016/j.bbamcr.2011.01.034 | |
| Srinivasa Rao PS, Lim TM, Leung KY. Opsonized virulent Edwardsiella tarda strains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates. Infection and Immunity, 2001, 69(9): 5689-5697 DOI:10.1128/IAI.69.9.5689-5697.2001 | |
| Swain B, Basu M, Samanta M. NOD1 and NOD2 receptors in mrigal (Cirrhinus mrigala): Inductive expression and downstream signalling in ligand stimulation and bacterial infections. Journal of Biosciences, 2013, 38(3): 533-548 DOI:10.1007/s12038-013-9330-y | |
| Takeda K, Akira S. Roles of Toll-like receptors in innate immune responses. Genes to Cells, 2001, 6(9): 733-742 DOI:10.1046/j.1365-2443.2001.00458.x | |
| Zou PF, Chang MX, Li Y, et al. NOD2 in zebrafish functions in antibacterial and also antiviral responses via NF-κB, and also MDA5, RIG-I and MAVS. Fish and Shellfish Immunology, 2016, 55: 173-185 DOI:10.1016/j.fsi.2016.05.031 | |
| Zurek B, Proell M, Wagner RN, et al. Mutational analysis of human NOD1 and NOD2 NACHT domains reveals different modes of activation. Innate Immunity, 2012, 18(1): 100-111 DOI:10.1177/1753425910394002 |




 Channel catfish
Channel catfish