2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006
2. Shandong Marine Resource and Environment Research Institute, Shandong Provincial Key Laboratory of Marine Ecological Restoration, Yantai 264006
短蛸(Amphioctopus fangsiao)俗称坐蛸、饭蛸、八带,属头足纲(Mollusca),八腕目(Octopoda),无须亚目(Incirrata)、蛸科(Octopodidate)、蛸属(Octopus),主要群体栖居于温带偏北海域,在黄、渤海产量较大,是我国北部沿海蛸类中最重要的经济种之一(张龙岗等, 2009)。短蛸肉质鲜美,具有较高的食用和药用价值,国内市场及加工出口发展迅速,具有广阔产业发展前景。然而,由于市场消费需求的不断增长,对短蛸的捕捞强度不断增大,使得其自然资源日渐枯竭,对短蛸进行全人工养殖势在必行。交配期是头足类繁殖行为的重要时期,具有复杂的求偶、交配和繁殖策略(Hanlon et al, 1996)。交配行为模式研究能为短蛸的人工繁育及种质资源保护提供重要的基础资料。目前,有关短蛸人工育苗、精荚超微结构、摄食行为、营养成分、遗传多样性以及免疫应答机制等已展开诸多研究(朱文博等, 2015; Yang et al, 2011; 王卫军等, 2017; 薛静等, 2015; 张龙岗等, 2009; 张冉冉等, 2015),繁殖行为学的研究相对匮乏,只有张学舒(2002)和王卫军等(2010)对其进行了初步研究。
研究动物的交配模式最直观的方法是实地观察,但对于活性强的水生动物而言难度较大。而且,观察到多重交配行为并不代表多重受精成功,真正的雌性混交动物,其后代中应存在多父性现象,而多父性通过个体直接观察很难判断。微卫星标记,又称简单重复序列(Simple sequence repeats, SSR)具有共显性、高多态性、高保守性、检测快速等特点,是理想的亲权鉴定标记(Buresch et al, 2001; 李佳凯等, 2014; 汪金海等, 2017)。微卫星多重PCR可在同一反应体系中同时扩增多个位点,较传统PCR省时、高效、成本低,可有效减少靶基因片段的假阳性现象(罗伟等, 2013; 李东宇等, 2016)。
本研究利用实验室开发的微卫星标记,选择多态性高、特异性好、片段大小适中的位点进行优化组合,构建微卫星多重PCR体系,对短蛸亲体和幼体进行亲权鉴定,旨在分析其交配模式,为短蛸的种质资源保护及人工繁育提供科学依据和理论指导。
1 材料与方法 1.1 材料实验所用亲体与幼体样品于2015年采集于山东省海洋资源与环境研究院东营基地。将野生雄蛸和雌蛸于池中暂养,待其交配产卵后雄蛸陆续死亡,取19个雄蛸(编号♂1~♂19)腕部组织于无水乙醇中,–20℃保存备用。受精卵经雌蛸40 d护卵孵化后,获得短蛸幼体,随机选取4个雌蛸(编号♀1~♀4)及对应幼蛸共104个保存备用。
1.2 方法 1.2.1 短蛸基因组DNA的提取和检测用CTAB法(Winnepenninckx et al, 1993)抽提DNA,于30 μl 1× TE Buffer(pH=8.0)溶解,用1%琼脂糖凝胶电泳检测基因组DNA的完整性,Thermo Scientific NanoDrop™ OneC超微量紫外分光光度计测定DNA浓度和纯度,将DNA浓度调至50 ng/μl,-20℃保存备用。
1.2.2 微卫星多重PCR的设计和优化在实验室开发的微卫星标记中,根据扩增条带清晰度、亮度及多态性选用12个位点(未发表),分别为DS140,DS135,DS226,DS94,DS150,DS35,DS16,DS132,DS290,DS157,DS169,DS271。依据各位点PCR退火温度、等位基因大小范围、是否存在非特异性条带、引物间是否存在较强的互补性,挑选引物序列间互不干扰、扩增片段长度不重叠、退火温度相近的位点构建多重PCR。首先进行两位点的组合实验,在二重PCR基础上不断调整引物浓度构建多重PCR。
利用建立的多重PCR分别对19个候选父本、4个母本及对应的104个幼蛸进行特异性扩增。多重PCR反应体系为10 ml,包括模板DNA 1.0 μl (50 ng),10 × PCR buffer(Mg2+ plus) 1.0 μl,2.5 mmol/L dNTPs 1.0 μl,10 μmol/L正反引物共2.0 μl,5 U/μl Taq DNA聚合酶0.05 μl,ddH2O 4.9 5μl。PCR反应程序为94℃预变性5 min;94℃变性45 s,退火温度45 s,72℃延伸45 s,循环35次;最后,72℃延伸6 min;4℃保存。扩增产物通过8%的非变性聚丙烯酰胺凝胶电泳,银染显色,于Bio-5000 plus电泳扫描仪拍照保存,以10 bp DNA Marker为参考标准对目的条带判读。
1.2.3 数据统计分析用CERVUS 3.0进行亲子鉴定分析,母本已知,具体参数设置为候选父本19,模拟子代数为10000,亲本检测率100%,分型误差率1%,位点检测率100%,95%的置信区间。
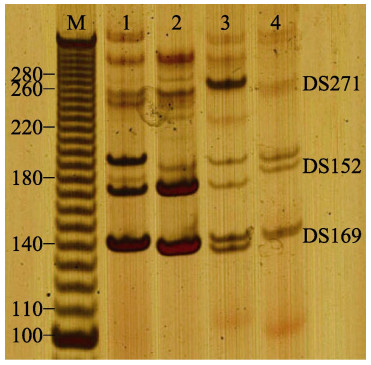
2 结果 2.1 短蛸微卫星多重PCR体系的构建12个位点经优化组合后得到4组三重PCR,三重PCR体系引物的位点组合、重复单元、碱基序列、产物大小、退火温度详见表 1。其中,3个微卫星位点DS169、DS152、DS271构建的多重PCR在短蛸子代中的部分扩增结果见图 1。图 1中3个位点的扩增片段长度不重叠,能清晰区别和有效判读目的条带,本研究构建的微卫星多重PCR反应体系可用于亲权鉴定分析。
|
|
表 1 短蛸4组微卫星三重PCR体系特征 Table 1 Characteristics of four microsatellite multiplex PCRs in A. fangsiao |
|
图 1 3个微卫星位点DS169、DS152和DS271构建的多重PCR在短蛸子代中部分扩增结果 Figure 1 The partial amplification results of multiplex PCR consist of three microsatellites DS169, DS152, and DS271 in offsprings of A. fangsiao M: DNA marker; 1~4: ♀1的4个子代(Four offsprings of ♀1 group) |
利用4组三重PCR体系,使用CERVUS 3.0对4个母本、104个子代及19个候选父本进行亲权鉴定,基于似然法从非排除亲本中选出最可能亲本。分析结果如下:104个子代鉴定率为94.23%(98/104),♀1组幼蛸有12个个体鉴定到父本(12/14),父本为♂2、♂7或♂16;♀2组幼蛸有40个个体检测到父本(40/41),父本有7个,为♂2、♂3、6、♂7、♂10、♂12或♂15;♀3组和♀4组分别鉴定出19、27个幼蛸个体(19/21、27/28),父本分别为♂2、♂3和♂2、♂3、♂7、♂10。每组样品亲子鉴定结果见表 2。
|
|
表 2 短蛸4组样品的亲子鉴定结果 Table 2 The paternity results of the four group of offsprings in A. fangsiao |
微卫星通常作为单个位点以PCR方式扩增,此过程需要一定时间和成本。多重PCR在微卫星遗传分析中可以节省大量时间、成本和工作量,也可以在PCR操作过程中减小人为的误差(Porta et al, 2006),在分析大量实验样本时,多重PCR技术的优势更加明显。20世纪80年代,Chamberlain等(1988)首次尝试了多重PCR反应模式。目前,多重PCR扩增体系已广泛应用于一些水产动物的亲权鉴定、遗传多样性研究中,例如大黄鱼(Larimichthys crocea)(李佳凯等, 2014)、团头鲂(Megalobrama amblycephala)(罗伟等, 2013)、长牡蛎(Crassostrea gigas)(纪仁平等, 2015)等。理想的多重PCR要求在同一反应体系完成多个位点的特异性扩增,并非单一PCR的简单组合,要针对目的产物,反复试验综合分析,构建最优的反应体系和反应条件(陈明洁等, 2005)。本研究主要优化引物浓度和退火温度,在二重PCR基础上进行三重PCR实验,直至各产物条带清晰能明显区分,得到最优组合。利用构建的4组三重PCR体系,104个子代鉴定率达到94.23%(98/104),成功率较高。研究表明,分子标记的选择在很大程度上影响着亲子关系鉴定的结果,用于亲子关系鉴定的微卫星标记数量越大、多态性越高,则鉴定的成功率和准确率越高(Jerry et al, 2004)。本研究需增加更多的微卫星标记以提高鉴定成功率。
交配模式分析有助于全面了解水产动物复杂的繁殖行为,能为其人工繁育、增养殖、遗传育种及人工放流等多个方面提供重要支撑。传统的交配模式研究方法主要基于野外或人工养殖观察,其结果易受外界条件影响。随着多态性标记技术在亲权鉴定方面的应用,生物交配模式研究已从宏观深入到微观,结果更具可靠性。Stanback等(2002)利用小卫星DNA标记研究犀鸟(Tockus monteiri)的交配模式,发现大多数为多配型,而野外观察结果属单配型。Buresch等(2001)用微卫星标记对枪乌贼(Loligo pealeii)卵群进行分析,证实了枪乌贼为一雌多雄交配模式。本研究利用构建的微卫星多重PCR体系对4组短蛸亲本和子代样品进行亲权鉴定,结果显示,4组短蛸父本数分别为3、7、2和4,证明短蛸存在多雌多雄交配模式。多雌多雄交配模式是水产动物对环境及人为捕捞压力的一种适应,能有效提高等位基因遗传多样性以及子代遗传变异类型,对稳定其种群结构、提高繁殖效率和子代质量起到积极作用。采用实地观察方法进行交配模式研究时,观察到多重交配行为并不代表多重受精成功。本研究,4组样品经鉴定涉及到的候选父本为8个,说明其余11个父本未参与交配或交配后受精未成功。
本研究4组样品中父本♂2的后代比例分别高达71.43%(10/14)、60.98%(25/41)、85.71%(18/21)和75%(21/28),远超过其他父本,说明参与受精并受精成功的精子多数来自♂2,♂2在精子竞争或隐性雌性选择中占有优势。精子竞争是指来自2个或2个以上雄性个体的精子为争夺对卵的受精权而展开的竞争,它属于交配后性选择,实质是一种行为学现象,一种用来保证自己精子高受精率的繁殖策略(Hanlon et al, 1996)。在对无针乌贼(Sepiella japonica)、金乌贼(Sepia esculenta)、克氏原螯虾(Procambarus clarkii)等多种水生生物研究中也证明了精子竞争现象的存在(Wada et al, 2006; 汪金海等, 2017; 宋亮等, 2013)。雄性的精子竞争根据最后交配雄性子代比例可分为3类(Birkhead et al, 1990):最先雄性精子优先、最后雄性精子优先和无雄性精子优先。繁殖期的头足类交配前为争夺雌性配偶会展开斗争,实质也属精子竞争。关于短蛸属于哪类精子竞争、交配前雌性(或雄性)对雄性(雌性)是否有行为选择需进一步深入研究。
本研究利用微卫星标记亲子鉴定技术研究短蛸的交配模式,将为短蛸种质资源保护及人工繁育提供科学依据和理论指导,为海洋头足类性选择机制及物种进化等研究提供基础资料。构建的多重PCR体系也将有助于长蛸、真蛸、乌贼等近缘物种的种质资源研究。
| Birkhead TR, Hunter FM. Mechanisms of sperm competition. Trends in Ecology and Evolution, 1990, 5(2): 48-52 DOI:10.1016/0169-5347(90)90047-H | |
| Buresch KM, Hanlon RT, Maxwell MR, et al. Microsatellite DNA markers indicate a high frequency of multiple paternity within individual field-collected egg capsules of the squid Loligo pealeii. Marine Ecology Progress, 2001, 210(8): 161-165 | |
| Chamberlain JS, Gibbs RA, Ranier JE, et al. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification. Nucleic Acids Research, 1988, 16(23): 11141-11156 DOI:10.1093/nar/16.23.11141 | |
| Chen MJ, Fang T, Ke T, et al. Multiplex PCR-A molecular biotechnique of high efficiency and speed. Journal of Wuhan University of Technology, 2005, 27(10): 33-36 DOI:10.3321/j.issn:1671-4431.2005.10.010 [陈明洁, 方倜, 柯涛, 等. 多重PCR-一种高效快速的分子生物学技术. 武汉理工大学学报, 2005, 27(10): 33-36] | |
| Hanlon RT, Messenger JB. Cephalopod behaviour. Cambridge: Cambridge University Press, 1996: 4-8. | |
| Jerry DR, Preston NP, Crocos PJ, et al. Parentage determination of Kuruma shrimp Penaeus(Marsupenaeus) japonicus using microsatellite markers (Bate). Aquaculture, 2004, 235(1-4): 237-247 DOI:10.1016/j.aquaculture.2004.01.019 | |
| Ji RP, Li HJ, Feng YW, et al. Development of multiplex PCR of microsatellites and its application to kinship analysis in Crassostrea gigas. Oceanologia et Limnologia Sinica, 2015, 46(6): 1542-1548 [纪仁平, 李焕军, 冯艳微, 等. 长牡蛎(Crassostrea gigas)微卫星多重PCR体系构建及其在家系鉴定中的应用. 海洋与湖沼, 2015, 46(6): 1542-1548] | |
| Li DY, Kong J, Meng XH, et al. Development of multiplex PCR systems of microsatellite markers for Pacific white shrimp (Litopenaeus vannamei) and its application for parentage identification. Progress in Fishery Sciences, 2016, 37(3): 58-67 DOI:10.11758/yykxjz.20151125002 [李东宇, 孔杰, 孟宪红, 等. 凡纳滨对虾(Litopenaeus vannamei)微卫星多重PCR体系的建立及其在家系亲权鉴定中的应用. 渔业科学进展, 2016, 37(3): 58-67] | |
| Li JK, Wang ZY, Wei XJ, et al. Development and application of three multiplex PCR panels of microsatellites in large yellow croaker (Larimichthys crocea). Journal of Fisheries of China, 2014, 38(4): 472-477 [李佳凯, 王志勇, 韦信键, 等. 大黄鱼微卫星多重PCR体系的建立及其应用. 水产学报, 2014, 38(4): 472-477] | |
| Luo W, Gao ZX, Zeng C, et al. Establishment and application of microsatellite multiplex PCR system for bluntsnout black bream Megalobrama amblycephala. Journal of Dalian Fisheries University, 2013, 28(5): 418-423 [罗伟, 高泽霞, 曾聪, 等. 团头鲂微卫星多重PCR体系的建立及应用. 大连海洋大学学报, 2013, 28(5): 418-423] | |
| Porta J, Porta JM, Martínez-Roríguez G, et al. Development of a microsatellite multiplex PCR for Senegalese sole (Solea senegalensis) and its application to broodstock management. Aquaculture, 2006, 256(1-4): 159-166 DOI:10.1016/j.aquaculture.2006.02.022 | |
| Song L, Han XL, Jiang J, et al. Sperm competition in red swamp crayfish (Procambarus clarkii). Fisheries Science, 2013, 32(6): 338-342 [宋亮, 韩晓磊, 江军, 等. 克氏原螯虾精子竞争研究. 水产科学, 2013, 32(6): 338-342] | |
| Stanback M, Richardson DS, Boix-Hinzen C, et al. Genetic monogamy in Monteiro's hornbill, Tockus monteiri. Animal Behaviour, 2002, 63(4): 787-793 DOI:10.1006/anbe.2001.1975 | |
| Wada T, Takegaki T, Mori T, et al. Reproductive behavior of the Japanese spineless cuttlefish Sepiella japonica. Venus Journal of the Malacological Society of Japan, 2006, 65(3): 221-228 | |
| Wang JH, Han S, Zheng XD. Molecular identification of reproduction model for Sepia esculenta (Cephalopoda:Sepiida). Oceanologia et Limnologia Sinica, 2017, 48(1): 184-189 [汪金海, 韩松, 郑小东. 金乌贼(Sepia esculenta)繁殖模式的分子学鉴定. 海洋与湖沼, 2017, 48(1): 184-189] | |
| Wang WJ, Dong G, Li HJ, et al. Feeding behavior of larval Amphioctopus fangsiao and the effect of different diets on its growth and survival. Progress in Fishery Sciences, 2017, 38(6): 100-106 DOI:10.11758/yykxjz.20160830001 [王卫军, 董根, 李焕军, 等. 短蛸(Amphioctopus fangsiao)幼体摄食行为和不同饵料对其生长、存活的影响. 渔业科学进展, 2017, 38(6): 100-106] | |
| Wang WJ, Yang JM, Zhou QL, et al. Reproductive behavior and process of embryonic development of Octopus ocellatus. Journal of Fishery Sciences of China, 2010, 17(6): 1157-1165 [王卫军, 杨建敏, 周全利, 等. 短蛸繁殖行为及胚胎发育过程. 中国水产科学, 2010, 17(6): 1157-1165] | |
| Winnepenninckx B, Backeljau T, De Wachter R. Extraction of high molecular weight DNA from molluscs. Trends in Genetics, 1993, 9(12): 407 DOI:10.1016/0168-9525(93)90102-N | |
| Xue J, Ma JM, Zhang XX, et al. Analysis and quality evaluation of nutritional components in the muscle of two kinds of octopus. Journal of Chinese Institute of Food Science and Technology, 2015, 15(12): 203-211 [薛静, 马继民, 张信祥, 等. 两种海洋蛸类营养成分分析与评价. 中国食品学报, 2015, 15(12): 203-211] | |
| Yang JM, Wang WJ, Zheng XD, et al. The ultrastructure of the spermatozoon of Octopus ocellatus Gray, 1849 (Cephalopoda:Octopoda). Chinese Journal of Oceanology and Limnology, 2011, 29(1): 199-205 DOI:10.1007/s00343-010-9995-y | |
| Zhang LG, Yang JM, Liu XQ, et al. The genetic diversity of Octopus ocellatus by AFLP markers. Oceanologia et Limnologia Sinica, 2009, 40(6): 803-807 DOI:10.11693/hyhz200906021021 [张龙岗, 杨建敏, 刘相全, 等. 短蛸(Octopus ocellatus)四个地理群体遗传特性的AFLP分析. 海洋与湖沼, 2009, 40(6): 803-807] | |
| Zhang RR, Wei XM, Yang JM, et al. Cloning of a tyrosine protein kinase gene from Octopus ocellatus and the expression pattern after bacteria stimulation. Oceanologia et Limnologia Sinica, 2015, 46(1): 173-180 [张冉冉, 韦秀梅, 杨建敏, 等. 短蛸(Octopus ocellatus)酪氨酸蛋白激酶基因的克隆及其mRNA在细菌刺激后的表达规律. 海洋与湖沼, 2015, 46(1): 173-180] | |
| Zhang XS. The breeding action and embryogensis of Octopus ocellatus in man-made environment. Journal of Zhejiang Ocean University (Natural Science), 2002, 21(3): 220-224 [张学舒. 人工环境中短蛸的繁殖行为和胚胎发生. 浙江海洋学院学报(自然科学版), 2002, 21(3): 220-224] | |
| Zhu WB, Sun YZ, Guo JJ, et al. Common problems and countermeasures on artificial seed rearing technique of Octopus ocellatus. Aquaculture, 2015, 12: 46-47 [朱文博, 孙玉忠, 郭见军, 等. 短蛸全人工育苗中常见的问题及对策. 水产养殖, 2015, 12: 46-47] |



