2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 环境保护部核与辐射安全中心 北京 100082
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. Nuclear and Radiation Safety Center, Ministry of Environmental Protection, Beijing 100082
近年来,我国海滨地区的多座大型核电厂将其循环冷却水(温排水)直接排入环境水体,使受纳海域的水温升高,而排水口的水温可升高8℃~12℃(Bamber, 1995),造成局部海域热污染。温度升高不仅改变了受纳海域的理化性质,而且影响海洋生物的繁殖和发育,严重时会影响生物的生长和存活,造成大范围海域内生物的消失,威胁着该海域的物种多样性,对近海生态系统结构与功能产生深刻的负面效应(Gooseff et al, 2005)。温排水对近岸海域生态环境及海洋生物产生的热污染已引起人们的普遍关注,成为热(核)电厂工程建设规划和环境评价中考虑的首要问题之一(陈全震等, 2004)。开展海洋生物热耐受性研究,查明海洋生物温度适应能力,能更科学地认识温排水对海洋生物和海洋生态环境的热效应。
海洋生物热耐受性研究始于国外学者Carter (1887)对鱼类温度适应能力及可塑性等方面的研究。其后,许多学者对海洋生物热耐受性研究方法进行了评价和改进(Hutchison, 1961; Kilgour et al, 1986; Beitinger et al, 2000)。生物热耐受性实验是热生物学研究领域中的普遍方法,包括动态温升实验和静态实验2种:前者是以一定的升温速率对水体进行持续加热,观察实验过程中受试生物因温升受到热刺激而发生的行为反应,评价指标主要是最大临界温度(Critical temperature maximum, CTMax)(Becker et al, 1979; Fangue et al, 2003; Selong et al, 2001);后者是将生物体从某一适应温度突然暴露于实验温度,统计一定时间内实验生物的存活情况,评价指标为高起始致死温度(Upper incipient lethal temperature, UILT50) (江志兵等, 2008; 廖一波等, 2008; Kivivuori et al, 1996)。静态实验能直接反映实验生物的死亡率与温度之间的关系,但所用实验生物较多,周期较长(Bennett et al, 1997);而动态实验与自然水域条件相似,设计简单,所需实验生物较少,能够较快地获取数据,尤其适用于对濒危物种的耐热性研究(Ospina et al, 2004)。在海洋生物热耐受性研究中,运用动态实验评价指标更符合海水温度变化的现状,能客观的反应实验生物的热耐受力。半致死温度(Lethal temperature of 50%, LT50)建立在CTMax基础之上,定义为在特定基础水温下以一定的温升速率加热直到实验生物出现50%死亡率时的温度。CTMax以实验生物丧失逃避致死环境能力作为端点(Cox, 1974),而LT50以实验生物50%死亡率为端点,更能反映热冲击下海洋生物的热耐受特征,是对海洋生物热耐受性评价指标的有效补充。
辽东湾位于渤海北部,周年平均水温为14.8℃,最高值出现在8月(28.8℃),最低值出现在12月(-2.1℃);周年盐度变化为29.2~31.2。该海域生物资源丰富,是我国重要渔场之一,主要经济渔业生物有矛尾
实验用矛尾
|
|
表 1 4种实验生物的规格 Table 1 Sizes of four experimental animals |
实验在150 L水体的水槽内进行,实验用水取自辽东湾东部自然海域,盐度为28.2~30.2,pH为8.1~8.2。实验过程中充气,光照为自然光照条件。各水槽水温由精密控温仪(温控范围为0~90℃,感温灵敏度为0.1℃,韩国A-MI 211H;钛加热棒为100~2000 W,德国Armaturenbau)控制。实验期间,定时用水银温度计测定核对水槽内水温。
1.2.2 动态温升实验本实验是在持续升温条件下研究海洋生物的热耐受特征。基础水温根据各实验季节自然海水的平均水温设置为8.0℃(冬季)、14.0℃和18.0℃(春季)、24.0℃和28.0℃(夏季)。各基础水温下均设置9个温升速率梯度:0.5、1.0、2.0、3.0、4.0、6.0、9.0、12.0、15.0℃/h,每个温度处理设3个平行组,内置生物个体的数量见表 1,采用多物种混合实验方式。以基础水温为起始温度,按照设定温升速率对水体进行持续升温,同时,记录受试生物死亡数量,记录死亡数量达到总数一半时的水温,该水温为LT50。实验过程中,以生物鳃盖(鱼类)停止运动,碰触无反应等定义为生物个体死亡(Becker et al, 1979)。
1.3 数据处理数据统计结果表示为平均值±标准差(Mean± SD),对数据进行正态分布检验(Kolmogorov-Smirnov test)和方差齐性检验(Levene test)。在满足正态分布和方差齐性条件下,进行方差分析(ANOVA)和多重比较(Duncan test)。对动态温升实验中各实验生物的LT50值进行可重复双因素方差分析(Two-way ANOVA),分析温升速率和基础水温对实验生物LT50的影响。以上分析均在IBM SPSS Statistics 22.0上进行,显著性水平设为P=0.05。
2 结果双因素方差分析结果显示,基础水温和温升速率显著(P < 0.05)影响4种实验生物LT50(表 2)。各温升速率处理组中,4种实验生物的LT50随着基础水温的升高呈显著升高趋势(P < 0.05),且在同一温升速率下各基础水温间的LT50存在显著差异(P < 0.05)。而温升速率对各实验生物LT50的影响因基础水温和物种而异(图 1~图 5)。
|
|
表 2 基础水温和温升速率对4种实验生物LT50的影响的显著性分析 Table 2 ANOVA results of the interaction of acclimation temperature and heating rate on the LT50 of four experimental species |
|
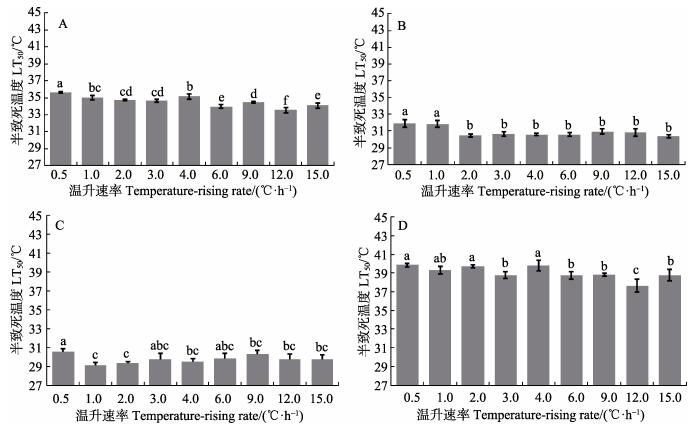
图 1 8.0℃基础水温不同温升速率下4种实验生物的LT50
Figure 1 LT50 of four experimental species acclimated at 8.0℃ at different heating rates
A:矛尾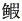 虎鱼;B:许氏平鲉;C:口虾蛄;D:日本蟳。下同
A: C. stigmatias; B: S. schlegeli; C: O. oratoria; D: C. japonica. The same as below 虎鱼;B:许氏平鲉;C:口虾蛄;D:日本蟳。下同
A: C. stigmatias; B: S. schlegeli; C: O. oratoria; D: C. japonica. The same as below
|
|
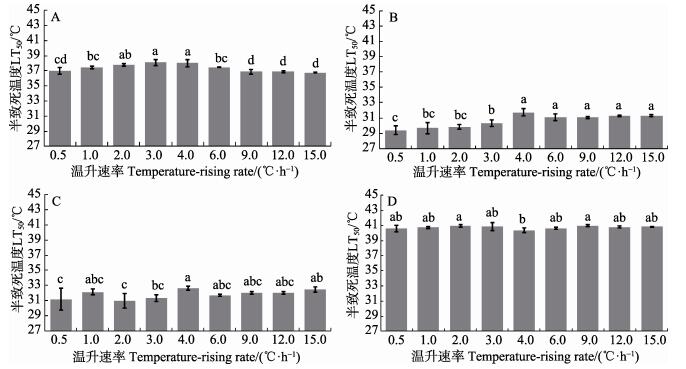
图 2 14.0℃基础水温不同温升速率下4种实验生物的LT50 Figure 2 LT50 of four experimental species acclimated at 14.0℃ at different heating rates |

|
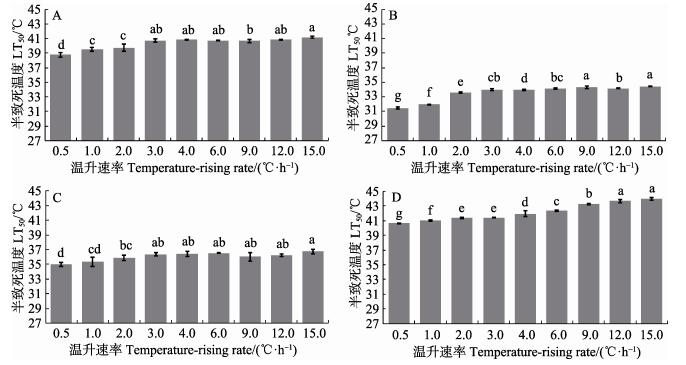
图 3 18.0℃基础水温不同温升速率下4种实验生物的LT50 Figure 3 LT50 of four experimental species acclimated at 18.0℃ at different heating rates |
|
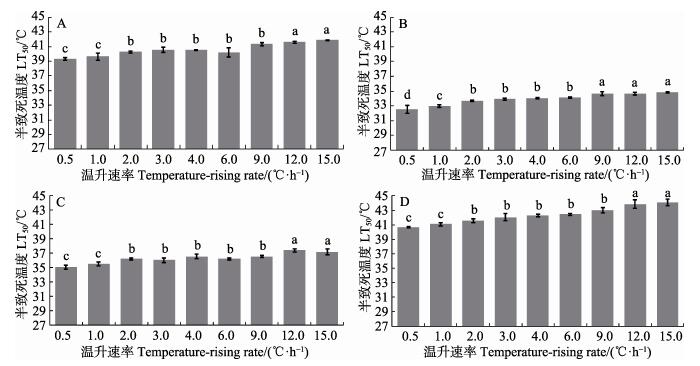
图 4 24.0℃基础水温不同温升速率下4种实验生物的LT50 Figure 4 LT50 of four experimental species acclimated at 24.0℃ at different heating rates |
|
图 5 28.0℃基础水温不同温升速率下实验生物的LT50 Figure 5 LT50 of four experimental species acclimated at 28.0℃ at different heating rates |
在基础水温为8.0℃时,许氏平鲉、矛尾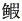
在基础水温14.0℃时,许氏平鲉和口虾蛄的LT50随温升速率的增大而显著升高(P < 0.05)(图 2),且均在温升速率4.0℃/h处理组达到最大值,分别为31.7℃和32.6℃;而LT50最低值分别为29.4℃(0.5℃/h)和31.0℃(2.0℃/h)。许氏平鲉和口虾蛄LT50在温升速率为4.0~15.0℃/h范围内,组间差异不显著,变化范围分别为31.1℃~31.7℃和31.7℃~32.6℃。矛尾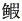
在基础水温为18.0℃时,许氏平鲉和口虾蛄的LT50变化趋势相似,均随温升速率的增大而显著升高(P < 0.05)(图 3);高温升速率(9.0~15.0℃/h)处理组LT50显著高于低温升速率(0.5~2.0℃/h)处理组的LT50 (P < 0.05)。许氏平鲉和口虾蛄的LT50最大值均出现在15.0℃/h处理组,分别为33.1℃和34.1℃;而LT50最小值分别为31.8℃(2.0℃/h)和32.3℃(0.5℃/h)。矛尾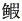
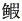
在基础水温为24.0℃时,4种实验生物LT50均随温升速率的增大而显著升高(P < 0.05)(图 4),高温升速率(9.0~15.0℃/h)处理组LT50显著高于低温升速率(0.5~1.0℃/h)下的LT5(P < 0.05)0。矛尾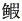
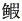
与基础水温为24.0℃时的4种实验生物的LT50变化类似,在基础水温28.0℃下,4种实验生物LT50均随温升速率的增大而显著升高(图 5)(P < 0.05),高温升速率(120~15.0℃/h)处理组LT50显著高于低温升速率(0.5~1.0℃/h)下的LT50(P < 0.05)。除口虾蛄外,矛尾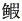
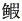
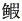
目前,海洋生物热耐受性评价指标主要集中于动态温升实验方法的CTMax和UILT50。CTMax是以特定温升速率(如1.0℃/h)持续升温,直至海洋生物出现临界特征,以此时的温度为最大临界温度。Cox(1974)定义鱼类此临界特征为机体活动失去平衡,失去逃离高温致死环境的能力,并将导致鱼很快死亡。目前,学者们大都认同Cox的说法。
本研究使用LT50就是建立在CTMax基础之上,定义为特定温升速率时实验生物达到CTMax后继续升温,直至出现50%死亡率时的温度值。而UILT50是将实验生物从适应的水温突然暴露于一系列实验水温,实验过程中,水温保持恒定,计算实验时段内受试生物出现半数死亡时的温度值。目前一般采用高温暴露24 h的50%致死量温度来计算UILT50(江志兵等, 2010)。本研究中使用的热耐受指标LT50以受试生物的50%死亡率作为端点,相较于静态实验需要的实验生物较少,经济性较强;能直接观察实验生物从实验开始直至50%个体死亡的整个过程,通过测量水温能直接得到LT50值,快速获取数据;该研究方法更接近自然条件,符合温排水排放造成局部海域水温缓慢升高的现状。但动态温升实验方法的缺点是实验时的温升速率未形成统一的标准,而过慢或过快的升温都有可能会对实验生物的热耐受性评价产生一定的影响(Ospina et al, 2004)。而静态实验将各种因素考虑进去,通过数理统计的方法计算UILT50,能直观地反映实验生物的死亡率与温度之间的关系;但静态实验需要实验生物较多,实验持续时间较长(Bennett et al, 1997);UILT50在数理统计上是在有限的时间内(如24 h)统计某一生物在无限时间内死亡半数的温度值(陈全震等, 2004),需要借助于统计分析方法计算得出,获取数据较慢且存在一定误差。因此,动态实验方法相比静态实验具有经济性、周期短、科学性等优点。LT50作为动态实验中与UILT50所对应的指标可以广泛应用于海洋生物的热耐受性评价中。
3.2 基础水温和温升速率对海洋生物热耐受性的影响生物热耐受能力受多种因素的制约,而基础水温和温升速率被认为是生物热耐受性实验中的重要影响因素。
海洋动物作为变温动物,其种群结构、生长和繁殖均受到环境温度的影响(于欢欢等, 2014; 钱佳慧等, 2015),在适温范围内,适度的温升能提高海洋动物的摄食能力,促进其性成熟,加速生长。在耐温范围内,海洋动物可以被驯化,如超出其耐受范围的限度,就会引起机体机能的损害,甚至造成其死亡。本研究特定温升速率下,4种实验生物的LT50均随基础水温的增大而显著升高(P < 0.05)。口虾蛄在基础水温为8.0℃时,温升速率分别为1.0、3.0、6.0和12.0℃/h时的LT50分别为29.1℃、29.8℃、29.8℃和29.7℃;基础水温为18.0℃,相应温升速率下的LT50分别为32.4℃、33.22℃、33.4℃和34.0℃;而当基础水温为28℃时,LT50相应变为35.5℃、36.1℃、36.2℃和37.4℃。上述研究结果表明,基础水温显著影响实验生物的热耐受能力(P < 0.05),生物的热耐受能力随基础水温升高而增强。这与黄鳍结鱼(Tor putitora)、条纹狼鲈(Morone saxatilis)和虹鳟(Oncorhynchus mykiss)等(Currie et al, 1998; Cook et al, 2006; Akhtar et al, 2013)的热耐受指标的变化趋势一致。类似地,蔡泽平等(1999)研究大亚湾3种经济鱼类,黑鲷(Sparus macrocephalus)、平鲷(Rhadbosargus sarba)和细鳞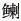
在动态温升研究中,除了基础水温外,温升速率也是影响实验生物热耐受能力的重要因素。一般而言,缓慢升温可以给予实验生物充分的时间适应环境,增强其热耐受能力;而升温速率过快,可能会对实验生物产生热冲击(Barker et al, 1981; Hutchison et al, 1985),对机体造成损伤,加速其死亡。在本研究中,温升速率对受试生物热耐受能力的影响表现为种间和种内的差异性。例如,14.0℃基础水温时,许氏平鲉和口虾蛄的LT50均随温升速率的增大而显著升高(P < 0.05);矛尾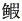
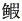
除了基础水温和温升速率之外,生物的热耐受性受很多因素影响,如生活方式、栖息地环境因子、暴露时间、实验生物规格等均能对生物的热耐受性评价产生一定的影响。生物的热耐受能力是物种在生态环境作用下,长期选择、进化的结果,不同生物体对环境温度的耐受范围各不相同(Pörtner, 2001、2002),这与生物的生活方式和栖息地的温度变化紧密相连。生活于环境温度变化较大(广温性)的生物比生活于温度比较稳定(狭温性)的生物适应的温度范围更广(Cossins et al, 1987),热耐受能力更强。如本研究的实验生物日本蟳,在各基础水温、温升速率下,其LT50值均显著高于其他3种实验生物(P < 0.05)(图 1~图 5)。日本蟳属于广温广盐型分布种,广泛分布于我国各海区(梁象秋等, 1996),对高、低温的适应范围广。同一基础水温、温升速率下,随着暴露时间的延长,实验生物热耐受能力有显著变化。马胜伟等(2005)以大黄鱼(Pseudosciaena crocea)、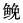
| Akhtar MS, Pal AK, Sahu NP, et al. Thermal tolerance, oxygen consumption and haemato-biochemical variables of Tor putitora juveniles acclimated to five temperatures. Fish Physiology and Biochemistry, 2013, 39(6): 1387-1398 DOI:10.1007/s10695-013-9793-7 | |
| Baker SC, Heidinger RC. Upper lethal temperature tolerance of fingerling black crappie. Journal of Fish Biology, 1996, 48(6): 1123-1129 | |
| Bamber RN. The influence of rising background temperature on the effects of marine thermal effluents. Journal of Thermal Biology, 1995, 20(1-2): 105-110 DOI:10.1016/0306-4565(94)00038-K | |
| Barker SL, Townsend DW, Hacunda JS. Mortalities of Atlantic hearing, Clupea h. harengus, smooth flounder, Liopsetta putnami, and rainbow smelt, Osmerus mordax, larvae expose to acute thermal shock. Fishery Bulletin, 1981, 79(1): 198-200 | |
| Becker CD, Genoway RG. Evaluation of the critical thermal maximum for determining thermal tolerance of freshwater fish. Environmental Biology of Fishes, 1979, 4(3): 245-256 DOI:10.1007/BF00005481 | |
| Beitinger TL, Bennett WA, Mccauley RW. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature. Environmental Biology of Fishes, 2000, 58(3): 237-275 DOI:10.1023/A:1007676325825 | |
| Bennett WA, Beitinger TL. Temperature tolerance of the sheepshead minnow, Cyprinodon variegatus. Copeia,, 1997(1): 77-87 | |
| Cai ZP, Chen HR, Jin QZ, et al. Influence of thermal power effluent on three species of fishes in Daya Bay. Tropic Oceanology, 1999, 18(2): 11-19 [蔡泽平, 陈浩如, 金启增, 等. 热废水对大亚湾三种经济鱼类热效应的研究. 热带海洋, 1999, 18(2): 11-19] | |
| Carter WA. Temperature in relation to fish. Nature, 1887, 36: 213-214 DOI:10.1038/036213a0 | |
| Chen QZ, Zeng JN, Gao AG, et al. Advances in study of temperature of thermal tolerance of fishes. Journal of Fisheries of China, 2004, 28(5): 562-567 [陈全震, 曾江宁, 高爱根, 等. 鱼类热忍耐温度研究进展. 水产学报, 2004, 28(5): 562-567] | |
| Cook AM, Duston J, Bradford RG. Thermal tolerance of a northern population of striped bass Morone saxatilis. Journal of Fish Biology, 2006, 69(5): 1482-1490 DOI:10.1111/jfb.2006.69.issue-5 | |
| Cossins AR, Bowler K. Temperature biology of animals. London, England: Chapman and Hall, 1987 | |
| Cox DK. Effects of the three heating rates on the critical thermal maximum of bluegill. In: Gibbons JW, Sharitz RR (eds). Thermal Ecology AEC Symposium Series. Springfield VA, USA: National Technical Information Service, 1974, 158-163 | |
| Currie RJ, Bennett WA, Beitinger TL. Critical thermal minima and maxima of three freshwater game-fish species acclimated to constant temperatures. Environmental Biology of Fishes, 1998, 51(2): 187-200 DOI:10.1023/A:1007447417546 | |
| Dent L, Lutterschmidt WI. Comparative thermal physiology of two sympatric sunfishes (Centrarchidae: Perciformes) with a discussion of microhabitat utilization. Journal of Thermal Biology, 2003, 28(1): 67-74 | |
| Dou SZ, Nan O, Cao L, et al. A comparative study of the thermal tolerance of four common fish species in Shidao Bay, the Yellow Sea. Marine Sciences, 2017, 41(9): 56-64 DOI:10.11759/hykx2017031002 [窦硕增, 南鸥, 曹亮, 等. 石岛湾四种常见鱼类的热耐受性比较研究. 海洋科学, 2017, 41(9): 56-64] | |
| Elliott JM, Elliott JA. The effect of the rate of the temperature increase on the critical thermal maximum for parr of Atlantic salmon and brown trout. Journal of Fish Biology, 1995, 47(5): 917-919 DOI:10.1111/jfb.1995.47.issue-5 | |
| Fangue NA, Bennett WA. Thermal tolerance responses of laboratory-acclimated and seasonally acclimatized Atlantic stingray, Dasyatis sabina. Copeia, 2003(2): 315-325 | |
| Fu KK, Cao ZD, Fu SJ. Effects of acclimation temperature on thermal tolerance and hypoxia tolerance in Rhodeus ocellatus. Chinese Journal of Ecology, 2015, 34(6): 1586-1590 [付康康, 曹振东, 付世建. 温度驯化对高体鳑鲏热耐受及低氧耐受能力的影响. 生态学杂志, 2015, 34(6): 1586-1590] | |
| Gooseff MN, Strzepek K, Chapra SC. Modeling the potential effects of climate change on water temperature downstream of a shallow reservoir, lower madison river, MT. Climatic Change, 2005, 68(3): 331-353 DOI:10.1007/s10584-005-9076-0 | |
| Hernández RM, Bückle RLF. Temperature tolerance polygon of Poecilia sphenops Valenciennes (Pisces: Poeciliidae). Journal of Thermal Biology, 2002, 27(1): 1-5 | |
| Hutchison VH, Murphy K. Behavioral thermoregulation in the salamander Necturus maculosus after heat shock. Comparative Biochemistry and Physiology Part A: Physiology, 1985, 82(2): 391-394 DOI:10.1016/0300-9629(85)90873-4 | |
| Hutchison VH. Critical thermal maxima in salamanders. Physiological Zoology, 1961, 34(2): 92-125 DOI:10.1086/physzool.34.2.30152688 | |
| Jiang ZB, Zeng JN, Chen QZ, et al. Effect of heating rate on the upper incipient lethal temperature for copepods. Journal of Tropical Oceanography, 2010, 29(3): 87-92 DOI:10.11978/j.issn.1009-5470.2010.03.087 [江志兵, 曾江宁, 陈全震, 等. 不同升温速率对桡足类高起始致死温度的影响. 热带海洋学报, 2010, 29(3): 87-92] | |
| Jiang ZB, Zeng JN, Chen QZ, et al. Effects of residual heat and chlorine in cooling water from coastal power plant on Calanus sinicus. Chinese Journal of Applied Ecology, 2008, 19(6): 1401-1406 [江志兵, 曾江宁, 陈全震, 等. 滨海电厂冷却水余热和余氯对中华哲水蚤的影响. 应用生态学报, 2008, 19(6): 1401-1406] | |
| Kilgour DM, Mccauley RW. Reconciling the two methods of measuring upper lethal temperatures in fishes. Environmental Biology of Fishes, 1986, 17(4): 281-290 DOI:10.1007/BF00001494 | |
| Kivivuori LA, Laheds EO. How to measure the thermal death of Daphnia? A comparison of different heat tests and effects of heat injury. Journal of Thermal Biology, 1996, 21(5-6): 305-311 DOI:10.1016/S0306-4565(96)00014-9 | |
| Liang XQ, Fang JZ, Yang HQ. Hydrobiology. Beijing: China Agriculture Press, 1996. [梁象秋, 方纪祖, 杨和荃. 水生生物学. 北京: 中国农业出版社, 1996.] | |
| Liao YB, Chen QZ, Zeng JN, et al. Thermal tolerance of some marine copepods. Chinese Journal of Applied Ecology, 2008, 19(2): 449-452 [廖一波, 陈全震, 曾江宁, 等. 海洋桡足类的热耐受性. 应用生态学报, 2008, 19(2): 449-452] | |
| Lutterschmidt WI, Hutchison VH. The critical thermal maximum: History and critique. Canadian Journal of Zoology, 1997, 75(10): 1561-1574 DOI:10.1139/z97-783 | |
| Ma SW, Shen AL, Shen XQ. Acute lethal effect of water temperatures on inhomogeneous fishes. Marine Fisheries, 2005, 27(4): 298-303 [马胜伟, 沈盎绿, 沈新强. 水温对不同鱼类的急性致死效应. 海洋渔业, 2005, 27(4): 298-303] | |
| Manush SM, Pal AK, Chatterjee N, et al. Thermal tolerance and oxygen consumption of Macrobrachium rosenbergii acclimated to three temperatures. Journal of Thermal Biology, 2004, 29(1): 15-19 DOI:10.1016/j.jtherbio.2003.11.005 | |
| Mora C, Maya MF. Effect of the rate of temperature increase of the dynamic method on the heat tolerance of fishes. Journal of Thermal Biology, 2006, 31(4): 337-341 DOI:10.1016/j.jtherbio.2006.01.005 | |
| Ospina AF, Mora C. Effect of body size on reef fish tolerance to extreme low and high temperatures. Environmental Biology of Fishes, 2004, 70(4): 339-343 DOI:10.1023/B:EBFI.0000035429.39129.34 | |
| Pörtner HO. Climate change and temperature-dependent biogeography: Oxygen limitation of thermal tolerance in animals. Naturwissenschaften, 2001, 88(4): 137-146 DOI:10.1007/s001140100216 | |
| Pörtner HO. Climate variations and the physiological basis of temperature dependent biogeography: Systemic to molecular hierarchy of thermal tolerance in animals. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2002, 132(4): 739-761 DOI:10.1016/S1095-6433(02)00045-4 | |
| Qian JH, Li ZM, Ye N, et al. Combined effects of temperature and salinity on the growth and survival of Fenneropenaeus meiguiensis. Progress in Fishery Sciences, 2015, 36(3): 62-67 DOI:10.11758/yykxjz.20150310 [钱佳慧, 栗志民, 叶宁, 等. 温度和盐度对墨吉明对虾(Fenneropenaeus meiguiensis)生长与存活的联合效应. 渔业科学进展, 2015, 36(3): 62-67] | |
| Rajaguru S. Critical thermal maximum of seven estuarine fishes. Journal of Thermal Biology, 2002, 27(2): 125-128 DOI:10.1016/S0306-4565(01)00026-2 | |
| Reash RJ, Seegert GL, Goodfellow WL. Experimentally-derived upper thermal tolerances for redhorse suckers: Revised 316(A) variance conditions at two generating facilities in Ohio. Environmental Science and Policy, 2000, 3(Suppl 1): 191-196 | |
| Selong JH, McMahon TE, Zale AV, et al. Effect of temperature on growth and survival of bull trout, with application of an improved method for determining thermal tolerance in fishes. Transactions of the American Fisheries Society, 2001, 130(6): 1026-1037 DOI:10.1577/1548-8659(2001)130<1026:EOTOGA>2.0.CO;2 | |
| Thyrel M, Berglund I, Larsson S, et al. Upper thermal limits for feeding and growth of 0+ Arctic charr. Journal of Fish Biology, 1999, 55(1): 199-210 DOI:10.1111/jfb.1999.55.issue-1 | |
| Vinagre C, Leal I, Mendonça V, et al. Effect of warming rate on the critical thermal maxima of crabs, shrimp and fish. Journal of Thermal Biology, 2015, 47: 19-25 DOI:10.1016/j.jtherbio.2014.10.012 | |
| Wang XJ, Wu DA. Studies on the criteria of water temperature for major cultured freshwater fishes. Journal of Fisheries of China, 1994, 18(2): 93-100 [汪锡钧, 吴定安. 几种主要淡水鱼类温度基准值的研究. 水产学报, 1994, 18(2): 93-100] | |
| Wang YS, Cao ZD, Fu SJ, et al. Thermal tolerance of juvenile Silurus meridionalis Chen. Chinese Journal of Ecology, 2008, 27(12): 2136-2140 [王云松, 曹振东, 付世建, 等. 南方鲇幼鱼的热耐受特征. 生态学杂志, 2008, 27(12): 2136-2140] | |
| Yu HH, Li YL, Chen C, et al. The effects of temperature on the embryonic development and the larval activity of F1 Epinephelus moara (♀)×E. septemfasciatus (♂). Progress in Fishery Sciences, 2014, 35(5): 109-114 DOI:10.11758/yykxjz.20140516 [于欢欢, 李炎璐, 陈超, 等. 温度对云纹石斑鱼(Epinephelus moara)(♀)×七带石斑鱼(Epinephelus septemfasciatus)(♂)杂交F1胚胎发育和仔鱼活力的影响. 渔业科学进展, 2014, 35(5): 109-114] |



