2. 农业农村部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071
脊尾白虾(Exopalaemon carinicauda)因繁殖周期长、卵巢可连续多次发育并抱卵繁殖而为人们所关注,是研究十足目真虾繁殖机制的潜在模式生物。卵黄蛋白原作为卵巢成熟和胚胎发育的营养物质,在卵黄合成期表达并积累,与脊尾白虾的繁殖力紧密相关(栗治国等, 2014)。研究表明,脊尾白虾卵黄蛋白原(Vg)的合成受温度、激素等调控,主要在肝胰腺内合成(张美, 2015; 李志敏等, 2016; 梁俊平等, 2015),这与日本沼虾(Macrobrachium nipponensis)、罗氏沼虾(Macrobrachium rosenbergii)等相似,而与日本对虾(Marsupenaeus japonicus)、短沟对虾(Penaeus vannamei)、中国明对虾(Fenneropenaeus chinensis)等卵黄蛋白原主要在卵巢内合成具有较大区别(Yano et al, 1987; Fainzilber et al, 1992)。组织学观察发现,甲壳动物卵母细胞的成熟伴随着细胞自噬的发生:卵黄发生过程中,卵母细胞内囊泡结构增加,溶酶体通过吞噬线粒体、内质网等细胞器,形成自噬溶酶体并产生卵黄颗粒(王玉凤等, 1999; 赵梦然等, 2009)。Suwansa-ard等(2016)研究发现,甲壳动物自噬标记蛋白含有其他动物自噬蛋白的保守基序,免疫组化分析显示,罗氏沼虾自噬标记蛋白Beclin1、LC3等在卵黄发生的卵母细胞质(阶段3和4)检测呈阳性,而在卵原细胞中不明显。这说明自噬与甲壳动物卵黄发生关系密切,但自噬在甲壳动物卵巢发育中的分子调控尚不清楚。
细胞自噬在哺乳动物中的研究比较深入,可由氧气缺乏、营养缺乏及其他应激所引起,由溶酶体等细胞器介导,在维持细胞内环境稳定、组织发育、肿瘤发生、免疫调节等方面发挥重要作用。缺氧诱导因子(Hif-1)是含有α和β两种亚基的转录因子,可由缺氧环境诱导并激活上百个有利于细胞在低氧环境中生存的基因参与细胞自噬调控。翻译控制肿瘤蛋白(TCTP)可与Hif-1α竞争结合于VHL的β结构域,保护Hif-1α不被降解,从而促进自噬发生(Chen et al, 2013)。Beclin1是哺乳动物自噬体的诱导和成核过程的关键靶位点,可与VPS34、VPS15等形成PI3KⅢ复合物正调控细胞自噬,是自噬形成的关键(Funderburk et al, 2010)。凋亡蛋白Bcl-2可以与Beclin1结合抑制PI3KⅢ复合物形成,从而负调控自噬的发生(He et al, 2010)。
翻译控制肿瘤蛋白(Translationally controlled tumor protein, TCTP)是一种在真核细胞中广泛表达的高保守多功能蛋白,因在大多数癌症细胞中高表达而闻名,以促增殖、促发育和参与免疫调节等功能而为人们所熟知(Batisti et al, 2012)。哺乳动物TCTP的多功能性早已得到证实,调节机制的研究也较多。TCTP的Ser46残基磷酸化可调节细胞骨架稳定性(Yarm, 2002)。TCTP通过与Oct4启动子的SF1位点结合调节细胞分化(Cheng et al, 2012)。TCTP可通过与mTOR信号通路成员的相互作用来调节细胞的增殖、凋亡等(Bommer et al, 2015; Chuang et al, 2016)。另外,Chen等(2013、2014)研究发现,TCTP还在哺乳动物细胞自噬中具有重要的调节作用,通过AMPK-ULK1通路激活了mTOR下游表达起始细胞自噬,同时它还可通过HIF-1α调节自噬活性。随着Bangrak等(2004)发现,TCTP在对虾抗病毒中具有重要作用,TCTP在甲壳动物中的免疫作用成为研究热点。Leu等(2013)进一步研究证实,对虾Pm-fortilin(TCTP同源类似物)可被WSSV诱导表达,通过Bax抑制线粒体触发的细胞凋亡。近年来,越来越多的研究发现,许多甲壳动物TCTP在其卵巢成熟的早期阶段呈显著性高表达,普遍认为这与卵母细胞组装细胞骨架相关。Loongyai(2007)等还发现,TCTP可与EF-1α形成聚合物,通过细胞增殖促进卵巢发育。Makkapan等(2011)研究表明,5-羟色胺可通过促进TCTP在墨吉对虾(Penaeus merguiensis)卵巢中的表达促进卵巢发育,同时上调的还有甲基法尼脂。
本研究通过克隆脊尾白虾TCTP基因,并研究自噬调控基因TCTP、Hif-1α、Beclin1和Bcl-2等在脊尾白虾卵巢发育期肝胰腺和卵巢中的表达,阐释自噬在脊尾白虾卵巢发育中的作用,为理解脊尾白虾卵黄蛋白原合成的分子调控过程、提高脊尾白虾繁殖力提供理论基础。
1 材料与方法 1.1 实验材料实验用脊尾白虾购自山东日照海辰水产有限公司。
1.2 实验试剂Trizol试剂购自美国Ambion公司;反转录试剂盒Primescript RT Reagent Kit with gDNA Eraser、SmartTM RACE cDNA Amplification Kit、PMD18-T载体、大肠杆菌感受态细胞DH5α、定量试剂盒SYBR® Premix Ex TaqTM和dNTP购自大连TaKaRa公司;HiFi Taq酶购自TransGen Biotech公司;DL2000 Marker购自天根生物有限公司;琼脂糖凝胶胶回收试剂盒购自康为世纪有限公司;其他试剂为国产分析纯。
1.3 实验方法 1.3.1 脊尾白虾TCTP基因克隆取健康活泼个体的组织,按照Trizol试剂说明书提取脊尾白虾总RNA,检测其完整性及含量。按照Primescript RT Reagent Kit with gDNA Eraser说明书合成cDNA第一链。按照SmartTM RACE cDNA Amplification Kit说明书合成RACE-Ready-cDNA。
参照脊尾白虾转录组和NCBI上Blast的比对结果,利用Primer 5.0软件设计特异性引物,对中间片段进行克隆,以合成的cDNA第一链为模板进行PCR扩增,反应体系为Premix Ex TaqTM 5 μl;正反向引物各0.4 μl;模板0.5 μl;灭菌双蒸水3.7 μl。反应程序:95℃ 5 min;95℃ 35 s,60℃ 30 s,72℃ 1 min,共35个循环;72℃ 10 min;4℃保存。扩增产物电泳检测,送生工生物工程(上海)股份有限公司测序,与转录组序列比对验证。
3′/5′RACE以扩增出来的中间片段为参考,设计3′RACE引物和5′RACE引物。以RACE-Ready-cDNA为模板进行PCR扩增,反应体系为模板0.5 μl,dNTP 0.8 μl,UPM引物2.5 μl,3′/5′RACE引物0.5 μl,HiFi Buffer(10×)1 μl,HiFi Taq酶0.1 μl,灭菌双蒸水4.5 μl。反应程序为95℃ 4 min;95℃ 30 s,61℃ 30 s,72℃ 1 min,每循环降落0.5℃,共11个循环;95℃ 30 s,55℃ 30 s,72℃ 1 min,共24个循环;72℃ 10 min;4℃保存。扩增产物用琼脂糖凝胶电泳检测,根据胶回收试剂盒说明书对电泳的目的条带进行切胶回收。回收的DNA溶液与pMD18-T载体连接,用热激法转入大肠杆菌感受态细胞,用氨苄青霉素培养基筛选,挑取阳性克隆单一菌落,菌落PCR验证并测序。
将3′/5′RACE以及中间片段的测序结果利用DNAstar软件拼接,获得脊尾白虾TCTP cDNA全长并找到ORF,翻译为氨基酸序列,将该序列与NCBI数据库中的同源序列进行比对验证。
1.3.2 脊尾白虾TCTP同源序列的多重比对和进化树分析在NCBI数据库中查找不同物种TCTP的同源序列,运用软件ClustalX 2.0.11和DNAMAN对不同动物TCTP的氨基酸序列进行多重比对分析。再根据比对信息,利用MEGA 5.0软件的Neighbor- joining法构建系统进化树。
1.3.3 脊尾白虾TCTP蛋白的生物信息学分析脊尾白虾TCTP蛋白理化性质分析,用Protparam软件预测脊尾白虾TCTP蛋白的氨基酸组成、等电点、分子量、分子式、脂溶指数和不稳定指数等;通过Predictprotein软件从PROSITE数据库搜索模体,预测该蛋白的潜在功能域等;运用NCBI的Conserved domain search功能预测该蛋白的保守结构域。
1.3.4 脊尾白虾TCTP基因的Real-time PCR定量检测根据栗治国等(2014)对卵巢发育的分期,对健康脊尾白虾的肝胰腺和卵巢组织取样,并进行荧光定量分析。参照脊尾白虾转录组,通过在NCBI数据库比对,找到自噬调控基因(Beclin1、TCTP、Hif-1α和Bcl-2)的部分序列,并利用Primer 5.0软件设计荧光定量引物(表 1)。以18S为内参,按照荧光定量试剂盒的说明书加样,使用ABI 7500 Fast Real-time仪器测定结果,采用2‒∆∆Ct法计算脊尾白虾自噬调控基因在卵巢发育过程中的相对表达量,用SPSS17.0软件进行显著性分析。
|
|
表 1 本研究所用引物序列 Table 1 Primers used in this study |
本研究克隆得到脊尾白虾TCTP基因cDNA序列,命名为EcTCTP,该基因全长为732 bp (GenBank No. KY411921),包括5′非编码区76 bp、3′非编码区149 bp以及开放阅读框507 bp,共编码168个氨基酸,理论等电点为4.48,分子量约为18.769 kDa (图 1)。具有TCTP1和TCTP2两个保守结构域。

|
图 1 脊尾白虾TCTP基因序列和氨基酸序列 Figure 1 The full-length cDNA sequence and deduced amino acid sequence of EcTCTP ATG为起始密码子,TAG为终止密码子,下划线为蛋白激酶C磷酸化位点,椭圆为酪氨酸激酶Ⅱ磷酸化位点 ATG is the start codon, TAG is the stop codon, protein kinase C phosphorylation sites is underlined, casein kinase Ⅱ phosphorylation sites is indicated by ellipse |
不同物种TCTP氨基酸序列进行多重比对结果见图 2。从图 2可以看出,不同物种TCTP既有高保守序列也有一定的差异序列。脊尾白虾TCTP与中华绒螯蟹(Eriocheir sinensis)序列一致性最高,各种属之间的TCTP序列保守性较好,但不同种属(如甲壳动物和哺乳动物)之间却有明显差异,比如:甲壳动物TCTP不含半胱氨酸残基(Cys)。

|
图 2 脊尾白虾TCTP与其他物种TCTP氨基酸序列多重比对
Figure 2 Multiple alignment of TCTP amino acids of E. carinicauda and other animals
ABB05535.1:中国明对虾Fenneropenaeus chinensis; ABZ90154.1:日本囊对虾Marsupenaeus japonicus; KY411921:脊尾白虾Exopalaemon carinicauda; ACR58988.1:印度明对虾Fenneropenaeus indicus; ABY55541.1:凡纳滨对虾Litopenaeus vannamei; AEF32710.1:中华绒螯蟹:Eriocheir sinensis; NP_937783.1:斑马鱼Danio rerio; ABD65408.1:大菱鲆Scophthalmus maximus ; NP_033455.1:小家鼠Mus musculus; AAQ01550.1:智人Homo sapiens; NP_001253308.1:猕猴Macaca mulatta; ▲: GTPase结合槽GTPase binding groove;  : TCTP1和TCTP2功能域TCTP1 and TCTP2 functional domain; : TCTP1和TCTP2功能域TCTP1 and TCTP2 functional domain;  :甲壳动物C末端的亮氨酸(Leu)和其他物种C末端的半胱氨酸(Cys) Leucine at the end of C in crustacean and Cysteine at the end of C in other animals :甲壳动物C末端的亮氨酸(Leu)和其他物种C末端的半胱氨酸(Cys) Leucine at the end of C in crustacean and Cysteine at the end of C in other animals
|
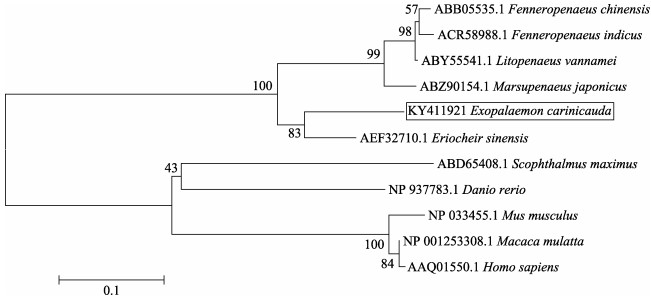
构建进化树如图 3,哺乳动物聚为一支,甲壳动物聚为一支;甲壳动物中脊尾白虾与同为抱卵亚目的中华绒螯蟹进化关系最近,置信度为82;产卵亚目的中国明对虾、印度明对虾、凡纳滨对虾和日本对虾聚为一支。
|
图 3 不同物种TCTP氨基酸序列进化树 Figure 3 Phylogenetic tree analysis of TCTP amino acid sequences |
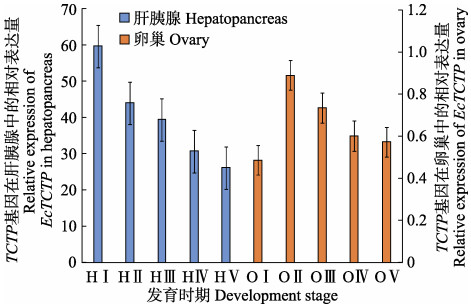
TCTP基因在脊尾白虾卵巢发育过程中的组织表达见图 4。如图 4所示,肝胰腺中的TCTP基因在卵巢发育增殖期表达量最高并显著高于其他时期(P<0.05),然后持续下降,在产后恢复期达到最低值。卵巢中TCTP基因在增殖期表达量最低,在小生长期表达量达到最高值并显著高于成熟期和产后恢复期(P<0.05),从小生长期到产后恢复期表达量持续下降。肝胰腺中TCTP的表达总量是卵巢中TCTP表达总量的60倍左右。
|
图 4 EcTCTP在脊尾白虾卵巢各发育期的相对表达 Figure 4 Relative expression of EcTCTP in different development stages of ovary in E. carinicauda H:肝胰腺;O:卵巢;Ⅰ:增殖期;Ⅱ:小生长期;Ⅲ:大生长期;Ⅳ:成熟期;Ⅴ:产后恢复期。下同 H: Hepatopancreas; O: Ovary; Ⅰ: Proliferative phase; Ⅱ: Niche long term; Ⅲ: Long term; Ⅳ: Maturity; Ⅴ: Postpartum recovery period. The same as below |
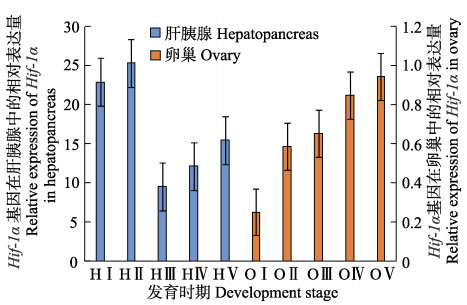
Hif-1α基因在脊尾白虾卵巢发育过程中的组织表达见图 5。如图 5所示,肝胰腺中的Hif-1α在卵巢发育增殖期和小生长期表达量最高,且无显著性差异,在大生长期急剧下降到最低值并极显著低于前2期(P<0.01),大生长期与成熟期无显著差异,但显著低于产后恢复期(P<0.05)。卵巢中的Hif-1α基因在卵巢发育的增殖期表达量最低,显著低于小生长期(P<0.05),从小生长期到产后恢复期持续升高,并在产后恢复期表达量达到最高,其中,小生长期和大生长期表达量无显著性差异。肝胰腺中Hif-1α的整体表达量约为卵巢中表达量的26倍。
|
图 5 Hif-1α基因在脊尾白虾卵巢各发育期的相对表达 Figure 5 Relative expression of Hif-1α in different development stages of ovary in E. carinicauda |
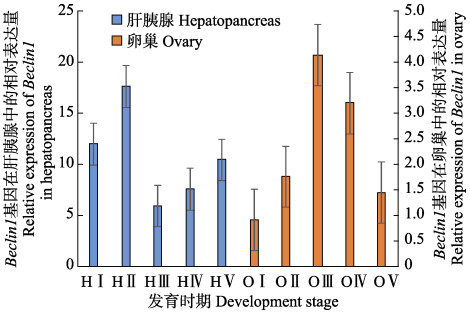
脊尾白虾Beclin1基因(Ec-Beclin1)在卵巢发育过程中的组织表达如图 6所示,肝胰腺中的Ec- Beclin1从增殖期到小生长期表达量上升,大生长期表达量极显著下降(P<0.01)并达到最低,从大生长期到产后恢复期表达量回升(P<0.05)。卵巢中的Ec- Beclin1从增殖期到小生长期表达量上升,大生长期表达量极显著上升并达到最高(P<0.01),成熟期和产后恢复期的表达量极显著下降(P<0.01)。
|
图 6 Ec-Beclin1在脊尾白虾卵巢各发育期的相对表达 Figure 6 Relative expression of Ec-Beclin1 in different development stages of ovary in E. carinicauda |
Bcl-2基因在脊尾白虾卵巢发育发育过程中的表达量如图 7所示:肝胰腺中Bcl-2基因从增殖期到小生长期表达极显著上调(P<0.01),大生长期极显著下降并达到最低值(P<0.01),成熟期和产后恢复期表达量逐渐升高但差异不显著。卵巢中Bcl-2基因从增殖期到小生长期表达量上升,但差异不显著,大生长期表达极显著下降(P<0.01)并达到最低,成熟期和产后恢复期表达量均发生极显著上升(P<0.01),在大生长期表达量最低,产后恢复期表达量最高。
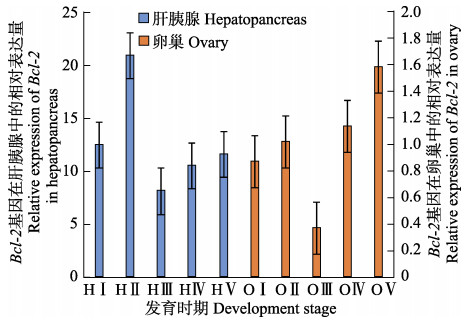
|
图 7 Bcl-2基因在脊尾白虾卵巢各发育期的相对表达 Figure 7 Relative expression of Bcl-2 in different development stages of ovary in E. carinicauda |
通过序列多重比对发现,不同物种TCTP都具有保守功能域TCTP1和TCTP2,而且发现Glu12、Leu74、Glu132等位点的保守性极高。Dong等(2009)研究表明,Glu12等构成了人类TCTP的GTPase结合槽,可通过与Rheb的Lys45形成盐桥,交换鸟嘌呤激活Rheb的GTPase活性,从而调控mTOR信号通路。功能域预测发现,脊尾白虾TCTP蛋白含有蛋白激酶C(PKC)磷酸化位点和酪氨酸激酶Ⅱ(KTⅡ)磷酸化位点等,而PKC和KTⅡ都是mTOR信号通路成员,可以通过该通路调节细胞的生长增殖和存活(Guertin et al, 2006)。所以,脊尾白虾TCTP可能通过与免疫生长相关的mTOR信号通路参与生命活动的调节。
在卵巢各发育时期,自噬相关基因在脊尾白虾卵黄蛋白原合成器官中发挥着不同的调控作用。卵巢发育期,脊尾白虾肝胰腺TCTP基因在增殖期表达量最高,之后表达量持续下降,这与脊尾白虾肝胰腺甲基法尼脂转移酶的表达趋势具有相似性(李志敏等, 2016),且与墨吉对虾TCTP基因在卵巢中的表达趋势具有一致性(Loongyai et al, 2007)。脊尾白虾TCTP在卵巢发育的小生长期表达量最高,这与栗治国等(2014)发现的脊尾白虾卵巢小生长期开始出现内源性卵黄合成期卵母细胞相符。Makkapan等(2011)用5-羟色胺(5-HT)处理刀额新对虾(Metapenaeus ensis)卵巢,发现5-HT可促进甲基法尼脂(MF)释放入血淋巴,并促进卵巢发育至卵黄成熟期,还可使卵巢外植体中的TCTP基因表达上调。
脊尾白虾Hif-1α基因在肝胰腺中的表达量远高于卵巢,肝胰腺Hif-1α的表达趋势与外源性卵黄蛋白原的表达趋势大致相反,即在外源性卵黄蛋白原表达量低的时期(增殖期和小生长期),肝胰腺Hif-1α表达量高,在外源性卵黄蛋白原表达量高的时期(大生长期和成熟期),肝胰腺Hif-1α表达量低;卵巢Hif-1α的表达趋势与内源性卵黄蛋白原的表达趋势基本一致,均是从增殖期到产后恢复期持续增高(梁俊平等, 2015)。这说明,适当的缺氧微环境可能是脊尾白虾卵巢发育所必需的。栗治国等(2014)发现,脊尾白虾卵巢无隔室,无血管和血窦,并猜测这与脊尾白虾卵巢体积小、氧气便于运输相关,本研究从一定程度上验证了该猜测。
脊尾白虾肝胰腺中的Beclin1基因与Hif-1α基因的表达趋势相一致。唐中园等(2015)研究上皮性卵巢癌时发现,低氧下敲除Hif-1α后,Beclin1表达下降,并认为低氧可诱导Hif-1α表达,促进卵巢自噬的发生。Beclin1基因可介导其他自噬蛋白定位于前自噬小体,是自噬发生的关键靶点(段振玲等, 2007)。因此,脊尾白虾肝胰腺Beclin1基因可能在Hif-1α的调节下参与自噬的发生,并与外源性卵黄蛋白原合成相关。卵巢中Beclin1基因的表达从增殖期到大生长期表达量不断升高,并在大生长期达到最高,在成熟期和产后恢复期Beclin1基因的表达量又下降,这与脊尾白虾蜕皮激素受体(EcR)在卵巢中的表达趋势相似(梁俊平, 2015),可能与蜕皮激素受体的表达具有相关性。梁俊平等(2015)认为,脊尾白虾卵巢和肝胰腺中EcR均参与了卵黄蛋白原合成,且可能对卵巢的多次成熟具有调节作用。因此,脊尾白虾自噬相关基因Beclin1可能在肝胰腺和卵巢合成卵黄蛋白原的过程中发挥调节作用。
脊尾白虾肝胰腺Bcl-2基因小生长期表达量最高,整个表达趋势与Beclin1基因一致。研究表明,凋亡蛋白Bcl-2可通过BH3结构域与Beclin1蛋白相结合,从而抑制细胞自噬作用,可能对细胞最终走向自噬凋亡起着关键作用(Pattingre et al, 2005; He et al, 2010; 叶挺等, 2013)。这说明脊尾白虾肝胰腺Bcl-2可能通过与Beclin1结合抑制发育早期自噬的发生并促进大生长期和成熟期发生自噬。研究表明,大生长期和成熟期是肝胰腺外源性卵黄蛋白原合成旺盛期(梁俊平等, 2015),这说明肝胰腺Bcl-2可能通过对自噬的调节促进外源性卵黄蛋白原的合成。脊尾白虾卵巢Bcl-2基因在卵巢发育大生长期表达量最低,整体表达趋势与脊尾白虾卵巢Beclin1基因的表达趋势相反。Bcl-2蛋白可以通过抑制Beclin1与VPS34共结合发挥抑制自噬的作用,说明脊尾白虾卵巢Bcl-2基因与Beclin1基因协同作用,共同促进大生长期发生自噬,而抑制其他时期的自噬。又由于小生长期和大生长期是内源性卵黄蛋白合成期卵母细胞主要存在的时期(栗治国等, 2014),因此,Bcl-2和Beclin1基因在卵巢中的表达共同促进自噬的发生可能与参与内源性卵黄蛋白原的合成相关。
综上所述,卵巢发育时期脊尾白虾自噬调控基因TCTP、Hif-1α、Beclin1和Bcl-2相互协调,可能通过自噬作用参与脊尾白虾卵黄蛋白原的调节促进卵巢发育。
4 小结本研究克隆得到了脊尾白虾TCTP基因全长并对该蛋白的结构和功能进行了预测。另外,通过研究卵巢发育期自噬相关基因在脊尾白虾肝胰腺和卵巢中的表达,阐述了卵黄蛋白原合成过程中4种自噬相关基因的调控趋势。为阐明脊尾白虾卵黄蛋白原合成的分子调控过程、提高脊尾白虾繁殖力提供了理论基础,也为环境测评和毒理学研究提供了基础数据。
Bangrak P, Graidist P, Chotigeat W, et al. Molecular cloning and expression of a mammalian homologue of a translationally controlled tumor protein (TCTP) gene from Penaeus monodon shrimp. Journal of Biotechnology, 2004, 108(3): 219-226 DOI:10.1016/j.jbiotec.2003.12.007 |
Batisti C, Ambrosio MR, Rocca BJ, et al. Translationally controlled tumour protein (TCTP) is present in human cornea and increases in herpetic keratitis. Diagnostic Pathology, 2012(7): 90 |
Bommer UA, Iadevaia V, Chen JZ, et al. Growth-factor dependent expression of the translationally controlled tumour protein TCTP is regulated through the PI3-K/AKT/mTORC1 signalling pathway. Cellular Signalling, 2015, 27(8): 1557-1568 DOI:10.1016/j.cellsig.2015.04.011 |
Chen K, Chen SL, Huang CH, et al. TCTP increases stability of hypoxia-inducible factor 1α by interaction with and degradation of the tumour suppressor VHL. Biology of the Cell, 2013, 105(5): 208-218 DOI:10.1111/boc.201200080 |
Chen K, Huang CH, Yuan J, et al. Long-term artificial selection reveals a role of TCTP in autophagy in mammalian cells. Molecular Biology and Evolution, 2014, 31(8): 2194-2211 DOI:10.1093/molbev/msu181 |
Cheng X, Li JH, Deng J, et al. Translationally controlled tumor protein (TCTP) downregulates Oct4 expression in mouse pluripotent cells. BMB Reports, 2012, 45(1): 20-25 DOI:10.5483/BMBRep.2012.45.1.20 |
Chuang WL, Lin PY, Lin HC, et al. The apoptotic effect of ursolic acid on SK-Hep-1 cells is regulated by the PI3K/Akt, p38 and JNK MAPK signaling pathways. Molecules, 2016, 21(4): 460 DOI:10.3390/molecules21040460 |
Dong XC, Yang B, Li YJ, et al. Molecular basis of the acceleration of the GDP-GTP exchange of human Ras homolog enriched in brain by human translationally controlled tumor protein. Journal of Biological Chemistry, 2009, 284(35): 23754-23764 DOI:10.1074/jbc.M109.012823 |
Duan ZL, Peng ZL, Wang ZH. Expression and involved signal transduction pathway of autophagy gene beclin 1 in epithelial ovarian cancer. Journal of Sichuan University (Medical Science Edition), 2007, 38(2): 239-242 [ 段振玲, 彭芝兰, 王赞宏. 上皮性卵巢癌中自噬基因Beclin 1的表达及其调控相关信号传导途径的研究. 四川大学学报(医学版), 2007, 38(2): 239-242] |
Fainzilber M, Tom M, Shafir S, et al. Is there extraovarian synthesis of vitellogenin in penaeid shrimp?. Biological Bulletin, 1992, 183(2): 233-241 DOI:10.2307/1542210 |
Funderburk SF, Wang QJ, Yue ZY, et al. The beclin 1-VPS34 complex-at the crossroads of autophagy and beyond. Trends in Cell Biology, 2010, 20(6): 355-362 DOI:10.1016/j.tcb.2010.03.002 |
Guertin DA, Stevens DM, Thoreen CC, et al. Ablation in mice of the mTORC components raptor, rictor, or mLST8 reveals that mTORC2 is required for signaling to Akt-FOXO and PKC alpha but not S6K1. Developmental Cell, 2006, 11(6): 859-871 DOI:10.1016/j.devcel.2006.10.007 |
He C, Levine B. The beclin 1 interactome. Current Opinion in Cell Biology, 2010, 22(2): 140-149 DOI:10.1016/j.ceb.2010.01.001 |
Leu JH, Lin SJ, Huang JY, et al. A model for apoptotic interaction between white spot syndrome virus and shrimp. Fish and Shellfish Immunology, 2013, 34(4): 1011-1017 DOI:10.1016/j.fsi.2012.05.030 |
Li ZG, Zhang CS, Li FH, et al. Histological study on the gonadal development of Exopalaemon carinicaudal (Holthuis, 1950). Journal of Fisheries of China, 2014, 38(3): 362-370 [ 栗治国, 张成松, 李富花, 等. 脊尾白虾的性腺发育及组织结构观察. 水产学报, 2014, 38(3): 362-370] |
Li ZM, Li J, Li JT, et al. The expression analysis of farnesoic acid O-methyl transferase (FAMeT) gene during the ovarian development cycles of Exopalaemon carinicaudal. Progress in Fishery Sciences, 2016, 37(1): 46-51 [ 李志敏, 李健, 李吉涛, 等. 脊尾白虾(Exopalaemon carinicaudal) FAMeT基因在卵巢发育周期中的表达分析. 渔业科学进展, 2016, 37(1): 46-51 DOI:10.11758/yykxjz.20141217001] |
Liang JP, Wang Y, Duan YF, et al. Molecular cloning of ecdysteroid receptor and its expression during the ovarian development and embryogenesis of Exopalaemon carinicauda. Journal of Fisheries of China, 2015, 39(7): 942-952 [ 梁俊平, 王芸, 段亚飞, 等. 脊尾白虾EcR基因的克隆及其在卵巢和胚胎发育过程中的表达分析. 水产学报, 2015, 39(7): 942-952] |
Loongyai W, Phongdara A, Chotigeat W, et al. Cloning and expression of a TCTP homolog from the ovaries of banana prawn. Marine Biology, 2007, 150(3): 455-462 |
Makkapan W, Maikaeo L, Miyazaki T, et al. Molecular mechanism of serotonin via methyl farnesoate in ovarian development of white shrimp:Fenneropenaeus merguiensis de Man. Aquaculture, 2011, 321(1-2): 101-107 DOI:10.1016/j.aquaculture.2011.08.016 |
Pattingre S, Tassa A, Qu XP, et al. Bcl-2 antiapoptotic proteins inhibit beclin 1-dependent autophagy. Cell, 2005, 122(6): 927-939 DOI:10.1016/j.cell.2005.07.002 |
Suwansa-ard S, Kankuan W, Thongbuakaew T, et al. Transcriptomic analysis of the autophagy machinery in crustaceans. BMC Genomics, 2016, 17: 587 DOI:10.1186/s12864-016-2996-4 |
Tang ZY, Zhang N, Di W, et al. Regulation of hypoxia-induced autophagy by hypoxia-inducible factor-1α. Journal of Shanghai Jiaotong University (Medical Science), 2015, 35(12): 1804-1808 [ 唐中园, 张宁, 狄文, 等. 缺氧诱导因子-1α对低氧诱导自噬的调控作用. 上海交通大学学报(医学版), 2015, 35(12): 1804-1808] |
Wang YF, Du NS, Lai W. Studies on the relationship of organelles in oocyte with vitellogenesis of Macrobrachium rosenbergii. Acta Hydrobiologica Sinica, 1999, 23(1): 24-28 [ 王玉凤, 堵南山, 赖伟. 罗氏沼虾卵母细胞细胞器与卵黄发生的关系. 水生生物学报, 1999, 23(1): 24-28] |
Yano I, Chinzei Y. Ovary is the site of vitellogenin synthesis in kuruma prawn, Penaeus japonicus. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1987, 86(2): 213-218 DOI:10.1016/0305-0491(87)90280-X |
Yarm FR. Plk phosphorylation regulates the microtubule-stabilizing protein TCTP. Molecular and Cellular Biology, 2002, 22(17): 6209-6221 DOI:10.1128/MCB.22.17.6209-6221.2002 |
Ye T, Shao ZW. The function of Bcl-2/Beclin-1 complex in autophagy regulation. Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(6): 513-519 [ 叶挺, 邵增务. Bcl-2/Beclin-1复合体在自噬中的调节作用. 中国生物化学与分子生物学报, 2013, 29(6): 513-519] |
Zhang M. Cloning and expression analysis of hyperglycemic hormone family gene from Exopalaemon carinicauda after function research. Masterxs Thesis of Dalian Ocean University, 2015[张美. 脊尾白虾高血糖激素家族基因的克隆、表达及功能研究. 大连海洋大学硕士研究生学位论文, 2015]
|
Zhao MR, Kang XJ, Mu SM, et al. Ultrastructure of the vitellogenesis in the oocytes of Neocaridina denticulata sinensis. Journal of Hebei University(Natural Science Edition), 2009, 29(3): 318-323, 328 [ 赵梦然, 康现江, 穆淑梅, 等. 中华锯齿米虾卵母细胞卵黄发生的超微结构. 河北大学学报(自然科学版), 2009, 29(3): 318-323, 328] |



