2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
2010年6月我国南方突发凡纳滨对虾(Litopenaeus vannamei)大量死亡的情况,在放苗后7~31 d出现肝胰腺萎缩、发黄,死亡率达90% (张宝存等, 2012),同时,越南也出现了类似病害(Tran et al, 2013),在2010~ 2014年期间,该病扩散到了东南亚的马来西亚、泰国以及美洲的墨西哥(Nunan et al, 2014; Sotorodriguez et al, 2014; Joshi et al, 2014)。该疫病早先被称为早期死亡综合征(Early mortality syndrome, EMS),对虾发病后的典型症状主要包括肝胰腺颜色变浅、萎缩、空肠空胃、甲壳变软、失去活力等(FAO, 2013; Han et al, 2015a; la Peña et al, 2015),对感染地区的对虾养殖业造成了严重的经济损失(Flegel et al, 2012; Lightner et al, 2012)。张宝存等(2012)最早报道从发病对虾中分离到1株高毒力及耐药的副溶血弧菌(Vibrio parahaemolyticus),Tran等(2013)研究表明,导致该病的病原是副溶血弧菌,因病原和病理的明确,该病被重新命名为急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease, AHPND) (FAO, 2013),导致AHPND的副溶血弧菌(AHPND-causing Vibrio parahaemolyticus, VpAHPND)携带含毒力基因pirAVp和pirBVp的pVA1-like质粒(Han et al, 2015b; Lee et al, 2015; Yang et al, 2013),该质粒大小为70 kbp,可表达毒力蛋白PirABVp (PirAVp和PirBVp),该蛋白是AHPND的致病因子(Lee et al, 2015)。
目前,多数国内外研究者普遍采用Tran等(2013)建立的人工感染方法,使用高浓度(108 CFU/ml)的VpAHPND浸泡幼虾15 min,然后持续在含低浓度(106 CFU/ml)的VpAHPND水体中养殖和观察,成功感染的对虾可能在24~72 h内接近100%的死亡,并出现典型的AHPND症状,包括肝胰腺色浅、空肠空胃等,病理变化主要表现为肝胰腺小管上皮细胞变薄、脱落。在养殖过程中,水体中的病原达到如此高的浓度实现直接感染比较困难,绝大多数情况为中低浓度的感染,感染过程中,对虾的临床症状逐渐发生变化。基于这样的研究背景,本研究围绕凡纳滨对虾VpAHPND病原感染-病理变化-临床表征的相关性这一关键科学问题,通过对健康凡纳滨对虾进行低浓度的浸泡感染实验,采取组织病理学和荧光定量PCR等技术手段确定被感染凡纳滨对虾临床表征、病理变化与VpAHPND在体内的组织分布与载量的相关性,为AHPND的诊断、防控和生物安保体系提供理论基础。
1 材料与方法 1.1 菌种副溶血弧菌菌株20130629002S01为中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室保存菌株,于2013年6月分离自广西北海发病凡纳滨对虾幼虾,经鉴定带有毒力基因pirAVp和pirBVp,确定为致AHPND副溶血弧菌(VpAHPND),且完成了全基因组序列测定。
1.2 对虾体重为1 g左右的健康凡纳滨对虾购自山东东营对虾工厂化养殖场,将对虾分装到50 L水族箱中,保持水温恒定为(27±2)℃,每天投喂饲料1次,换水1次,每次换水量约为20%,在进行感染实验前于本实验室暂养约7 d。
1.3 病原检测随机采集128尾对虾,参照OIE (2017)水生动物疾病诊断手册及已发表文献中的PCR方法进行病原检测,包括白斑综合征病毒(WSSV)、黄头病毒(YHV)、传染性皮下及造血组织坏死病毒(IHHNV)、传染性肌坏死病毒(IMNV)、桃拉综合征病毒(TSV)、偷死病野田村病毒(CMNV) (Zhang et al, 2014)、虾肝肠胞虫(EHP) (Tang et al, 2015)和致急性肝胰腺坏死病副溶血弧菌(VpAHPND) (Sirikharin et al, 2014)。
1.4 qPCR质粒构建及标准曲线制作用引物扩增长度为135 bp的pirAVp基因片段(表 1),连接到pGEM-T载体上构建重组质粒pVpPirA-1 (Han et al, 2015b),转入大肠杆菌(Escherichia coli)后扩大培养提取质粒,Nanodrop 2000准确测定浓度,然后进行10倍梯度稀释,进行荧光定量PCR,制作标准曲线。
|
|
表 1 VpAHPND pirAVp基因实时荧光定量PCR方法的引物和探针序列 Table 1 The primers and probe sequence of the qPCR method for pirAVp gene of VpAHPND |
取150尾凡纳滨对虾,随机分成5组,1~4组为实验组,5组为对照组,每组设3个重复,每个重复20尾,早晚各投喂1次,每天换水1次。将菌株20130629002S01接种于含2% NaCl的TSB(TSB+)液体培养基中,摇床155 r/min、28℃培养12 h,8000 r/min离心5 min,收集沉淀,用灭菌海水重悬,测定浓度为109 CFU/ml。将细菌悬液加到水体中,使其浓度依次为108、107、106和105 CFU/ml,每天换水后补加菌液,整个感染实验中维持水体中菌的浓度不变;对照组添加等量海水。实验观察6 d,每日定时投喂并换水,记录死亡对虾尾数,计算20130629002S01对凡纳滨对虾的半致死量(LD50),用无菌牙签沾取肝胰腺部位接种到灭菌2216E培养基中,进行VpAHPND菌株20130629002S01重新分离鉴定。
1.6 人工感染实验设置实验组和对照组,每个组设3个平行,每个平行20尾凡纳滨对虾,置于50 L水族箱中,保持水温恒定为(27±2)℃,早晚各投喂1次。实验组采用菌液浸泡感染,根据VpAHPND菌株20130629002S01对凡纳滨对虾的毒力检测结果,水体中加入的菌液浓度约为2.19×105 CFU/ml,每天换水后补加菌液,整个感染实验中维持水体中菌的浓度不变;对照组添加等量海水。
1.7 组织病理学观察人工感染后,对照组随机选取凡纳滨对虾实验组分别于24、48、72 h选取出现肝胰腺发白、萎缩,疑似感染VpAHPND对虾和已失去活力的濒死对虾,将对虾肝胰腺从头胸甲中线切开,一半采用Davidson’s AFA固定液固定(Bell et al, 1988),另一半肝胰腺提取DNA用于qPCR检测;Davidson’s AFA固定液固定的头胸甲组织,经过梯度脱水、透蜡、切片后进行HE染色,中性树脂封片后进行组织病理学观察。
1.8 样本采集和qPCR检测浸泡感染2~9 d,对照组每天随机选取对虾、实验组每天对濒死凡纳滨对虾肝胰腺、鳃、中后肠道、尾节肌肉进行取样,每个组分别采3尾,每个平行1尾,将组织样品装入1.5 ml空无菌离心管并称重。依据海洋动物组织基因组DNA提取试剂盒(天根生化科技公司, 北京)说明书进行对虾样品DNA的提取,加入50 μl无RNase水溶解,并用核酸蛋白测定仪测定其准确浓度和纯度,实时荧光定量PCR方法检测各组织中VpAHPND数量。
2 结果 2.1 实验虾的检测对随机取样的128尾实验用虾,采用OIE(2017)标准和文献报道的方法对其进行病原检测,检测结果表明,WSSV、YHV、IHHNV、IMNV、TSV、CMNV、EHP和VpAHPND均为阴性。
2.2 qPCR标准曲线提取重组质粒pVpPirA-1,调整其浓度为1.0× 109 copies/μl DNA,对已知浓度的pVpPirA-1进行梯度稀释,以稀释的梯度溶液为模板进行qPCR扩增,确定其标准曲线灵敏度为10 copies/μl DNA,标准曲线的R2=0.993,回归方程为:
| $ Ct = -3.235 \times {\rm{Lg}}\left(N \right) + 37.555 $ |
式中,N为拷贝数,Ct为循环数。与Han等(2015b)的结果一致。
2.3 VpAHPND菌株20130629002S01对凡纳滨对虾的毒力检测实验组1~4组分别用浓度为108、107、106和105 CFU/ml的菌株20130629002S01对凡纳滨对虾进行浸泡感染,记录实验组6 d内对虾死亡情况(表 2),由Reed-Muench法(Brown, 1964)计算出20130629002S01对凡纳滨对虾的LD50为6.52× 105 CFU/ml;凡纳滨对虾肝胰腺中的细菌通过重新分离、鉴定,确定可分离出带有毒力基因pirAVp可致AHPND的VpAHPND。
|
|
表 2 不同浓度VpAHPND菌株20130629002S01浸泡感染凡纳滨对虾死亡率 Table 2 Mortality of L. vannamei challenged with different dose of VpAHPND strain 20130629002S01 by immersion |
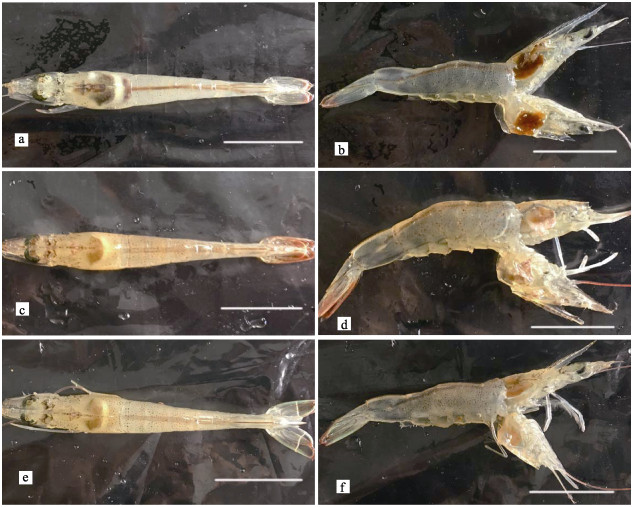
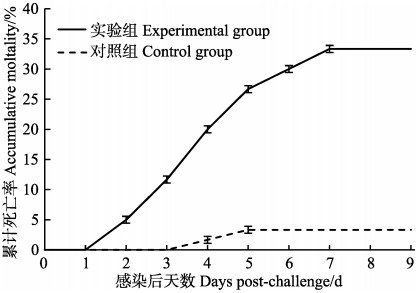
用2.19×105 CFU/ml (即0.34 LD50)的菌株20130629002S01浸泡感染凡纳滨对虾,整个感染实验为11 d。实验期间,对照组虾肝胰腺正常,切面深棕色,腹节肌肉透明,对虾正常摄食,胃肠道充满食物(图 1a和图 1b)。实验组凡纳滨对虾在感染第2天开始出现虾体颜色变浅、肝胰腺外观颜色变浅甚至发白、萎缩变小;肝胰腺切面色浅,变淡黄色,呈糜烂状;腹节肌肉透明度下降,变得略微浑浊;对虾停止摄食,出现空肠空胃现象(图 1c和图 1d),有症状个体会逐渐加重,并在随后几天内死亡。感染第2天即出现有发病死亡的对虾,随后死亡对虾数量陆续增加,9 d的累积死亡率为33%;在感染9 d后,几乎所有存活的对虾都出现虾体颜色变浅、肝胰腺色浅或发白,肝胰腺切面色浅,糜烂明显等症状(图 1e和图 1f)。感染组2~9 d,每天早上统计死亡数并采集对虾肝胰腺、鳃、中后肠道、尾节肌肉样品,选取肝胰腺发白、萎缩且活力明显下降的濒死对虾,根据SigmaPlot 12回归分析,感染所致的LT50为(3.55± 0.12) d(图 2);对照组除在第3天和第4天分别意外死亡1尾外,其余时间未出现死亡。阳性组与阴性组差异显著(P < 0.05)。
|
图 1 对照组凡纳滨对虾和浸浴感染VpAHPND后幸存的凡纳滨对虾外观 Figure 1 The appearance of L. vannamei in the control group and survivals of L. vannamei challenged with VpAHPND via immersion a、b:未感染的对照组对虾(9 d后);c、d:VpAHPND感染2 d的患病存活对虾;e、f:VpAHPND感染9 d后的患病存活对虾;标尺均为1 cm a, b: L. vannamei without challenge in the control group after day 9; c, d: Morbid L. vannamei survival challenged with VpAHPND on day 2; e, f: Morbid L. vannamei survival challenged with VpAHPND after day 9; Scale bars=1 cm |
|
图 2 2.19×105 CFU/ml的VpAHPND 20130629002S01浸浴感染对虾累积死亡率 Figure 2 Accumulative mortality of L. vannamei challenged with 2.19×105 CFU/ml of VpAHPND strain 20130629002S01 by immersion |
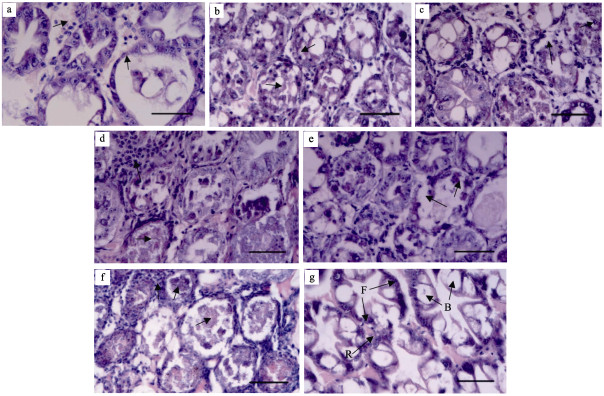
浸浴感染凡纳滨对虾过程中,取样对虾肝胰腺经石蜡切片和HE染色制片,进行光镜下病理观察。结果显示,对照组对虾肝胰腺小管上皮细胞层饱满,可清晰分辨出B、R、F等各种功能细胞,R细胞内脂肪泡丰富,细胞核大小正常,小管间血窦中血细胞数量不多(图 3g)。实验组对虾感染后24 h,出现肝胰腺发白、变浅明显症状的对虾肝胰腺脂肪细胞明显减少,肝胰腺小管上皮细胞偶见脱落现象,部分肝胰腺小管上皮层变薄,血窦中血细胞增多(图 3a);对同时期的濒死对虾取样的病理切片的肝胰腺则出现更多肝胰腺小管上皮细胞脱落的现象,此时,部分细胞仍然可以看到还有脂肪滴和分泌泡(图 3b)。感染后48 h,出现肝胰腺发白、萎缩、空肠空胃明显症状的对虾肝胰腺出现肝胰腺小管上皮细胞脱落以及细胞核肿大现象(图 3c);同时期取样的濒死对虾肝胰腺更是出现了大量血细胞浸润的现象,部分小管出现了大量细菌的二次感染(图 3d)。感染后72 h,出现虾体发白、肝胰腺发白、萎缩、空肠空胃明显症状的对虾肝胰腺小管功能细胞缺失,部分小管上皮细胞明显脱落(图 3e);同时期取样的濒死对虾肝胰腺小管细胞全面坏死,肝胰腺小管间呈现大量血细胞浸润的炎症反应,多数小管内可见严重的二次感染,出现大量的细菌,部分小管结构完全坏死并被血淋巴细胞围绕形成结节(图 3f)。
|
图 3 浸浴感染VpAHPND后不同时间幸存的有症状对虾和濒死对虾肝胰腺组织病理变化 Figure 3 The histopathological changes in hepatopancreas of L. vannamei survivals with clinical signs and moribund shrimp which were challenged with VpAHPND via immersion a,c,e:分别为感染24、48、72 h时明显症状的幸存对虾肝胰腺组织;b,d,f:分别为感染24、48、72 h濒死对虾肝胰腺组织;g:对照组对虾肝胰腺;箭头所指处为文中描述的细胞或组织病变处;标尺均为50 μm a, c, e: Hepatopancreas of L. vannamei with typical clinical signs in experimental group at 24, 48, and 72 h post-challenge respectively; b, d, f: Hepatopancreas of moribund L. vannamei with typical clinical signs in experimental group at 24, 48, and 72 h post-challenged respectively; g: Hepatopancreas of normal L. vannamei in control group; the arrow refers to the cell or tissue lesions described in the paper; Scale bars=50 μm |
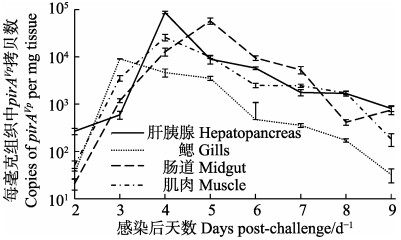
实时荧光定量PCR检测结果显示,在各取样时间段,实验组凡纳滨对虾各组织均能检测到pirAVp,对照组未检测出;各组织中pirAVp基因的拷贝数大致分布在101~105 copies/mg;组织内的菌量随时间大体呈先上升后下降的趋势(图 4)。在感染后的2 d内,各组织中pirAVp的拷贝数都处于较低的水平,肝胰腺、鳃、肠道和肌肉分别为2.67×102、3.49×101、2.09× 101和5.09×101 copies/mg;随后,pirAVp拷贝数最早的高峰出现在3 d的鳃中,达到9.08× 103 copies/mg,且高于此时同一尾虾的肝胰腺14.3倍、肠道6.63倍和肌肉1.56倍;随后到达高峰的是4 d的肝胰腺和肌肉,其中,肝胰腺内的pirAVp拷贝数达到8.71×104 copies/mg,分别是同一尾虾肌肉的3.36倍、肠道的6.75倍和鳃的18.7倍;最后达到高峰的组织是感染后5 d的肠道,为5.76×104 copies/mg,此时,是同一尾虾的肌肉的5.79倍,肝胰腺的6.44倍,鳃的16.3倍。每毫克组织中pirAVp拷贝数对数的所有时段平均值由高到低依次是肝胰腺(3.40±0.80)、肠道(3.30±1.07)、肌肉(3.24±0.88)和鳃(2.71±0.94)。
|
图 4 2.19×105 CFU/ml VpAHPND 20130629002S01浸浴感染后凡纳滨对虾不同组织pirA拷贝数随时间变化 Figure 4 The copies of pirAVp in different tissues of L. vannamei challenged with 2.19×105 CFU/ml of VpAHPND strain 20130629002S01 via immersion |
致AHPND副溶血弧菌感染凡纳滨对虾、斑节对虾(Penaeus monodon)、中国明对虾(Fenneropenaeus chinensis) (Han et al, 2015a)等水产动物后,可导致对虾肝胰腺小管细胞脱落,发生急性坏死,短期内即可导致对虾大规模死亡。AHPND作为近年来一种危害较大的对虾新发疫病,病原菌的感染机制以及准确的诊断方法受到广泛关注。AHPND的常规PCR检测方法(Sirikharin et al, 2014; Otta et al, 2014)以及实时荧光qPCR方法(Han et al, 2015b)都已经建立。前者以检测pirAVp或pirBVp毒力基因来定性检测VpAHPND;后者通过检测PirA毒力基因拷贝数实现对VpAHPND的定量检测,从而可定量地分析病原菌的侵染途径。本研究采用实时荧光qPCR方法,灵敏度可以达到10 copies/mg组织(Han et al, 2015b),且具有很强的特异性,在探讨VpAHPND对凡纳滨对虾的感染途径上是行之有效的方法。
在水环境中,鳃和消化道是对虾与外界接触的重要器官,病原菌可以通过鳃或消化道进入对虾体内,增加了对虾组织受病原菌感染的可能性。Tran等(2013)采用非创伤的感染方法,是将108 CFU/ml的高浓度菌液浸浴对虾15 min,然后再维持106 CFU/ml的菌量持续浸浴,这种感染方式除非对虾摄食病虾或高浓度病原菌污染的饲料,否则养殖水体中很难达到这么高的菌浓度。在本研究测试浸浴条件下VpAHPND 20130629002S01的LD50,表明该菌株在2.58×105 CFU/ml持续浸浴就能导致半数死亡,该浓度是普通养殖条件下很容易达到的浓度,说明VpAHPND 20130629002S01菌株能在普通养殖条件下经水体导致对虾感染,这是养殖条件下VpAHPND经水体感染的直接证明。
由于对虾的鳃比表面积大,且与外界水体直接接触,因此,在浸浴感染中,与肝胰腺、中肠和尾节肌肉相比,鳃组织中VpAHPND的量最先达到较小的峰值,但这种峰值可能是因为鳃外部富集的病原菌所致,而且,其峰值并没有维持下去,随后肝胰腺及中肠的VpAHPND量迅速并远远地超过了鳃的水平,因此,鳃的小高峰尚不能表明,鳃是病原菌侵入的通道,对虾的口器与鳃部靠近,并直通虾胃及肝胰腺,更可能成为病原菌直接入侵的通道。
对虾肝胰腺小管上皮细胞脱落是AHPND的典型症状(Tran et al, 2013),肝胰腺是VpAHPND主要靶器官。本研究实验组肝胰腺中pirAVp所代表的VpAHPND量在感染后的第3天后迅速上升,在第4天时达到高峰,且高于所有其他组织出现的最大值,这时正是半数死亡时间,即死亡发生最多的时候,表明对虾的死亡的确是由VpAHPND对肝胰腺的侵染造成的。值得注意的是,病理切片显示,感染时间越长的濒死个体,组织病理切片中见到肝胰腺中的细菌越多,但超过死亡高峰后,肝胰腺VpAHPND的量却大大下降,说明此时主要由细菌二次感染所致。随着感染持续,VpAHPND从肝胰腺小管中进入肠道,第5天时,VpAHPND的量在中肠中出现峰值。
由于组织病理分析或分子检测都是需要将患病虾致死进行取样,所以,不同时间点的样品来源不可能是同一尾虾。本研究采用不同时间点每个实验组各取3尾的方式进行分析,结果表明,感染后的组织中pirAVp拷贝数相同时,濒死对虾比呈现AHPND典型症状的对虾肝胰腺组织病理变化更重,而感染第4天后,濒死对虾即使肝胰腺病变更重,pirAVp的拷贝数却不升反降,这为采样和检测以及对定性或定量的分子检测的解释提供了参考。养殖场采样时,不可能知道每一尾对虾确切的感染时间,有时对虾濒死状态的症状典型,但pirAVp的分子检测结果阳性强度不高或者定量值很低,并不能以此为依据判断对虾的致病不是AHPND所致。最新发布的OIE(2017)水生动物手册的AHPND诊断章节指出,最好的采样部位是肠道关联的器官,包括肝胰腺、胃、中肠、后肠和粪便。本研究表明,在经水传播AHPND的过程中,发病之前,鳃可能有更灵敏的病原菌检出,而发病高死亡率期间,肝胰腺是最灵敏的可检测组织,而在发病后期,除了肝胰腺和肠道以外,也可选择肌肉。
Bell TA, Lightner DV. A handbook of normal penaeid shrimp histology. World Aquaculture Society, Baton Rouge, LA, 1988
|
Brown WF. Variance estimation in Reed-Muench fifty percent end-point determination. American Journal of Epidemiology, 1964, 79(1): 37-46 DOI:10.1093/oxfordjournals.aje.a120362 |
Fisheries and Fisheries Administration Bureau of the Ministry of Agriculture. China fishery statistics yearbook. Beijing: China Agricultural Press, 2016 [ 农业部渔业渔政管理局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2016]
|
FAO. Report of the FAO/MARD technical workshop on early mortality syndrome (EMS) or acute hepatopancreatic necrosis syndrome (AHPNS) of cultured shrimp (under TCP/VIE/3304) Hanoi, Viet Nam, 25-27 June, 2013, FAO Fisheries and Aquaculture Report, 1053
|
Flegel TW. Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 2012, 110(2): 166-173 DOI:10.1016/j.jip.2012.03.004 |
Han JE, Tang KFJ, Tran LH, et al. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp. Diseases of Aquatic Organisms, 2015a, 113(1): 33-40 DOI:10.3354/dao02830 |
Han JE, Tang KFJ, Pantoja CR, et al. qPCR assay for detecting and quantifying a virulence plasmid in acute hepatopancreatic necrosis disease (AHPND) due to pathogenic Vibrio parahaemolyticus. Aquaculture, 2015b, 442: 12-15 DOI:10.1016/j.aquaculture.2015.02.024 |
Joshi J, Srisala J, Truong VH, et al. Variation in Vibrio parahaemolyticus, isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 2014, 428-429: 297-302 DOI:10.1016/j.aquaculture.2014.03.030 |
la Peña LD, Cabillon NA, Catedral DD, et al. Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P. monodon cultured in the Philippines. Diseases of Aquatic Organisms, 2015, 116(3): 251-254 DOI:10.3354/dao02919 |
Lee CT, Chen IT, Yang YT, et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10798-10803 DOI:10.1073/pnas.1503129112 |
Lightner DV, Redman RM, Pantoja CR, et al. Early mortality syndrome affects shrimp in Asia. Global Aquaculture Advocate, 2012, (Jan/Feb): 40. https://www.aquaculturealliance.org/pdf/GAA-Lightner-Jan12.pdf
|
Nunan L, Lightner DV, Pantoja C, et al. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Diseases Aquatic Organisms, 2014, 111(1): 81-86 DOI:10.3354/dao02776 |
OIE. Manual of diagnostic tests for aquatic animals. World Organisation of Animal Health. 2017, http://www.oie.int/international-standard-setting/aquatic-manual/access-online/
|
Otta SK, Praveena P, Bhuvaneswari T, et al. Protocols for detection of shrimp EMS/AHPND. Training Manual on Health Management Practices for Finfish and Shellfish of Brackish Water Environment 115. Aquaculture Animal Health and Environment Division, Central Institute of Brackishwater Aquaculture, Puran, Chennai, 2014, 98-100
|
Sirikharin R, Taengchaiyaphum S, Sritunyalucksana K, et al. A new and improved PCR method for detection of AHPND bacteria. https://enaca.org/?id=96&title=new-pcr-detection-method-for-ahpnd, 2014
|
Sotorodriguez SA, Gomezgil B, Lozanoolvera R, et al. Field and experimental evidence of Vibrio parahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp (Litopenaeus vannamei) in Northwestern Mexico. Applied and Environmental Microbiology, 2014, 81(5): 1689-1699 |
Tang KFJ, Pantoja CR, Redman RM, et al. Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei (EHP), a microsporidian parasite infecting penaeid shrimp. Journal of Invertebrate Pathology, 2015, 130: 37-41 DOI:10.1016/j.jip.2015.06.009 |
Tran L, Nunan L, Redman RM, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 2013, 105(1): 45-55 DOI:10.3354/dao02621 |
Yang YT, Chen IT, Lee CT, et al. Draft genome sequences of four strains of Vibrio parahaemolyticus, three of which cause early mortality syndrome/acute hepatopancreatic necrosis disease in shrimp in China and Thailand. Genome Announcements, 2013, 2(5): 814-830 |
Zhang BC, Liu F, Bian HH, et al. Isolation, identification, and pathogenicity analysis of a Vibrio parahaemolyticus strain from Litopenaeus vannamei. Progress in Fishery Sciences, 2012, 33(2): 56-62 [ 张宝存, 刘飞, 边慧慧, 等. 一株凡纳滨对虾病原菌的分离、鉴定及其致病力分析. 渔业科学进展, 2012, 33(2): 56-62] |
Zhang QL, Liu Q, Liu S, et al. A new nodavirus is associated with covert mortality disease of shrimp. Journal of General Virology, 2014, 95(12): 2700-2709 |



