2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是泰国Tourtip等(2009)描述的微孢子虫新种,属于真菌界(Fungi)、微孢子虫门(Microsporidia)、单倍期纲(Haplophasea)、壶孢目(Chytridiopsida)、肠胞虫科(Enterocytozoonidae)、肠胞虫属(Enterocytozoon) (鲁兴萌等, 1999; Samtom, 2001; Tang et al, 2015),严格细胞内寄生(Lom et al, 2002; Phelps et al, 2007)。自2003年以来,泰国养殖斑节对虾(Penaeus monodon)出现生长缓慢综合征(MSGS),造成了严重的经济损失(Chayaburakul et al, 2004)。Tourtip等(2009)在生长缓慢的斑节对虾肝胰腺中检测到EHP,但感染EHP在组织病理学上难以诊断,重度感染的对虾肝胰腺在常规的苏木精-伊红染色下,很难观察到特征性的病理变化,而通过原位杂交则能显示凡纳滨对虾(Litopenaeus vannamei)感染EHP后,其肝胰腺小管上皮细胞中存在明显杂交信号(Tang et al, 2015)。感染EHP的凡纳滨对虾肝胰腺、粪便及养殖对虾水体能经PCR检测检出EHP阳性(Han et al, 2016; Tang et al, 2016; Rajendran et al, 2016),其肝胰腺、鳃、血淋巴、肠、心脏、肌肉组织也均可检测到EHP阳性(Han et al, 2016; Santhoshkumar et al, 2016; 骆云慧等, 2016),但不同组织中EHP载量的差异及相互关系还不明确。
中国水产科学研究院黄海水产研究所海水养殖生物疾病控制与分子病理学研究室检测发现,在我国养殖凡纳滨对虾中,自2013年起有很高的EHP阳性率,刘珍等(2016)建立了EHP的SYBR Green Ⅰ实时荧光定量检测方法。对3批凡纳滨对虾样品检测表明,EHP与对虾生长率呈一定的负相关关系,肝胰腺中EHP在103 copies/ng DNA以上可能代表较高的风险。而EHP载量较低时,则EHP感染与对虾生长的相关性尚不明确。目前,对EHP的检测多以肝胰腺为目标组织,其他组织EHP检测有效性不明。因此,本研究对不同自然感染的凡纳滨对虾群体的EHP与生长相关性开展进一步研究,并对不同组织EHP载量的差异进行定量检测和原位杂交验证。
1 材料与方法 1.1 实验动物来源于2016年6月26日、7月20日、9月14日和9月20日自河北黄骅(HH)、山东平度(PD)、江苏吴江(WJ)和山东日照(RZ) 4个凡纳滨对虾养殖场分别采集放苗养殖40~80 d的凡纳滨对虾样品共274尾(表 1)。其中,HH群体养殖时间为54 d,PD群体养殖时间为60 d,WJ群体养殖时间为40 d,3个群体均表现为生长缓慢,个体差异较大;RZ群体养殖时间为80 d,在4个群体中养殖期最长,生长接近正常。
|
|
表 1 对虾群体样品采集信息 Table 1 The sampling information of shrimp populations |
上述HH、PD和WJ群体样品为现场取样,保存于3倍体积的95%乙醇中,带回实验室进行体长(L)和体重(W)测量。RZ群体凡纳滨对虾装于塑料袋中,充纯氧后运送至实验室,经暂养后,抽取对虾血淋巴至1.5 ml离心管中,置于–80℃冰箱中保存。将对虾沿中线剖为两半,一半用置于Davideson’s AFA固定液(Bell et al, 1998)中固定24 h,再保存于70%乙醇中;另一半分别取凡纳滨对虾的整个肝胰腺、中肠、第1腹节肌肉、鳃丝,置于1.5 ml离心管中,于–80 ℃冰箱保存。
1.2 群体生长相关参数计算方法为了对不同放苗时间的各群体进行生长比较,根据各群体放苗后的养殖天数(T),假定放苗时平均体长(L0)为1 cm,并用体重指数Pi=W×L–3的关系估计放苗时平均体重(W0),推算各群体的体长日增长率(Daily growth rate of length, DGL, %/d)和体重的日增长率(Daily growth rate of weight, DGW, %/d)。公式如下:
| $ \begin{array}{l} {\rm{DGL = }}\left({L - {L_\mathit{0}}} \right)\left({{L_\mathit{0}} \times T} \right) \times 100\% \\ {\rm{DGW = }}\left({W - {W_\mathit{0}}} \right)\left({{W_\mathit{0}} \times W} \right) \times 100\% \end{array} $ |
将乙醇保存的样品倒去乙醇,用无RNase水冲洗后充分研磨;–80℃冰箱保存的样品置于冰上融化后充分研磨。取30 mg研磨匀浆液,用海洋动物组织基因组DNA提取试剂盒(天根生化科技有限公司, 北京)提取DNA。用核酸分析仪(Nanodrop 2000c, Thermo Scientific)进行浓度测定,于–20℃冰箱保存。
1.4 EHP定量标准制备取实验室制备的EHP标准重组质粒菌株(Liu et al, 2017),接种到1 ml LB液体培养基中(含氨苄青霉素100 μg/ml),37℃恒温培养箱中培养4~5 h,再按1%的量接种到5 ml LB培养基。置于37℃恒温培养箱中,200 r/min揺瓶培养约12 h。取4 ml培养液,用Mini BEST Plasmid Purification Kit Ver.4.0(TaKaRa, 大连)质粒小提试剂盒按说明书方法提取质粒,所提取质粒溶解在50 μl Elution Buffer中。用核酸分析仪(Nanodrop 2000c, Thermo)测定提取质粒样品的核酸浓度,计算质粒拷贝数。按10倍梯度稀释成108~ 100 copies/μl的梯度作为TaqMan qPCR标准品。
1.5 EHP的TaqMan qPCR检测采用Liu等(2017)建立的TaqMan实时荧光定量检测方法进行EHP定量检测。定量所用引物和探针序列分别为F168 (5'-AGT AAA CTA TGC CGA CAA-3')、R168 (5'- GCG TTG AGT TAA ATT AAG C -3')和TaqMan探针(5'-FAM-TCC TGG TAG TGT CCT TCC GT-TAMRA-3')。引物和探针均由生工生物工程(上海)股份有限公司合成,实时荧光定量反应体系为20 μl包含10 μl 2× Premix Ex TaqTM Probe qPCR体系(TaKaRa, 大连),0.8 μl 10 μmol/L引物F186,0.8 μl 10 μmol/L引物R186,0.4 μl 10 μmol/L TaqMan探针,7 μl无RNase水,1 μl模板DNA。扩增反应在实时荧光定量PCR仪(CFX96, BIO-Rad)中进行,反应扩增程序为95℃ 30 s预变性后,95℃ 5 s和60℃ 30 s,进行40个循环后终止反应。
1.6 EHP原位杂交用DIG探针制备根据GenBank中的EHP SSU rDNA (KF362129)序列,用Primer Premier 5.0设计了原位杂交探针合成引物,Probe-F (5'-AGC CAT TGA GTT TGT TGA-3')和Probe-R (5'-TTT CGC CTC CGT TG-3'),引物序列送生工生物工程(上海)股份有限公司合成。扩增产物为144 bp。在50 μl反应体系中,包含0.25 μl Ex Taq version 2.0 (TaKaRa, 大连),5 μl 10×Buffer (TaKaRa,大连),3 μl 20 mmol/L MgCl2, 5 μl DIG-dNTP Mix (Roche, 上海),2 μl 10 μmol/L引物Probe-F,2 μl 10 μmol/L引物Probe-R,31.75 μl无RNase水,1 μl DNA模板。反应在94℃预变性2 min后,于94℃ 30 s,47℃ 30 s,72℃ 30 s进行30个循环,最后72℃ 2 min延伸。PCR产物用2%琼脂糖凝胶电泳进行检测。
1.7 原位杂交原位杂交基本按照Bruce等(1993)的方法进行。Davidson’s AFA固定后的组织样品经脱水、透明和石蜡包埋,制备4 μm石蜡切片,于65℃烘片4 h,切片复水处理,经10 μg/ml蛋白酶K于37℃消化30 min,再经0.4%预冷的甲醛固定5 min。于42℃进行预杂交30 min,与DIG标记探针于42℃杂交12 h,经漂洗和封闭后,用1:1000碱性磷酸酶偶联的抗DIG抗体(Roche,上海)于37℃反应30 min,再经漂洗后,用NBT/BCIP避光显色2~3 h,终止后用0.5% Bismarck Brown Y复染,经脱水、透明和封片,在显微镜下观察。
1.8 数据分析相关性分析采用Microsoft Excel的数据分析加载项计算数据间相关系数(R),根据不同样本数和不同显著性水平的相关系数临界值,判断相关性的显著性水平。未特别注明的,以P < 0.05为显著差异水平,以P < 0.01为差异极显著水平。
2 结果 2.1 凡纳滨对虾群体生长特征对各群体进行体长和体重测量(表 2)。4个群体体长差异从大到小依次为PD > HH > RZ > WJ,体长日增长率从小到大依次为WJ < HH < PD~RZ,其中,WJ,HH和PD群体差异显著(P < 0.05),PD和RZ群体无显著差异(P > 0.05)。从体重测量数据来看,4个群体体重差异从大到小依次为RZ > PD > HH > WJ,体重日增长率从小到大依次为WJ < HH < PD < RZ。从体重指数来看,体重指数差异从大到小依次是WJ > PD > HH > RZ。
|
|
表 2 对虾群体样品生物学信息 Table 2 The biological information of samples from shrimp populations |
对4个凡纳滨对虾群体样品进行实时荧光定量检测。结果显示,4个凡纳滨对虾群体样品肝胰腺中EHP载量和阳性率各不相同(表 3)。HH群体阳性检出率为77.8%,考虑到qPCR的灵敏度,将阴性样品的EHP对数值归零,得4个群体中阳性率从高到低顺序分别为WJ > RZ > PD > HH,总平均EHP对数从高到低的顺序是PD~WJ > HH~RZ,其中,PD与WJ无显著差异,HH和RZ无显著差异,PD、WJ群体与HH、RZ群间差异显著。
|
|
表 3 4个养殖凡纳滨对虾群体中肝胰腺EHP检出情况 Table 3 EHP detection in hepatopancreas from 4 populations of farmed L. vannamei |
对4个群体EHP对数的分布进行分析(图 1)。结果显示,HH群体的EHP对数分布为0.11~3.42,呈近正态分布,但在分布中的值为2.0~2.4范围内的数量降低,其分布呈2个有所重叠的双峰状态(图 1a);PD群体的阳性样本的EHP对数分布为0.88~5.88,但分布峰值为0.8~2.8和3.2~6.0 2个完全分离的区域(图 1b);WJ群体的阳性样本的EHP对数分布在0.52~ 4.40范围,为标准的正态分布,在2.8~3.2位置呈单峰值(图 1c);RZ群体阳性样本的EHP对数分布为0.19~ 2.62,呈类泊松分布,峰值位于0.4~0.8位置(图 1d)。从主要样本的EHP分布范围的宽度来看,PD > HH > RZ > WJ,WJ和RZ群体中,各个体的EHP感染水平较为接近,而PD和HH群体中,各个体的EHP感染水平差异大。
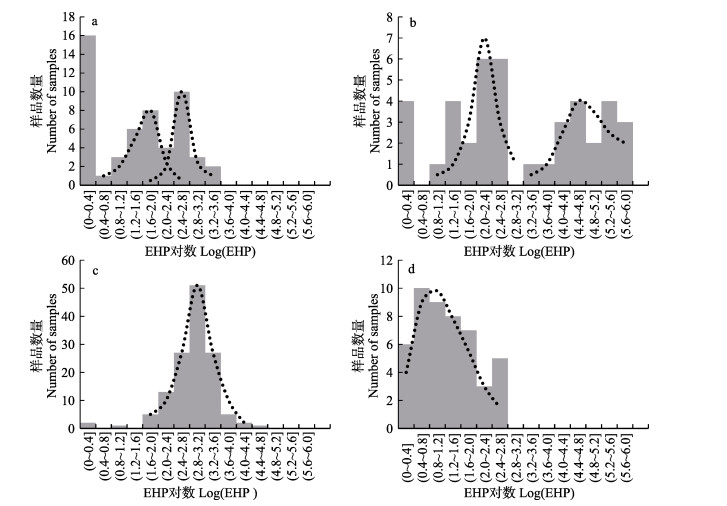
|
图 1 各群体感染EHP水平的分布
Figure 1 Distribution of quantity of EHP infection in different populations
a:黄骅群体;b:平度群体;c:吴江群体;d:日照群体。 EHP指每ng组织总DNA中EHP SSU rDNA拷贝数。灰色方块为实际样本数统计,黑色虚线为分布趋势 a: HH; b: PD; c: WJ; d: RZ. EHP means copies of EHP SSU rDNA per ng tissue total DNA, the same as below. Gray blocks are based on actual statistics, while dotted black lines show distribution trends |
分别对4个群体凡纳滨对虾肝胰腺EHP对数与对虾的体长、体重和体重指数等生长参数进行线性相关性分析(表 4)。
|
|
表 4 4个养殖凡纳滨对虾群体中肝胰腺EHP与生长指标的相关性分析 Table 4 Correlation analysis between EHP in hepatopancreas and growth indexes of 4 populations of farmed L. vannamei |
HH群体样品数量n=54,显著相关R0.05=±0.268,EHP对数与体长、体重和体重指数的相关性均无95%的显著性意义,其中,EHP对数与体重指数R=0.2155,介于R0.2=0.177和R0.1=0.226之间,达到80%显著性水平。根据该群体EHP双峰分布,将其分为EHP低的子群HH1 (n=32)和EHP高的子群HH2 (n=22),HH2的EHP对数与体长和体重的相关系数分别为-0.452和-0.517,均达到了显著相关水平(R0.05=0.423,P < 0.05) (图 2a和图 2b)。

|
图 2 4个养殖凡纳滨对虾群体中肝胰腺EHP与体长和体重的相关性 Figure 2 Correlation of logarithmic EHP in hepatopancreas to body length and body weight of 4 populations of farmed L. vannamei a,b:HH群体;c,d:PD群体;e,f:WJ群体;g,h:RZ群体;标注*为95%显著相关性(P < 0.05) a, b: Population HH; c, d: Population PD; e, f: Population WJ; g, h: Population RZ; Data marked with * means 95% significant correlation (P < 0.05) |
PD群体样品数量n=42,显著相关R0.05=±0.304,EHP对数与体长、体重和体重指数均无显著相关,其中,EHP对数与体长和体重相关系数分别为–0.2174和–0.2280,介于R0.1=–0.257和R0.2=–0.202之间,负相关性具有80%显著性水平(P < 0.01)。根据该群体EHP双峰分布,将该群体分为EHP低的子群PD1 (n=22)和EHP高的子群PD2 (n=20),PD2的EHP对数与体长和体重的相关系数分别为–0.377和–0.467,体重相关性达到R0.05=–0.444的95%显著性水平(P < 0.05),体长相关性接近90%显著性水平(图 2c和图 2d)。
WJ群体样品数量n=132,显著相关R0.05=±0.171,EHP对数与3个生长指数的相关系数均未达到95%的显著性水平(P > 0.05),其中,EHP对数与体重的相关系数R=–0.1635 < R0.1=–0.144,具有90%的显著性水平(P < 0.01)(图 2e和图 2f)。
RZ群体样品数量n=48,显著相关R0.05=±0.285,其中,EHP对数与对虾体长R=–0.2949,表明该群体的EHP与体长存在显著负相关性(P < 0.05),EHP与体重的相关系数为R=–0.2782 < R0.1=–0.240,负相关性具有90%的显著性水平(P < 0.01),EHP与体重指数的系数R=–0.1909 < R0.2=–0.188,负相关性具有80%的显著性水平(P < 0.2)(图 2g和图 2h)。
2.5 不同组织中EHP的TaqMan qPCR检测分别对RZ群体样品的肝胰腺、肠道、肌肉、血淋巴和鳃5种组织进行实时荧光定量检测,检测结果显示,该群体5种组织中EHP载量各不相同,且5种组织中EHP阳性率也有差异(表 5)。其中,肝胰腺的EHP最高,阳性率也最高;其次是中肠,EHP对数是肝胰腺的84.1%;再次是血淋巴,EHP对数是肝胰腺的76.2%;鳃EHP对数是肝胰腺的62.7%,其阳性率最低;肌肉的EHP对数是肝胰腺的15.1%。
|
|
表 5 RZ群体凡纳滨对虾各组织中EHP载量和阳性率 Table 5 The detection of EHP from the tissuse of RZ population of L. vannanmei |
对RZ群体各个体的5种组织中的EHP对数进行组织间的相关性分析(表 6)。根据RZ群体的48个样品,确定95.0%、99.0%、99.5%和99.9%的显著性水平的相关系数R0.05分别为0.285、0.368、0.399和0.460。相关性分析表明,不同组织之间的EHP均有正相关趋势,从R值大小来判断,肝胰腺、中肠和鳃3种组织相互之间的EHP对数相关性最强,超过99.9%的显著性水平,其他依次为肠道与肌肉、鳃与肌肉、肝胰腺与肌肉、肌肉与血淋巴、肠道与血淋巴等组织之间的EHP对数,这些均有极显著相关性;肝胰腺与血淋巴和鳃与血淋巴的EHP对数的相关性没有达到95.0%的显著性水平。
|
|
表 6 不同组织EHP对数间的相关性 Table 6 Relationship of logarithmic EHP between different tissues |
取RZ群体不同组织进行原位杂交。结果显示,EHP阴性样品没有杂交信号,EHP阳性样品表现出杂交信号,对照样品没有出现任何杂交信号,表明所用的EHP探针杂交特异性良好。肝胰腺、肌肉、鳃、中肠中均可观察到杂交信号,在这些组织中,肝胰腺组织切片杂交信号最多且较强,视野中大约5%~10%的细胞呈现阳性;肌肉和鳃组织中杂交信号较少且较弱;肠道中仅在中肠部位观察到杂交信号,中肠内容物的杂交信号强,中肠上皮细胞内的杂交信号弱(图 3)。

|
图 3 感染虾肝肠胞虫凡纳滨对虾不同组织的原位杂交 Figure 3 In situ hybridization of different tissues of L. vannamei infected with EHP a:肝胰腺;b:鳃;c:肌肉;d;中肠;e:肝胰腺阴性对照 a: Hepatopancreas; b: Gills; c: Muscle; d: Midgut; e: Negative control of hepatopancreas |
本实验室前期对虾肝肠胞虫与凡纳滨对虾生长的相关性已经有相关研究。结果显示,EHP在103 copies/ng HPDNA以上时,表现出较高的风险水平,且与对虾的生物学生长呈现一定的负相关性,但在较低的差异范围内,EHP与凡纳滨对虾生长的相关性不显著。本研究分别从河北黄骅、山东平度、江苏吴江和山东日照采集到4个凡纳滨对虾群体,其中,在生长相关各参数上RZ群体最优。qPCR测定表明,RZ群体肝胰腺EHP也是最低的。对EHP对数的分布进行统计表明,WJ、RZ群体的EHP对数分布为单峰,各个体的EHP载量接近;而HH、PD群体分布为双峰,各个体的EHP载量差异大。这种分布可能提示WJ、RZ群体主要是单一感染,而HH、PD群体可能存在群体内2次或多次传播。对群内EHP与凡纳滨对虾生长参数的相关性分析表明,RZ群体的肝胰腺EHP对数与对虾体长呈现显著的负相关性(P < 0.05),与对虾体重也呈较显著的负相关性(P < 0.1),WJ群体的EHP对数与体重呈现较显著的负相关性(P < 0.1),而HH和PD群体整体上EHP对数与对虾生长参数的相关性均未达到显著水平;但根据EHP对数的分布将HH和PD群体各分为EHP低和高的2个子群后,EHP高的子群中与对虾体长或体重间出现了显著或较显著的相关性。上述结果说明,EHP对数与对虾生长参数的相关性与EHP感染的时间点有重要关系,这可以解释前期研究中某些群体的EHP与对虾生长参数呈现显著负相关性,但另一些群体中没有明显相关性的现象(刘珍等, 2016; 刘亚梅等, 2017; 刘宝彬等, 2017),EHP感染主要发生在较相近的时间点时,这种负相关性才能较明显;群体中存在2次传播或感染在不同时间点时,后续感染可能就扰乱了这种相关性。
本研究对凡纳滨对虾不同组织进行EHP检测,RZ群体是4个群体中EHP载量最低,但阳性率较高的群体,个体间肝胰腺EHP载量比较接近,这可能是由于该群体受到较低水平EHP传染源的感染所致,如经水体传播的EHP孢子的感染,该群体有利于对不同组织间的EHP进行分析。qPCR检测结果表明,EHP从高到低的顺序依次是肝胰腺 > 中肠 > 血淋巴 > 鳃 > 肌肉;而检出率高低顺序在肌肉和鳃略有差异。经相关性分析表明,各组织EHP对数总体上有正相关性,肝胰腺、肠道和鳃三者之间的相关性达到99.9%的极显著水平(P < 0.001),肌肉-鳃、肝胰腺-肌肉、肌肉-血淋巴、肠道-血淋巴等组织间也呈极显著相关性(P < 0.01)。这显示EHP主要感染的组织可能是肝胰腺和肠道,用血淋巴、鳃或肌肉进行定量或定性检测,能一定程度地反映肝胰腺中的EHP感染情况,但在感染水平较低时,可能存在较多的假阳性比率。Santhoshkumar等(2016)、Salachan等(2017)研究表明,用常规PCR在对虾肝胰腺、鳃、血淋巴、肠、心脏、肌肉组织均可检测到EHP阳性,但这些研究未揭示不同组织间EHP载量的关系及阳性率的高低。
前人在组织病理学观察及原位杂交的研究表明,肝胰腺和肠道中能观察到EHP的感染(Tang et al, 2015; Rajendran et al, 2016; Santhoshkumar et al, 2016),但在其他组织上未观察到感染的证据。为了说明EHP在不同组织中的检出是属于污染还是组织内的感染,作者对RZ群体的不同组织进行了原位杂交检测,结果显示,RZ群体中较低的EHP感染水平下,对虾肝胰腺中的杂交信号比以往报道中所看到的(Tang et al, 2015, Salachan et al, 2007)数量要少得多,大约5%~10%的细胞显示为阳性,但在所检测的几种组织中是最多的;中肠的原位杂交结果则显示,肠腔内容物中出现出较强的杂交信号,中肠上皮细胞中也出现较弱的杂交信号;此外,在鳃和肌肉细胞中也观察到少量杂交信号,但信号强度相对较弱。这说明EHP可能造成肝胰腺以外的组织感染,但细胞感染率和感染强度低。
本研究通过qPCR获得了EHP在凡纳滨对虾不同群体和不同组织中感染量的准确数据。群体内EHP载量的分布特点表示,EHP在群体内可能存在2次或多次传播,群体中EHP感染发生在较相近的时间点时,其量与凡纳滨对虾的生长参数呈显著的负相关性。EHP能在多组织中检出,各组织EHP载量有显著相关性,其中,肝胰腺和中肠中分布最多,肝胰腺是EHP检测的最灵敏组织;原位杂交显示,EHP在其他组织中的存在是因为在其他组织中存在一定水平的感染,中肠内容物中存在原位杂交信号,表明EHP可能通过粪便进行传播,粪便也可作为检测的样品。EHP在对虾群体和体内的感染和分布情况能为该病的诊断和预防研究提供基础数据。
Bell TA, Lightner DV. A Handbook of normal penaeid shrimp histology. World Aquaculture Society, Baton Rouge, LA, 1988
|
Bruce LD, Redman RM, Lightner DV, et al. Application of gene probes to detect a penaeid shrimp baculovirus in fixed tissue using in situ hybridization. Diseases of Aquatic Organisms, 1993, 17(3): 215-221 |
Chayaburakul K, Nash G, Pratanpipat P, et al. Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand. Diseases of Aquatic Organisms, 2004, 60(2): 89-96 |
Han JE, Tang KFJ, Pantoja CR, et al. Detection of a new microsporidium Perezia sp. in shrimps Penaeus monodon and P. indicus by histopathology, in situ hybridization and PCR. Diseases of Aquatic Organisms, 2016, 120(2): 165-171 DOI:10.3354/dao03022 |
Liu BB, Yang B, Lv XW, et al. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus (IHHNV) and Enterocytozoon hepatopenaei (EHP) of Litopenaeus vannamei by real-time PCR. Progress in Fishery Sciences, 2017, 38(2): 158-166 [ 刘宝彬, 杨冰, 吕秀旺, 等. 凡纳滨对虾(Litopenaeus vannamei)传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测. 渔业科学进展, 2017, 38(2): 158-166 DOI:10.11758/yykxjz.20160123001] |
Liu YM, Qiu L, Sheng AZ, et al. Quantitative detection method of Enterocytozoon hepatopenaei using Taqman probe real-time PCR. Journal of Invertebrate Pathology, 2018, 151: 191-196 DOI:10.1016/j.jip.2017.12.006 |
Liu YM, Qiu L, Chen DY, et al. The relationship between body length and weight in Enterocytozoon hepatopenaei detected Litopenaeus vannamei populations. Progress of Fishery Sciences, 2017, 38(4): 96-103 [ 刘雅梅, 邱亮, 程东远, 等. 检出虾肝肠孢虫(Enterocytozoon hepatopenaei)的凡纳滨对虾(Litopenaeus vannamei)群体的体长和体重关系. 渔业科学进展, 2017, 38(4): 96-103] |
Liu Z, Zhang QL, Wan XY, et al. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119-126 [ 刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119-126 DOI:10.11758/yykxjz.20150512003] |
Lom J, Dyková I. Ultrastructure of Nucleospora secunda n. sp. (Microsporidia), parasite of enterocytes of Nothobranchius rubripinnis. European Journal of Protistology, 2002, 38(1): 19-27 DOI:10.1078/0932-4739-00844 |
Lu XM, Jin W. Recent advances in taxonomy of phylum Microspora. Bulletin of Science and Technology, 1999, 15(2): 119-125 [ 鲁兴萌, 金伟. 微孢子虫分类学研究进展. 科技通报, 1999, 15(2): 119-125] |
Luo YH, Shi J, Fang L, et al. Development and application of a TaqMan real-time PCR assay for the detection of Enterocytozoon hepatopenaei. Veterinary Science in China, 2016, 46(7): 847-852 [ 骆云慧, 石坚, 方磊, 等. 虾肝肠胞虫TaqMan实时荧光定量PCR检测方法的建立及应用. 中国兽医科学, 2016, 46(7): 847-852] |
Phelps NB, Goodwin AE. Validation of a quantitative PCR diagnostic method for detection of the microsporidian Ovipleistophora ovariae in the cyprinid fish Notemigonus crysoleucas. Diseases of Aquatic Organisms, 2007, 76(3): 215-221 |
Rajendran KV, Shivam S, Praveena PE, et al. Emergence of Enterocytozoon hepatopenaei (EHP) in farmed Penaeus (Litopenaeus) vannamei in India. Aquaculture, 2016, 454: 272-280 DOI:10.1016/j.aquaculture.2015.12.034 |
Salachan PV, Jaroenlak P, Thitamadee S, et al. Laboratory cohabitation challenge model for shrimp hepatopancreatic microsporidiosis (HPM) caused by Enterocytozoon hepatopenaei (EHP). BMC Veterinary Research, 2017, 13(1): 1-7 |
Santin M. Enterocytozoon bieneusi. Springer Berlin Heidelberg, 2001, 218-220
|
Santhoshkumar S, Sivakumar S, Vimal S, et al. Biochemical changes and tissue distribution of Enterocytozoon hepatopenaei (EHP) in naturally and experimentally EHP-infected whiteleg shrimp, Litopenaeus vannamei (Boone, 1931), in India. Journal of Fish Diseases, 2016, 40(4): 529-539 |
Tang KFJ, Han JE, Aranguren LF, et al. Dense populations of the microsporidian Enterocytozoon hepatopenaei (EHP) in feces of Penaeus vannamei exhibiting white feces syndrome and pathways of their transmission to healthy shrimp. Journal of Invertebrate Pathology, 2016, 140: 1-7 DOI:10.1016/j.jip.2016.08.004 |
Tang KFJ, Pantojaa CR, Redmana RM, et al. Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei (EHP), a microsporidian parasite infecting penaeid shrimp. Journal Invertebrate Pathology, 2015, 130: 37-41 DOI:10.1016/j.jip.2015.06.009 |
Tourtip S, Wongtripop S, Stentiford GD, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida:Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda:Penaeidae):Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21-29 DOI:10.1016/j.jip.2009.06.004 |



