近年来,随着环境污染以及人地关系紧张等现象的不断出现,近海岩礁岸线的生态环境遭到极大的破坏,导致岩相潮间带马尾藻(Sargassum sp.)资源严重衰竭(Yu et al, 2012),这将直接影响马尾藻场在生境营造、资源养护、饵场形成、水质净化和碳汇功能等方面的重要作用。为了防止潮间带‘荒漠化’,恢复海区生物多样性和海洋生态服务功能,人工重建马尾藻场已成为国家和社会共同关注的问题。目前,人工育苗增移殖是重建马尾藻场的真正有效方式(Yu et al, 2012; Xie et al, 2013; Yoon et al, 2014),而马尾藻幼苗移殖海区的时间选择至关重要。以广东大亚湾为例,马尾藻的成熟繁殖季节在4、5月,当人工繁育的马尾藻幼苗移至潮间带培育时,6~10月的高温季节不利于幼苗的存活和生长,再加上无脊椎动物附着和杂藻丛生,致使幼苗脱落死亡严重,限制了其规模化增养殖。而室内温度相对较低,培育条件易于控制,将马尾藻幼苗的室内培育期延长至11月后再移殖海区,可避免夏季海区高温、敌害生物等不利环境。因此,马尾藻幼苗在室内能否顺利度夏将直接关系着马尾藻场重建成败的一个重要环节。
海藻生长需要大量的营养物质和能量进行组织构建,尤其是氮(N)营养盐。N是藻细胞蛋白质、磷脂和叶绿素等的基本元素,也是藻体组织和器官的重要组分,N缺乏可严重抑制藻细胞的正常生长(Dawes et al, 1990)。许多学者对马尾藻吸收水体营养盐、修复海区富营养化已展开了研究(Alquezar et al, 2013; Hwang et al, 2004; 姜宏波等, 2007; 徐智广等, 2013),而关于N营养盐对马尾藻幼苗培育阶段生理特性的影响研究较少。
本研究以半叶马尾藻(Sargassum hemiphyllum)为研究对象,其隶属于褐藻门(Phaeophyta),马尾藻科(Sargassaceae),马尾藻属(Sargassum),是中国东海和南海沿岸常见种和优势种。同时,该藻藻体较大,生长较快,是进行人工海藻场重建的优良物种。为此,通过室内模拟不同N营养条件研究半叶马尾藻幼苗的相对生长速率、藻体内可溶性蛋白质、可溶性糖、光合色素及组织N含量等生理生化指标的变化,探索适合半叶马尾藻幼苗生长的营养环境,以期为开展马尾藻场重建工作提供理论基础和技术指导。
1 材料与方法 1.1 材料2014年4月,从广东深圳市南澳镇杨梅坑海域采集具有受精卵挂托的半叶马尾藻,并迅速运至中国水产科学研究院南海水产研究所深圳试验基地育苗车间。选择健康完整的种藻,除去藻体表面附着物,经消毒海水冲洗后放入水槽(60 cm x 50 cm × 40 cm)中充气、培养,翻动种藻使受精卵脱落,采用孔径为200目的筛绢过滤收集受精卵,播种于底部铺有水泥砖块的水体中。水体保持静止24 h,以便受精卵附着在砖块表面。育苗用海水为经暗处理7 d的砂滤海水,每7 d更换1次。培养120 d后,采集附着基上健康完整的幼苗,平均株高为2.0 cm左右,在经高压灭菌的N限制海水[预先用石莼(Ulva lactuca)吸收4 d,N浓度<1 μmol/L,其余营养组分参照f/2培养液添加]中培养14 d后用于实验。暂养条件:温度为23℃,光强为80 μmol photons/(m2·s),光照周期L:D=12 h:12 h,充气泵24 h充空气。
1.2 不同氮营养条件的设置实验材料在装有1 L高压灭菌N限制海水的球形培养瓶中培养,24 h充气,可在培养瓶内形成水流使藻体转动。培养过程中,硝氮(NO3--N)、氨氮(NH4+-N)和尿素氮(Urea)分别作为唯一N源,设置5个N浓度梯度,分别为10、25、50、100、150 μmol/L,N限制海水(N浓度<1 μmol/L)为对照组,各设3个重复。实验在GXZ智能型光照培养箱(宁波江南制造厂)中进行,藻体培养密度为2 g/L,培养条件与暂养期间一致,每2 d更换1次培养液,共培养24 d。
1.3 相对生长速率的测定实验前和实验后,用滤纸吸干藻体表面的多余水分,称量藻体鲜重, 计算相对生长速率(μ),利用公式求得:
| $ \mu \left({\% /{\rm{d}}} \right){\rm{ }} = {\rm{ }}100 \times {\rm{ln}}\left({{W_t}/{\mathit{W}_\mathit{0}}} \right)/t $ |
式中,W0为实验初始藻体鲜重(g),Wt为实验结束时藻体鲜重(g),t为实验培养时间(d)。
1.4 光合色素含量的测定参照Seely等(1972)的方法,取1.0 g藻体,用去离子水快速冲洗藻体,吸干表面多余水分并剪碎,加入4 ml的二甲基亚砜(DMSO)第1次萃取,提取5 min后,收集黄褐色的提取液(X1);接着对藻体进行第2次萃取,加入4 ml的丙酮反应5 min后,收集深绿色的提取液(X2);取3 ml丙酮提取液,加入1 ml的正己烷和0.75 ml蒸馏水,萃取分离,正己烷相(X2A)用0.5 ml的100%甲醇和0.13 ml蒸馏水连续提取2次,并收集水性丙酮-甲醇相(X2B);DMSO相(X1),DMSO:蒸馏水按照4:1比例稀释,测定其在波长为665、631、582、480 nm处的吸光值,正己烷相(X2A),正己烷:丙酮按照1:10比例稀释,测定其在波长为480、661 nm处的吸光值,水性丙酮-甲醇相(X2B),丙酮:甲醇:蒸馏水按照3:1:1比例稀释,测定其在波长为664、631、581、479 nm处的吸光值,根据以下公式计算叶绿素a(Chl-a)、叶绿素c(Chl-c)和墨角藻黄素(Fx)含量:
| $ \begin{array}{*{20}{c}} {{\rm{Chl}} - a\left({{\rm{mg}}/{\rm{g}}} \right) = \left({{A_{665}}/72.8} \right) \times {V_1}/\left({I/W} \right) + 4/3 \times }\\ {\left({{A_{661}}/83.3} \right) \times {V_2}/\left({I/W} \right) + 4/3 \times \left({{A_{664}}/73.6} \right) \times {V_3}/\left({I/W} \right), }\\ {{\rm{Chl}} - c\left({{\rm{mg}}/{\rm{g}}} \right) = ({A_{631}} + {A_{582}} - 0.297{A_{665}})/61.8 \times {V_1}/\left({I/W} \right) + }\\ {4/3 \times ({A_{631}} + {A_{581}} - 0.300{A_{664}})/62.2 \times {V_3}/\left({I/W} \right), }\\ {F{\rm{x}}\left({{\rm{mg}}/{\rm{g}}} \right) = [{A_{480}} - 0.722({A_{631}} + {A_{582}} - 0.297{A_{665}}) - }\\ {0.049{A_{665}}]/130/\left({I/W} \right) + 4/3 \times [{A_{470}} - 1.239({A_{631}} + }\\ {{A_{581}} - 0.300{A_{664}}) - 0.0275{A_{664}}]]/141 \times {V_3}/\left({I/W} \right)} \end{array} $ |
式中,A为吸光值,V1为提取液X1的体积(4 ml+ 1 ml=5 ml),V2为提取液X2A的体积(1 ml+10 ml=11 ml),V3为提取液X2B的体积(3 ml+1 ml+1 ml=5 ml),I为比色皿的光径(1 cm),W为藻体鲜重(g)。
1.5 可溶性蛋白(SP)含量测定可溶性蛋白含量采用考马斯亮蓝G-250染料结合法测定(Kochert, 1978)。取0.2 g藻体用0.1 mol/L的磷酸缓冲液(pH = 6.8)研磨,定容,离心,取0.5 ml上清液,加5 ml考马斯亮蓝G-250,混匀后595 nm测定其吸光度。其计算公式为:
| $ {\rm{SP}}\left({{\rm{mg}}/{\rm{g}}} \right) = C \times {V_t}/({V_l} \times W \times 1000) $ |
式中,C为查得的牛血清标准曲线值(μg);Vt为提取液总体积(ml),W为样品鲜重(g),Vl为测定时的加样量(ml)。
1.6 可溶性糖(SS)含量测定可溶性糖含量采用苯酚-硫酸法测定(Kochert, 1978)。称取0.2 g的藻体,蒸馏水研磨后定容至25 ml,70℃水浴提取30 min。待提取液冷却后过滤,取2 ml待测液加入6%苯酚试剂1 ml和浓硫酸5 ml,冷却后485 nm波长测定吸光度,对照标准曲线计算可溶性糖含量。标准曲线以葡萄糖为标准绘制。其计算公式为:
| $ {\rm{SS}}\left( {{\rm{mg}}/{\rm{g}}} \right) = C \times V/\left( {W \times {V_{\rm{l}}}} \right) $ |
式中,C为葡萄糖标准曲线中查得的值(mg),V为样品提取液体积(ml),Vl为显色时取样品液量(ml),W为样品湿重(g)。
1.7 组织氮含量的测定参照Abreu等(2011)的方法,将剩余的藻体于60℃下烘干48 h后,称量其干重,烘干的样品用研磨器磨成粉末状,过80目的样品筛后,利用VARIO EL Ⅲ元素分析仪测量组织N含量(%)。
1.8 数据处理与分析相对生长速率与组织N含量的关系可由Droop (1983)方程拟合,得出公式:
| $ \begin{array}{*{20}{c}} {\mu = {\mu _{{\rm{max}}}}(1 - {N_{\rm{Q}}}/N)}\\ {{N_{{\rm{req}}}} = {\mu _{{\rm{max}}}} \times {N_{\rm{C}}}} \end{array} $ |
式中,μmax(%/d)为最大相对生长率,NQ(%)为藻类维持生存的最低组织N含量,N(%)为藻类实际组织N含量,NC(%)为藻类维持最大生长速率所必需N的临界值,Nreq(%/d)为维持藻类以最大速率生长的N需求(Pedersen et al, 1997)。
采用SPSS17.0软件对数据进行统计分析,所有测定结果均表示为平均值±标准差(Mean±SD)(n≥3),采用双因子方差分析(Two-way ANOVA)和单因子方差分析(One-way ANOVA)检验差异的显著水平,设显著水平为P<0.05。
2 结果 2.1 生长双因子方差分析表明,半叶马尾藻幼苗的相对生长速率受培养水体中N源、N浓度以及二者的交互作用影响显著(P<0.05)。在3种N源加富培养下,幼苗相对生长速率均随着N浓度的增加呈先上升后下降的变化趋势,在浓度为50 μmol/L时达到最大值,Urea组的最大相对生长速率显著低于NO3--N和NH4+-N组(P<0.05)。在浓度为10、25 μmol/L时,NH4+-N组幼苗的相对生长率显著高于相同浓度下的NO3--N组(P<0.05),而在浓度为50~150 μmol/L时则相反。在浓度为150 μmol/L时,NH4+-N组中幼苗相对生长速率降低至对照组水平(图 1)。
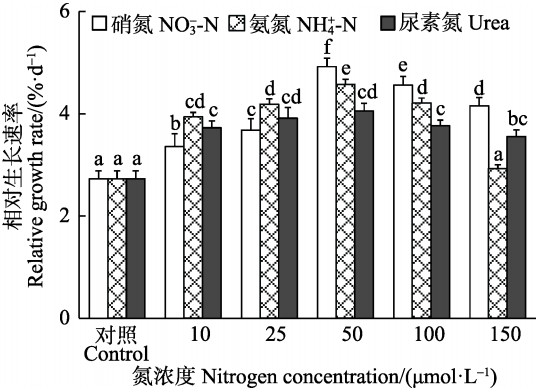
|
图 1 不同氮条件下半叶马尾藻幼苗的相对生长速率 Figure 1 Relative growth rate of S. hemiphyllum seedling cultured under different nitrogen conditions 注:不同的小写字母表示在P<0.05水平具有显著性差异,下同 Note: Lowercase letters indicate significant differences at P<0.05 among the treatments, the same as below |
双因子方差分析表明,半叶马尾藻幼苗的3种光合色素含量均受培养水体中N源和N浓度的影响显著(P<0.05),而N源和N浓度无显著交互作用(P>0.05)。在相同N源下,藻体各光合色素基本上随着N浓度的升高而增大,并逐渐趋于稳定,在浓度为100、150 μmol/L组之间无显著差异(P>0.05)。在10~ 50 μmol/L内,相同浓度下3种N源间的光合色素无显著差异(P>0.05),而在浓度为100、150 μmol/L时,NO3--N和NH4+-N组的幼苗Chl-a含量显著高于Urea组(P<0.05),而对于Fx含量来说,则是Urea加富组显著高于NH4+-N和NO3--N加富组(P<0.05)(图 2)。
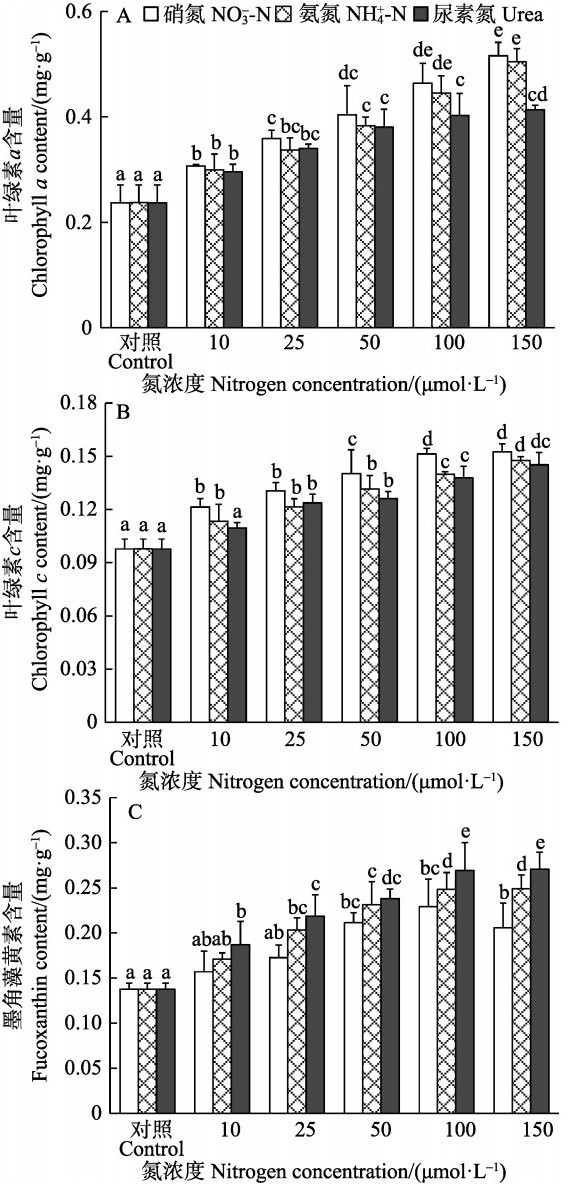
|
图 2 不同氮条件下半叶马尾藻幼苗的光合色素含量 Figure 2 Photosynthetic pigment contents of S. hemiphyllum seedlings cultured under different nitrogen conditions |
双因子方差分析表明,半叶马尾藻幼苗SP含量仅受培养水体中N浓度影响显著(P<0.05),而SS含量不受N源、N浓度和二者交互作用的显著影响(P>0.05)。在相同N源下,随着N浓度的升高,SP含量逐渐增大,在浓度为100 μmol/L组中达到最大值,而当NH4+-N浓度增至150 μmol/L时,SP含量显著下降(P<0.05)(图 3A)。对于加富组的SS来说,随着N浓度的升高,SS含量逐渐降低,除了浓度为10、25 μmol/L NO3--N组高于对照组外,其余均低于对照组,但与对照组间无显著差异(P>0.05)(图 3B)。
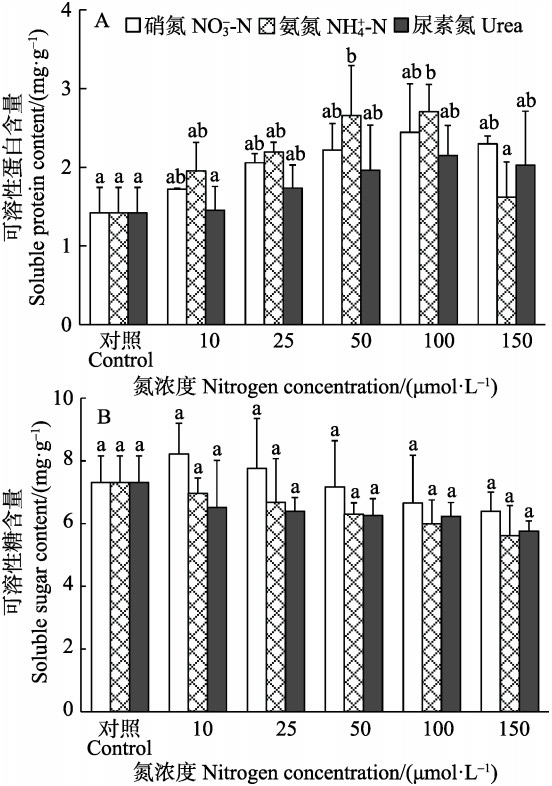
|
图 3 不同氮条件下半叶马尾藻幼苗的可溶性蛋白和可溶性糖含量 Figure 3 Soluble protein and soluble sugar contents of S. hemiphyllum seedlings cultured under different nitrogen conditions |
双因子方差分析表明,半叶马尾藻幼苗的组织N含量受培养水体中N源、N浓度和二者交互作用影响显著(P<0.05)。在相同N源条件下,组织N含量随着N浓度的升高显著增加(P<0.05),在浓度为150 μmol/L时,达到最大值。在浓度为10、25 μmol/L时,N源种类对组织N含量的影响不显著(P>0.05),而在浓度为50~150 μmol/L范围内,Urea组的组织N含量显著低于NO3--N和NH4+-N组(P<0.05),除了150 μmol/L NH4+-N中的组织N含量显著高于NO3--N组外(P<0.05),NH4+-N和NO3--N加富组间的组织N含量无显著差异(P>0.05)(图 4)。
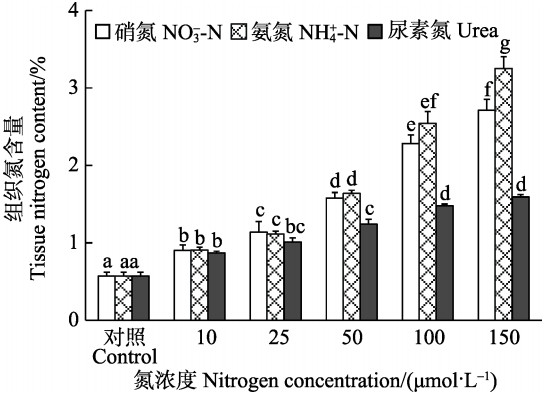
|
图 4 不同氮条件下半叶马尾藻幼苗的组织氮含量 Figure 4 Tissue nitrogen content of S. hemiphyllum seedlings cultured under different nitrogen conditions |
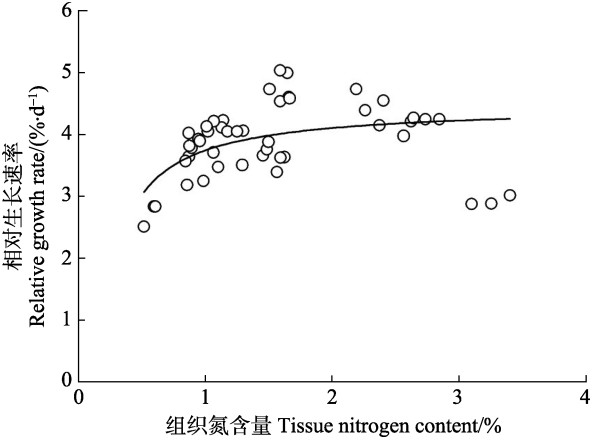
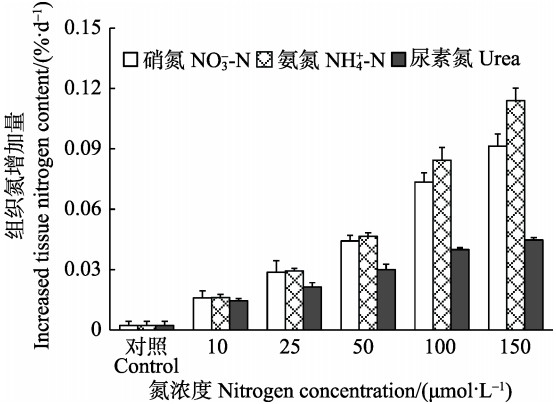
从藻体相对生长率与组织N含量的关系中可以看出(图 5),除了浓度为150 μmol/L NH4+-N组,半叶马尾藻幼苗的相对生长速率总体上随组织N含量的增加逐渐增大并趋于稳定。利用非线性回归得到,半叶马尾藻幼苗的最大生长速率为4.85 %/d,NQ为0.22%,NC为0.67%,Nreq为0.032%/d。同时,从图 6可以看出,除了对照组的组织N含量小于0.67%外,加富组的组织N含量均高于N的临界值,但仅在浓度为25~150 μmol/L NO3--N和NH4+-N组以及浓度为50~150 μmol/L Urea组中,幼苗每天增长的N含量接近或高于0.032%。
|
图 5 半叶马尾藻幼苗的相对生长速率与组织氮含量的关系 Figure 5 Relationship between relative growth rate and tissue nitrogen content of S. hemiphyllum seedlings |
|
图 6 不同氮条件下半叶马尾藻幼苗组织氮的增加量 Figure 6 Increased tissue nitrogen content of S. hemiphyllum seedlings cultured under different nitrogen conditions |
N是维持植物正常生长所必需的营养元素,适宜的N加富可使海藻吸收利用N营养盐的底物浓度升高,在一定范围内促进其快速生长,而过低或者过高的N浓度则会限制海藻的生长(黄中坚等,2014;徐智广等,2016)。大量研究表明,大型海藻的组织N含量与水体N浓度呈正相关(Hwang et al, 2004; Gómez et al, 1998),这与本研究结果正好吻合,半叶马尾藻幼苗的组织N含量随着N浓度的升高而增加。本研究结果表明,加富组的组织N含量高于N的临界值,说明加富组的N营养水平可保证半叶马尾藻幼苗的正常生长,但仅在浓度为25~150 μmol/L NO3--N(或NH4+-N)和浓度为50~150 μmol/L Urea组中的组织N含量满足幼苗最大速率生长的N需求(0.032%/d),当海藻吸收的N营养盐超过了N需求,N只会储存在体内,不会继续促进藻体的增长,甚至会起到抑制作用(Hanisak, 1990)。因此,3种N源加富均能提高半叶马尾藻幼苗的生长,在N浓度为50 μmol/L时,获得最大生长速率。
海藻对不同形态N源吸收和同化的能量学可影响藻体对代谢产物的积累与调节分配(Hurd et al, 2014)。在藻体吸收不同N营养盐后,NH4+-N可以直接与氨基酸结合,有机N源Urea可以不经过消耗能量的过程而直接释放出NH4+-N进入同化过程,而NO3--N必须通过能量消耗还原成NH4+-N后才能进行同化(Tamminen et al, 1996),因而,NO3--N吸收在能量利用方面是最不经济的。在浓度为10、25 μmol/L时,NO3--N组幼苗生长速率最低,而在浓度为50~ 150 μmol/L时,NO3--N组的生长速率显著高于同浓度的NH4+-N和Urea组。这与海藻对NO3--N具有更强的储存能力有关,海藻细胞能够将吸收后未被还原利用的NO3--N全部储存在液泡中,可使胞内外NO3--N浓度比高达1000:1(Gordillo et al, 2002),从而保证了海藻在光合作用时所需的大量N源(徐智广等, 2016)。因此,高浓度的NO3--N比NH4+-N和Urea更有利于海藻的营养代谢和能量合成,对海藻生长具有更显著的促进作用。
藻类的生长是在光合作用合成物质的基础上进行的,藻体内各光合色素的含量随着外界环境因子的变化而变化,当它们满足藻体光合作用的需求时,将会促进藻体的生长(陈伟洲等, 2014)。Chl-a是海藻最重要的光合色素,Fx是一种特殊的类胡萝卜素,Chl-c是光系统Ⅱ的辅助色素。海水中主要是蓝光和绿光,Fx能吸收光谱中绿色部分(500~560 nm)的光, 在550 nm处有80%的光被Fx所吸收,吸收的光能可以直接或通过Chl-c高效传至Chl-a,而叶绿素对这种光的吸收很少(张栩等, 2004)。本研究中,NH4+-N加富可以促进藻体内光合色素增加直至相对稳定,但这与NH4+-N加富对半叶马尾藻幼苗生长先促进后抑制的影响趋势不同,原因可能是当过量的NH4+-N积累在藻体中时,藻体可通过补偿性合成体内光合色素水平来提高对光能的有效利用率(芦薇薇等, 2016),促进NH4+-N同化过程,降低NH4+对藻体的胁迫伤害,但是,由于补偿性的能量消耗高于能量积累,不足以维持藻类的快速生长。同时,在高N浓度下,NO3--N和NH4+-N组幼苗的Chl-a含量显著高于Urea组,而Urea组幼苗的Fx含量显著高于NO3--N和NH4+-N组。Urea在海水总氮中所占的百分含量不高,海藻从自然海水中主要吸收NO3--N和NH4+-N形式营养盐(徐智广等, 2016)。从环境适应性上分析,由于底物浓度低,海藻在单位面积内接触Urea机会少,大型海藻对Urea的有效吸收利用能力低于NO3--N和NH4+-N(Phillips et al, 2004),导致Urea组幼苗的组织N含量显著低于NO3--N和NH4+-N组。由于Chl-a是富含氮素的化合物,是藻类的主要光合作用中心,在N缺乏的情况下,叶绿素合成减少,细胞内多余的C、H转向合成非N色素,导致Fx含量升高(汪亚俊等, 2014)。
N加富可在一定程度上增强以N为底物的N代谢作用,促进可溶性蛋白的大量合成,从而提高其在藻体内的含量,为藻体储存多余的N源(Martínez et al, 2008)。而最高NH4+-N浓度(150 μmol/L)使可溶性蛋白含量大幅度下降,其原因可能是过量的NH4+-N会破坏藻体中的pH平衡,阻碍H+的传送,进而影响海藻的光学反应,造成NH4+-N在藻体中累积,叶绿体中的NH4+转化为NH3进入线粒体等组织,使叶绿体中N含量减少,藻体对NH4+-N同化代谢能力降低(秦梅,2014),可溶性蛋白的合成随之减少。可溶性糖含量的变化与光合产物合成速率及光合产物消耗速率有关。N浓度的升高可增加藻体的N同化作用,加快利用碳骨架合成一些含N化合物,导致可溶性糖含量逐渐降低(黄晓航等, 1989)。同时,NO3--N加富组幼苗的可溶性糖含量高于NH4+-N和Urea加富组,这除了与NO3-具有在细胞内较强的储存能力有关外(Gordillo et al, 2002),NO3--N还能够激活细胞内的氧化磷酸化过程,合成更多的ATP,增强卡尔文循环,促进可溶性糖的积累(Huppe et al, 1992; 徐智广等, 2016)。
综上所述,在半叶马尾藻幼苗室内培育阶段通过向水体中提供氮营养盐,使NO3--N加富至50~ 150 μmol/L或NH4+-N加富至25~100 μmol/L,可有效提高半叶马尾藻幼苗对N营养盐的吸收利用能力,实现其最大生长速率,为马尾藻幼苗室内成功度夏培育提供了保障。
Abreu MH, Pereira R, Buschmann AH, et al. Nitrogen uptake responses of Gracilaria vermiculophylla (Ohmi) Papenfuss under combined and single addition of nitrate and ammonium. Journal of Experimental Marine Biology and Ecology, 2011, 407(2): 190-199 |
Alquezar R, Glendenning L, Costanzo S. The use of the brown macroalgae, Sargassum flavicans, as a potential bioindicator of industrial nutrient enrichment. Marine Pollution Bulletin, 2013, 77(1-2): 140-146 DOI:10.1016/j.marpolbul.2013.10.013 |
Chen WZ, Zhong ZH, Jin YL, et al. Effects of light intensity, temperature and salinity on growth and biochemical constituents of Hypnea cervicornis. South China Fisheries Science, 2014, 10(2): 48-53 [ 陈伟洲, 钟志海, 金玉林, 等. 光照强度、温度和盐度对鹿角沙菜生长及生化组分的影响. 南方水产科学, 2014, 10(2): 48-53] |
Dawes CJ, Koch EW. Physiological responses of the red algae Gracllarla verrucosa and G. tikvahiae before and after nutrient enrichment. Bulletin of Marine Science, 1990, 46(2): 335-344 |
Droop MR. 25 years of algal growth kinetics a personal view. Botanica Marina, 1983, 26(3): 99-112 |
Gómez I, Wiencke C. Seasonal changes in C, N and major organic compounds and their significance to morpho-functional processes in the endemic Antarctic brown alga Ascoseira mirabilis. Polar Biology, 1998, 19(2): 115-124 DOI:10.1007/s003000050222 |
Gordillo FJL, Dring M, Savidge G. Nitrate and phosphate uptake characteristics of three species of brown algae cultured at low salinity. Marine Ecology Progress Series, 2002, 234(1): 111-118 |
Hanisak MD. The use of Gracilaria tikvahiae (Gracilariales, Rhodophyta) as a model system to understand the nitrogen nutrition of cultured seaweeds. Hydrobiologia, 1990, 204-205(1): 79-87 DOI:10.1007/BF00040218 |
Huang XH, Wen ZC, Wu CY. Effect of ammonium-nitrogen on growth and chemical composition of Gracilaria sjoestedtii Kylin. Oceanologia et Limanologia Sinica, 1989, 20(6): 493-501 [ 黄晓航, 温宗存, 吴超元. 铵氮对龙须菜含氮化合物和碳水化合物组成的影响. 海洋与湖沼, 1989, 20(6): 493-501] |
Huang ZJ, Zhong ZH, Song ZM, et al. Effects of different nutrient salts on growth and chemical constituents of Gracilaria blodgettii. South China Fisheries Science, 2014, 10(5): 30-38 [ 黄中坚, 钟志海, 宋志民, 等. 不同营养盐水平对芋根江蓠的生长及生化组分的影响. 南方水产科学, 2014, 10(5): 30-38] |
Huppe HC, Vanlerberghe GC, Turpin DH. Evidence for activation of the oxidative pentose phosphate pathway during photosynthetic assimilation of but not by a green alga. Plant Physiology, 1992, 100(4): 2096-2099 DOI:10.1104/pp.100.4.2096 |
Hurd CL, Harrison PJ, Bischof K, et al. Seaweed ecology and physiology. New York: Cambridge University Press, 2014: 255-282
|
Hwang RL, Tsai CC, Lee TM. Assessment of temperature and nutrient limitation on seasonal dynamics among species of Sargassum from a coral reef in southern Taiwan. Journal of Phycology, 2004, 40: 463-473 DOI:10.1111/jpy.2004.40.issue-3 |
Jiang HB, Tian XL, Dong SL, et al. Effects of nutrient factors on the uptake of nitrogen and phosphorus by Sargassum thunbergii. Periodical of Ocean University of China, 2007, 37(S1): 175-180 [ 姜宏波, 田相利, 董双林, 等. 不同营养盐因子对鼠尾藻氮、磷吸收速率的影响. 中国海洋大学学报, 2007, 37(S1): 175-180] |
Kochert G. Carbohydrate determination by the phenol-sulfuric acid method. Handbook of Phycological Methods:Physiological and Biochemical Methods. London, New York, Melboume: Cambridge University Press, 1978: 95-97
|
Kochert G. Protein determination by dye binding. Handbook of Phycological Methods:Physiological and Biochemical Methods. London, New York, Melboume: Cambridge University Press, 1978: 92-93
|
Lu WW, Wang QH, Gong QL. Effects of light and temperature on growth and biochemical composition of a marine macroalga (Macrocystis pyrifera) young sporophyte. Periodical of Ocean University of China (Natural Science), 2016, 46(1): 40-48 [ 芦薇薇, 王巧晗, 宫庆礼. 光照强度和温度对巨藻孢子体的生长和生化组成的影响. 中国海洋大学学报(自然科学版), 2016, 46(1): 40-48] |
Martínez B, Rico JM. Changes in nutrient content of Palmaria palmate in response to variable light and upwelling in northern Spain. Journal of Phycology, 2008, 44(1): 50-59 DOI:10.1111/jpy.2008.44.issue-1 |
Pedersen MF, Borum J. Nutrient control of estuarine macroalgae:Growth strategy and the balance between nitrogen requirements and uptake. Marine Ecology Progress Series, 1997, 161(8): 155-163 |
Phillips JC, Hurd CL. Kinetics of nitrate, ammonium, and urea uptake by four intertidal seaweeds from New Zealand. Journal of Phycology, 2004, 40(3): 534-545 DOI:10.1111/jpy.2004.40.issue-3 |
Qin M. Responses of physiological function to increased NH4+ concentrations of seawater under different environmental conditions in marine macroalgae. Master's Thesis of the South China University of Technology, 2014, 10-20[秦梅. 不同环境条件下大型海藻生理功能对海水中NH4+增高的响应. 华南理工大学硕士研究生学位论文, 2014, 10-20]
|
Seely GR, Duncan MJ, Vidaver WE. Preparative and analytical extraction of pigments from brown algae with dimethyl sulfoxide. Marine Biology, 1972, 12: 184-188 DOI:10.1007/BF00350754 |
Tamminen T, Irmisch A. Urea uptake kinetics of a midsummer planktonic community on the SW coast of Finland. Marine Ecology Progress Series, 1996, 130: 201-211 DOI:10.3354/meps130201 |
Wang YJ, Sun MZ, Li AF, et al. Effects of nitrogen concentration on the growth and photosynthetic physiology of Scenedesmus acuminatus. China Biotechnology, 2014, 34(12): 51-58 [ 汪亚俊, 孙明哲, 李爱芬, 等. 不同氮素水平对产油尖状栅藻生长及光合生理的影响. 中国生物工程杂志, 2014, 34(12): 51-58] |
Xie EY, Liu DC, Jia C, et al. Artificial seed production and cultivation of the edible brown alga Sargassum naozhouense Tseng et Lu. Journal of Applied Phycology, 2013, 25(2): 513-522 DOI:10.1007/s10811-012-9885-2 |
Xu ZG, Li MZ, Sun FX, et al. Effects of temperature, irradiance level and nutritional history on the uptake of inorganic phosphorus in Hizikia fusiforme. South China Fisheries Science, 2013, 9(3): 8-13 [ 徐智广, 李美真, 孙福新, 等. 温度、光强和营养史对羊栖菜无机磷吸收的影响. 南方水产科学, 2013, 9(3): 8-13] |
Xu ZG, Wu HY, Sun FX, et al. Effects of enrichment with different nitrogen sources on growth, photosynthetic carbon fixation and nitrogen uptake of Saccharina japonica. Journal of Fisheries of China, 2016, 40(4): 577-584 [ 徐智广, 吴海一, 孙福新, 等. 不同氮源加富对海带生长、光合固碳和氮吸收特性的影响. 水产学报, 2016, 40(4): 577-584] |
Yoon JT, Sun SM, Chung G. Sargassum bed restoration by transplantation of germlings grown under protective mesh cage. Journal of Applied Phycology, 2014, 26(1): 505-509 DOI:10.1007/s10811-013-0058-8 |
Yu YQ, Zhang QS, Tang YZ, et al. Establishment of intertidal seaweed beds of Sargassum thunbergii through habit creation and gerling seeding. Ecological Engineering, 2012, 44(7): 10-17 |
Zhang X, Li DP, Shi DJ, et al. Photosynthesis properties of gametophytes and juvenile sporophytes of algae, Undaria pinnatifida. Marine Sciences, 2004, 28(11): 20-27 [ 张栩, 李大鹏, 施定基, 等. 裙带菜配子体和孢子体的光合作用特性. 海洋科学, 2004, 28(11): 20-27 DOI:10.3969/j.issn.1000-3096.2004.11.006] |



